世界上每年约有500~1 000万t油类物质因为石油开采泄露、井喷事故、港口和船舶含油废水跑冒滴漏等进入海洋环境。石油污染物进入海水后,会影响海气交换、消耗海水中溶解氧、影响海洋植物的光合作用,并对海洋生物产生毒害作用[1-2]。微生物处理技术因具有处理费用低、无二次污染、处理效果好等优点,在诸多含油海水处理方法中被认为是最有前途的处理技术。游离微生物在处理含油海水时存在利用率低、容易流失、抗毒性差等缺点[3-4],限制了生物处理技术的推广应用。
微生物固定化技术因具有耐环境冲击、去除率高、可回收利用等突出优点,已广泛应用于有机污染物的净化处理[5-8]。本研究将实验室前期筛选分离得到的海洋石油降解菌进行包埋固定,通过优化包埋条件确定其最佳的固定化方法,并考察了pH值、盐度和温度等海水环境条件对固定化小球降解含油海水的影响,比较分析了游离菌和固定化小球的含油海水的降解效率,以期为海洋石油污高效染治理提供理论依据和实验数据支持。
1 材料与方法 1.1 实验材料实验所用海洋石油降解菌株筛选分离自渤海入海口处修船厂滩涂的泥沙中,经鉴定该菌株为假交替单胞菌(Pseudoalteromon sp.),石油样品采自大港油田。
高盐LB培养基:NaCl 35.0 g,胰蛋白胨10.0 g,酵母提取物5.0 g,蒸馏水补足至1 L,调节pH值至7.0。然后添加1.5%的琼脂粉,121 ℃高压灭菌20 min。
石油培养基:K2HPO4 1.0 g,KH2PO4 1.0 g,MgSO4·7H2O 0.5 g,NH4NO3 1.0 g,酵母提取物0.01 g,原油1.5 g,陈海水补足至1 L,121 ℃高压灭菌20 min。
1.2 固定化小球的制备取一定浓度的聚乙烯醇和海藻酸钠混合溶液,加入混合菌泥,搅拌均匀后用注射器滴入交联剂中进行交联,交联剂由质量分数为2%的CaCl2和饱和硼酸组成(用NaCO3调节pH值到6.7),4 ℃交联一定时间后,取出用蒸馏水冲洗2~3次,再用1 mol/L的KH2PO4溶液硬化,固定化小球取出后用生理盐水冲洗2~3次,湿态下保存于蒸馏水中,备用,使用上述方法制得的固定化小球直径在3 mm左右。
1.3 固定化小球性能测定密度测定方法如下:取一定量的固定化小球用去离子水清洗干净,倒干水分进行称量,记录质量M。在量筒内加入蒸馏水,记录体积V1,将小球倒入量筒,记录体积V2,则小球的密度为M/(V1-V2)。
机械强度测定:取一定数目(约100颗)的固定化小球放入烧杯中,加入蒸馏水后利用搅拌器进行搅拌,查看搅拌后剩余结构完整的小球数量。
弹性测定:取3颗形态完好、大小均匀的固定化小球,呈品字形置于载玻片上并盖上盖玻片,测量两玻片之间的高度H0,然后将50 g的砝码置于盖玻片并测量两玻片之间的高度H1,H1/H0越小则说明小球的弹性越好,比较海藻酸钠(1#)、聚乙烯醇(2#)及海藻酸钠与聚乙烯醇(3#)的弹性,弹性最好的记为“+++”,弹性最差的记为“+”,弹性中间的记为“++”。
稳定性测定:取一定数目(约100颗)的固定化小球放入烧杯中,加入蒸馏水后进行持续曝气,观察小球溶胀、破损情况。
渗透性能测定:取20颗固定化小球投入盛有200 mL蒸馏水的烧杯中,滴加2滴惰性红墨水,定时观察红墨水进入各种配方固定化小球的情况,判断固定化小球的传质性能。
1.4 固定化小球石油降解率测定取SI-JHS固定化小球0.5 g,分别接种到不同pH值、盐度和温度的石油培养基中,35 ℃下160 r/min摇床培养5 d,采用紫外分光光度法[9]测定石油培养基中石油的剩余含量,计算固定化小球对石油的降解率。
2 结果与讨论 2.1 固定化小球制备方法的确定 2.1.1 基本包埋条件表 1为不同包埋剂对固定化小球的弹性、传质性能和稳定性的影响。从表 1可以看出,海藻酸钠(SA)制备的1#固定化小球稳定性差,在水中曝气一定时间后容易发生溶胀现象;2#聚乙烯醇(PVA)小球不会溶胀,但有轻微黏连现象。2#PVA小球的稳定性高于海藻酸钠小球,这是因为PVA分子链较长,其与硼酸交联后形成的凝胶较为稳定,而SA与CaCl2交联形成的海藻酸钙凝胶稳定性较差[10]。在传质性能测试中,1#SA小球在红墨水中浸泡30 min左右,其切片断面已完全被红墨水浸透,但PVA小球达到相同的传质效果则需要107 min,这说明以天然材料SA为包埋剂制备出的固定化小球传质性能要优于以人工合成高分子材料PVA为载体制备出的固定化小球。在PVA中加入一定量的SA制备3#PVA+SA小球,不仅成球容易,传质性能增强,还可以防止溶胀和黏连现象,经过30 d在水中连续浸泡,未发现添加的海藻酸钠析出。但添加过高浓度SA,所形成的小球结构不稳定,在水中浸泡后,SA容易析出,导致小球结构松散,容易发生解体。
| 编号 | 1# | 2# | 3# |
| 包埋剂 | 4%SA | 10%PVA | 10%PVA+1%SA |
| CaCO3 | 0 | 0 | 0.005(g/g) |
| 包菌量(v/v) | 0.20 | 0.20 | 0.20 |
| 交联剂 | 4%CaCl2 | 饱和硼酸 | 饱和硼酸+3%CaCl2 |
| 成球粒径/mm | 3 | 3 | 3 |
| 弹性 | + | ++ | +++ |
| 传质性能 | 30 min变红 | 107 min变红 | 52 min变红 |
| 稳定性 | 不黏连,溶胀 | 轻微黏连,不溶胀 | 不黏连,不溶胀 |
从图 1可以看出,1#SA小球呈黄色,无拖尾现象,SA与CaCl2的反应迅速,使成球迅速容易;2#PVA小球呈白色,PVA与H3BO3的反应很慢,滴下的时间相差不大时,2液滴会黏在一起,不易成球。在PVA-H3BO3法包埋微生物中投加一定量的SA,不仅能使成球容易,还可有效防止黏连现象。

|
| 图 1 不同包埋剂制备出的固定化小球照片 Fig.1 Photos of immobilized beads prepared by different embedding materials |
| |
固定化小球的完整系数(integrity coefficient,IC)是表征其机械强度的重要参数,实验测定了SA、PVA和SA+PVA小球在不同搅拌强度下的IC值,见表 2。
| 包埋剂 | 时间 | 转速/(r·min-1) | ||
| 100 | 200 | 300 | ||
| 1# 4%SA | 2 | 100 | 92 | 87 |
| 4 | 99 | 88 | 72 | |
| 6 | 90 | 80 | 66 | |
| 8 | 85 | 75 | 52 | |
| 10 | 79 | 62 | 31 | |
| 2# 10%PVA | 2 | 100 | 100 | 100 |
| 4 | 100 | 100 | 100 | |
| 6 | 100 | 100 | 99 | |
| 8 | 100 | 100 | 96 | |
| 10 | 100 | 99 | 92 | |
| 3# 10%PVA+1%SA | 2 | 100 | 99 | 90 |
| 4 | 100 | 100 | 100 | |
| 6 | 100 | 100 | 100 | |
| 8 | 100 | 100 | 99 | |
| 10 | 100 | 100 | 97 | |
从表 2中可以看出,当选用4%SA作为包埋剂时,制备出的固定小球在搅拌过程中表面侵蚀严重,溶液浑浊,在300 r/min搅拌8 h后,小球有50%发生破损,10 h后小球的破损率到达了70%;当包埋剂为10%PVA时,在300 r/min搅拌6 h时,小球表面有轻微侵蚀;而当包埋剂采用10%PVA+1%SA时,制备出的固定化小球在100、200和300 r/min搅拌过程中,小球表面一直光滑,溶液一直澄清,未出现侵蚀现象。
由于在PVA-H3BO3固定化包埋方法中,作为交联剂的饱和硼酸溶液pH值只有4左右,而海洋石油降解菌在这种酸性环境下生长会受到抑制,致使活性下降,同时又影响了聚乙烯醇的凝胶过程,所以通过调节pH值减小固定化过程对微生物活性的影响。同时,为使固定化小球保持较好的强度和传质性能,选用3#小球试验条件作为固定化小球的基本包埋条件,即采用10%聚乙烯醇+1%海藻酸钠作为包埋剂,含3%的CaCl2和硼酸饱和溶液(NaHCO3调节pH值到6.7)为交联剂,并用KH2PO4进行硬化处理,以增加小球的机械强度。
2.1.2 活性炭投加对固定化小球密度的影响固定化小球的密度直接影响小球与海水接触程度,一般情况下密度略大于含油海水密度为最适宜。活性炭投加量是控制小球密度的有效手段。表 3为不同活性炭投加量下的小球密度。
| 活性炭投加量/(g·g-1) | 固定化小球密度/(g·cm-3) |
| 0.04 | 1.063 |
| 0.05 | 1.117 |
| 0.06 | 1.132 |
从表 3中可以看出,随着活性炭添加量的增加,小球的密度增大,当活性炭投加量达到6%时,小球密度达1.132 g/cm3。但活性炭浓度过高,会导致小球在制备过程出现拖尾和黏连的现象,因此固定化小球中活性炭的最适宜添加量为4%~5%。
2.1.3 菌液包埋量对固定化小球性能的影响能保持较高的微生物量是固定化微生物的一大优点,在处理要求一定的情况下,尽量提高固定化小球内的微生物浓度是提高含油海水处理率的有效方法,同时也是降低固定化小球投加量,降低处理成本的重要方式。但固定化小球中微生物量的增加直接影响到小球的性能。为确定适宜的菌株包埋量,以H3BO3+3%CaC12作为交联剂,活性炭投加量为5%制备固定小球,控制PVA-SA溶液与菌液的质量比分别为10%、20%、30%,并通过l mol/L的KH2PO4加强小球的机械性能。
从表 4中可以看出,当包菌量为10%时,小球机械强度好且密度较大,随着复合菌群包埋量的增加;小球的密度逐渐降低,机械强度也降低;当包菌量达30%时,小球形稳定性较差,易发生破碎,包菌量为20%时制备出的固定化小球弹性和机械性能最佳。
| 菌株包埋量/ % | 密度/ (g·cm-3) | 弹性 | IC(%) |
| 10 | 1.126 | +++ | 100 |
| 20 | 1.113 | ++++ | 100 |
| 30 | 1.058 | ++ | 72 |
| 注:“+”表示固定化小球弹性,“+”越多,弹性越好。 | |||
在最适宜的固定化条件下将实验室前期分离得到的海洋石油降解菌SI-JHS包埋制成固定化小球,考察其对含油海水的降解效果及影响因素。图 2为不同pH值、盐度和温度条件下,SI-JHS固定化小球对含油海水的降解效果。
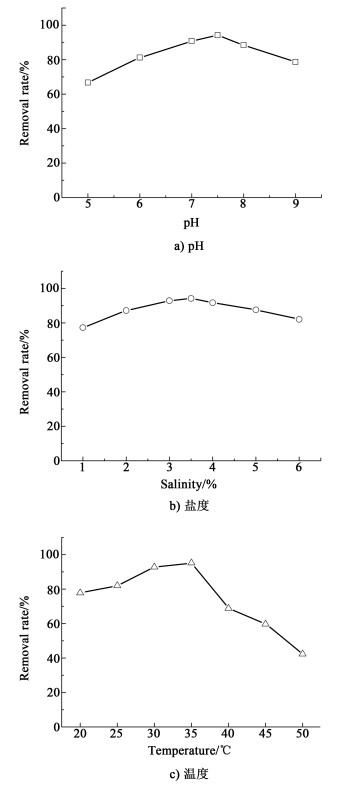
|
| 图 2 环境条件对降解效果的影响 Fig.2 Effects of environmental conditions on degradation efficiencies |
| |
从图 2a)中可以看出,SI-JHS固定化小球在中性条件下对含油海水的效果最高,pH值在7.0~7.5时降解率均在90%以上,pH值在6.0以下或9.0以上时降解率显著降低,当pH值为5.0时,SI-JHS固定化小球对含油海水的降解率仅为66.7%。与游离菌相比[11],固定化后的SI-JHS海油石油降解菌在更宽的pH值范围内均对含油海水具有高效去除作用,pH值不仅可以改变细胞膜的通透性,扰乱细胞对物质的交换过程,还能够通过酶的解离过程影响酶活。固定化后的海洋石油降解菌在包埋剂海藻酸钙和聚乙二醇的保护作用下,酸性和碱性pH值环境对菌株的伤害得到缓解,底物与酶的结合位点也更能承受pH值变化,从而增强了SI-JHS海油石油降解菌对含油海水的降解效率。
盐度对SI-JHS固定化小球的降解效果也有明显影响[图 2b)],盐度在3.0%~4.0%时,降解率均在90%以上;盐度在2.0%和5.0%时,降解率有所下降;在低于1.0%或高于6.0%时,降解率仅为70%左右。由于SI-JHS海油石油降解菌分离于渤海入海口处修船厂滩涂的泥沙中,该菌株的生长环境接近于天然海水盐度(3.3%左右),因此当含油海水的盐度在3.0%~4.0%时,SI-JHS固定化小球对其的降解效果最好。
从图 2c)中可以看出,当含油海水的温度在30~35 ℃时,SI-JHS固定化小球对其的降解效果最好,温度过高或过低时降解率均有所降低,特别是在高温环境下(40 ℃以上),固定化小球的降解效率显著降低。温度过高会使SI-JHS海油石油降解菌的蛋白质发生变性,酶系统遭到破坏而失活,而温度过低则会影响菌株的代谢能力。一般含油海水的pH值在8.0左右,盐度在3.3%左右,温度在20~35 ℃之间,因此SI-JHS固定化小球能够对其进行高效降解。
2.2.2 SI-JHS固定化小球的降解曲线配制2份石油含量均为15 g/L的石油培养基,其中1份投加0.5 g SI-JHS固定化小球,另一份作为空白对照组不投加任何菌剂,每隔24 h测定2份培养液中的石油含量,测定结果如图 3所示。

|
| 图 3 固定化小球对含油海水的降解动力学曲线 Fig.3 Degradation dynamic curve of immobilized beads for oil containing seawater |
| |
从图 3中可以看出,1 d后培养基中的石油含量降低至10 g/L左右,5 d后,SI-JHS固定化小球对石油的降解基本达到平衡,培养基中石油的去除率达到94.3%,而在整个培养过程中空白对照组的石油含量基本维持不变。将培养基中石油含量的自然对数(ln C)与培养天数(t)按照准一级降解动力学方程进行线性拟合[12],相关系数R2为96.6%,而按照准二级降解动力学模型拟合实验数据时相关性较差,说明SI-JHS固定化小球对石油的降解更符合准一级动力学过程。
2.2.3 固定化SI-JHS小球与游离菌降解效果对比将SI-JHS游离菌与SI-JHS固定化小球分别投加到石油含量为1.5 g/L海水中,对比分析二者对含油海水的降解效果,结果如图 4所示。

|
| 图 4 固定化小球与游离菌降解效果对比 Fig.4 Comparison of degradation efficiencies between immobilized beads and free bacteria |
| |
从图 4中可以看出,在pH值为7.5,盐度为3.5%,温度为35 ℃的海水环境下,游离菌对海水中石油的降解率为76.2%,将SI-HJS菌株固定化后其对海水中石油的降解率增加到97.8%。这是由于固定化小球中微生物密度比游离状态高,减少了微生物的流失,提升了降解速率。包埋物优良的渗透性能使底物与细胞间的传质性能得到增强,使微生物保持了较高的生物活性。同时,利用固定化技术可为微生物提供保护环境,提升其对有毒物质及恶劣环境的耐受能力。
3 结论1) 确定了SI-JHS固定化小球的最适宜包埋条件:包埋剂10%PVA+1%SA,0.5% CaCO3,PVA-SA溶液与菌液的质量比20%,活性炭添加量为5%,交联剂为含3% CaCl2的硼酸饱和溶液,并用NaHCO3调节pH值至6.7,交联时间为24 h。在此固定化条件下,制备出的固定化小球成球性好,具有较好的传质性能和机械强度。
2) 小球对含油海水的降解SI-JHS固定化小球对含油海水的最佳降解条件为:pH值7.0~7.5、盐度3%~4%、温度30~35 ℃。将SI-JHS海洋石油降解菌包埋固定能够显著提高其对含油海水的降解率,SI-JHS固定化小球对含油海水的降解率为97.8%,较游离菌提高了22.6%,固定化小球对石油的降解过程符合准一级降解动力学模型。
| [1] |
Wang X, Wang X, Liu M, et al. Adsorption-Synergic biodegradation of diesel oil in synthetic seawater by acclimated strains immobilized on multifunctional materials[J]. Marine Pollution Bulletin, 2015, 92(1/2): 195-200. |
| [2] |
李艳梅, 曾文炉, 余强, 等. 海洋溢油污染的生态与健康危害[J]. 生态毒理学报, 2011, 6(4): 345-351. Li Yanmei, Zeng Wenlu, Yu Qiang, et al. Adverse effect of marine oil spills on human health and ecosystem:A review[J]. Asian Journal of Ecotoxicology, 2011, 6(4): 345-351. (in Chinese) |
| [3] |
Pontes J, Mucha A P, Santos H, et al. Potential of bioremediation for buried oil removal in beaches after an oil spill[J]. Marine Pollution Bulletin, 2013, 76(1/2): 258-265. |
| [4] |
Radwan S, Al-Hasan R, Salamah S, et al. Bioremediation of oily sea water by bacteria immobilized in biofilms coating macroalgae[J]. International Biodeterioration & Biodegradation, 2002, 50(1): 55-59. |
| [5] |
李欣, 凌婉婷, 刘静娴, 等. 固定化菌剂对污水和牛粪中雌二醇和已烯雌酚的去除作用[J]. 环境科学, 2015, 36(7): 2581-2590. Li Xin, Ling Wanting, Liu Jingxian, et al. Immobilization of estrogen-degrading bacteria to remove the 17β-estradiol and diethylstilbestrol from polluted water and cow dung[J]. Environmental Science, 2015, 36(7): 2581-2590. (in Chinese) |
| [6] |
Alessandrello M J, Juárez Tomás M S, Raimondo E E, et al. Petroleum oil removal by immobilized bacterial cells on polyurethane foam under different temperature conditions[J]. Marine Pollution Bulletin, 2017, 122(1/2): 156-160. |
| [7] |
邵基伦, 曹刚, 李紫惠, 等. 包埋固定化异养硝化菌强化处理氨氮有机废水[J]. 中国给水排水, 2015, 31(1): 5-9. Shao Jilun, Cao Gang, Li Zihui, et al. Enhanced treatment of organic wastewater containing ammonia nitrogen by embedded immobilized heterotrophic nitrobacteria[J]. China Water & Wastewater, 2015, 31(1): 5-9. (in Chinese) |
| [8] |
Shen Y, Gao J, Li L. Municipal wastewater treatment via co-immobilized microalgal-bacterial symbiosis:Microorganism growth and nutrients removal[J]. Bioresource Technology, 2017, 243: 905-913. DOI:10.1016/j.biortech.2017.07.041 |
| [9] |
任华峰, 张雨山, 王静, 等. 石油烃降解菌的分离鉴定及其产生乳化剂条件[J]. 化学工业与工程, 2010, 27(3): 189-194. Ren Huafeng, Zhang Yushan, Wang Jing, et al. Isolation and characterization of a hydrocarbon-degrading bacteria strain[J]. Chemical Industry and Engineering, 2010, 27(3): 189-194. DOI:10.3969/j.issn.1004-9533.2010.03.001 (in Chinese) |
| [10] |
Wu K, Wisecarver K D. Cell immobilization using PVA crosslinked with boric acid[J]. Biotechnology Bioengineering, 1992, 39: 447-449. DOI:10.1002/(ISSN)1097-0290 |
| [11] |
张爱君, 郝建安, 杨波, 等. 海洋石油降解菌的筛选、鉴定及降解活性[J]. 化学工业与工程, 2015, 32(1): 31-36. Zhang Aijun, Hao Jianan, Yang Bo, et al. Isolation and identification of petroleum degrading marine bacteria and its activity[J]. Chemical Industry and Engineering, 2015, 32(1): 31-36. DOI:10.3969/j.issn.1006-7906.2015.01.007 (in Chinese) |
| [12] |
孙瑞珠, 马玉龙, 张娟, 等. 泰勒菌素降解菌的筛选及其降解动力学研究[J]. 中国环境科学, 2013, 33(4): 722-727. Sun Ruizhu, Ma Yulong, Zhang Juan, et al. Isolation and degradation dynamic of a tylosin-degrading strains[J]. China Environmental Science, 2013, 33(4): 722-727. DOI:10.3969/j.issn.1000-6923.2013.04.021 (in Chinese) |
 2019, Vol. 36
2019, Vol. 36





