2. 西安近代化学研究所, 西安 710065
2. Xi'an Modern Chemistry Research Institute, Xi'an 710065, China
生物矿化指生物体内形成矿物的过程。当生物矿化形成结石或引起其他疾病时,这个过程被称为病理矿化。病理矿化造成的肾结石、胆结石、痛风和动脉硬化等疾病的发病率很高,例如,痛风的患病人口已达到中国全部人口的1.1%,存在痛风风险的高尿血酸症患者更是占中国总人口的13.3%[1]。因此,病理矿化在医学界受到广泛的关注。另外,生物体内存在的透明质酸钠、多肽、蛋白质等复杂多样的分子都可能影响矿物结晶过程,但其内在机制尚未明确。例如,高尿血酸症患者中只有10%~15%生成了尿酸钠结石,其中的机理仍不明确[2]。尿路结石鸟粪石表面有规则的纹路,形成机制可能是尿路感染细菌代谢的大分子使晶体以颗粒聚集取向方式结晶[3]。此外,细胞代谢产生复杂的化学成分导致病理矿化的很多现象难以被解释。
材料科学同样关注天然生物材料的结晶方式[4-7]。这是因为一些天然材料具有优异的性能,例如,交叉层状微结构的海螺壳具有远超文石的优异机械性能[8];珍珠层的韧性和硬度分别是碳酸钙块体的10倍和100倍[9]。贝壳类外壳的微观多级结构的形成过程,首先通过有机物诱导从液相分离出液态的结晶前驱体,然后沉淀为无定形相,最后组装去水化转化成生物矿物[10-12]。虽然天然生物材料的结晶机制被广泛研究,但是材料科学家很少关注病理性生物矿物的形成机制。
生物矿物一般由晶体和有机物基质组成。例如,从肾结石中分离出的尿蛋白、酶类和多糖等有机物的含量占总质量的5%左右[13]。研究者使用有机溶剂和蛋白酶溶解肾结石中的有机基质之后结石的形态并未崩解,说明结石中有机基质和无机晶体的结构并不仅是晶体被有机物粘接在一起[14]。除了有机基质和无机晶体的宏观混和,有机物分子也可以嵌入在晶格中。例如嵌入在尿酸晶体中的色素分子使尿结石呈现棕色[15]。
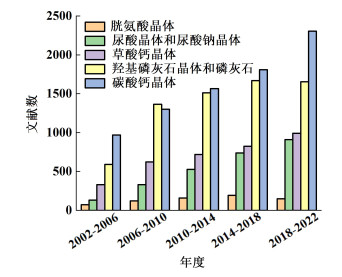
生物矿化相关的文章发表数量如图 1所示,近20年发表研究较多的生物矿物依次是碳酸钙、羟基磷灰石、一水合草酸钙、尿酸和尿酸钠。生物矿化相关矿物的结晶研究文献发表数量逐年增加,碳酸钙和羟基磷灰石的结晶研究也包含在材料科学主题下,而草酸钙研究的主题大多是肾结石。可以看出,病理矿化主题的相关研究不断涌现,尤其是近十年增长的尿酸和尿酸钠的结晶学研究已经可以与草酸钙结晶研究文献数量相当。这些文献研究的生物矿化晶体对应于不同的医学疾病,肾结石的主要成分有一水合草酸钙、磷酸钙和尿酸[13];胆结石的主要成分是L-胱氨酸;异常矿化的牙齿对应于[16]磷酸钙和羟基磷酸钙[16, 17];尿酸钠晶体引发痛风。综上,本论文将综述生物矿化诱发的结石疾病的结晶调控研究,重点阐述小分子、大分子、纳米颗粒和聚合物表面抑制病理矿化的研究进展。
|
| 图 1 2002—2022生物矿化晶体有关的文章发表数量(数据来源于Web of Science检索) Fig.1 Numbers of articles related to pathological mineralization published from 2002 to 2022 (data were retrieved from Web of Science) |
| |
病理矿化的第一步是液相转变为固相的成核过程,理解成核过程对控制病理矿化有重要意义。经典成核理论[18]把从溶液中形成半径为r的球形团的吉布斯自由能ΔGhom(r)变化描述为2项的和:
| $ \Delta {G_{{\rm{hom}}}}(r) = - \frac{4}{3}\frac{{{N_{\rm{A}}}\pi \Delta \mu }}{{{v_{\rm{m}}}}}{r^3} + 4\pi {\gamma _{{\rm{ln}}}}{r^2} $ | (1) |
式(1)中:NA是阿伏伽德罗常数;vm是每摩尔分子的体积;Δμ是溶质在固液相的化学势差;γln是液相和晶核之间的界面能。方程右侧第1项表示生长单元形成固相矿物造成的能量变化,在过饱和的条件下这一项始终保持负值;第2项表示增加界面面积造成的能量增长。随着r的增大,晶核比表面积减小,相变的自由能从正值变为负值,成核自发进行。相变自由能为零时的晶核半径r*被称为临界晶核半径,晶核的形成需要晶体团簇大小超过临界晶核尺寸,这样才能满足后续晶体生长而不是团簇的溶解。
成核是一个概率事件,通常研究它的方法是测量从产生过饱和度开始到第1个晶核出现的时间,即成核诱导期。研究者往往需要大量的实验得到诱导期分布。生物矿化环境中,除了过饱和度以外,pH值、流速、生物分子和复杂的离子环境都会在一定范围内改变临界晶核的形成能垒和速率,理解临界晶核的形成机制将帮助研究者设计能够调控病理矿化成核的策略。
在生物矿化的环境中,细胞膜和细胞器膜提供了异相成核场所。异相成核能垒需要考虑液相与细胞膜脂质基底之间的界面能γls,细胞膜脂质基底与晶核之间的界面能γsn,液相与晶核之间的界面能γln。在相界面上的成核能垒更低,更易发生成核现象。异相成核能垒ΔGhet*表示为均相成核能垒ΔGhom*乘以修正因子f(θn/w)[19]:
| $ \Delta G_{{\rm{het}}}^* = f\left( {{\theta _{{\rm{n}}/{\rm{w}}}}} \right)\Delta G_{{\rm{hom}}}^{{*^{\frac{1}{4}\mathit{cos}{{\rm{ \mathsf{ θ} }}_{n/w}}^2}}}\left( {2 + \cos {\theta _{{\rm{n}}/{\rm{w}}}}} \right)\Delta G_{{\rm{hom}}}^* $ | (2) |
| $ \cos {\theta _{{\rm{n}}/{\rm{w}}}} = \frac{{{\gamma _{{\rm{ls}}}} - {\gamma _{{\rm{sn}}}}}}{{{\gamma _{{\rm{ln}}}}}} $ | (3) |
式(2)和式(3)中:θn/w是水相中球冠状晶核在基底表面的接触角;由于晶核的形状受晶体结构的影响,不能简单地被认为是球冠形,θn/w仅仅是用于定量比较晶核与基底之间、水与基底之间的相互作用大小。
研究者通过使用先进的分析技术观察晶体成核过程,揭示了大量的非经典成核现象[20]。生物大分子的通过2个步骤成核,成核过程起初形成了稳定的前驱体液滴,液相前驱体经过结构整合形成晶核[21]。小分子晶体如碳酸钙[22]、磷酸钙[23]和草酸钙[24]的结晶体系中也相继发现了稳定的无定形的团簇聚集体,溶液中的离子首先形成了稳定的团簇聚集体,此时的团簇聚集体仍是无定形的,通过内部结构重组形成晶核。
1.2 病理矿化晶体的生长模型碳酸钙、草酸钙和羟基磷灰石等钙质结石以及尿酸和尿酸钠等结石在水中的溶解性通常与酸碱度相关。随pH值升高前3种物质溶解度降低,尿酸和尿酸钠变得易溶。这是因为构成晶体的阴离子浓度受pH值影响显著。在人体生理pH值下基本所有结石都具有极低的溶解度。
在低溶质浓度下,体相到晶体表面的扩散往往很容易达到平衡,晶体生长由晶体表面生长过程控制。例如,在模拟体内浓度的溶液中,草酸钙晶体以螺旋位错方式生长[25]。螺旋生长模型由Burton, Cabrera和Frank建立,指出低过饱和度下无法越过二维成核能垒,晶体依靠螺旋位错产生的台阶生长。螺旋位错作为台阶源可以生成始终存在的台阶结构,使晶体能在低过饱和度条件下生长[26],如图 2所示。鸟粪石结石(六水合磷酸氨镁晶体)在低过饱和度下以螺旋位错生长,较高过饱和度下以二维成核模式生长[27]。二维成核生长模型指出晶体生长是通过生长面上临界核产生和随后的延展。当溶液过饱和度较高时,二维岛状核不断产生,二维成核的边缘会产生大量扭折,为分子并入晶体提供活跃的生长位点,溶质分子不断结合在扭折点上使台阶前进。
生物对体内矿物质结晶精确调控,已经启发人们仿生调控结晶过程[29]。生物调控结晶的策略是大分子与晶面[30]和成核前体[31]的特异性结合,以及有机基质限域空间内的结晶行为调控[32]。与构成晶体的分子结构相似的添加剂分子还能嵌入到晶格中,通过产生缺陷影响晶体机械性能[33]。然而,最常见的结晶调控现象是生物分子影响溶质嵌入晶面的过程。Cabrera-Vermilyea (C-V)模型被广泛地用来解释添加剂分子作用下的生长动力学[34],晶面台阶移动速度是结晶推动力和动力学系数的函数,通过式(4)描述。
| $ V = \beta \Delta c = \beta \left( {c - {c_{{\rm{eq}}}}} \right) = {\beta ^\prime }\frac{{c - {c_{{\rm{eq}}}}}}{{{c_{{\rm{eq}}}}}} $ | (4) |
式(4)中:V为晶面台阶移动速度;β为动力学系数;c为溶质浓度;ceq为平衡浓度。
当晶体以螺旋位错生长模型生长时,相邻螺旋形台阶边缘的距离表示为:
| $ d = s{r_{\rm{c}}} $ | (5) |
式(5)中:d为台阶间距;s为形状因子;rc为临界晶核半径。
临界晶核半径用Gibbs-Thomson方程:
| $ {r_{\rm{c}}} = \frac{{\gamma \omega }}{{\Delta \mu }} $ | (6) |
式(6)中:γ为表面能;ω为晶体摩尔体积;Δμ为结晶的化学势推动力。
晶面的法向生长速度表示为:
| $ R = pV $ | (7) |
式(7)中:p=h/d为生长丘坡度;h为台阶高度。
生物分子在晶面上的吸附过程可以用众所周知的亨利等温吸附描述:
| $ \theta = \frac{{K{c_{{\rm{ad}}}}}}{{1 + K{c_{{\rm{ad}}}}}} $ | (8) |
式(8)中:θ为表面覆盖率;cad为溶液中添加剂分子浓度;K为吸附常数。
Cabrera-Vermilyea模型中认为吸附的杂质分子固定在晶面上,形成二维格子。台阶移动速度为:
| $ V = {V_0}{\left( {1 - 2{r_{\rm{e}}}/{L_{{\rm{ad}}}}} \right)^{1/2}} $ | (9) |
式(9)中:Lad为吸附杂质分子平均间距。吸附分子之间的距离Lad也可以表示为平均吸附密度的平方根:
| $ {L_{{\rm{ad}}}} = \sqrt {{n_{\max }}\theta } $ | (10) |
式(10)中:nmax为吸附位点总数量。
式(9)描述了当杂质分子间距小于两倍临界晶核半径时,台阶停止向前推移;当杂质分子间距大于两倍临界晶核半径时,台阶能够以减慢的速度向前推移。由于Langmuir等温吸附对大分子吸附描述的不完备,C-V模型会偏离实验结果。尽管如此C-V模型很好地描述了生长死区和粗糙台阶边缘的出现[35]。
C-V模型不仅仅用来描述添加剂存在下的晶体生长动力学,还可以用来验证添加剂分子抑制结晶的方式是否为经典的层生长抑制机理。同时,式(6)体现出,能够造成可观的台阶速度减慢的添加剂分子仅仅需要晶面上吸附稀疏的1层,也就是说很少数量的添加剂分子就可以对晶体生长产生可观的影响。这一理论鼓励研究者探索能高效抑制结石生长的抑制剂分子。
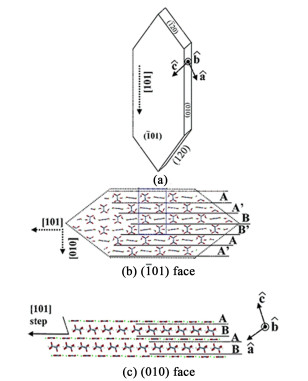
2 钙质结石的晶体生长调控研究肾结石中最常见草酸钙的一水合草酸钙晶型(COM)。COM的晶体结构如图 3所示,单斜晶系,空间群P21/n,晶胞参数a=0.9976 nm,b=1.4588 nm,c=0.6291 nm,β=107.05°。这种晶体的形状和尺寸受生长条件影响,例如离子强度、pH值和温度。最常见的一水合草酸钙的晶面族是{-1 0 1},{0 1 0}和{1 2 0}。能够影响COM结晶的分子包括柠檬酸、羟基柠檬酸、天冬氨酸、骨桥蛋白(Osteopontin, OPN)和Tamm-Horsfall蛋白(Tamm-Horsfall protein, THP)、多肽。此外,在尿液和结石基质中发现的糖胺聚糖和其他多糖也受到研究者的关注[36-38]。
临床上,柠檬酸被用作治疗肾结石的口服药物。它可以酸化尿液,增加草酸钙结石的溶解度,同时体外实验证明了柠檬酸分子对草酸钙结晶动力学的抑制。柠檬酸容易与正电性的草酸钙晶面结合,覆盖生长单元结合位点,阻碍台阶推移进而抑制晶体生长。研究者使用原子力显微镜对生长中草酸钙晶面形貌进行观察,如图 4所示,柠檬酸对(-1 0 1)面螺旋位错三角形生长丘的形貌有巨大影响。随着柠檬酸浓度增加,(-1 0 1)面的(1 0 1)台阶边缘变得粗糙,台阶推移速度迅速下降,晶习发生变化。柠檬酸分子3个羧基与(-1 0 1)面(1 0 1)台阶的钙离子位置有好的匹配,对比于其他台阶边缘,柠檬酸分子变形扭曲的最小。在(0 1 0)面上由于钙离子位置的不匹配和草酸延申出平面的羧基基团的静电排斥,导致柠檬酸在(0 1 0)面的结合能较小[25]。(-1 0 1)晶面生长台阶推移速度与柠檬酸浓度的关系符合Cabrera-Vermilyea (C-V) 模型拟合的结果。晶面钙离子密度与柠檬酸抑制效果的一致性和存在生长死区的现象都符合经典的C-V模型[39, 40]。羟基柠檬酸分子比柠檬酸分子对草酸钙结晶的抑制能力更强,而且羟基的位置和数量影响显著,但添加剂分子与晶面结合的立体化学因素仍有待深入研究[41, 42]。
2.2 多肽抑制剂多肽链与晶面有更多的结合位点和覆盖面积,使它比小分子更有效。当添加剂实现对草酸钙结晶的等效抑制时,60个单体的聚天冬氨酸和独立作用的天冬氨酸单体浓度分别大约是0.1和1 000 mg ·L-1,降低了约10 000倍[43]。
聚天冬氨酸(PolyD)是研究蛋白质调控草酸钙结晶的模型多肽。Wang等比较了不同链构象如何影响多肽与晶面的结合能力,他们在27个单体长度的聚天冬氨酸链中,每3个天冬氨酸序列插入1个甘氨酸或丝氨酸,通过诱导期、实时溶液成分、AFM台阶形貌的比较,插入丝氨酸链的抑制活性大于插入甘氨酸链抑制活性的30倍。由于2种肽链的构象不同,插入丝氨酸的多肽链具有灵活的线形结构,插入甘氨酸的多肽链倾向于球形结构[44]。Kang等研究了手性氨基酸对草酸钙晶体的影响,发现L-PolyD6和R-PolyD6对晶体外形和(-1 0 1)晶面台阶形貌产生手性修饰,手性分子对不同螺旋方向生长丘上扭折点的吸附能力不同,从而对晶体生长产生手性修饰[45]。
2.3 骨桥蛋白和Tamm-Horsfall蛋白抑制剂骨桥蛋白(OPN)表达基因敲除的小鼠更易患上钙结石和动脉硬化,证明OPN对草酸钙晶体形成中有重要影响。研究者通过激光共聚焦显微镜表征发现,荧光标记的骨桥蛋白吸附在草酸钙的(-1 0 1)和{1 2 1}晶面[46]。与小分子的快速吸附不同,蛋白质大分子的吸附时间达到1~40 min,吸附的同时伴随着构象的变化,所以大分子吸附到晶面的行为用多步吸附来描述。研究者通过大分子存在弱吸附阶段,解释生长中的晶面离开抑制剂分子环境后,台阶推移速度恢复需要的时间要超过生长单层晶面的时间[30]。OPN属于阴离子蛋白,序列包含丰富的天冬氨酸,OPN蛋白在草酸钙晶面的吸附能力来源于蛋白质丰富的羧基基团。除天冬氨酸带来的羧基外,骨桥蛋白序列中高度磷酸化的肽段有更好的抑制效果,这是因为磷酸基提供了更多的静电作用,并起到了维持多肽构象的作用[46]。
Tamm-Horsfall蛋白黏连一水合草酸钙晶体。Viswanathan等通过动态激光散射法测量蛋白质对一水合草酸钙微晶悬浮液粒径的影响,发现Tamm-Horsfall蛋白加入后造成一水合草酸钙微晶的聚集,这是因为蛋白质多个部位可与草酸钙微晶结合,在特定的浓度范围内造成微晶的聚集[47]。
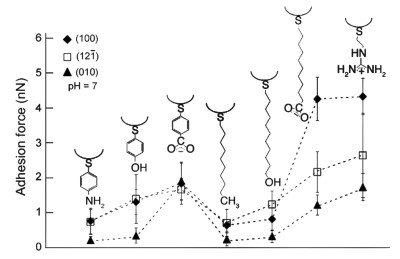
为了研究化学基团与晶面的相互作用力大小,Sheng等使用含不同基团的硫醇修饰原子力显微镜的探针针尖,分析了烷基、氨基、羟基、羧基和脒基与晶体表面之间的作用力。结果表明羧基基团和脒基基团与草酸钙(1 2 0)晶面的结合力明显大于烷基、羟基等不带电基团的结合力[48]。长烷基链连接的羧基与草酸钙(1 2 0)晶面的结合力,要比苯环连接羧基与草酸钙(1 2 0)晶面的结合力强,说明以配位键结合的羧基与晶面Ca2+与羧基,烷基链提供给羧基取向的自由度导致了更稳定的结合。然而,羟基没有出现同样的结果,说明以氢键结合的羟基与晶面,氢键较大的自由度导致基团取向影响不显著。
|
| 图 5 化学修饰的AFM尖端与草酸钙晶面的脱附力[48] [有些文献采用不同的晶胞坐标,图5中晶面(1 0 0)和(1 2-1)分别等效于图 3中描述的晶面(-1 0 1)和(1 2 0)] Fig.5 For the desorption force between chemically modified AFM tip and calcium oxalate crystal plane, some literatures use different cell coordinates[48]. Here, face (1 0 0) and (1 2-1) are respectively equivalent to face (-1 0 1) and (1 2 0) described in Fig. 3 in second section |
| |
综上,相比于小分子抑制剂,多肽类和蛋白质抑制剂可能含有成百上千的有效基团,能结合更多的生长位点,在较低浓度下有更好的抑制效果。但是由于大分子构象变化和多级结构的复杂性,大分子的结晶抑制机制仍不清晰,理性设计大分子抑制剂的结构仍然存在困难。
3 尿酸钠和尿酸结石的结晶调控研究尿酸分子在人体中由嘌呤物质代谢而来。酸性条件下无水尿酸(UA)或二水合尿酸(UAD)晶体析出,中性和碱性环境下一水合尿酸钠(MSUM)晶体析出。尿酸和尿酸钠晶体可以在碱性条件下溶解,但在人体生理pH=7.4环境中溶解度极小,高Na+浓度使尿酸钠溶解度更小。相关溶度积数据如表 1所示。
UA是UAD的稳定晶型,在泌尿系统结石中少量存在。MSUM是人体尿酸代谢紊乱时沉积的针状晶体,引起严重的炎症反应,并通过影响成骨细胞侵蚀骨。尿酸和尿酸钠的晶体结构如图 6所示。UA单斜晶系(P21/a, a=1.4464 nm, b=0.7403 nm, c=0.6208 nm, β=65.10°) 具有层状结构,由尿酸分子头-头、尾-尾相连而成的分子带,分子带沿a轴排列组成一层,分子带平面垂直于bc平面,层内没有氢键连接,分子带与相邻层之间的分子带以氢键连接。UAD (P21/c,a=0.7237 nm, b=0.6363 nm, c=1.7449 nm, β=90.51°)与UA具有相同的层结构,层之间有水分子层。
|
| 图 6 晶体结构 Fig.6 Crystal structure |
| |
MSUM属于三斜晶系(P-1,a=1.0888 nm, b=0.9534 nm, c=0.3567 nm, α=95.06°, β=99.47°,γ=97.17°) 尿酸根分子的嘌呤环沿c轴方向紧密堆叠(0.328 nm)。三维结构中存在静电力和氢键作用,Na+与水分子和尿酸根的配位接近于八配位。尿酸的晶体形态沿着c轴方向伸长,Rinaudo基于周期性键链理论预测了实验中未观察到的一些晶面,其中的(1 -1 0)晶面在生理条件下结晶的晶体中显现[50]。
3.1 尿酸钠晶体形貌除了常见的针状形态外,尿酸钠晶体常以球状结晶,在医学文献中被称为“沙滩球”。Meng等通过提高Na+的浓度制备了球状的尿酸钠,球状的尿酸钠由结晶度较差的纳米尺寸纤维状晶体组成[51]。球状晶的形成可能与晶体聚集和枝晶过度生长有关。他们还发现当pH值由酸性到中性时,UAD到MSUM的转变要比单独MSUM生长更迅速,这通过人体血浆与组织之间的pH值梯度解释了人体痛风结石发展迅速的原因。同时,透明质酸和Ca2+离子同时存在时晶体数量减少,可能是透明质酸-Ca2+-尿酸根的结合减少了游离的尿酸根浓度。
Jeniffer等[52]通过在线原子力显微镜对单晶的研究发现,尿酸钠晶体(0 1 0)面的生长方式是二维成核延展机制。Li等[53]观察到了非经典的结晶机制:尿酸钠晶体的生长依次经历了纤维状的无定形相,纳米纤维的聚集,无定形到丝状晶体的相变。
与实验室得到的无色晶体不同,人体形成的尿酸结晶显棕色,许多色素分子能够嵌入尿酸和二水合尿酸的晶格当中[15, 54-58]。Jeniffer等制作了可以测量晶体可见光吸收的显微镜,便于测量色素分子在晶体中的浓度。无水尿酸晶体和二水合尿酸晶体的色素掺入行为非常相似,可能归因于相似的晶体结构,以及添加剂分子的杂环或芳香环与尿酸分子的嘌呤环产生π-π作用。进一步研究一系列的色素分子,吖啶、噻嗪、吖嗪、偶氮和三芳基甲烷的掺入行为,发现阳离子色素可以嵌入尿酸的晶格中,而且大部分能够改变尿酸晶习,使尿酸的{2 1 0}晶面族显现。掺入的色素有可能染色某个生长区,这种掺入位置的各向异性取决于色素种类和浓度。偶氮分子比吖啶稠环和三芳基甲烷等分子有更大的构象自由,所以偶氮分子可以在更低浓度(2 μmol ·L-1)下改变晶习。但是,添加剂分子结构与调控结晶行为需要大量分子动力学模拟的进一步解释。
色素对晶体的机械性能也会产生影响[59, 60]。纳米压痕实验证明色素掺入尿酸晶体中降低了特定晶面的模量。机械性能的变化来源于色素分子掺入晶格造成的缺陷导致的弹性软化。同时,孪晶的出现可能意味着缺陷导致的晶格畸变。大分子甚至微纳米颗粒的掺入可能会有更好的效果。
3.2 晶体生长速率调控报道的尿酸钠晶体抑制分子有苯扎氯铵、黄嘌呤[61, 62]和乙醛[63]。添加剂分子与构晶分子有相似的分子结构,被称为“冒充者(imposter)”。L-胱氨酸,胆结石的结晶受到胱氨酸二甲酯(L-CDME)的抑制[64]。L-CDME分子把L-胱氨酸的羧基氢取代为甲氧基,与胱氨酸相似的分子结构起到分子识别作用,能够吸附到生长位点,甲氧基部分干扰溶质分子嵌入晶格。如图 7所示,抑制尿酸钠结晶的“冒充者分子”为黄嘌呤、绿原酸、咖啡因和可可碱分子,后3种分子也存在抑制尿酸结晶的作用。乙酸对尿酸钠结晶的作用存在矛盾。Liu等[65]在5 mmol ·L-1的尿酸浓度下,通过测量尿酸钠晶体c轴的生长速度,发现乙酸促进了晶体生长,而且对成核诱导期没有影响。但是,最近研究发现在更接近真实病人的体液环境下(尿酸浓度1.5 mmol ·L-1),乙酸延缓了尿酸钠晶体出现时间并减少最终的产率[63]。
Mg2+、NH4+、Ca2+和K+离子在低浓度下促进成核,而在高浓度下抑制成核。通过动态光散射表征团簇大小,发现低浓度下阳离子结合尿酸根导致大的团簇出现。而高浓度的阳离子对团簇有稳定作用[66]。Li等通过单晶生长实验发现Na+对尿酸晶体生长的抑制作用,K+促进晶体a轴方向生长的作用,使用在线AFM发现K+的弱结合使晶面粗糙化,生长模式变为法向生长从而加速,而Na+结合更强使生长方式从螺旋位错生长转变为2D生长[67]。Parekh等使用多种植物提取物调控尿酸钠结晶,报道了15 d后一个实验组的晶体溶解消失和另一个实验组晶体质量的显著下降[68]。Ozono等发现随着搅拌强度增大,针状尿酸钠晶体的聚集现象越明显,同时结晶速度加快。通过动态激光散射和紫外可见吸收光谱表征尿酸钠的粒径和颗粒数发现,增大尿酸根的浓度主要增强了成核,对晶体生长速度的作用很小[69]。Matsumoto等通过鼓泡方式调控尿酸钠结晶,气液界面的引入抑制了微晶的聚集,同时注入的微气泡表面附近富集的Na+增强成核,导致了更小粒径的尿酸钠晶体[70]。
Molly等发现尽管碱性下尿酸钠可以溶解,但是显著的溶解需要达到pH=13。超声能够把尿酸钠针状晶体劈裂成细丝状,直至成为纳米尺度粗细的柔软纤维状,同时XRD衍生强度降低,可能是转化为聚合的尿酸钠分子链[71]。目前还没有体内溶解或消除尿酸钠结石的手段。医学上使用酸性的溶液溶解肾结石,但需要谨慎防范危险的并发症出现[72]。螯合剂也被用于溶解钙结石,但难以达到好的溶解效果[73]。溶解结石需要发掘更多的物理化学原理。
综上,结晶学角度的研究为痛风的治疗开辟了新的思路。例如,通过超声分解结石为更细小的晶体,有助于病人将其排出体外;在晶体中掺入色素分子,改变晶体形貌和机械性能。总之,研究晶体生长与成核过程,理解其特性规律,必将为痛风的治疗提供更多方案。
4 材料表面调控病理矿化研究材料与溶剂的固液介面能影响病理矿化的非均相成核能垒。材料界面也能诱导特定晶型药物形成[75]。经典成核理论认为成核过程需要越过临界核能垒,只有当晶核半径大于临界核半径时,晶核才能继续生长为宏观晶体[76]。材料表面能影响晶体成核界面上的二维成核自由能[77]。胆固醇晶体在细胞膜双磷脂层表面外延生长,使用透射电子显微镜观察到胆固醇首先在磷脂层表面形成单斜晶格的丝状晶体,转晶逐渐呈现棒状、片状,最后形成三斜晶格的四方形晶体[78]。在人体内虐原虫把有毒的游离血红素结晶为无害的血红素晶体,透射电镜研究发现血红素分子在虐原虫消化囊泡脂质层表面定向排列,迅速转变为晶体结构[79]。
当材料尺寸减小到微纳米级时,类似于大分子添加剂,材料颗粒可以吸附在晶面影响晶体生长。Panagiotis等制备了用于细胞低温保存的嵌段聚合物抗冻剂,发现单独使用聚乙烯吡咯烷酮时没有抗冻活性,而使用自组装方法构建表面具有聚乙烯吡咯烷酮基团的纳米颗粒能够抑制冰晶形成,这可能与颗粒表面高的基团密度有关[80]。
Yin等通过可逆加成断裂链转移(RAFT)聚合制备了可调控颗粒大小、亲水链长度、链密度、链电荷和基团的纳米聚合物颗粒,如图 8所示,并应用于典型的氨扩散法碳酸钙晶体生长实验中[74]。他们典型的一个聚合物颗粒模型是甲基丙烯酸苄酯与甲基丙烯酸构成的二嵌段聚合物。他们发现对于颗粒尺寸在5~500 nm的范围内,聚合物颗粒都可以浸入碳酸钙晶体内部。而聚合物颗粒进入晶体表层还是均匀地分布在晶体中,取决于聚合物的亲水链长度、链密度和链电荷。链长越长,电荷越负,链构象越自由,越容易与晶面产生强结合,导致强烈吸附并掺入晶体。链密度存在最优值,链密度过高会使得颗粒之间通过与Ca2+的作用桥接在一起,减弱其与晶面的相互作用。这些发现与水溶性大分子在晶面的吸附能力有一致性。除了以上对微纳米颗粒的研究之外,已经有研究证明了溶解分子形式的添加剂设计策略可以被应用在材料制备中,以调控材料界面的晶体生长。例如,Adam等针对乙酰氨基酚药物的结晶调控,将抑制药物晶体生长的定制添加剂分子N-羟基苯基甲基丙烯酰胺,接枝共聚在不溶性的聚苯乙烯中,产生的聚合物薄膜能够显著降低药物的成核诱导期[75]。

|
| 图 8 (i~iv)合成荧光标记的负载二氧化硅的纳米颗粒,有固定腔尺寸和可调节的位阻稳定链密度;光学显微镜照片(a~g); 扫描电镜(h~n); 碳酸钙晶体生长于不同聚合度的聚甲基丙烯酸链的聚合物颗粒囊泡溶液中(o~u)对应碳酸钙晶体的断面形貌,表明聚合物囊泡的嵌入[74] Fig.8 Effect of varying the steric stabilizer chain length on the occlusion of vesicles within calcite crystals. (i-iv) Synthesis of fluorescein-labeled silica-loaded vesicles with a fixed lumen diameter and a tunable steric stabilizer chain length. Representative optical microscopy images (a-g) and SEM images (h-n) of calcite crystals grown in the presence of vesicles bearing poly(methacrylic acid) chains of varying DP. (o-u) SEM images of the corresponding fractured calcite crystals, revealing the presence of the occluded vesicles[74] |
| |
聚乙二醇二丙烯酸酯和N-异丙基丙烯酰胺共聚的水凝胶片能够诱导人工尿液结晶形成花簇状的尿酸钠晶体[81]。最近,Meng等通过水凝胶模拟软骨膜,设计了符合实际关节腔流动和组织液渗透的器件作为研究平台(图 9);并对仿生水凝胶表面分子结构进行设计,提高表面成核能垒,降低界面过饱和度,实现尿酸钠结晶的有效抑制[63]。
材料表面设计策略可以分为表面形貌改变和表面化学成分改变。通常的方法是首先在基材上制备出特殊的形貌,接着用化学方法修饰表面[82]。同时,也存在一步做到化学修饰和表面形貌的方法[83]。目前的医疗涂层种类有超支化聚乙二醇、两性离子共聚物、生物分子[84]和水凝胶[83],依靠表面强亲水性形成水膜和空间位阻效应达到抗黏附效果。
使用肝素涂覆的硅胶导管是常见的医疗手段,在尿路中放置6周,未出现明显结垢[85]。肝素是葡萄糖胺、葡萄糖醛酸等强酸性粘多糖组成的混和物,因为许多细菌、哺乳动物细胞在生理条件下具有净负表面电荷,肝素的强负电性可以阻止微生物和蛋白质的附着[86]。多巴胺是一种广泛的黏合剂,它的邻苯二酚基团仅通过浸渍可以与聚合物、金属和陶瓷等结合,胺基作为反应基团共价连接防垢聚合物材料。受天然贻贝黏附蛋白的启发,将葡聚糖与多巴胺在碱性条件下混和,多巴胺自发氧化形成葡聚糖掺入的聚多巴胺层抑制蛋白质黏附。邻苯二酚基团功能化的超支化聚甘油涂层,邻苯二酚提供的锚定和交联相互作用可以增强涂层的稳定性(图 10)。但邻苯二酚基团过多可导致蛋白质吸附和细胞黏附[87]。
植入人体的材料需要考虑细胞在表面上的黏附。例如,尿路中置入支架是治疗尿路结石的常用手段[88-92]但奇异假单胞菌对导尿管定植,催化尿素水解产生氨,同时增加尿液pH值引起钙和磷酸镁晶体在导管壁上沉积。更重要的是,微生物的黏附在医疗植入材料表面构建了新的有机物和微生物混杂的生物膜。
通过抗生素杀菌是一种方法,涂覆抗生素的尿管[93]、镀银的尿管[94]和带通电银丝的尿管[95]被开发出来。但是抗生素耐药性不断增长,促使可以替代抗生素的方法防止细菌的附着。
针对微生物附着的问题,把PDMS管浸入硅油中溶胀,管表面硅油层防止生物膜形成[96]。PDMS在水中脱溶剂收缩使硅油层出现,液-液界面的光滑性和疏水性防止生物膜形成。但是管体积被溶胀增大,机械性能可能发生下降。硅油会脱离管表面,还须考虑硅油对人体造成的潜在影响[97, 98]。
氧等离子体处理常用于改变聚合物的形貌,为了防止人工晶体植入手术后囊混浊,氧等离子体处理使疏水性丙烯酸表面形成纳米级粗糙,接着在化学气相沉积系统中,将气化的聚二甲基硅氧烷沉积在基材表面构成聚二甲基硅氧烷聚合物刷。修饰之后的人工晶体表现出增强的疏水性和优异的抗细胞附着性能[99]。
另一种表面形貌的形成方法是在聚合物表面沉积无机物。Malobi等通过在棉纤布上生长Ni(OH)2构建了多级的粗糙表面,接着浸入热的十八烷基酸溶液中化学修饰疏水性,160°的水接触角和小于10°的滚动角,表现出可应用于油水分离的优异超亲油性和抗微生物性[100]。将基材浸入硅酸四乙酯溶液后水解原位生成纳米SiO2颗粒是常见方法。Song等通过在棉纤布上原位生成TEOS凝胶水解形成纳米SiO2颗粒,氨丙基三乙氧基硅烷固定SiO2颗粒后表面氟化并修饰光动力学杀菌剂二氢卟吩E6,构建的超疏水表面在水中和空气中的细菌黏附减小了90%以上[101]。
聚合物可以通过简单的成型工艺构建表面形貌,起皱、模板和热压花等。最先进的方法之一是通过光刻法生产的硅晶圆母版来精心制造表面形貌。鲨鱼皮的表面形貌被应用于减少细菌黏附,通过SEM成像评估导管的细菌黏附和生物膜形成。微图案导管的SEM图像如图 11所示,与标准硅胶导管相比,外表面的生物膜形成显着减少[102]。结果表明通过表面形貌修饰改善防污性能,而无需复杂的浸渍涂层是有希望的方法。
综上,已经有确切的证据证明表面化学在控制结石形成方面的重要性。但目前的研究主要针对防有机和生物污垢,对材料表面形貌和表面化学调控,抗结石黏附的医疗材料的研发仍然在进行中。
5 结论和展望介绍了调控病理矿化过程的天然的、人工合成的分子及材料,分析了它们抑制晶体生长、改变晶体黏附能力等机制。总体上,它们可以被分为2类,一类是分子形式的结晶调控剂,比如离子、合成小分子和蛋白质大分子。此类调控手段效果较佳,但是容易受到生物体中复杂的溶液环境影响,将体外实验在体内实验中重复仍然存在困难。另一类方法是针对容易形成结石的界面处进行材料改性,比如,人工软骨的界面化学结构设计、尿路导管表面改性。通过此类方法可以获得长期抵抗结石形成或黏附的能力,但是有机物容易污染表面,液相中形成的微晶也会附着在界面处。
尽管已经有大量的病理矿化抑制剂研究,但是仍然面临一些关键的应用基础瓶颈:对于分子抑制剂,架起体外研究和临床应用的“桥梁”是个挑战。对于材料改性调控方法,目前大多研究集中在防止有机物的污染,如何进行抗无机矿物沉积的材料表面改性尚未解决。因此未来的病理矿化研究可以从以下几个方面开展:(1)开发新的分子添加剂。大分子蛋白质往往有高效的结晶调控能力,但是由于其稳定性不高限制了它的应用。多肽序列和类肽的聚合物大分子有着巨大的可设计空间,构建高效特异性结合晶体的大分子添加剂是未来重要的研究方向。(2)生物矿化经常以非经典结晶机制发生。但是目前研究者开发的结晶抑制剂分子,大多通过晶面吸附,阻碍溶质结合到生长位点的方式发生抑制作用。如果从病理矿化机制出发,理解结石的结晶过程,必将加速针对非经典结晶过程的抑制策略的开发。(3)开发病理矿化的纳米颗粒抑制剂。小于30 nm的颗粒能够透过肠壁进入人体循环,另外水凝胶材料的高生物相容性,避免被人体的代谢循环过程分解的高稳定性,使其医疗生物应用前景广阔。同时水凝胶材料的制备和改性方法成熟,在病理矿化抑制剂领域有巨大的商业化前景。(4)开发仿生的体外研究平台。体外实验和临床实验的差距使体外开发的抑制剂分子只有少数能够在体内发生作用。因此通过膜材料模拟体内隔膜等界面,模拟体液的流动,物质的渗透扩散和软骨之间的摩擦等,开发与体内环境更加相近的研究平台是以后体外实验的发展方向。
| [1] |
曾小峰, 陈耀龙. 2016中国痛风诊疗指南[J]. 浙江医学, 2017, 39(21): 1823-1832. ZNG Xiaofeng, CHEN Yaolong. 2016 China gout diagnosis and treatment Guide[J]. Zhejiang Medical Journal, 2017, 39(21): 1823-1832. (in Chinese) |
| [2] |
RICHETTE P. Gout[J]. The Lancet, 2010, 375(9711): 318-328. DOI:10.1016/S0140-6736(09)60883-7 |
| [3] |
PRYWER J, OLSZYNSKI M. Bacterially induced formation of infectious urinary stones: Recent developments and future challenges[J]. Current Medicinal Chemistry, 2017, 24(3): 292-311. DOI:10.2174/0929867323666161028154545 |
| [4] |
JIA Z, DENG Z, LI L. Biomineralized materials as model systems for structural composites: 3D architecture[J]. Advanced Materials (Deerfield Beach, Fla), 2022. DOI:10.1002/adma.202106259 |
| [5] |
HYDE S T, MELDRUM F C. Starfish grow extraordinary crystals[J]. Science, 2022, 375(6581): 615-616. DOI:10.1126/science.abn2717 |
| [6] |
LANG A, POLISHCHUK I, CONFALONIERI G, et al. Tuning the magnetization of manganese (Ⅱ) carbonate by intracrystalline amino acids[J]. Advanced Materials (Deerfield Beach, Fla), 2022. DOI:10.1002/adma.202201652 |
| [7] |
SCHOEPPLER V, COOK P K, DETLEFS C, et al. Untangling the mechanisms of lattice distortions in biogenic crystals across scales[J]. Advanced Materials (Deerfield Beach, Fla), 2022. DOI:10.1002/adma.202200690 |
| [8] |
HOU D, ZHOU G, ZHENG M. Conch shell structure and its effect on mechanical behaviors[J]. Biomaterials, 2004, 25(4): 751-756. DOI:10.1016/S0142-9612(03)00555-6 |
| [9] |
SONG F, BAI Y L. Nanostructure of nacre and its mechanical effects[J]. International Journal of Nonlinear Sciences and Numerical Simulation, 2002, 3(3/4): 257-260. |
| [10] |
STIFLER C A, KILLIAN C E, GILBERT P U P A. Evidence for a liquid precursor to biomineral formation[J]. Crystal Growth & Design, 2021, 21(12): 6635-6641. |
| [11] |
GOWER L B, ODOM D J. Deposition of calcium carbonate films by a polymer-induced liquid-precursor (PILP) process[J]. Journal of Crystal Growth, 2000, 210(4): 719-734. DOI:10.1016/S0022-0248(99)00749-6 |
| [12] |
NUDELMAN F, SHIMONI E, KLEIN E, et al. Forming nacreous layer of the shells of the bivalves Atrina rigida and Pinctada margaritifera: An environmental-and cryo-scanning electron microscopy study[J]. Journal of Structural Biology, 2008, 162(2): 290-300. DOI:10.1016/j.jsb.2008.01.008 |
| [13] |
马凤宁, 施国伟, 张跃辉, 等. 肾结石成分与患者年龄及性别的关系分析[J]. 中华泌尿外科杂志, 2013, 34(7): 530-532. MA Fengning, SHI Guowei, ZHANG Yuehui, et al. Analysis of the relationship between the composition of stones and the age and sex in patients with kidney stones[J]. Chinese Journal of Urology, 2013, 34(7): 530-532. DOI:10.3760/cma.j.issn.1000-6702.2013.07.016 (in Chinese) |
| [14] |
ADELMAN A, SHILO Y, MODAI J, et al. Do organic substances act as a degradable binding matrix in calcium oxalate kidney stones?[J]. BMC Urology, 2021. DOI:10.1186/s12894-021-00818-3 |
| [15] |
HALL V M, COX K A, SOURS R E, et al. Urochrome pigment in uric acid crystals[J]. Chemistry of Materials, 2016, 28(11): 3862-3869. DOI:10.1021/acs.chemmater.6b00977 |
| [16] |
Qin W, Wan Q, Ma Y, et al. Manifestation and mechanisms of abnormal mineralization in teeth[J]. ACS Biomaterials Science & Engineering, 2021. DOI:10.1021/acsbiomaterials.1c00592 |
| [17] |
BUSCH S, SCHWARZ U, KNIEP R. Morphogenesis and structure of human teeth in relation to biomimetically grown fluorapatite-gelatine composites[J]. Chemistry of Materials, 2001, 13(10): 3260-3271. DOI:10.1021/cm0110728 |
| [18] |
GIBBS J W. An anthology of nineteenth-century american science writing[M]. London: Anthem Press, 2012.
|
| [19] |
TONG T, WALLACE A F, ZHAO S, et al. Mineral scaling in membrane desalination: Mechanisms, mitigation strategies, and feasibility of scaling-resistant membranes[J]. Journal of Membrane Science, 2019, 579: 52-69. DOI:10.1016/j.memsci.2019.02.049 |
| [20] |
ERDEMIR D, LEE A Y, MYERSON A S. Nucleation of crystals from solution: Classical and two-step models[J]. Accounts of Chemical Research, 2009, 42(5): 621-629. DOI:10.1021/ar800217x |
| [21] |
GALKIN O, PAN W, FILOBELO L, et al. Two-step mechanism of homogeneous nucleation of sickle cell hemoglobin polymers[J]. Biophysical Journal, 2007, 93(3): 902-913. DOI:10.1529/biophysj.106.103705 |
| [22] |
GEBAUER D, VÖLKEL A, CÖLFEN H. Stable prenucleation calcium carbonate clusters[J]. Science, 2008, 322(5909): 1819-1822. DOI:10.1126/science.1164271 |
| [23] |
GEBAUER D, C LFEN H. Prenucleation clusters and non-classical nucleation[J]. Nano Today, 2011, 6(6): 564-584. DOI:10.1016/j.nantod.2011.10.005 |
| [24] |
RUIZ-AGUDO E, BURGOS-CARA A, RUIZ-AGUDO C, et al. A non-classical view on calcium oxalate precipitation and the role of citrate[J]. Nature Communications, 2017. DOI:10.1038/s41467-017-00756-5 |
| [25] |
QIU S, WIERZBICKI A, SALTER E A, et al. Modulation of calcium oxalate monohydrate crystallization by citrate through selective binding to atomic steps[J]. Journal of the American Chemical Society, 2005, 127(25): 9036-9044. DOI:10.1021/ja043591s |
| [26] |
WOODRUFF D P. How does your crystal grow? A commentary on Burton, Cabrera and Frank (1951) 'The growth of crystals and the equilibrium structure of their surfaces'[J]. Philosophical Transactions Series A, Mathematical, Physical, and Engineering Sciences, 2015. DOI:10.1098/rsta.2014.0230 |
| [27] |
KIM D, OLYMPIOU C, MCCOY C P, et al. Time-resolved dynamics of struvite crystallization: Insights from the macroscopic to molecular scale[J]. Chemistry (Weinheim an Der Bergstrasse, Germany), 2020, 26(16): 3555-3563. |
| [28] |
UWAHA M. Introduction to the BCF theory[J]. Progress in Crystal Growth and Characterization of Materials, 2016, 62(2): 58-68. DOI:10.1016/j.pcrysgrow.2016.04.002 |
| [29] |
王一平, 朱丽, 李韡, 胡彤宇, 廖明锋, 冀秀玲. 仿生合成技术及其应用研究[J]. 化学工业与工程, 2001, 18(5): 272-278 WANG Yiping, ZHU Li, LI Wei, et al. Biomimetic synthesis technology and its application researches[J]. Chemical Industry and Engineering, 2001, 18(5): 272-278(in Chinese) |
| [30] |
SHTUKENBERG A G, WARD M D, KAHR B. Crystal growth with macromolecular additives[J]. Chemical Reviews, 2017, 117(24): 14042-14090. DOI:10.1021/acs.chemrev.7b00285 |
| [31] |
汤伟伟, 李斯, 龚俊波. 有机晶体成核分子机理研究进展[J]. 化学工业与工程, 2018, 35(3): 2-11. TANG Weiwei, LI Si, GONG Junbo. Research progress on molecular mechanism of nucleation of organic crystals[J]. Chemical Industry and Engineering, 2018, 35(3): 2-11. DOI:10.13353/j.issn.1004.9533.20182005 (in Chinese) |
| [32] |
邢晓红, 欧阳金波, 周利民, 等. 限域空间内的结晶研究进展[J]. 化学工业与工程, 2022, 39(5): 39-48. XING Xiaohong, OUYANG Jinbo, ZHOU Limin, et al. Research progress of crystallization in confined space[J]. Chemical Industry and Engineering, 2022, 39(5): 39-48. (in Chinese) |
| [33] |
于增瑞, 王永莉, 周靖, 等. 有机晶体缺陷的研究进展[J]. 化学工业与工程, 2020, 37(2): 19-29. YU Zengrui, WANG Yongli, ZHOU Jing, et al. Progress on defects in organic crystal[J]. Chemical Industry and Engineering, 2020, 37(2): 19-29. DOI:10.13353/j.issn.1004.9533.20181080 (in Chinese) |
| [34] |
QIU S, ORME C A. Dynamics of biomineral formation at the near-molecular level[J]. Chemical Reviews, 2008, 108(11): 4784-4822. DOI:10.1021/cr800322u |
| [35] |
DE YOREO J J, VEKILOV P G. Principles of crystal nucleation and growth[J]. Reviews in Mineralogy and Geochemistry, 2003, 54(1): 57-93. DOI:10.2113/0540057 |
| [36] |
CLAYMAN R V. Modulators of urinary stone formation[J]. Journal of Urology, 2005. DOI:10.1097/01.ju.0000149869.80976.9e |
| [37] |
VERKOELEN C F. Crystal retention in renal stone disease: A crucial role for the glycosaminoglycan hyaluronan?[J]. Journal of the American Society of Nephrology: JASN, 2006, 17(6): 1673-1687. DOI:10.1681/ASN.2006010088 |
| [38] |
GOHEL M D I, SHUM D K Y, TAM P C. Electrophoretic separation and characterization of urinary glycosaminoglycans and their roles in urolithiasis[J]. Carbohydrate Research, 2007, 342(1): 79-86. DOI:10.1016/j.carres.2006.11.001 |
| [39] |
WEAVER M L, QIU S R, HOYER J R, et al. Improved model for inhibition of pathological mineralization based on citrate-calcium oxalate monohydrate interaction[J]. Chemphyschem: A European Journal of Chemical Physics and Physical Chemistry, 2006, 7(10): 2081-2084. DOI:10.1002/cphc.200600371 |
| [40] |
WANG L, DE YOREO J J, GUAN X, et al. Constant composition studies verify the utility of the cabrera-vermilyea (C-V) model in explaining mechanisms of calcium oxalate monohydrate crystallization[J]. Crystal Growth & Design, 2006, 6(8): 1769-1775. |
| [41] |
CHUNG J, GRANJA I, TAYLOR M G, et al. Molecular modifiers reveal a mechanism of pathological crystal growth inhibition[J]. Nature, 2016, 536(7617): 446-450. DOI:10.1038/nature19062 |
| [42] |
CHUNG J, SOSA R, RIMER J D. Elucidating the effects of polyprotic acid speciation in calcium oxalate crystallization[J]. Crystal Growth & Design, 2017, 17(8): 4280-4288. |
| [43] |
RIMER J D, KOLBACH-MANDEL A M, WARD M D, et al. The role of macromolecules in the formation of kidney stones[J]. Urolithiasis, 2017, 45(1): 57-74. DOI:10.1007/s00240-016-0948-8 |
| [44] |
WANG L, QIU S, ZACHOWICZ W, et al. Modulation of calcium oxalate crystallization by linear aspartic acid-rich peptides[J]. Langmuir: the ACS Journal of Surfaces and Colloids, 2006, 22(17): 7279-7285. DOI:10.1021/la060897z |
| [45] |
CHO K R, SALTER E A, DE YOREO J J, et al. Impact of chiral molecules on the formation of biominerals: A calcium oxalate monohydrate example[J]. Crystal Growth & Design, 2012, 12(12): 5939-5947. |
| [46] |
GROHE B, O'YOUNG J, IONESCU D A, et al. Control of calcium oxalate crystal growth by face-specific adsorption of an osteopontin phosphopeptide[J]. Journal of the American Chemical Society, 2007, 129(48): 14946-14951. DOI:10.1021/ja0745613 |
| [47] |
VISWANATHAN P, RIMER J D, KOLBACH A M, et al. Calcium oxalate monohydrate aggregation induced by aggregation of desialylated Tamm-Horsfall protein[J]. Urological Research, 2011, 39(4): 269-282. DOI:10.1007/s00240-010-0353-7 |
| [48] |
SHENG X, JUNG T, WESSON J A, et al. Adhesion at calcium oxalate crystal surfaces and the effect of urinary constituents[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(2): 267-272. DOI:10.1073/pnas.0406835101 |
| [49] |
KÖNIGSBERGER E, KÖNIGSBERGER L C. Thermodynamic modeling of crystal deposition in humans[J]. Pure and Applied Chemistry, 2001, 73(5): 785-797. DOI:10.1351/pac200173050785 |
| [50] |
RINAUDO C, BOISTELLE R. Theoretical and experimental growth morphologies of sodium urate crystals[J]. Journal of Crystal Growth, 1982, 57(2): 432-442. DOI:10.1016/0022-0248(82)90500-0 |
| [51] |
CHIH M H, LEE H L, LEE T. The culprit of gout: Triggering factors and formation of monosodium urate monohydrate[J]. CrystEngComm, 2016, 18(2): 290-297. DOI:10.1039/C5CE01656H |
| [52] |
PERRIN C M, DOBISH M A, VAN KEUREN E, et al. Monosodium urate monohydrate crystallization[J]. CrystEngComm, 2011, 13(4): 1111-1117. DOI:10.1039/c0ce00737d |
| [53] |
LI M, LI S, TANG W, et al. Understanding the crystallization pathway of monosodium urate monohydrate in a biomimetic matrix[J]. Crystal Growth & Design, 2020, 20(2): 804-812. |
| [54] |
ZELLELOW A Z, ABIYE M, FINK D A, et al. Doping uric acid crystals. 1. uric acid dihydrate[J]. Crystal Growth & Design, 2010, 10(8): 3340-3347. |
| [55] |
ZELLELOW A Z, COX K A, FINK D A, et al. Doping uric acid crystals. 2. anhydrous uric acid[J]. Crystal Growth & Design, 2010, 10(8): 3348-3354. |
| [56] |
SOURS R E, FINK D A, SWIFT J A. Dyeing uric acid crystals with methylene blue[J]. Journal of the American Chemical Society, 2002, 124(29): 8630-8636. DOI:10.1021/ja026083w |
| [57] |
FINK D A, SOURS R E, SWIFT J A. Modulated uric acid crystal growth in the presence of acridine dyes[J]. Chemistry of Materials, 2003, 15(14): 2718-2723. DOI:10.1021/cm021751y |
| [58] |
SOURS R E, FINK D A, COX K A, et al. Uric acid dye inclusion crystals[J]. Molecular Crystals and Liquid Crystals, 2005, 440(1): 187-193. DOI:10.1080/15421400590958250 |
| [59] |
LIU F, HOOKS D E, LI N, et al. Molecular crystal mechanical properties altered via dopant inclusion[J]. Chemistry of Materials, 2020, 32(9): 3952-3959. DOI:10.1021/acs.chemmater.0c00433 |
| [60] |
LIU F, HOOKS D E, LI N, et al. Mechanical properties of anhydrous and hydrated uric acid crystals[J]. Chemistry of Materials, 2018, 30(11): 3798-3805. DOI:10.1021/acs.chemmater.8b00939 |
| [61] |
LIU Y, JING J, OU C, et al. Self-suppression from metabolin with a precursor in pathology crystallization of gout[J]. CrystEngComm, 2019, 21(25): 3774-3778. DOI:10.1039/C9CE00214F |
| [62] |
ZHOU D, JIAO S, ZHANG P, et al. Elucidating the mechanism of nucleation inhibition of pathology crystallization of gout based on the evidence from amorphous form and in solution[J]. RSC Advances, 2022, 12(35): 22574-22580. DOI:10.1039/D2RA03289A |
| [63] |
MENG Y, QI Z, JIANG H, et al. Restrained MSUM crystallization via hydrogel composited membrane based platform for gout prevention and control[J]. Chemical Engineering Journal, 2022. DOI:10.1016/j.cej.2022.138155 |
| [64] |
RIMER J D, AN Z, ZHU Z, et al. Crystal growth inhibitors for the prevention of L-cystine kidney stones through molecular design[J]. Science, 2010, 330(6002): 337-341. DOI:10.1126/science.1191968 |
| [65] |
LIU Y, CHENG R, OU C, et al. Acetate: An alcohol metabolite as a growth promoter of pathological crystallization of gout[J]. Crystal Growth & Design, 2020, 20(5): 2842-2846. |
| [66] |
DA A, REN A, CHENG R, et al. Opposite effects of cations in enhancing and suppressing nucleation in the pathological crystallization of gout[J]. CrystEngComm, 2021, 23(47): 8411-8417. DOI:10.1039/D1CE01178B |
| [67] |
LI M, HAN D, GONG J. What roles do alkali metal ions play in the pathological crystallization of uric acid?[J]. CrystEngComm, 2022, 24(20): 3749-3761. DOI:10.1039/D2CE00107A |
| [68] |
PAREKH. In vitro growth and inhibition studies of monosodium urate monohydrate crystals by different herbal extracts[J]. American Journal of Infectious Diseases, 2009, 5(3): 225-230. DOI:10.3844/ajidsp.2009.225.230 |
| [69] |
OZONO C, HIRASAWA I, KOHORI F. Shape change and growth behavior of monosodium urate monohydrate in a gout model[J]. Chemical Engineering & Technology, 2017, 40(7): 1231-1234. |
| [70] |
MATSUMOTO M, WADA Y, OTSU R, et al. Controlling nucleation and crystal growth during reactive crystallization of monosodium urate monohydrate from simulated synovial fluid by N2 fine bubble injection[J]. Journal of Crystal Growth, 2020. DOI:10.1039/c8cc10050k |
| [71] |
MOLLOY R G E, SUN W, CHEN J, et al. Structure and cleavage of monosodium urate monohydrate crystals[J]. Chemical Communications, 2019, 55(15): 2178-2181. DOI:10.1039/C8CC10050K |
| [72] |
GONZALEZ R D, WHITING B M, CANALES B K. The history of kidney stone dissolution therapy: 50 years of optimism and frustration with renacidin[J]. Journal of Endourology, 2012, 26(2): 110-118. DOI:10.1089/end.2011.0380 |
| [73] |
CINI R, CHINDAMO D, CATENACCIO M, et al. Dissolution of calcium pyrophosphate crystals by polyphosphates: An in vitro and ex vivo study[J]. Annals of the Rheumatic Diseases, 2001, 60(10): 962-967. DOI:10.1136/ard.60.10.962 |
| [74] |
NING Y, ARMES S P. Efficient occlusion of nanoparticles within inorganic single crystals[J]. Accounts of Chemical Research, 2020, 53(6): 1176-1186. DOI:10.1021/acs.accounts.0c00103 |
| [75] |
PFUND L Y, PRICE C P, FRICK J J, et al. Controlling pharmaceutical crystallization with designed polymeric heteronuclei[J]. Journal of the American Chemical Society, 2015, 137(2): 871-875. DOI:10.1021/ja511106j |
| [76] |
ZUOXUAN Z, SI L, WEIWEI T, et al. 人体生物矿化与病态结晶研究进展[J]. Chinese Science Bulletin, 2022. DOI:10.1007/978-3-540-74761-1_2 |
| [77] |
MARKOV I V. Nucleation at surfaces[M]//Springer Handbook of Crystal Growth. Berlin, Heidelberg: Springer Berlin Heidelberg, 2010: 17-52
|
| [78] |
ZIBLAT R, FARGION I, LEISEROWITZ L, et al. Spontaneous formation of two-dimensional and three-dimensional cholesterol crystals in single hydrated lipid bilayers[J]. Biophysical Journal, 2012, 103(2): 255-264. DOI:10.1016/j.bpj.2012.05.025 |
| [79] |
EGAN T J, CHEN J Y J, DE VILLIERS K A, et al. Haemozoin (β-haematin) biomineralization occurs by self-assembly near the lipid/water interface[J]. FEBS Letters, 2006, 580(21): 5105-5110. DOI:10.1016/j.febslet.2006.08.043 |
| [80] |
GEORGIOU P G, MARTON H L, BAKER A N, et al. Polymer self-assembly induced enhancement of ice recrystallization inhibition[J]. Journal of the American Chemical Society, 2021, 143(19): 7449-7461. DOI:10.1021/jacs.1c01963 |
| [81] |
XIA Z, WANG L, HE G, et al. Morphology regulation of monosodium urate monohydrate crystals via fabricated uniform hydrogel slices[J]. Crystal Research and Technology, 2020. DOI:10.1016/j.cis.2020.102230 |
| [82] |
FAUSTINO C M C, LEMOS S M C, MONGE N, et al. A scope at antifouling strategies to prevent catheter-associated infections[J]. Advances in Colloid and Interface Science, 2020. DOI:10.1021/acsabm.2c00586 |
| [83] |
DURAND H, WHITELEY A, MAILLEY P, et al. Combining topography and chemistry to produce antibiofouling surfaces: A review[J]. ACS Applied Bio Materials, 2022. DOI:10.1089/end.2007.0218 |
| [84] |
CAUDA F, CAUDA V, FIORI C, et al. Heparin coating on ureteral Double J stents prevents encrustations: An in vivo case study[J]. Journal of Endourology, 2008, 22(3): 465-472. DOI:10.1089/end.2007.0218 |
| [85] |
TENKE P, RIEDL C R, JONES G L, et al. Bacterial biofilm formation on urologic devices and heparin coating as preventive strategy[J]. International Journal of Antimicrobial Agents, 2004, 23. |
| [86] |
TENKE P, RIEDL C R, JONES G L, et al. Bacterial biofilm formation on urologic devices and heparin coating as preventive strategy[J]. International Journal of Antimicrobial Agents, 2004, 23: 67-74. |
| [87] |
WEI Q, BECHERER T, MUTIHAC R C, et al. Multivalent anchoring and cross-linking of mussel-inspired antifouling surface coatings[J]. Biomacromolecules, 2014, 15(8): 3061-3071. DOI:10.1021/bm500673u |
| [88] |
张嘉希, 黄赤兵, 许晓婷, 等. 带双线输尿管支架管在老年男性上尿路手术中的应用[J]. 中华老年多器官疾病杂志, 2017, 16(7): 531-532. ZHANG Jiaxi, HUANG Chibing, XU Xiaoting, et al. Application of double-line ureteral stent in upper urinary tract surgery of elderly men[J]. Chinese Journal of Multiple Organ Diseases in the Elderly, 2017, 16(7): 531-532. (in Chinese) |
| [89] |
叶卫东, 何荣通. 带双线输尿管支架管在上尿路手术中的应用效果分析[J]. 当代医学, 2012, 18(22): 110-110. YE Weidong, HE Rongtong. Analysis of application effect of double-line ureteral stent in upper urinary tract surgery[J]. Contemporary Medicine, 2012, 18(22): 110-110. (in Chinese) |
| [90] |
丁国庆, 芮雪芳, 张大宏, 等. 上尿路手术中腹腔镜直视下双J导管的放置方法[J]. 中华外科杂志, 2007, 45(4): 287-288. DING Guoqing, RUI Xuefang, ZHANG Dahong, et al. Placement method of double J catheter under laparoscopy in upper urinary tract surgery[J]. Chinese Journal of Surgery, 2007, 45(4): 287-288. (in Chinese) |
| [91] |
李志坚, 毛亚南, 杨诚, 等. 双J管内引流在上尿路手术中的应用[J]. 临床外科杂志, 2002(S1): 50-51. LI Zhijian, MAO Yanan, YANG Cheng, et al. An application of double J tube internal drainage to the operation of upper urinary tract(Report of 104 cases)[J]. Journal of Clinical Surgery, 2002(S1): 50-51. (in Chinese) |
| [92] |
高文喜, 谈太生, 詹呜. 双J支架管和肾造瘘管在复杂上尿路手术中的应用[J]. 临床泌尿外科杂志, 1997, 12(2): 118-118. GAO Wenxi, TAN Taisheng, ZHAN Wu. Application of double J stent tube and nephrostomy tube in complicated upper urinary tract surgery[J]. Journal of Clinaical Urology, 1997, 12(2): 118-118. (in Chinese) |
| [93] |
CHEW B H, CADIEUX P A, REID G, et al. In-vitro activity of triclosan-eluting ureteral stents against common bacterial uropathogens[J]. Journal of Endourology, 2006, 20(11): 949-958. |
| [94] |
QIAN G, ZHANG L, LIU X, et al. Silver-doped bioglass modified scaffolds: A sustained antibacterial efficacy[J]. Materials Science and Engineering: C, 2021, 129: 112425. |
| [95] |
CHAKRAVARTI A, GANGODAWILA S, LONG MICHAEL J, et al. An electrified catheter to resist encrustation by proteus mirabilis biofilm[J]. The Journal of Urology, 2005, 174(3): 1129-1132. |
| [96] |
EPSTEIN A K, WONG T S, BELISLE R A, et al. Liquid-infused structured surfaces with exceptional anti-biofouling performance[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(33): 13182-13187. |
| [97] |
MACCALLUM N, HOWELL C, KIM P, et al. Liquid-infused silicone as a biofouling-free medical material[J]. ACS Biomaterials Science & Engineering, 2015, 1(1): 43-51. |
| [98] |
LAVIELLE N, ASKER D, HATTON B D. Lubrication dynamics of swollen silicones to limit long term fouling and microbial biofilms[J]. Soft Matter, 2021, 17(4): 936-946. |
| [99] |
WU Q, LIU D, CHEN W, et al. Liquid-like layer coated intraocular lens for posterior capsular opacification prevention[J]. Applied Materials Today, 2021. DOI:10.1007/s11998-021-00559-w |
| [100] |
SETH M, JANA S. Fabrication and multifunctional properties of fluorine-free durable nickel stearate based superhydrophobic cotton fabric[J]. Journal of Coatings Technology and Research, 2022, 19(3): 813-827. |
| [101] |
SONG L, SUN L, ZHAO J, et al. Synergistic superhydrophobic and photodynamic cotton textiles with remarkable antibacterial activities[J]. ACS Applied Bio Materials, 2019, 2(7): 2756-2765. |
| [102] |
MAGYAR A, ARTHANAREESWARAN V K A, SOóS L, et al. Does micropattern (sharklet) on urinary catheter surface reduce urinary tract infections? Results from phase I randomized open label interventional trial[J]. European Urology Supplements, 2017, 16(3): e146-e148. |
 2023, Vol. 40
2023, Vol. 40