2. 河南工业大学化学化工学院, 郑州 450001
2. School of Chemical Engineering and Environment, Henan University of Technology, Zhengzhou 450001, China
随着我国机动车保有量的迅猛增长,汽车尾气排放的氮氧化物在城市大气中所占比率越来越高,对自然环境和人类健康带来严重危害[1]。稀燃汽油机通过电控单元和节气门的调节,发动机在60~90 s的稀燃(富氧)阶段后转入3~5 s的富燃(贫氧)阶段,持续交替运行,稀燃阶段和富燃阶段周期性循环[2-3]。针对这种工况下NOx的消除,传统的三元催化剂操作窗口较窄,远远跟不上氮氧化物的生成速度,无法达到排放标准[4]。NOx储存-还原技术(NOx storage-reduction, NSR),是1994年Toyota公司提出的一种新型的稀燃NOx脱除方法,也称为稀燃NOx阱(Lean NOx trap,LNT)。这种技术已经率先在日本的稀燃汽油车上实现了商业化,NOx的净化效率可达到70%~90%,是非常有前景的一种NOx消除方法[5-7]。
然而,传统的NSR催化剂中贵金属Pt的含量高达1%甚至更多[8-9],成本高昂成为制约催化剂实际应用的一个瓶颈。2010年Kim等[7]报道添加Sr的LaCoO3和LaMnO3钙钛矿在300~350 ℃对NO-to-NO2的这一关键步骤有很高的活性,有望替代传统的Pt/Ba/Al2O3催化剂,成为新一代的NSR催化剂。在这种新型NSR催化剂中,Sr取代Ba作为NOx的储存中心。LaCoO3钙钛矿取代贵金属Pt作为氧化还原中心,这样既能提高催化剂的稳定性也能降低制造成本。据文献[10-16]报道,碱金属或碱土金属的引入,能够提高钙钛矿的碱性,增加表面碳酸盐的含量,有利于NOx的储存。稀燃-富燃循环气氛中NOx的脱除不仅取决于储存相,还涉及到NOx储存后的释放与还原,是催化剂储存中心和氧化还原中心协同作用的结果。
不同Sr的引入方法势必会影响碳酸盐储存相的分布,影响2种活性中心之间的距离和相互作用。基于这种思路,本实验设计了3种不同的Sr加入方法,即柠檬酸络合法、浸渍法和机械混合法,比较不同制备方法得到的La-Sr-Co复合氧化物的NO氧化能力、NOx储存性能和NOx的脱除效率,并通过XRD和FT-IR技术手段进行表征,分析验证不同引入Sr的方法对催化剂性能的影响。
1 实验部分 1.1 催化剂制备柠檬酸络合法:称量适量金属盐La(NO3)3·6H2O、Co(NO3)2·6H2O和Sr(NO3)2溶于去离子水中,之后依次加入柠檬酸(CA)和乙二胺四乙酸(EDTA),超声至溶解。金属元素La:Sr:Co的物质的量之比为0.7:0.3:1.0。总金属离子、柠檬酸(CA)和乙二胺四乙酸(EDTA)的物质的量之比为1.0:1.0:1.5。然后,用氨水调节溶液的pH值至4~5,在80 ℃水浴中连续搅拌得到紫色凝胶,转移到真空干燥箱中80 ℃干燥12 h。将烘干后的样品先在300 ℃焙烧2 h,使柠檬酸和EDTA分解,再转移到管式炉中,在流动空气气氛条件下,以5 ℃ ·min-1升温至600 ℃焙烧6 h,焙烧后得到黑色粉末,压片造粒备用。该催化剂标记为LSC-CA。
浸渍法:柠檬酸络合法制备LaCoO3钙钛矿,具体步骤同上,n(La):n(Co)限定为0.7:1.0。等体积浸渍Sr(NO3)2水溶液,浸渍量为11.4%(质量分数,下同)。静置12 h后,在管式炉中,流动空气气氛条件下580 ℃焙烧6 h,得到的催化剂标记为LSC-IM。
机械混合法:柠檬酸络合法制备LaCoO3钙钛矿,具体步骤同上,n(La):n(Co)限定为0.7:1.0。将适量的LaCoO3钙钛矿粉末与SrCO3放于研钵中充分粉碎研磨,得到的催化剂标记为LSC-MB。
3种制备方法中各金属元素的含量保持一致。为进行比较,本研究也采用柠檬酸络合法制备了纯LaCoO3钙钛矿[n(La):n(Co)限定为1:1],得到的催化剂标记为LaCoO3。
1.2 催化剂活性测试 1.2.1 NO氧化和稳态NOx储存性能测试NOx储存性能测试在内径为4 mm的不锈钢固定床反应器中进行。汽车尾气模拟气(体积分数,下同)为800×10-6 NO,5% O2,N2作为平衡气,总流速400 mL/min,空速60 000 mL·g-1·h-1,催化剂的用量为400 mg。各气体流速通过质量流量计来控制,NOx储存在300 ℃进行。用Model 42i-HL型氮氧化物分析仪(Thermo Scientific)在线记录反应器出口气体中NOx的浓度。
NOx储存量(NOx storage capacity,NSC)和CO2脱附量(CO2 desorption capacity,CDC)通过式(1)和式(2)进行计算。
| $ \begin{array}{*{20}{c}} {{\rm{NSC}} = \frac{{{{\left[ {{\rm{N}}{{\rm{O}}_x}} \right]}_{{\rm{inlet}}}}Vt}}{{{N_{\rm{o}}}m}} \times }\\ {\frac{{{{\left[ {{\rm{N}}{{\rm{O}}_x}} \right]}_{{\rm{inlet}}}}t - \int_0^t {{{\left[ {{\rm{N}}{{\rm{O}}_x}} \right]}_{{\rm{outlet}}}}} {\rm{d}}t}}{{{{\left[ {{\rm{N}}{{\rm{O}}_x}} \right]}_{{\rm{lista}}}}t}} \times {{10}^{ - 6}}} \end{array} $ | (1) |
| $ {\rm{CDC}} = \frac{{\int_0^t {{{\left[ {{\rm{C}}{{\rm{O}}_2}} \right]}_{{\rm{outlet }}}}} Vt}}{{{N_0}m}} \times {10^{ - 6}} $ | (2) |
NO转化率(NO-to-NO2 conversion,XNO)通过式(3)进行计算:
| $ {X_{{\rm{NO}}}} = \frac{{{{\left[ {{\rm{N}}{{\rm{O}}_2}} \right]}_{{\rm{eq}}}}}}{{{{\left[ {{\rm{N}}{{\rm{O}}_x}} \right]}_{{\rm{eq}}}}}} \times 100\% $ | (3) |
式(3)中:[NOx]inlet、[NOx]outlet和[CO2]outlet分别代表气体进、出口的浓度,单位为10-6;V代表进料气体体积流速,为400 mL·min-1;N0代表标准状况下气体摩尔体积,为22.4 L·mol-1;m代表催化剂的质量,为400 mg;t是储存时间,单位为min;XNO代表储存于催化剂中的NOx的量与整个储存过程中通入的NOx的量的比值;[NO2]eq和[NOx]eq分别代表储存达到平衡时气体的浓度,单位为10-6。
1.2.2 循环NOx储存-还原性能测试NOx储存还原(NSR)循环性能测试在内径为4 mm的不锈钢管固定床反应器中进行,以2路气氛来分别来模拟贫燃气氛和富燃气氛,贫富燃气氛的切换通过四通阀来实现,切换时间(min)为4/1。将贫燃气氛记作氧化路,其气体组成为以N2为平衡气,500×10-6 NO,体积分数为5%的O2,气体总流速为150 mL·min-1;将富燃气氛记作还原路,其气体组成为以N2为平衡气,500×10-6 NO,1 000×10-6 C3H6,气体总流速为150 mL·min-1。NOx储存-还原测试在300 ℃进行。用Model 42i-HL型氮氧化物分析仪(Thermo Scientific)在线记录反应器出口气体中NOx的浓度,用CXH-104C型红外线气体分析仪在线检测和记录CO和CO2气体。
循环气氛下催化剂的NOx脱除效率(NOx removal efficiency,NRE)由式(4)计算得出。
| $ {\rm{NRE}} = \frac{{{{\left[ {{\rm{N}}{{\rm{O}}_x}} \right]}_{{\rm{inlet }}}}\left( {{t_2} - {t_1}} \right) - \int_{{t_1}}^{{t_2}} {{{\left[ {{\rm{N}}{{\rm{O}}_x}} \right]}_{{\rm{outlet }}}}} {\rm{d}}t}}{{{{\left[ {{\rm{N}}{{\rm{O}}_x}} \right]}_{{\rm{inlet }}}}\left( {{t_2} - {t_1}} \right)}} \times 100\% $ | (4) |
式(4)中:[NOx]inlet和[NOx]outlet分别代表NOx进、出口的浓度,单位为10-6;t1、t2分别是1个循环起始和终止的时间。
1.3 催化剂的表征 1.3.1 X射线衍射分析(XRD)测试X射线衍射分析测试是在德国布鲁克AXS公司生产的D8 Fouces X’pert Pro型衍射仪进行。采用Cu靶Kα射线作为X射线源,设定操作电压电流分别为40 kV和40 mA。扫描范围为2θ=10°~90°,采集步长0.02°。
1.3.2 透射电子显微镜(TEM)测试催化剂的微观结构是通过型号为Philips Techai G2F2的发射透射电子显微镜进行测试的,操作电压设为200 kV。在测试前,取少量催化剂溶于乙醇中并且经过超声波分散后,将催化剂溶液滴到铜网支撑碳膜上,干燥后对铜网支撑碳膜进行测试。
1.3.3 傅里叶变换红外光谱(FT-IR)测试FT-IR测试在Thermo Nicolet公司生产的Nexus FT-IR红外光谱仪上进行。所测样品采用KBr压片处理:样品与KBr以1:100的质量比混合,与KBr研磨均匀后压片进行测试。红外测试谱图的扫描范围4 000~400 cm-1,扫描次数64,其分辨率4 cm-1。
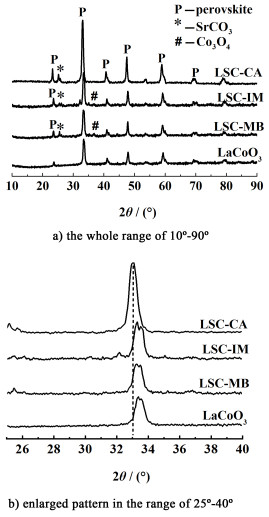
2 结果与讨论 2.1 催化剂的物相分析图 1是不同催化剂样品的XRD图。
|
| 图 1 不同样品的XRD谱图 Fig.1 XRD patterns of the samples |
| |
根据图 1,LaCoO3钙钛矿氧化物样品在2θ为23.21°、33.05°、47.45°和58.92°都处出现钙钛矿的特征衍射峰(JCPDS No. 36-1393)。相对于LaCoO3钙钛矿氧化物样品,LSC-CA样品的2θ值向小角度方向偏移,说明柠檬酸络合法制备的样品中离子半径较大的Sr2+(0.112 nm)取代了原来离子半径较小的La3+(0.106 nm)的位置,钙钛矿的晶格发生膨胀[17];LSC-IM和LSC-MB样品的主要衍射峰位置不变。同时,可以观察到,相较于纯LaCoO3钙钛矿氧化物样品,所有含Sr的催化剂样品在2θ=25.04°处出现新的衍射峰,归属为SrCO3相(JCPDS No. 02-0397)。根据谢乐公式计算了SrCO3的晶粒大小LSC-MB>LSC-CA>LSC-IM。除此之外,浸渍法和机械混合法得到的样品LSC-IM和LSC-MB样品上还有Co3O4相(JCPDS No. 43-1003),说明在体相钙钛矿之外的非计量Co元素以Co3O4相存在。
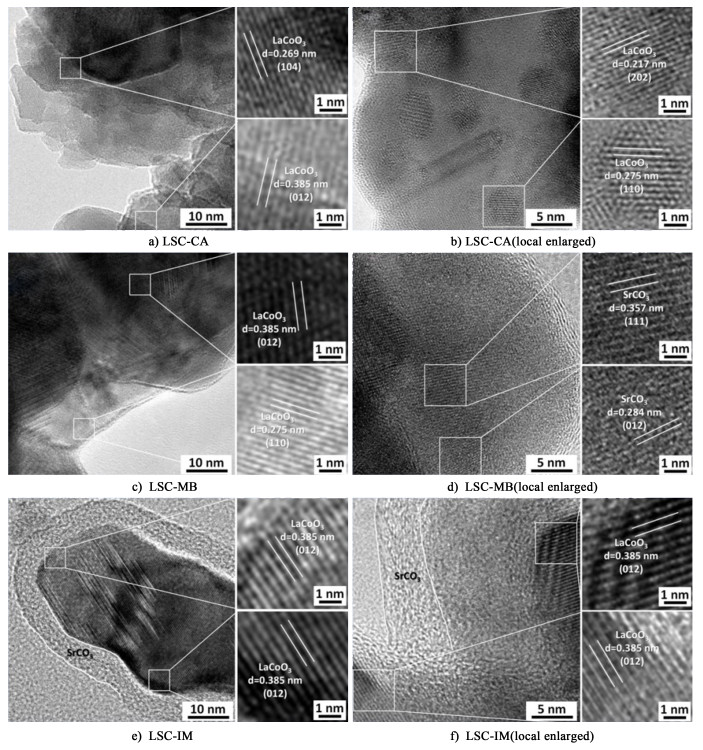
2.2 催化剂的透射电子显微分析图 2为催化剂样品的TEM图。图 2a)和图 2b)为LSC-CA样品的TEM图,图 2c)和图 2d)为LSC-MB样品的TEM图,图 2e)和图 2f)为LSC-IM样品的TEM图。
|
| 图 2 样品的TEM图 Fig.2 TEM images of the samples |
| |
从图 2a)中可以看出样品的晶面间距与LaCoO3钙钛矿相一致,从图 2b)中可以看出,样品中有少量的无定型碳酸盐覆盖在钙钛矿表面,使样品衬度下降,晶格条纹变得模糊。结合XRD结果,说明LSC-CA样品中的物相主要以Sr掺杂的LaCoO3钙钛矿为主,少量的Sr物种形成了无定型的SrCO3,覆盖在钙钛矿表面。从图 2c)和图 2d)中可以看出样品中存在2种物相,分别是LaCoO3钙钛矿相和SrCO3相。TEM图中明显看到SrCO3的晶格条纹,说明机械混合的样品中SrCO3以大颗粒形式存在,与钙钛矿松散接触。,从图 2e)和图 2f)中可以看出,浸渍法制备的样品在LaCoO3钙钛矿表面形成了一层无定型SrCO3覆盖层。LSC-CA和LSC-IM样品中SrCO3晶粒较小,均匀分布在LaCoO3钙钛矿表面,与钙钛矿相接触紧密。
2.3 稳态气氛下的NOx储存-还原一般认为,NO的捕获过程是NO被催化剂氧化为NO2后,以硝酸盐(NO3-)形式储存在碳酸盐上[6]。表面碳酸盐是主要的储存相,主要反应如式(5)~(7):
| $ {\rm{NO}} + 1/2{{\rm{O}}_2} \to {\rm{N}}{{\rm{O}}_2} $ | (5) |
| $ {\rm{SrC}}{{\rm{O}}_3} + 2{\rm{NO}} + 3/2{{\rm{O}}_2} \to {\rm{Sr}}{\left( {{\rm{N}}{{\rm{O}}_3}} \right)_2} + {\rm{C}}{{\rm{O}}_2} $ | (6) |
| $ {\rm{SrC}}{{\rm{O}}_3} + 2{\rm{N}}{{\rm{O}}_2} + 1/2{{\rm{O}}_2} \to {\rm{Sr}}{\left( {{\rm{N}}{{\rm{O}}_3}} \right)_2} + {\rm{C}}{{\rm{O}}_2} $ | (7) |
实验过程中发现NOx储存过程伴随大量CO2的脱附,NOx的储存阶段与CO2的释放阶段对应。理论上释放出1 mol的CO2对应着2 mol的NOx储存,因此,将2倍CO2脱附量(CO2 desorption capacity,简写为CDC)对应碳酸盐对NOx储存的贡献。为定量计算SrCO3对NOx储存的贡献,本研究记录了CO2的释放曲线,通过积分计算120 min内NOx储存量和CO2释放量。
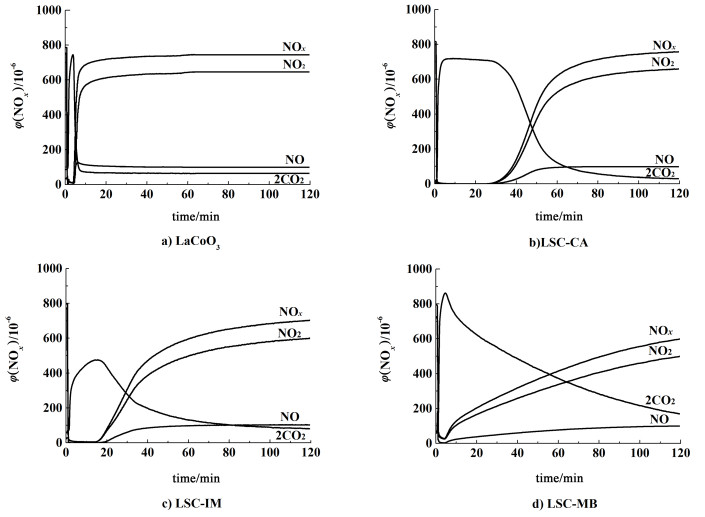
图 3是不同样品在NO+O2稳态气氛下NOx的储存和CO2的释放曲线。
|
| 图 3 样品的NOx储存曲线和CO2释放曲线图 Fig.3 NOx storage and CO2 release profiles of the samples |
| |
从NOx储存曲线可以看出,在最初阶段,经过催化剂床层后,NOx浓度瞬间降低;随着NOx在催化剂上储存达到饱和,NOx浓度又恢复到初始浓度水平。加入Sr后,NOx在LSC-CA和LSC-IM样品上的储存过程中出现了完全吸附现象,NOx的出口浓度基本为0,这一阶段称之为“NOx阱”[6]。LSC-CA样品的吸附阱的时间为29.3 min,LSC-IM样品的吸附阱时间为15.2 min。在LSC-MB样品上没有出现NOx完全吸附的情况,并且长时间内无法恢复到初始浓度,主要原因是机械混合法样品上的SrCO3晶粒尺寸大,体相SrCO3参与NOx储存的反应速率很低,导致NOx的储存难以达到饱和吸附。
表 1列出了催化剂上NO到NO2转化率。与纯LaCoO3样品相比,引入Sr后,NO转化率略有降低,催化剂的NO到NO2转化率顺序为LSC≌LSC-CA>LSC-IM>LSC-MB,推测大量的SrCO3晶粒分布在Co周围降低了NO的氧化速率,晶粒越大这种效应越明显。与此同时,NOx储存量却大大提高,说明加入Sr后,形成的SrCO3相在储存过程中起到重要作用。
| Sample | NSC (120 min)/ (mmol·g-1) |
2CDC (120 min)/ (mmol·g-1) |
XNO/ % |
NRE/ % |
| LaCoO3 | 418.6 | 446.4 | 87.8 | 9.7 |
| LSC-CA | 2 007.6 | 1 584.1 | 87.1 | 70.5 |
| LSC-IM | 1 700.7 | 2 042.0 | 85.3 | 85.4 |
| LSC-MB | 2 166.4 | 2 166.5 | 83.4 | 72.1 |
在表 1中,LSC-CA样品上,NSC值大于2CDC值,说明SrCO3的含量较少,NOx除了吸附在SrCO3位上之外,还有部分NOx吸附在钙钛矿晶格中的SrO位上,也生成Sr(NO3)2;LSC-IM样品上,NSC值小于2CDC值,说明表面SrCO3的含量较高,除储存NOx外,还可以在300 ℃发生分解释放出更多的CO2;LSC-MB样品上,NSC值与2CDC值相当,从曲线特性看,与NOx储存速率一样,CO2的释放速率也非常缓慢,说明从碳酸盐到硝酸盐的转化速率非常低。
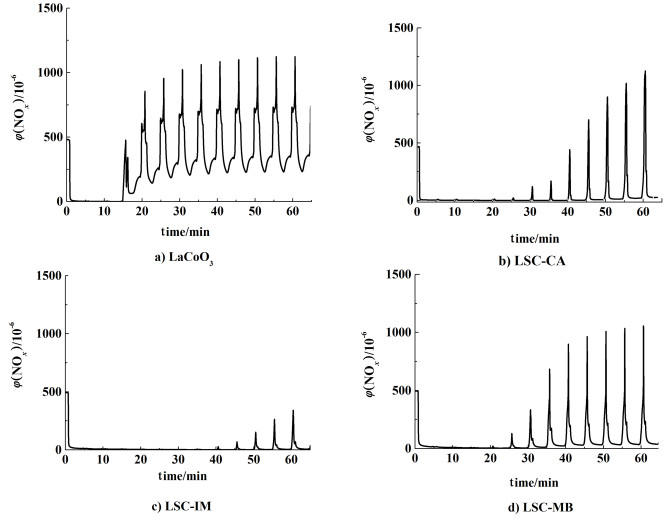
2.4 循环气氛下的NOx储存-还原图 4是不同样品贫燃-富燃切换气氛(4 min/1 min)中NOx的储存-还原曲线。在循环气氛中,富燃阶段(氧化气氛)NOx被氧化储存,贫燃阶段(还原气氛)NOx脱附还原,储存位再生,NOx总的脱除效率取决于储存位和氧化还原位的协同作用。本研究计算了各样品在循环气氛中稳定后的NOx脱除效率,具体见表 1。NOx的脱除效率LSC-IM> LSC-MB> LSC-CA,而通过NOx储存曲线得到NSC值LSC-MB>LSC-CA>LSC-IM,说明LSC-IM样品上储存位(主要是SrCO3)的再生效率较高,因此能持续的吸附-脱附-再吸附NOx。5个循环之后,LaCoO3样品尾气中的NOx体积分数始终保持在200×10-6以上,NOx无法完全储存,计算最后1个循环中NOx脱除效率仅为9.7%。经过多个循环之后,3个催化剂样品上都有NOx溢出。LSC-MB和LSC-CA的瞬间溢出量甚至超出入口浓度,说明在贫燃阶段大量NOx被释放,但又不能被还原或再储存。相比于纯LaCoO3, 加入Sr后所有样品的NOx脱除效率都大大提高。LSC-IM样品的脱除效率最高达到85.4%,分析原因在于浸渍法引入的Sr多以表面SrCO3形式存在,颗粒小,储存效率高;另外,储存位与氧化还原位的距离较近,紧密接触,协同作用强,储存的NOx更容易被还原。而LSC-MB样品上虽然SrCO3含量较高,但大晶粒不容易再生;LSC-CA样品上SrCO3含量较少,还有部分是以钙钛矿中“SrO”存在,再生性能也较差。
|
| 图 4 样品的NOx储存还原循环曲线 Fig.4 The NOx storage reduction curves of the samples |
| |
图 5给出了新鲜样品、稳态储存后、循环储存/还原后各样品的红外谱图。
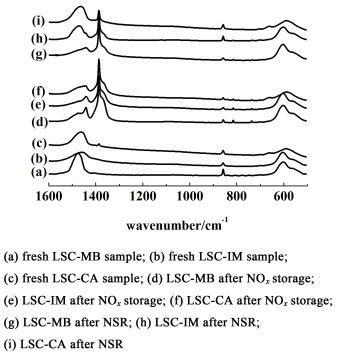
|
| 图 5 不同样品的FT-IR谱图 Fig.5 The FT-IR spectra of the samples |
| |
图 5中1 471和858 cm-1为碳酸盐特征峰[18],1 440、1 384和1 362 cm-1为硝酸盐物种的特征峰,其中,1 438 cm-1为单齿硝酸盐的特征峰,1 384 cm-1为自由硝酸根离子特征峰,1 362 cm-1为钙钛矿上的硝酸根离子[16, 19-20]。LSC-MB、LSC-IM和LSC-CA样品中含有大量碳酸盐,稳态NOx储存后大部分碳酸盐峰消失,出现3种硝酸盐的红外峰:单齿硝酸盐(1 440 cm-1),自由硝酸根离子(1 384 cm-1)和钙钛矿上的硝酸根离子(1 362 cm-1)。储存-还原循环后,硝酸盐分解,碳酸盐峰重新出现。而在LSC-MB储存还原后的样品上却没有重新出现碳酸盐的峰,推测可能是形成了体相的硝酸盐使得其难以在还原气氛中分解释放出NOx。
结果表明,样品在长时间的NO气氛处理后,碳酸盐基本都能转化为硝酸盐。但在稀燃-富燃不断切换的气氛中,大晶粒的SrCO3(LSC-MB样品)一旦转化为硝酸盐就很难还原或分解,而高度分散的小晶粒SrCO3(LSC-IM和LSC-CA样品)更容易在富燃阶段释放NOx,储存中心能不断再生,达到连续稳定的净化效果。NOx最终的脱除效果取决于储存中心和氧化还原中心的协同作用。
3 结论在LaCoO3中引入碱土金属Sr后,催化剂无论在稳态气氛中的NOx储存量还是循环气氛中的NOx脱除效率都大大增加。不同制备方法引入Sr的结果不同。通过对比储存过程中CO2释放曲线和NOx储存曲线发现,柠檬酸络合法LSC-CA样品中表面碳酸盐的量相对较少,主要是因为引入的Sr部分进入到钙钛矿晶格中;机械混合法LSC-MB样品中大量的SrCO3以大晶粒存在,NOx储存缓慢,同时也很难在还原气氛中再生;浸渍法得到的LSC-IM样品中都以小晶粒SrCO3存在,与Co中心的协同作用强,再生效率高,在模拟机动车尾气的富燃-贫燃循环气氛中NOx脱除效率最高达到85.4%。
| [1] |
范秀英, 张微, 韩圣慧. 我国汽车尾气污染状况及其控制对策分析[J]. 环境科学, 1999, 20(5): 102-108. Fan Xiuying, Zhang Wei, Han Shenghui. Vehicle pollution situation and its control in China[J]. Chinese Journal of Enviromental Science, 1999, 20(5): 102-108. (in Chinese) |
| [2] |
王建昕. 汽车排气污染治理及催化转化器[M]. 北京: 化学工业出版社, 2000.
|
| [3] |
Kreuzer T, Lox E S, Lindner D, et al. Advanced exhaust gas aftertreatment systems for gasoline and diesel fuelled vehicles[J]. Catalysis Today, 1996, 29(1/2/3/4): 17-27. |
| [4] |
Heck R M, Farrauto R J. Automobile exhaust catalysts[J]. Applied Catalysis A:General, 2001, 221(1/2): 443-457. |
| [5] |
Shinjoh H, Takahashi N, Yokota K, et al. Effect of periodic operation over Pt catalysts in simulated oxidizing exhaust gas[J]. Applied Catalysis B:Environmental, 1998, 15(3/4): 189-201. |
| [6] |
Sedlmair C. Elementary steps of NOx adsorption and surface reaction on a commercial storage-reduction catalyst[J]. Journal of Catalysis, 2003, 214(2): 308-316. |
| [7] |
潘广宏, 孟明. 稀燃汽车尾气中氮氧化物的催化消除技术[J]. 化学工业与工程, 2011, 28(3): 67-73. Pan Guanghong, Meng Ming. Technology for the catalytic removal of nitrogen oxides in the lean-burn exhaust of vehicles[J]. Chemical Industry and Engineering, 2011, 28(3): 67-73. DOI:10.3969/j.issn.1004-9533.2011.03.015 (in Chinese) |
| [8] |
Kim C H, Qi G, Dahlberg K, et al. Strontium-doped perovskites rival platinum catalysts for treating NOx in simulated diesel exhaust[J]. Science, 2010, 327(5973): 1624-1627. DOI:10.1126/science.1184087 |
| [9] |
He X, Meng M, He J, et al. A potential substitution of noble metal Pt by perovskite LaCoO3 in ZrTiO4 supported lean-burn NOx trap catalysts[J]. Catalysis Communications, 2010, 12(3): 165-168. |
| [10] |
范丰奇, 孟明. 焙烧温度对CuO/K2CO3/TiO2催化剂NOx储存还原性能的影响[J]. 化学工业与工程, 2017, 34(2): 55-61. Fan Fengqi, Meng Ming. Effect of calcination temperature on the catalytic performance of non-platinic lean NOx trap catalyst CuO-K2CO3/TiO2[J]. Chemical Industry and Engineering, 2017, 34(2): 55-61. DOI:10.3969/j.issn.1006-7906.2017.02.011 (in Chinese) |
| [11] |
张成伍, 丁彤, 查宇清, 等. 锰负载量对NSR催化剂Mn-K2CO3/γ-Al2O3催化性能的影响[J]. 化学工业与工程, 2018, 35(2): 9-15. Zhang Chengwu, Ding Tong, Zha Yuqing, et al. Effect of manganese loading on catalytic performance of Mn-K2CO3/γ-Al2O3 catalysts for NSR[J]. Chemical Industry and Engineering, 2018, 35(2): 9-15. (in Chinese) |
| [12] |
Milt V G, Peralta M A, Ulla M A, et al. Soot oxidation on a catalytic NOx trap:Beneficial effect of the Ba-K interaction on the sulfated Ba, K/CeO2 catalyst[J]. Catalysis Communications, 2007, 8(5): 765-769. DOI:10.1016/j.catcom.2006.09.011 |
| [13] |
Luo J, Gao F, Kim D H, et al. Effects of potassium loading and thermal aging on K/Pt/Al2O3 high-temperature lean NOx trap catalysts[J]. Catalysis Today, 2014, 231: 164-172. DOI:10.1016/j.cattod.2013.12.020 |
| [14] |
Zhang Y, Meng M, Dai F, et al. States and function of potassium carbonate species in the polytitanate nanobelt supported catalysts used for efficient NOx storage and reduction[J]. The Journal of Physical Chemistry C, 2013, 117(45): 23691-23700. DOI:10.1021/jp406950u |
| [15] |
Xian H, Zhang X, Li X, et al. BaFeO 3-x Perovskite:An efficient NOx absorber with a high sulfur tolerance[J]. The Journal of Physical Chemistry C, 2010, 114(27): 11844-11852. DOI:10.1021/jp100197c |
| [16] |
Li X, Dong Y, Xian H, et al. De-NOx in alternative lean/rich atmospheres on La1-xSrxCoO3 perovskites[J]. Energy & Environmental Science, 2011, 4(9): 3351-3354. |
| [17] |
Chen S, Wang H, Liu Y. Perovskite La-St-Fe-O (St=Ca, Sr) supported nickel catalysts for steam reforming of ethanol:The effect of the A site substitution[J]. International Journal of Hydrogen Energy, 2009, 34(19): 7995-8005. DOI:10.1016/j.ijhydene.2009.08.007 |
| [18] |
Epling W S, Peden C H F, Szanyi J. Carbonate formation and stability on a Pt/BaO/γ-Al2O3 NOx storage/reduction catalyst[J]. The Journal of Physical Chemistry C, 2008, 112(29): 10952-10959. DOI:10.1021/jp712180q |
| [19] |
Hodjati S, Petit C, Pitchon V, et al. Absorption/Desorption of NOx process on perovskites:Nature and stability of the species formed on BaSnO3[J]. Applied Catalysis B:Environmental, 2000, 27(2): 117-126. |
| [20] |
Merino N A, Barbero B P, Grange P, et al. La1-xCaxCoO3 perovskite-type oxides:Preparation, characterisation, stability, and catalytic potentiality for the total oxidation of propane[J]. Journal of Catalysis, 2005, 231(1): 232-244. |
 2019, Vol. 36
2019, Vol. 36





