2. 天津市功能精细化学品技术工程中心, 天津 300354;
3. 天津化学化工协同创新中心, 天津 300072
2. Tianjin Engineering Research Center of Functional Fine Chemicals, Tianjin 300354, China;
3. Collaborative Innovation Center of Chemical Science and Engineering(Tianjin), Tianjin 300072, China
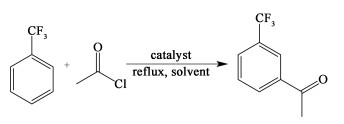
间三氟甲基苯乙酮(3-Trifluoromethyl acetophenone),简称TFAP,淡黄色液体,是合成甲氧基丙烯酯类化合物肟菌酯农药(Trifloxystrobin)的关键中间体,同时也是合成医药、染料等其他化学品的重要原料[1]。目前国内外报道了多种合成间三氟甲基苯乙酮的合成路线,凌岗等[2]以三氟甲苯为原料,在正丁基锂的催化作用下,一步合成间三氟甲基苯乙酮,反应条件苛刻,且正丁基锂价格昂贵,容易着火,生产操作极不安全;邱贵生等[3]以间氯三氟甲基苯为原料,经生成格氏试剂后与乙腈反应,合成过程中,加入金属镁可能会引发冲料风险,存在安全隐患;卜健鸿等[4]采用间三氟甲基苯胺重氮化后与乙醛肟偶合生成间三氟甲基苯乙酮肟,之后在盐酸中进一步水解,该方法可回收乙醛肟,并实现大部分乙醛肟的再生,但该生产技术流程操作复杂,重氮化反应为国家严控的本质危险生产工艺,安全措施要求校高,且排放大量生产废水,难于治理,造成环境污染等问题;孙绪兵等[5]将三氟甲苯与醋酸在催化剂的作用下缩合合成目标产物等。上述这些方法大多存在工艺操作步骤多、废水量大、环境污染以及安全隐患等问题[6]。而三氟甲苯上的三氟甲基属于强吸电基团,使得苯环钝化,三氟甲苯一步酰基化的反应不易发生。因此,现有的合成工艺没有直接采用一步酰基化的方法。针对现有工艺路线所存在的问题以及一步酰基化的技术挑战,本研究以三氟甲苯和乙酰氯为原料,采用固体酸催化的Friedel-Crafts酰基化反应来一步合成间三氟甲基苯乙酮(图 1),相比于以往的合成路线,该方法操作简便,目标产物选择性高,后处理时污染较少。
|
| 图 1 三氟甲苯经催化酰化制备间三氟甲基苯乙酮的合成路线 Fig.1 Synthetic route to m-trifluoromethyl acetophenone by catalytic acylation of trifluorotoluene |
| |
Friedel-Crafts酰基化反应是合成芳香酮的重要路线之一,是典型的酸催化反应[7],反应通常在Lewis酸(例如AlCl3)[8, 9]或Bronsted酸(例如H2SO4、HF或HCl)[10]存在下进行。然而,这些催化剂存在着严重缺陷,一方面催化剂使用量通常较大,另一方面后处理需要加酸分解络合物,产生大量酸性废水,会造成毒性、腐蚀、处理和处置方面的潜在危险等问题[11, 12]。因此,开发基于酸性固体催化剂的绿色高效工艺过程成为行业涉及此类反应亟需解决的关键技术问题。固体酸催化剂具有易于分离和重复使用的优势,且对酸催化有机反应具有优良的催化性能,为Friedel-Crafts酰基化反应的绿色发展开辟了全新思路[13, 14]。目前,用于Friedel-Crafts酰基化反应的固体酸催化剂主要有沸石分子筛[15, 16]、负载型固体酸[17, 18]、杂多酸[19, 20]、固体超强酸[21, 22]、金属有机骨架材料[23, 24]和离子液体[25, 26]等。负载型固体酸是将Lewis酸负载于载体上,具有催化剂用量少、选择性高、污染小等优点,本研究设计制备了数种负载型固体酸,研究其对三氟甲苯与乙酰氯的一步酰基化反应制备TFAP的催化性能,优化确定了该反应的较适宜工艺条件。
1 实验部分 1.1 仪器与试剂仪器:岛津LC-VP型液相色谱仪、赛默飞Thermo Kalpha X射线光电子能谱仪、麦克ASAP2460全自动比表面及孔隙度分析仪BET、TA SDT Q600热重分析仪、上海予华201恒温油浴锅。
试剂:三氟甲苯、乙酰氯、无水氯化铁、无水三氯化铝、无水氯化锌、氯化铬、γ-Al2O3、二氧化硅、二氧化钛、Hβ分子筛、HZSM-5分子筛、二氯甲烷、二氯乙烷、四氢呋喃、N, N-二甲基酰胺(DMF)均为市售化学纯试剂。
1.2 催化剂的制备合成了一系列负载型催化剂,由活性组分和负载体2部分组成。以Hβ分子筛、γ-Al2O3、SiO2等为催化剂的负载体材料,Lewis酸作为活性组分,所有催化剂均采用浸渍法制备。典型催化剂制备过程如下:将0.78 g FeCl3溶于10 mL去离子水中,搅拌至全溶,后加入8 g γ-Al2O3,室温下浸渍10 h,过滤并将其置于恒温干燥箱中110 ℃烘干10 h。其它催化剂的制备方法与此类似。
1.3 催化酰化反应实验氮气氛围下,在装有回流冷凝器和温度计的三口瓶中,分别加入7.3 g (0.05 mol)三氟甲苯,25 g 1, 2二氯乙烷,0.73 g催化剂,搅拌0.5 h后加入3.9 g (0.05 mol)乙酰氯,反应温度为50 ℃,反应时间为5 h。
反应结束后,离心分离催化剂,反应液加水洗涤,分离出有机相,旋蒸去除溶剂二氯乙烷后,采用减压蒸馏回收未反应的原料三氟甲苯,反应产物取样进行液相色谱分析。
1.4 检测方法使用岛津LC-VP型液相色谱仪检测反应液中各种物质的组成,使用面积归一法对组分含量进行定量分析,检测条件如下。色谱柱:C18(150 mm×4.6 mm,4.6 μm);检测器:UV检测器;流动相为乙腈、水和三氟乙酸混合物,体积比为300 ∶200 ∶1;流速:1.0 mL ·min-1;柱温:30 ℃;检测波长:254 nm。
1.5 催化剂的表征通过BET进行了比表面积分析,测定催化剂的比表面积和孔结构;采用XPS测量固体酸所负载的元素以及相对含量;经NH3-TPD测定其酸性位点与酸强度。
2 结果与讨论 2.1 催化剂的优化筛选本研究以三氟甲苯与乙酰氯为反应底物,首先选取传统的Lewis酸催化三氟甲苯与乙酰氯的酰基化反应,筛选出最佳的Lewis酸作为活性组分,再研究固体酸催化剂中负载体的种类对制备间三氟甲基苯乙酮反应选择性、转化率和收率的影响,反应结果见表 1。
| 编号 | 催化剂 | 用量/g | 转化率/% | 选择性/% | 收率/% |
| 1 | FeCl3 | 9.70 | 75.0 | 49 | 37.0 |
| 2 | AlCl3 | 8.00 | 61.0 | 42 | 26.0 |
| 3 | ZnCl2 | 8.10 | 1.2 | 99 | 1.2 |
| 4 | CrCl3 | 9.50 | 0 | 0 | 0 |
| 5 | FeCl3/γ-Al2O3 | 0.73 | 15.6 | 99 | 15.5 |
| 6 | FeCl3/SiO2 | 0.73 | 1.1 | 99 | 1.1 |
| 7 | FeCl3/TiO2 | 0.73 | 1.9 | 99 | 1.8 |
| 8 | FeCl3/Hβ | 0.73 | 8.4 | 99 | 8.3 |
| 9 | FeCl3/HZSM-5 | 0.73 | 2.5 | 99 | 2.5 |
由表 1中实验1~4可以得知,FeCl3单独作为催化剂时,对反应有较高的催化活性,且FeCl3相比于其余Lewis酸,要更安全、价格更便宜,因此选用FeCl3作为负载型催化剂的活性组分;对比表 1中实验5~9可知,选用负载体为γ-Al2O3时,催化剂对反应有较高的催化活性,三氟甲苯的转化率为15.5%,虽然相比于FeCl3收率有所降低,但FeCl3作为催化剂时,目标产物的选择性较低,仅为49%,且需要加入大量的催化剂,后处理还需要加入大量水以水解FeCl3,产生的含金属盐废水,造成严重环境污染等问题;将FeCl3负载到载体上时,目标产物的选择性高达99%,提高了原子经济性,降低了原料消耗成本,且克服了传统催化剂后处理困难等问题,符合绿色化学,有较好的发展前景。因此选用FeCl3为活性组分,γ-Al2O3为载体的固体酸催化剂较好。
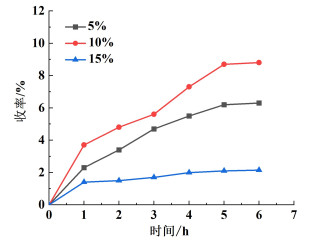
2.2 FeCl3的负载量对产品收率的影响研究了FeCl3负载量对产品收率的影响,结果如图 2所示。随着FeCl3的负载量由5%增加到10%,活性组分增加,目标产物的收率迅速提升。但当负载量达到15%的时候,在相同的反应条件下,目标产物的收率相比于负载量为10%时有所降低。一方面原因在于催化剂制备过程中FeCl3的用量增加,其在水中没有完全溶解,有部分水解为Fe(OH)3,进一步分解为Fe2O3;另一方面是当负载量过大时,FeCl3与Fe2O3在γ-Al2O3表面发生了多层覆盖,减少了有效活性位点,使得催化剂的催化活性降低。因此,FeCl3的负载量为10%时,其催化活性最高。
|
| 图 2 FeCl3负载量对产品收率的影响 Fig.2 Effect of FeCl3 loading on yield of product |
| |
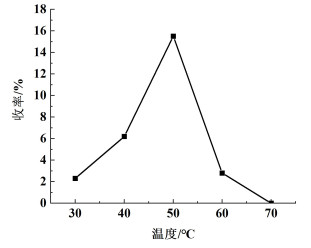
在30~70 ℃的温度范围内,考察了反应温度对产品收率的影响,结果如图 3所示。目标产物的收率随反应温度的增加而提高,但当温度超过50 ℃时,反应收率开始明显降低。当温度到达70 ℃时,收率仅为1.2%,原因在于FeCl3稳定性较差,容易分解为Fe2O3,失去催化活性。因此,反应温度为50 ℃时,催化制备产物结果最佳。
|
| 图 3 反应温度对产品收率的影响 Fig.3 Effect of reaction temperature on product yield |
| |
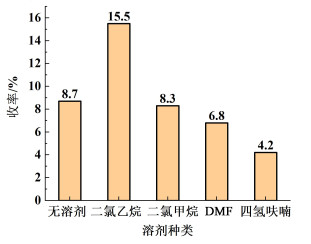
考察了不同溶剂对产品收率的影响,结果见图 4。
|
| 图 4 溶剂对产品收率的影响 Fig.4 Effect of solvent on product yield |
| |
由图 4的可以得知,二氯乙烷作为溶剂对反应有更好的促进效果。DMF与四氢呋喃作溶剂收率较低,且DMF沸点高,不利于回流反应。另外,二氯乙烷与水互溶度低,能更好地隔绝空气中水蒸气对反应的影响,且相比于二氯甲烷,更不易挥发。因此,综合考虑确定以二氯乙烷作为该反应的溶剂。
为了工业化生产应用,考虑对溶剂二氯乙烷进行回收套用,以便降低成本。采用减压蒸馏的方式回收溶剂,所回收溶剂加入无水硫酸钠进行干燥除水,溶剂回收率达到90%以上。如图 5所示,溶剂循环套用5次,转化率与选择性均没有降低。由此可见,该工艺过程中的溶剂二氯乙烷可有效回收套用,符合绿色化学的理念。
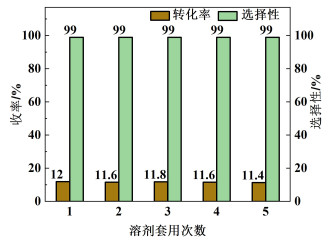
|
| 图 5 溶剂套用次数对产品收率影响 Fig.5 Effect of the cycle numbers of solvent applications on product yield |
| |
为了分析催化剂表面元素种类以及含量,对FeCl3/γ-Al2O3进行了XPS表征,如图 6所示,其中图 6(a)是FeCl3/γ-Al2O3的精细谱图,图 6(b)和图 6(c)分别为Cl和Fe的高分辨图。在FeCl3/γ-Al2O3的XPS宽光谱中可以发现Fe 2p和Cl 2p,这表明FeCl3成功地负载到γ-Al2O3上。从氯元素的精细谱中可以得知Cl 2p的结合能位于199.22 eV,说明氯元素是以FeCl3的形式存在,进一步证明了γ-Al2O3中存在FeCl3,FeCl3成功地负载到γ-Al2O3的表面。
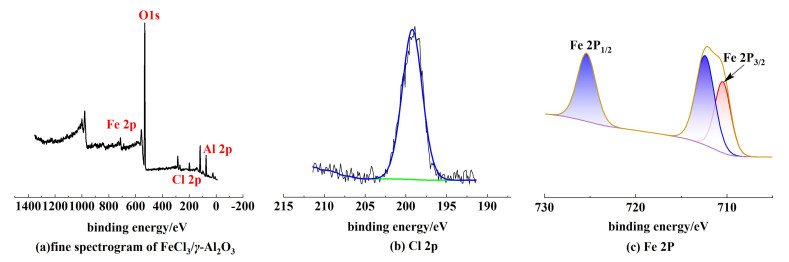
|
| 图 6 FeCl3/γ-Al2O3固体酸催化剂的XPS表征 Fig.6 XPS characterization of FeCl3/γ-Al2O3 solid acid catalysts |
| |
图 6(c)为铁元素的精细谱图,显示了铁元素的2个峰。在725.4和710.27 eV处的特征峰,分别对应于Fe 2p1/2和Fe 2p3/2,为Fe2O3的特征峰。在712.6 eV处检测的另外1个峰为FeCl3的特征峰。这3个峰分别对应于Fe—O、Fe—Cl。这表明在催化剂的制备过程中,少部分FeCl3在水中发生水解变为Fe(OH)3,在烘干的过程中进一步分解为Fe2O3,导致催化剂的催化活性降低。为了防止催化剂在反应过程中受空气中水蒸气的影响,加入溶剂二氯乙烷,一定程度上能隔绝空气对催化剂的影响,提高反应收率。
Friedel-Crafts酰基化反应是典型的亲电取代反应,其反应机理示意图见图 7。FeCl3负载在γ-Al2O3的表面,在反应过程中,1分子的乙酰氯首先吸附在γ-Al2O3的表面,进一步与FeCl3作用后脱去1个氯负离子,生成正碳离子中间体。三氟甲基属于强吸电基团,是间位定位基,会使苯环钝化,并使得新进入的取代基优先进入其间位,且新取代基乙酰基也会使得苯环进一步钝化,因此不易发生多酰化副反应。三氟甲苯吸附在γ-Al2O3表面的Lewis酸性位点,形成了局部的供电子区域,尤其增加了三氟甲苯苯环间位上的电子云密度,使得苯环活化,最后三氟甲苯与乙酰氯反应生成1分子的间三氟甲基苯乙酮,生成的产物脱附离去。反应中FeCl3活性组份与γ-Al2O3载体的协同作用,有效保证了催化过程的高选择性进行。
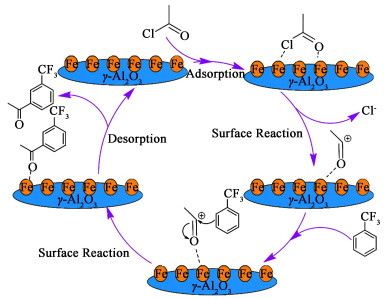
|
| 图 7 三氟甲苯与乙酰氯的催化反应机理示意图 Fig.7 Mechanism of catalytic reaction of trifluorotoluene with acetyl chloride |
| |
为了明确催化剂比表面积以及孔结构对反应的影响,对催化剂进行了N2等温吸附-脱附表征。FeCl3/γ-Al2O3的N2等温吸附脱附曲线如图 8(a)所示,属于IV型吸附-脱附曲线。在0.4~1.0分压区间内,脱附等温线与吸附等温线不重合,脱附等温线在吸附等温线上方,产生吸附滞后,形成了1个明显的回滞环,这表明催化剂具有介孔材料的特征;脱附等温线较为陡峭,说明材料在脱附时存在堵孔现象或空化蒸发引起的渗滤现象。为了更直观地比较负载体孔结构对反应的影响,根据等温线计算出了催化剂材料的孔径分布。由孔径分布图 8(b)可以得出,材料的孔径主要集中在3.7 nm左右,进一步证明FeCl3/γ-Al2O3是典型的介孔材料。本研究的催化介孔材料有利于反应物以及溶剂的传输,使得反应物更容易吸附在催化剂表面,与活性组分接触,促进反应更顺利进行。
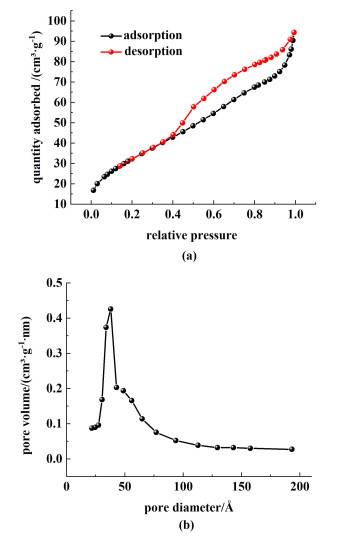
|
| 图 8 FeCl3/γ-Al2O3的(a) N2吸附-脱附等温线以及(b)孔径分布 Fig.8 (a) N2 adsorption-desorption isotherms and (b) pore size distribution of FeCl3/γ-Al2O3 |
| |
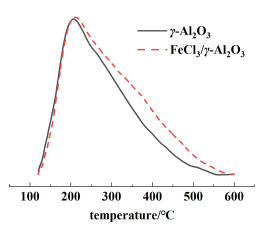
催化剂表面的酸强度和酸性位点分布对催化剂的活性有较大的影响,为了确定催化剂表面的酸性位点及其对催化性能的影响,对其进行了NH3-TPD分析,结果如图 9所示。
|
| 图 9 FeCl3/γ-Al2O3的NH3-TPD分析图 Fig.9 NH3-TPD analysis of FeCl3/γ-Al2O3 |
| |
从图 9中可以看出,催化剂主要存在一种强度的酸位,即脱附峰位于200~350 ℃之间的中强度酸位。当FeCl3负载在γ-Al2O3表面后,中强酸位的脱附温度有了明显提高,这说明中强酸位的酸强度得到了一定的提高,且总酸量增大。NH3-TPD数据分析表明,在催化三氟甲苯与乙酰氯的Friedel-Crafts酰基化反应中,起主要催化作用的酸位主要为中强度酸位。
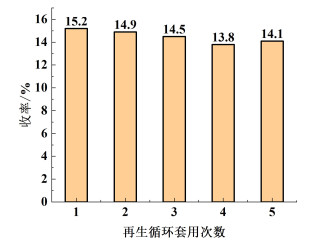
2.8 催化剂的再生循环套用对离心分离回收的催化剂进行再生套用,使用二氯乙烷对其进行超声清洗,之后将再生催化剂置于真空恒温干燥箱中于110 ℃烘干10 h,将其再次用于催化反应中,反应结果如图 10所示。
|
| 图 10 催化剂的再生循环套用 Fig.10 Regeneration cycle application of catalyst |
| |
从图 10中可以看出,催化剂在前2次的再生套用中催化活性基本不变,3次循环后,间三氟甲基苯乙酮的收率略有降低,这可能是因为催化剂的用量较少,在再生过程与转移过程中有一定的机械损失,从而导致了收率降低。总体来看,催化剂再生后的催化活性没有明显降低,可以循环套用。
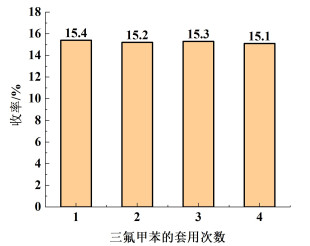
2.9 三氟甲苯的循环套用反应结束后,采用减压蒸馏对未反应的三氟甲苯进行回收,三氟甲苯的回收率达到了79.4%;补充新鲜的三氟甲苯,再将其用于三氟甲苯与乙酰氯的酰基化反应中,反应结果如图 11所示,考虑到多次套用之后,首次回收的三氟甲苯可能已经反应完全,故仅对此进行4次循环套用测试。
|
| 图 11 三氟甲苯的循环套用 Fig.11 Recycle application of trifluorotoluene |
| |
从图 11中可以得出,多次循环套用后反应收率没有明显降低,表明回收的三氟甲苯质量较好,可以进行回收套用。
3 结论(1) 较为系统地研究了固体酸催化三氟甲苯一步选择性制备间三氟甲基苯乙酮的Friedel-Crafts酰基化反应工艺。固体酸催化剂FeCl3/γ-Al2O3中FeCl3活性组分和γ-Al2O3负载体的协同作用表现出良好的催化效果。以二氯乙烷为溶剂,催化剂加入量为10%,在50 ℃回流的优化反应条件下,目标产物的选择性高达99%。相比于已有的合成工艺方法,该过程后处理简便、使用催化剂价格便宜、环境友好污染较小,符合绿色化学的理念;对实现行业关键中间体绿色经济型工业化生产具有重要意义。
(2) 催化剂回收再生处理后,多次循环套用仍保持优良催化活性;未反应的三氟甲苯通过减压蒸馏进行回收,回收的三氟甲苯在上述反应条件下进行反应,产品收率可以达到15.1%左右,表明回收的三氟甲苯质量较好,可以循环套用;溶剂二氯乙烷通过减压蒸馏的方式回收,回收率90%以上,循环套用5次,选择性与收率均没有明显降低。
(3) 在催化剂的制备过程中,有少量活性组分FeCl3水解为Fe(OH)3再受热分解为Fe2O3,不具备催化活性。因此,未来在制备过程中避免FeCl3的分解,保留其催化活性,延长使用寿命尚需要进一步研究。
| [1] |
周勇强, 薛勇, 向玉联. 间三氟甲基苯乙酮的合成[J]. 中国医药工业杂志, 2000, 31(2): 33-34. ZHOU Yongqiang, XUE Yong, XIANG Yulian. Synthesis of m-trifluoromethylacetophenone[J]. Chinese Journal of Pharmaceuticals, 2000, 31(2): 33-34. (in Chinese) |
| [2] |
凌岗, 殷亚林, 何建玲, 等. 一种合成间三氟甲基苯乙酮的方法: CN102690180A[P]. 2012-09-26
|
| [3] |
邱贵生, 杨芝. 间三氟甲基苯乙酮的合成新方法[J]. 浙江化工, 2009, 40(4): 1-2. QIU Guisheng, YANG Zhi. A new approach to m-trifluomethyl phenyl ethyl katone[J]. Zhejiang Chemical Industry, 2009, 40(4): 1-2. (in Chinese) |
| [4] |
卜健鸿, 常绚超. 间三氟甲基苯乙酮的合成工艺研究[J]. 浙江化工, 2013, 44(11): 5-7. BU Jianhong, CHANG Xuanchao. Study on the synthesis of 3-trifludromethylacetophenone[J]. Zhejiang Chemical Industry, 2013, 44(11): 5-7. (in Chinese) |
| [5] |
孙绪兵, 王同涛, 陈永平, 等. 一种间三氟甲基苯乙酮的制备方法: CN113956143A[P]. 2022-01-21
|
| [6] |
张学慧, 王丹丹. 间三氟甲基苯乙酮的合成新方法[J]. 化学试剂, 2017, 39(4): 446-448. ZHANG Xuehui, WANG Dandan. Synthesis of 3-trifluoromethyl-phenylethanone[J]. Chemical Reagents, 2017, 39(4): 446-448. (in Chinese) |
| [7] |
FRANCK H G, STADELHOFER J W. The future of aromatic chemistry[M]. Berlin, Heidelberg: Springer Berlin Heidelberg, 1988: 447-448.
|
| [8] |
PIVSA-ART S, OKURO K, MIURA M, et al. Acylation of 2-methoxynaphthalene with acyl chlorides in the presence of a catalytic amount of Lewis acids[J]. Journal of the Chemical Society, Perkin Transactions 1, 1994, 2(13): 1703-1707. |
| [9] |
乔兴龙, 胡学一, 方云. Friedel-Crafts酰基化催化剂的研究进展[J]. 化工进展, 2012, 31(12): 2702-2707. QIAO Xinglong, HU Xueyi, FANG Yun. Development of catalysts for Friedel-Crafts acylation[J]. Chemical Industry and Engineering Progress, 2012, 31(12): 2702-2707. (in Chinese) |
| [10] |
YOU S, CAI Q, ZENG M. Chiral Brønsted acid catalyzed Friedel-Crafts alkylation reactions[J]. Chemical Society Reviews, 2009, 38(8): 2190-2201. DOI:10.1039/b817310a |
| [11] |
BAYAT M, GHEIDARI D. Green lewis acid catalysis in organic reactions[J]. ChemistrySelect, 2022, 7(28): e202200774. DOI:10.1002/slct.202200774 |
| [12] |
佟天下, 陈志华, 杨丽娟, 等. 噻吩Friedel-Crafts酰基化反应的研究[J]. 化学工业与工程, 2014, 31(2): 1-6. TONG Tianxia, CHEN Zhihua, YANG Lijuan, et al. Friedel-Crafts acylation reaction of thiophene[J]. Chemical Industry and Engineering, 2014, 31(2): 1-6. (in Chinese) |
| [13] |
穆曼曼, 陈立功. 固体酸催化芳烃Friedel-Crafts酰基化反应的研究进展[J]. 精细化工, 2017, 34(4): 361-367, 406. MU Manman, CHEN Ligong. Progress of Friedel-Crafts acylation of arenes over solid acid catalysts[J]. Fine Chemicals, 2017, 34(4): 361-367, 406. (in Chinese) |
| [14] |
张方方, 吴广文, 李灿, 等. Friede1-Crafts酰基化催化剂的研究进展[J]. 应用化工, 2020, 49(7): 1823-1828, 1834. ZHANG Fangfang, WU Guangwen, LI Can, et al. Research progress of Friede1-Crafts acylation catalyst[J]. Applied Chemical Industry, 2020, 49(7): 1823-1828, 1834. (in Chinese) |
| [15] |
CHEN W, YI X, LIU Z, et al. Carbocation chemistry confined in zeolites: Spectroscopic and theoretical characterizations[J]. Chemical Society Reviews, 2022, 51(11): 4337-4385. DOI:10.1039/D1CS00966D |
| [16] |
NUNES N, CARVALHO A P, ELVAS-LEITÃO R, et al. Exploring the effect of hierarchical porosity in BEA zeolite in Friedel-Crafts acylation of furan and benzofuran[J]. Catalysts, 2022, 12(9): 1064. DOI:10.3390/catal12091064 |
| [17] |
LU H, XIE J, WU X, et al. Highly efficient Friedel-Crafts acylation of veratrole over TiO2-SnOx solid solution catalyst[J]. Applied Catalysis A: General, 2022, 648: 118922. DOI:10.1016/j.apcata.2022.118922 |
| [18] |
MARTINS A, NEVES V, MOUTINHO J, et al. Friedel-Crafts acylation reaction over hierarchical Y zeolite modified through surfactant mediated technology[J]. Microporous and Mesoporous Materials, 2021, 323: 111167. DOI:10.1016/j.micromeso.2021.111167 |
| [19] |
胡玉华, 单胜艳. 杂多酸催化剂在有机合成中的应用[J]. 化工进展, 2006, 25(5): 520-523. HU Yuhua, SHAN Shengyan. Application of heteropolyacids catalysts in organic synthesis[J]. Chemical Industry and Engineering Progress, 2006, 25(5): 520-523. (in Chinese) |
| [20] |
DESAI D S, YADAV G D. Friedel-Crafts acylation of furan using chromium-exchanged dodecatungstophosphoric acid: Effect of support, mechanism and kinetic modelling[J]. Clean Technologies and Environmental Policy, 2021, 23(8): 2429-2441. DOI:10.1007/s10098-021-02162-4 |
| [21] |
HACHIYA I, MORIWAKI M, KOBAYASHI S. Hafnium(Ⅳ) trifluoromethanesulfonate, an efficient catalyst for the Friedel-Crafts acylation and alkylation reactions[J]. Bulletin of the Chemical Society of Japan, 1995, 68(7): 2053-2060. DOI:10.1246/bcsj.68.2053 |
| [22] |
SELVAKUMAR S, GUPTA N M, SINGH A P. Nature of the acid sites in the metal triflates immobilized in SBA-15 and their role in the Friedel-Crafts acylation of naphthalene[J]. Applied Catalysis A: General, 2010, 372(2): 130-137. DOI:10.1016/j.apcata.2009.10.021 |
| [23] |
NGUYEN L T L, LE K K A, PHAN N T S. A zeolite imidazolate framework ZIF-8 catalyst for Friedel-Crafts acylation[J]. Chinese Journal of Catalysis, 2012, 33(4/5/6): 688-696. |
| [24] |
SINGH R, SINGH G, GEORGE N, et al. Copper-based metal-organic frameworks (MOFs) as an emerging catalytic framework for click chemistry[J]. Catalysts, 2023, 13(1): 130. DOI:10.3390/catal13010130 |
| [25] |
LERCH S, FRITSCH S, STRASSNER T. Friedel-Crafts acylation of benzene derivatives in tunable aryl alkyl ionic liquids (TAAILs)[J]. Beilstein Journal of Organic Chemistry, 2023, 19: 212-216. DOI:10.3762/bjoc.19.20 |
| [26] |
VALKENBERG M H, DECASTRO C, HÖLDERICH W F. Friedel-Crafts acylation of aromatics catalyzed by supported ionic liquids[J]. Applied Catalysis A: General, 2001, 215(1/2): 185-190. |
 2025, Vol. 42
2025, Vol. 42





