2. 浙江大学生物质化工教育部重点实验室, 化学工程与生物工程学院, 杭州 310058
2. Key Laboratory of Biomass Chemical Engineering of Ministry of Education, College of Chemical and Biological Engineering, Zhejiang University, Hangzhou 310058, China
作为一种同时含有氮、氧及双键的五元杂环化合物,2-噁唑啉类化合物因反应活性较高,在医药、催化剂和材料等领域有着广泛的应用[1, 2]。因2-噁唑啉环易与羧基反应生成酰胺键,二噁唑啉常用作聚酯、聚酰胺等含端羧基的聚合物的扩链剂,以促进其相对分子质量的快速增长或恢复,广泛用于树脂增黏及塑料加工和回收等过程。相比于二异氰酸酯、环氧化物等其它扩链剂,二噁唑啉扩链剂的优势在于不易发生交联[3-5],其劣势在于合成成本高,尚未实现规模化生产,导致品种稀少、价格昂贵,应用受到很大的限制。目前市售的二噁唑啉扩链剂仅有2, 2’-(1, 3亚苯基)二噁唑啉(1, 3-PBO)、2, 2’-(1, 4-亚苯基)二噁唑啉(1, 4-PBO)和2, 2’-双(2-噁唑啉) (BOZ)[5-9]3种,其中BOZ作为3者之中唯一的非芳香族二噁唑啉,价格最为昂贵。
迄今为止,关于噁唑啉的合成方法有很多,但大部分方法仅针对单噁唑啉[10-18]和芳香族二噁唑啉[19-27],对脂肪族二噁唑啉[28-30]的合成文献报道很少。相比于单噁唑啉,二噁唑啉更难合成,因为当1个噁唑啉环生成后,其吸电子性会阻碍另一端噁唑啉环的形成[31]。芳香族二噁唑啉因为结构中的苯环具有给电子性和共振稳定作用[31],有利于噁唑啉环的形成,因此合成难度相对较低。DAST和Deoxo-Fluor试剂[32]针对多种底物都可以60%以上的产率制得单噁唑啉,但反应中需要用到-78 ℃或-20 ℃的低温反应,粗产物需要经过色谱纯化,不利于大规模生产,更重要的是,当用烷基底物取代芳香基底物[33]后,产率不足45%。Burgess试剂[34]对芳香基底物具备较高的反应性,能以高产率制备高质量分数的噁唑啉,但Brugess试剂极为昂贵。与之类似的是,E-4沸石对芳香族底物环化效果良好[35],但对脂肪族底物则失去环化效果。二水乙酸锌[36]、氯化锌[37]、钼酸铵[38]、对甲苯磺酸[39]、多聚磷酸[40]和硼酸[11, 41]等也能用于单噁唑啉的合成,但实践证明,它们均难以用于合成脂肪族二噁唑啉。目前,1, 3-PBO和1, 4-PBO均以二腈和单乙醇胺(MEA)[26, 27, 42]为原料来合成,BOZ的合成则以草酸二乙酯和MEA为原料[28-30],经胺解、氯化亚砜氯化和碱性闭环3步反应,最终得到BOZ。然而,第2步中间产物N, N-双(氯乙基)乙二酰胺(BCEOA)的产率偏低,仅为69%~85%[29];第1和第3步需要用到多种溶剂(如苯、甲苯和1, 4-二氧六环)[28-30]、采用多种分离纯化方法(过滤+蒸发+结晶或过滤+萃取+蒸发)[28-30, 43],分离过程复杂,且溶剂沸点高,难以脱除干净。
针对以上问题,本研究从原料和溶剂选择、反应条件优化(反应物配比和温度)和分离方法的选择和优化等几方面对BOZ的合成过程进行改进,简化了合成和分离步骤,缩短了反应时间,降低了合成成本,提高了每步产物的产率和最终产物的质量分数,制得了高质量分数的BOZ。
1 实验部分 1.1 实验原料草酸(OX,质量分数为98%,源叶生物);草酸二甲酯(DMO,质量分数为98%,阿拉丁);草酸二乙酯(DEO,质量分数为99%,国药);乙醇胺(MEA,质量分数为99%,国药);氯化亚砜(SOCl2,质量分数为99%,国药);氢氧化钠(NaOH,质量分数为96%,国药);乙醇(质量分数为99.7%,国药);甲醇(质量分数为99.5%,国药);甲苯(质量分数为99.5%,国药);变色硅胶(质量分数为99%,国药,粒度2~8 mm,对水蒸气吸附量≥20%,符合Q/CYDZ 20—2008标准);氧化钙(CaO,质量分数为98%,罗恩);重水(D2O,质量分数为99.9%,迈瑞尔);氘代二甲基亚砜(DMSO-d6,质量分数为99.8%,Sigma)。以上试剂均直接使用。
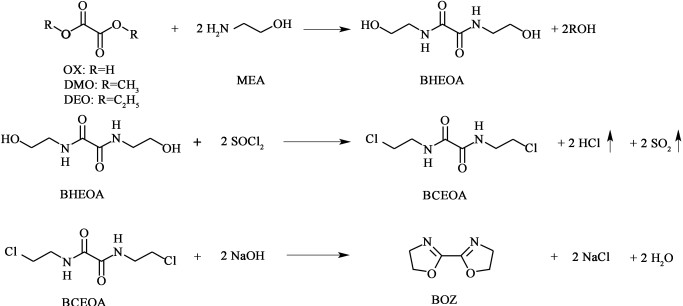
1.2 合成过程BOZ的合成分3步进行,过程如图 1所示。
|
| 图 1 2, 2’-双(2-噁唑啉) (BOZ)的合成步骤 Fig.1 Route of synthesis of 2, 2'-bis(2-oxazoline) (BOZ) |
| |
将1 000 mL三口烧瓶置于水浴中,保持器内温度为40 ℃,加入乙醇胺(158.8 g,2.6 mol)和乙醇(760 mL),再在搅拌下加入草酸二甲酯(118.1 g,1.0 mol),期间保持不停搅拌避免暴沸,控制反应温度不超过70 ℃;加完后继续反应20 min;过滤、洗涤、干燥得到172.8 g白色粉末状的BHEOA (产率98.1%,质量分数≥99%,熔点170.7 ℃,参考文献[29]熔点170.2~173.7 ℃)。
1.2.2 N, N-双(氯乙基)乙二酰胺(BCEOA)的合成在250 mL三口烧瓶中加入甲苯(120 mL)和BHEOA (52.9 g,0.3 mol),室温下搅拌使BHEOA分散均匀;滴加氯化亚砜(107.1 g,0.9 mol),控制滴加速率使釜内温度不超过50 ℃,尾气用足量的30%氢氧化钠水溶液进行吸收;滴加完毕后将反应温度升至50 ℃,观察尾气瓶中气体产生情况逐步升高温度,每次升高5 ℃,直至90 ℃反应至不再产生气体后通氮气0.5 h以充分排净装置内残余气体,视为反应结束。过滤产物,所得滤饼依次使用水和乙醇进行洗涤,干燥得到61.6 g白色粉末状的BCEOA (产率96.3%,质量分数≥99%,初始分解温度179.1 ℃,参考文献[29]熔点202.5~205.3 ℃)。
1.2.3 2, 2’-双(2-噁唑啉) (BOZ)的合成在100 mL三口烧瓶中先加入乙醇(60 mL)、变色硅胶(14.4 g)和氢氧化钠(3.2 g,0.08 mol),搅拌使氢氧化钠固体完全溶解,再加入BCEOA (8.6 g,0.04 mol),在回流温度下搅拌反应1 h;得到的悬浊液趁热过滤,然后进行冷却结晶,析出针状晶体,待晶体不再产生后过滤、干燥得到4.1 g白色针状晶体BOZ;将结晶母液进行二次结晶,得到0.7 g BOZ;2次结晶合计得到4.8 g BOZ(产率85.8%,其中一次结晶所得产物质量分数≥99.0%,二次结晶所得产物质量分数97.7%,总体质量分数≥98%,初始分解温度152.1 ℃,参考文献[29]熔点215.8 ℃)。
1.3 表征测试方法以核磁共振氢谱(Avance NEO核磁共振仪,500 M,德国Bruker公司)表征产物结构,所用氘代溶剂为D2O或DMSO-d6。以热重分析仪(TA-Q500) 表征产物的热稳定性。以差示扫描量热仪(TA-Q200)表征产物的熔点。
BOZ粗产率1(yc,BOZ1):即根据滤渣(认为是氯化钠)的质量计算的BOZ粗产率,如式(1)所示,其中: m(滤渣)为滤渣质量,g;n(BCEOA)为BCEOA的物质的量,mol;M(NaCl)为氯化钠的相对分子质量(58.44 g ·mol-1)。
| $ y_{\mathrm{c, BOZ1}}=\frac{m(\text { 滤渣 })}{2 n(\mathrm{BCEOA}) M(\mathrm{NaCl})} $ | (1) |
BOZ粗产率2(yc,BOZ2):即根据滤液蒸干后的粗产物(认为是BOZ)质量计算的BOZ粗产率,如式(2)所示,其中,m(粗产物)为滤液蒸干所得产物质量(g),M(BOZ)为BOZ的相对分子质量(140.14 g ·mol-1)。
| $ y_{\mathrm{c, BOZ2}}=\frac{m(\text { 粗产物 })}{n(\mathrm{BCEOA}) M(\mathrm{BOZ})} $ | (2) |
BOZ分离产率1(yi,BOZ1):即反应结束后滤液经一次结晶得到的BOZ的产率,如式(3)所示,式(3)中,m(一次结晶)为滤液一次结晶所得产物质的量,g。
| $ y_{i, \mathrm{BOZ1}}=\frac{m(\text { 一次结晶 })}{n(\mathrm{BCEOA}) M(\mathrm{BOZ})} $ | (3) |
总分离产率(yi,BOZ总):即一次结晶和结晶母液二次结晶所得全部BOZ的总产率,如式(4)所示,式(4)中,m(二次结晶)为结晶母液二次结晶所得产物质量,g。
| $ y_{i, \mathrm{BOZ} \text { 总 }}=\frac{m(\text { 一次结晶 })+m(\text { 二次结晶 })}{n(\mathrm{BCEOA}) M(\mathrm{BOZ})} $ | (4) |
理论上,选用草酸(OX)或者草酸二酯作为原料与乙醇胺(MEA)反应都可以合成BHEOA。因此,首先比较了OX、草酸二乙酯(DEO)和草酸二甲酯(DMO)3种原料对BHEOA合成的影响。反应条件及结果见表 1。
| Run | 原料 | 溶剂 | 配比a | Tb/℃ | tc/h | 产率d/% |
| 1 | OX | 甲苯 | 3.0 | 110 | 10.7 | 89.3 |
| 2 | OX | 6.0 | 160 | 5.0 | 84.2 | |
| 3 | DEO | 3.0 | 不加热 | 0.2 | 95.7 | |
| 4 | DEO | 2.2 | 不加热 | 0.2 | 96.5 | |
| 5 | DMO | 2.2 | 不加热 | 0.2 | 91.3 | |
| 6 | DMO | 乙醇 | 2.2 | 不加热 | 0.3 | 53.2 |
| 7 | DMO | 乙醇 | 2.6 | 不加热 | 0.3 | 86.5 |
| 8 | DMO | 乙醇 | 2.6 | 40 | 0.3 | 98.1 |
| 9 | DMO | 乙醇 | 2.6 | 78 | 0.3 | 88.9 |
| 10 | DMO | 甲醇 | 2.6 | 40 | 0.3 | 88.6 |
| a配比指乙醇胺与草酸或草酸二乙酯或草酸二甲酯的物质的量之比;b反应温度;c反应时长;d产率为所得BHEOA质量与BHEOA理论质量之比;其它条件:乙醇或甲醇溶剂的量为5 mL ·g-1乙醇胺。 | ||||||
采用OX为原料,在n(MEA)/n(OX)=3、甲苯作为溶剂和带水剂、釜内温度110 ℃的条件下反应10 h,BHEOA的产率可达89.3% (Run1),但反应耗时长。不使用带水剂甲苯且将n(MEA)/n(OX)提高到6 (即大大过量的MEA既充当反应原料又充当溶剂),在160 ℃下反应5 h,产率为84.2% (Run2),产率偏低且MEA利用率不高。由于OX为有机强酸,与MEA反应倾向于形成羧酸铵盐[44],需要在催化剂作用下高温脱水才能得到酰胺产物。在高温下OX易升华和分解,导致产率下降。
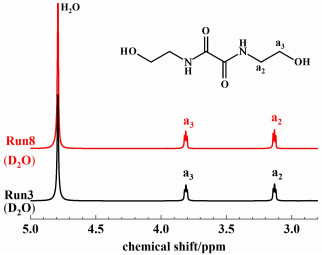
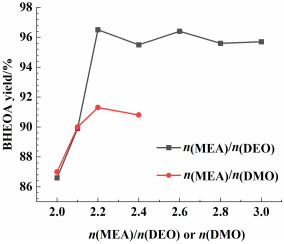
为提高反应速率,选用常温下为液态的DEO代替OX,DEO与MEA [n(MEA)/n(DEO)为3]可以快速混合均匀,且无需加热即可迅速发生反应,所得产物不溶于未反应的MEA中,以沉淀形式分散于MEA中,使得产物分离易于进行。反应10 min后,加入适量乙醇进行稀释、过滤、干燥,即得到BHEOA,其产率高达95.7% (Run3)。图 2证实其为目标产物。在上述条件下考察n(MEA) ∶n(DEO) 对DEO-MEA反应体系的产率的影响,结果见图 3。当n(MEA) ∶n(DEO)=2.2时,BHEOA产率最高,为96.5% (Run4);进一步提高物质的量之比,产率不再增加;当物质的量之比进一步下降2.2以下时,产率下降到90%以下。可见,MEA适当过量对BHEOA的合成仍是必要的。
|
| 图 2 N, N-双(2-羟乙基)乙二酰胺(BHEOA) (Run3和Run8) 的核磁氢谱(溶剂∶重水) Fig.2 1H NMR spectrum of the N, N-bis(2-hydroxyethyl) oxalamide (BHEOA) (Solvent ∶Deuterium oxide) |
| |
|
| 图 3 不加热、无外加溶剂条件下n(MEA)/n(二酯) 对BHEOA产率的影响 Fig.3 Effect of the molar ratio of MEA/DEO or DMO on the yield of BHEOA without heating and solvent |
| |
进一步考察了比DEO更为廉价的DMO的反应效果。DMO与MEA反应现象与DEO基本一致,室温下即迅速发生反应。考虑到DMO常温下为固体,与MEA混合需要一定的时间,故反应耗时略长,为20 min。反应结束后,加入乙醇进行稀释,经过滤、干燥,所得产物亦为白色固体粉末。n(MEA) ∶n(DMO)对BHEOA产率的影响(图 3)也类似于DEO-MEA体系,当物质的量之比等于2.2时达到最高产率,但最高产率略低,为91.3% (Run 5)。
相比DEO,以DMO为原料时BHEOA产率偏低,其可能的原因包括:(1) DMO常温下为无色晶体而DEO为液体,后者更易与MEA混合均匀,有利于反应进行;(2) DMO热稳定性不如DEO,DMO在55 ℃[45]下在1 h内完全水解,而DEO在80 ℃[46]仍需3 h才能水解完全,而该反应强放热的特性以及原料MEA的强吸湿性可能使DMO水解加剧,产率下降。因此,在以DMO为原料时,应适量添加溶剂以使DMO和MEA混合均匀且保持较低的反应温度。
由于酯的胺解反应的副产物是乙醇或甲醇,且产物BHEOA在乙醇或甲醇中溶解度低,因此以醇为溶剂会使体系更简单,也更有利于产物的分离和纯化。但是,在反应体系中引入乙醇反而导致产率显著下降,仅为53.2% (Run6)。为提高产率,进一步考察了以乙醇为反应介质时n(MEA)/n(DMO)对BHEOA产率的影响,结果见图 4(a)。可见,在乙醇溶剂存在下,进一步提高物质的量之比可显著提高BHEOA产率,在n(MEA)/n(DMO)=2.6时达到最高86.5% (Run7)。但该产率依旧低于无溶剂反应时的91.3% (Run5)。
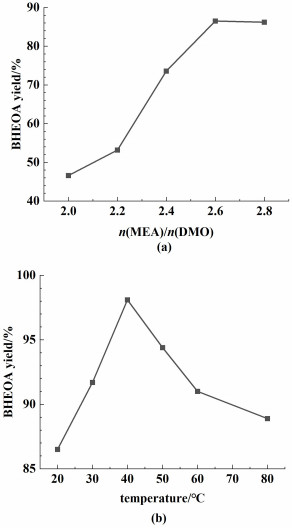
|
| 图 4 (a) 不加热、外加乙醇溶剂的条件下n(MEA)/ n(DMO)对BHEOA产率的影响; (b) 外加乙醇溶剂的条件下反应温度对BHEOA产率的影响 Fig.4 (a) Effect of molar ratio n(MEA)/n(DMO) on the yield of BHEOA synthesized from DMO and MEA without heating and added solvent; (b) Effect of reaction temperature on the yield of BHEOA synthesized from DMO and MEA using ethanol as added solvent |
| |
该反应属于强放热反应,在无外加溶剂、不加热的条件下,反应体系的温度可达到甚至超过100 ℃,导致草酸二酯尤其是DMO的分解,因而产率下降。当温度超过副产的乙醇或甲醇的沸点(78或65 ℃),也导致其暴沸或过度挥发,影响反应的稳定性,也不利于后续过滤过程的进行。而在外加溶剂的情况下,反应放热不足以达到足够的反应温度,釜内温度不足40 ℃,可能导致反应不完全。因此,在外加乙醇的情况下,考察了温度对DMO-MEA体系的BHEOA产率的影响,结果见图 4(b)。当反应温度低于40 ℃时,随温度升高,产率显著上升。反应温度为40 ℃时,产率达到最高值98.1% (Run8)。但是在温度高于40 ℃时,升高温度会导致DMO的水解程度增加,使BHEOA产率下降;在乙醇回流温度下,产率降至88.9% (Run 9)。将外加溶剂由乙醇换为甲醇后,产率降至88.6% (Run10),这是因为BHEOA在甲醇中的溶解度大于在乙醇的溶解度,从而导致BHEOA在过滤、洗涤过程中损失更多。室温下BHEOA的溶解度分别为0.37 g(甲醇为溶剂)和0.05 g(乙醇为溶剂)。
综上,以DEO为原料,在无外加溶剂、n(MEA)/ n(DMO)=2.2、不控温的条件下,BHEOA产率可高达96.5%;以DMO为原料,在外加乙醇溶剂、n(MEA)/n(DMO)=2.6、反应温度40 ℃的条件下,BHEOA产率高达98.1%。由于DMO成本远低于DEO,无论从提高产物产率还是降低成本的角度出发,选择DMO为原料更有利。
2.2 N, N-双(氯乙基)乙二酰胺(BCEOA)的合成BHEOA难以直接环化,因此先将BHEOA与氯化亚砜(SOCl2)反应,BHEOA的羟基被氯原子取代,得到N, N-双(氯乙基)乙二酰胺(BCEOA)。该反应通常选择甲苯为介质,在90 ℃下反应[28]。BHEOA在甲苯中难以有效溶解,形成分散液与SOCl2反应,生成的产物BCEOA也不溶于甲苯。这样,若BHEOA反应完全,则能通过过滤直接分离出产物。反应条件及结果见表 2。
| Run | 配比a | Tb/℃ | tc/h | 产率d/% |
| 11 | 3.0 | 90 | 4.0 | 91.1 |
| 12 | 3.0 | 50~90, 10e | 4.7 | 95.9 |
| 13 | 3.0 | 50~90, 5e | 5.0 | 96.3 |
| 14 | 2.8 | 50~90, 5e | 4.2 | 50.7 |
| 15 | 2.6 | 50~90, 5e | 3.7 | 37.2 |
| 16 | 2.2 | 50~90, 5e | 3.5 | 35.2 |
| a配比指氯化亚砜与BHEOA的物质的量之比;b反应温度及每次升温幅度;c反应时长; d产率为所得BCEOA质量与BCEOA理论质量之比;e“50~90, 10”表示反应温度从50 ℃开始每10 ℃升温1次直至90 ℃。其它条件:溶剂为甲苯。 | ||||
由于SOCl2极易挥发,在反应中损失较大,故应使其过量。在实验中,先将n(SOCl2)/n(BHEOA)固定为3.0。在SOCl2滴加过程中易出现产物的结块,影响搅拌和气体逸出。滴加完毕后若直接升温至90 ℃进行反应(Run11),随着反应的进行结块逐渐严重,使得搅拌出现困难,且反应生成气体的逸出也变得困难。这一现象随温度升高变得更为明显。若在滴加完成后先升温至50 ℃ (该反应为放热反应,在SOCl2滴加完毕后反应器内部升温至超过40 ℃,因此选择50 ℃作为起始温度),并根据气体的逸出情况按10 ℃ ·次-1逐步升温至90 ℃ (SOCl2沸点为78.8 ℃,若反应温度设置过高容易大量蒸出),并在90 ℃反应至不再产生气体(Run12),可以避免结块现象,BCEOA产率可以提升到95.9%。进一步调整升温速率为5 ℃ ·次-1逐步升温至90 ℃,BCEOA产率提升到96.3% (Run13),经过滤、洗涤、干燥,可直接得到高质量分数的白色粉末状BCEOA产物,而Run11的产物中仍含有少量未反应的BHEOA (见图 5),产率仅为91.1%。可见,逐步升温反应对提高BCEOA的产率和质量分数都是必要的。

|
| 图 5 在不同升温过程(Run11和Run13)下合成的N, N-双(氯乙基)乙二酰胺(BCEOA)的核磁氢谱(溶剂: 氘代二甲基亚砜) Fig.5 1H NMR spectra of N, N-bis(2-chloroethyl) oxalamide (BCEOA) synthesized at different temperature program (Run11 and Run13) (solvent : DMSO-d6) |
| |
在确定采用逐步升温方法有利于提高产物产率和质量分数之后,在相同的条件下进一步考察n(SOCl2)/n(BHEOA)对反应的影响,结果亦列于表 2。当n(SOCl2)/n(BHEOA)从3.0下降到2.2时,在反应过程中,可以明显地观察到气体逸出时间和逸出量大幅度减小,产率显著下降,在n(SOCl2)/n(BHEOA)=2.2时,产率降低到35.2% (Run16)。可见,SOCl2过量50%对该反应的顺利进行是必要的。从提高原料利用率和产率的角度出发,选择n(SOCl2)/n(BHEOA)=3.0作为合成BCEOA的最适宜条件。
2.3 2, 2’-双(2-噁唑啉) (BOZ)的合成BCEOA易与NaOH在乙醇中发生消去反应,脱去1个氯化氢分子和1个水分子而闭环[31],得到2, 2’-双(2-噁唑啉) (BOZ)。BCEOA不溶于乙醇,形成悬浊液,与NaOH反应,生成的BOZ溶于乙醇,副产物氯化钠则从乙醇中析出。若BCEOA反应完全,则能通过过滤直接将BOZ(含少量BHEOA)产物和氯化钠分离。在回流温度下的反应结果见表 3。
| Run | 配比a | 其他 | tb/ h | yc, BOZc/ % | 杂质d/ % | yi, BOZe/ % |
| 17 | 2.0 | 0.5 | 110.4f, 87.8 | 8.4 | 59.7, 69.0 | |
| 18 | 2.0 | 1.0 | 89.0, 93.9 | 7.3 | 65.2, 76.7 | |
| 19 | 2.0 | 2.0 | 81.3, 101.3g | 47.3 | ||
| 20 | 3.0 | 1.0 | 100.1h, 104.2g | 97.6 | ||
| 21 | 2.0 | 变色硅胶i | 1.0 | 92.4, 93.5 | 4.6 | 73.6, 85.8 |
| 22 | 2.0 | CaO | 1.0 | 93.3, 94.2 | 42.0 | |
| a配比指氢氧化钠与BCEOA的物质的量之比;b反应时长;c根据滤渣质量和滤液蒸干后的粗产物质量分别估算的BOZ “粗产率1”和“粗产率2”;d滤液蒸干后的粗产物中BHEOA的含量;e BOZ的分离产率, 逗号前为一次结晶的产率,逗号后为一次结晶和结晶母液二次结晶所得全部BOZ的总产率;f滤渣中含有未反应的BCEOA导致BOZ的“粗产率1”大于100%;g滤液蒸干后的粗产物中存在BHEOA导致BOZ的“粗产率2”大于100%;h BHEOA在反应过程中析出导致BOZ的“粗产率1”大于100%;i m(变色硅胶)/m(BCEOA)=2。其它反应条件:溶剂为乙醇;反应温度为回流温度)。 | ||||||
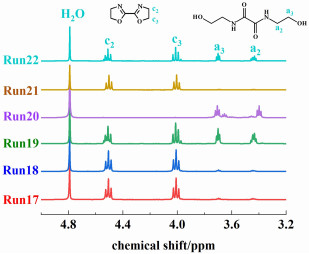
在NaOH/BCEOA物质的量之比为2/1的条件下,在回流温度下反应0.5 h,根据滤渣质量计算的BOZ“粗产率1” (认为滤渣为副产物氯化钠)>100%,表明BCEOA尚未反应完全而进入滤渣中,但1H NMR结果(图 6)表明,滤液蒸干后的粗产物含有8.4%的BHEOA (Run17);反应1 h,BCEOA反应完全,BHEOA含量基本不变(Run18);但继续延长反应时间至2 h,滤液蒸干后的粗产物中BHEOA含量显著增加到47.3%,使得根据粗产物质量计算的“粗产率2” (认为粗产物即为BOZ)也高于100% (Run19)。
BHEOA的生成有2方面的原因。一是反应生成的水与BCEOA发生取代副反应[28, 47],导致原料BCEOA部分转化为BHEOA。溶剂的极性越小,消去反应越有利,因此通常采用极性比水更小的乙醇作为该反应的介质[28, 29]。二是产物BOZ发生了水解反应,导致生成BHEOA,见图 7。Xu等[48]报道BOZ在酸性条件下可发生水解。我们的实验结果表明,在沸水中加热1 h,BOZ的水解率达到71.7%。通常,碱能催化取代和水解反应。因此,在闭环反应过程中,NaOH的存在必然会促进BHEOA的生成。事实上,将NaOH过量50%时,发现粗产物中BHEOA含量大幅升高至97.6%,使得“粗产率2”大于100% (Run20),并生成其它副产物(图 6)。由于部分BHEOA在反应过程中就析出,故“粗产率1”也大于100% (Run20)。可见,NaOH过量不利于BOZ的提纯,并导致产物发黄且容易吸潮。因此n(NaOH)/n(BCEOA)=2.0为宜。
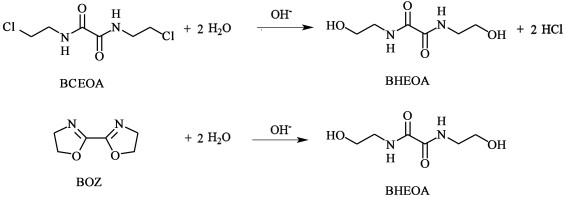
|
| 图 7 BCEOA闭环生成BOZ的反应过程中的副反应 Fig.7 Side reactions occurred during synthesis of BOZ from BCEOA |
| |
碱和水的存在都促进上述副反应。而碱的存在对闭环反应必不可少,故应尽可能脱除反应生成的水。加入足量吸水剂变色硅胶,在与Run18同样的条件下反应1 h,BOZ的粗产率基本不变,但粗产物中BHEOA的含量由7.3%降至4.6%(Run21)。
可见,快速脱除反应体系中产生的水分对抑制BHEOA的生成、提高BOZ的选择性和产率是有效的。值得注意的是,氧化钙(CaO)吸水剂的加入并未起到同样的效果,反而使粗产物中BHEOA的含量由7.3%显著上升到42.0% (Run22)。这是由于CaO作为化学吸收剂,其吸水作用虽然在一定程度上抑制了BHEOA的生成,但另一方面,化学吸水产生的氢氧化钙会造成溶液的碱性增强,反而大大促进了BHEOA的生成。
可见,BCEOA在n(NaOH)/n(BCEOA)=2.0、有效脱水的条件下在乙醇回流温度下闭环反应1 h,可以约93%的“粗产率”和约95%的选择性获得BOZ粗产物。
在室温下,BOZ溶于乙醇,BHEOA微溶于乙醇;在反应温度下,BHEOA在乙醇中也具有较高的溶解度,因此,趁热过滤的滤液中含有一定的BHEOA,需要进行分离纯化,以得到高质量分数的BOZ。文献中采用萃取[43]、蒸发过程来提纯BOZ,或者先蒸除乙醇后再用二氧六环[30]或甲苯[28, 29]使BOZ结晶。我们发现,BOZ在这2种溶剂中的溶解度很低,其中,常温(22 ℃)下溶解度为0.31 g(甲苯为溶剂)和0.20 g(二氧六环为溶剂),在沸点时依旧很低,为0.42 g(甲苯为溶剂)和0.57 g(二氧六环为溶剂),故它们不是理想的结晶溶剂,文献结果难以重复。同时,我们观察到,滤液在冷却过程中有较多的BOZ晶体析出,说明乙醇本身应该是优良的结晶溶剂。经测定,在常温(22 ℃)和78 ℃(乙醇沸点,也是反应温度)的乙醇中,BOZ的溶解度分别为2.04和13.44 g (乙醇为溶剂),二者溶解度相差5倍以上,故乙醇可以直接作为BOZ的结晶溶剂。
为促进结晶的高效进行,应选取合理的乙醇用量,使生成的BOZ在乙醇中的浓度接近其78 ℃下的饱和浓度,从而在趁热过滤后可以立即进行冷却结晶,免除或缩短浓缩过程。在BCEOA浓度为0.67 mol ·L-1乙醇的条件下加入足量吸水剂,在回流温度下反应1 h,趁热过滤后直接进行结晶,BOZ的分离产率为73.6%,1H NMR (图 8)显示无明显杂质。结晶后的滤液可重新用作闭环反应的介质,或二次结晶进一步回收BOZ。二次结晶的产物中含有2.4%的BHEOA和97.6%的BOZ。经二次结晶,总的分离产率提高到85.8%。
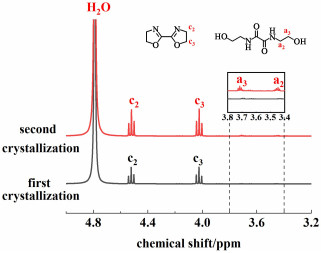
|
| 图 8 滤液结晶所得BOZ和结晶滤液二次结晶所得BOZ的核磁氢谱(溶剂:重水) Fig.8 1H NMR spectra of the BOZ from filtrate crystallization and secondary crystallization of crystallized filtrate (solvent : deuterium oxide) |
| |
首次以草酸二甲酯和单乙醇胺为原料,经酯的胺解、氯化和闭环3步反应,高产率地合成高质量分数2, 2’-双(2-噁唑啉)。各步骤的优化条件和产率为:(1)以乙醇为反应介质,在n(MEA)/n(DMO)= 2.6、40 ℃条件下DMO与MEA反应20 min,过滤洗涤得到高纯BHEOA,产率98.1%。(2)以甲苯为反应介质,在n(SOCl2)/n(BHEOA)=3.0、50~90 ℃逐步升温的条件下BHEOA与SOCl2反应5 h,过滤洗涤得到高纯BCEOA,产率96.3%。(3)以乙醇为溶剂,在吸水剂存在下,在n(NaOH)/n(BCEOA)=2.0、BCEOA浓度0.67 mol ·L-1、回流温度的条件下,BCEOA与氢氧化钠反应1 h,然后直接过滤、结晶,得到高纯BOZ,产率73.6%;滤液二次结晶可使产率提高到85.8%。
该法原料价廉易得,所需溶剂种类少(3步反应仅用2种溶剂,每步均采用单一溶剂进行反应和分离纯化),分离纯化过程简单(采用简单的过滤或单一溶剂的过滤+结晶过程),反应温度低,反应时间短,产品产率和质量分数高,因而是高效、成本较低的BOZ合成方法。
| [1] |
FRUMP J A. Oxazolines. Their preparation, reactions, and applications[J]. Chemical Reviews, 1971, 71(5): 483-505. DOI:10.1021/cr60273a003 |
| [2] |
张慧珍, 周成合, 耿蓉霞, 等. 噁唑类化合物合成研究新进展[J]. 有机化学, 2011, 31(12): 1963-1976. ZHANG Huizhen, ZHOU Chenghe, GENG Rongxia, et al. Recent advances in syntheses of oxazole compounds[J]. Chinese Journal of Organic Chemistry, 2011, 31(12): 1963-1976. (in Chinese) |
| [3] |
INATA H, MATSUMURA S. Chain extenders for polyesters. I. Addition-type chain extenders reactive with carboxyl end groups of polyesters[J]. Journal of Applied Polymer Science, 1985, 30(8): 3325-3337. DOI:10.1002/app.1985.070300815 |
| [4] |
KYLMÄ J, TUOMINEN J, HELMINEN A, et al. Chain extending of lactic acid oligomers. Effect of 2, 2'-bis(2-oxazoline) on 1, 6-hexamethylene diisocyanate linking reaction[J]. Polyme, 2001, 42(8): 3333-3343. DOI:10.1016/S0032-3861(00)00751-5 |
| [5] |
INATA H, MATSUMURA S. Chain extenders for polyesters. IV. Properties of the polyesters chain-extended by 2, 2'-bis(2-oxazoline)[J]. Journal of Applied Polymer Science, 1987, 33(8): 3069-3079. DOI:10.1002/app.1987.070330838 |
| [6] |
TAYLAN E, KÜSEFOǦLU S H. Chain extension reactions of unsaturated polyesters with bis(2-oxazoline)S[J]. Journal of Applied Polymer Science, 2012, 124(4): 3229-3235. DOI:10.1002/app.35450 |
| [7] |
BERG D, SCHAEFER K, MOELLER M. Impact of the chain extension of poly(ethylene terephthalate) with 1, 3-phenylene-bis-oxazoline and N, N'-carbonylbiscaprolactam by reactive extrusion on its properties[J]. Polymer Engineering & Science, 2019, 59(2): 284-294. |
| [8] |
LOONTJENS T, PAUWELS K, DERKS F, et al. The action of chain extenders in nylon-6, PET, and model compounds[J]. Journal of Applied Polymer Science, 1997, 65(9): 1813-1819. DOI:10.1002/(SICI)1097-4628(19970829)65:9<1813::AID-APP18>3.0.CO;2-N |
| [9] |
黄超群, 徐少轶, 赵京波, 等. 由对苯二甲酰胺二醇合成聚酯酰胺及其扩链反应的研究[J]. 高分子学报, 2010(2): 237-244. HUANG Chaoqun, XU Shaoyi, ZHAO Jingbo, et al. Synthesis of polyesteramides from N, N'-bis(2-hydroxyethyl)-terephthalamide and chain extension reaction[J]. Acta Polymerica Sinica, 2010(2): 237-244. (in Chinese) |
| [10] |
RAJARAM S, SIGMAN M S. Modular synthesis of amine-functionalized oxazolines[J]. Organic Letters, 2002, 4(20): 3399-3401. DOI:10.1021/ol0264758 |
| [11] |
ILKGUL B, GUNES D, SIRKECIOGLU O, et al. Synthesis of 2-oxazolines via boron esters of N-(2-hydroxyethyl) amides[J]. Tetrahedron Letters, 2010, 51(40): 5313-5315. DOI:10.1016/j.tetlet.2010.07.167 |
| [12] |
JADHAV K A, BHOSLE S D, ITAGE S V, et al. A novel method for the synthesis of 2-oxazolines[J]. Tetrahedron Letters, 2022, 106: 154048. DOI:10.1016/j.tetlet.2022.154048 |
| [13] |
MOLLO M C, ORELLI L R. Microwave-assisted synthesis of 2-aryl-2-oxazolines, 5, 6-dihydro-4H-1, 3-oxazines, and 4, 5, 6, 7-tetrahydro-1, 3-oxazepines[J]. Organic Letters, 2016, 18(23): 6116-6119. DOI:10.1021/acs.orglett.6b03122 |
| [14] |
HAJRA S, BAR S, SINHA D, et al. Stereoselective one-pot synthesis of oxazolines[J]. The Journal of Organic Chemistry, 2008, 73(11): 4320-4322. DOI:10.1021/jo8003937 |
| [15] |
ABAZID A H, HOLLWEDEL T N, NACHTSHEIM B J. Stereoselective oxidative cyclization of N-allyl benzamides to oxaz(ol)ines[J]. Organic Letters, 2021, 23(13): 5076-5080. DOI:10.1021/acs.orglett.1c01607 |
| [16] |
ZENG X, ZHONG G, ZHOU H, et al. Synthesis of 3-oxazolines via SnCl4-promoted formal[3+2]cycloaddition of donor-acceptor oxiranes and nitriles[J]. Synlett, 2015, 26(12): 1693-1696. DOI:10.1055/s-0034-1380216 |
| [17] |
BENDI A, ATRI S, DHARMA RAO G, et al. Ultrasound-accelerated, concise, and highly efficient synthesis of 2-oxazoline derivatives using heterogenous calcium ferrite nanoparticles and their DFT studies[J]. Journal of Chemistry, 2021, 2021(1): 7375058. |
| [18] |
KARADE N, TIWARI G, GAMPAWAR S. Efficient oxidative conversion of aldehydes to 2-substituted oxazolines and oxazines using (diacetoxyiodo)benzene[J]. Synlett, 2007, 2007(12): 1921-1924. DOI:10.1055/s-2007-982571 |
| [19] |
MIRKHANI V, MOGHADAM M, TANGESTANINEJAD S, et al. Preparation of an improved sulfonated carbon-based solid acid as a novel, efficient, and reusable catalyst for chemoselective synthesis of 2-oxazolines and bis-oxazolines[J]. Monatshefte Für Chemie-Chemical Monthly, 2009, 140(12): 1489-1494. DOI:10.1007/s00706-009-0213-8 |
| [20] |
张浩, 曾桂钰, 陶锡祺. 1, 3-双(2-噁唑啉基)苯的合成工艺优化[J]. 精细化工中间体, 2021, 51(5): 78-80. ZHANG Hao, ZENG Guiyu, TAO Xiqi. Process optimization for the preparation of 2, 2'-(1, 3-phenylene) bis-(2-oxazoline)[J]. Fine Chemical Intermediates, 2021, 51(5): 78-80. (in Chinese) |
| [21] |
MOHAMMADPOOR-BALTORK I, MIRKHANI V, MOGHADAM M, et al. Silica sulfuric acid: A versatile and reusable heterogeneous catalyst for the synthesis of oxazolines and imidazolines under various reaction conditions[J]. Catalysis Communications, 2008, 9(5): 894-901. DOI:10.1016/j.catcom.2007.09.017 |
| [22] |
LI X, ZHOU B, ZHANG J, et al. Solvent-free tandem synthesis of 2-thiazolines and 2-oxazolines catalyzed by a copper catalyst[J]. European Journal of Organic Chemistry, 2012, 2012(8): 1626-1632. DOI:10.1002/ejoc.201101786 |
| [23] |
MOGHADAM M, MIRKHANI V, TANGESTANINEJAD S, et al. InCl3 as an efficient catalyst for synthesis of oxazolines under thermal, ultrasonic and microwave irradiations[J]. Journal of the Iranian Chemical Society, 2009, 6(2): 251-258. DOI:10.1007/BF03245832 |
| [24] |
MOHAMMADPOOR-BALTORK I, MOGHADAM M, TANGESTANINEJAD S, et al. Environmental-friendly synthesis of oxazolines, imidazolines and thiazolines catalyzed by tungstophosphoric acid[J]. Catalysis Communications, 2008, 9(6): 1153-1161. DOI:10.1016/j.catcom.2007.10.026 |
| [25] |
CHEN L, XU Y. Studies on the synthesis of 2, 2'-(1, 3-phenylene) bis(2-oxazoline)[J]. Journal of Materials Science Letters, 2003, 22(13): 953-954. DOI:10.1023/A:1024644425392 |
| [26] |
LI S, WANG L. Curing behavior of 4, 4'-diamonodiphenyl methane-based benzoxazine oligomers/bisoxazoline copolymers and the properties of their cured resins[J]. Journal of Applied Polymer Science, 2006, 99(4): 1359-1366. DOI:10.1002/app.22310 |
| [27] |
BOLM C, WEICKHARDT K, ZEHNDER M, et al. Synthesis of optically active bis(2-oxazolines): Crystal structure of a 1, 2-bis(2-oxazolinyl)benzene ZnCl2 complex[J]. Chemische Berichte, 1991, 124(5): 1173-1180. DOI:10.1002/cber.19911240532 |
| [28] |
高利斌, 许国志, 付婧. 全生物降解PBS新型扩链剂BOZ的合成研究[J]. 中国塑料, 2006, 20(3): 94-98. GAO Libin, XU Guozhi, FU Jing. Synthesis of new chain extender BOZ for biodegradable PBS[J]. China Plastics, 2006, 20(3): 94-98. (in Chinese) |
| [29] |
LU C, CHEN T, ZHAO X, et al. Chemical modification of polyamide-6 by chain extension with 2, 2'-bis(2-oxazoline)[J]. Journal of Polymer Science B Polymer Physics, 2007, 45(15): 1976-1982. DOI:10.1002/polb.21107 |
| [30] |
陈玉君, 游飞越, 潘鉴元. 双噁唑啉化合物偶联聚酯的研究I. 双噁唑啉化合物的合成及其性能[J]. 高分子学报, 1996(6): 722-725. CHEN Yujun, YOU Feiyue, PAN Jianyuan. Study on the coupling of polyesters with bisoxazoline compounds I. Synthesis and properties of bisoxazoline compounds[J]. Polyester Industry, 1996(6): 722-725. (in Chinese) |
| [31] |
HOLERCA M, PERCEC V. 1H NMR spectroscopic investigation of the mechanism of 2-substituted-2-oxazoline ring formation and of the hydrolysis of the corresponding oxazolinium salts[J]. European Journal of Organic Chemistry, 2000, 2000(12): 2257-2263. DOI:10.1002/1099-0690(200006)2000:12<2257::AID-EJOC2257>3.0.CO;2-2 |
| [32] |
PHILLIPS A J, UTO Y, WIPF P, et al. Synthesis of functionalized oxazolines and oxazoles with DAST and deoxo-fluor[J]. Organic Letters, 2000, 2(8): 1165-1168. DOI:10.1021/ol005777b |
| [33] |
KANGANI C O, KELLEY D E, DAY B W. One pot direct synthesis of oxazolines, benzoxazoles, and oxadiazoles from carboxylic acids using the Deoxo-Fluor reagent[J]. Tetrahedron Letters, 2006, 47(37): 6497-6499. DOI:10.1016/j.tetlet.2006.07.032 |
| [34] |
WIPF P, VENKATRAMAN S. An improved protocol for azole synthesis with PEG-supported Burgess reagent[J]. Tetrahedron Letters, 1996, 37(27): 4659-4662. DOI:10.1016/0040-4039(96)00918-5 |
| [35] |
CWIK A, HELL Z, HEGEDÜS A, et al. A simple synthesis of 2-substituted oxazolines and oxazines[J]. Tetrahedron Letters, 2002, 43(22): 3985-3987. DOI:10.1016/S0040-4039(02)00723-2 |
| [36] |
王家聪, 张未星. 2-甲基-2-噁唑啉的合成研究[J]. 化学世界, 2010, 51(4): 240-242. WANG Jiacong, ZHANG Weixing. Synthesis of 2-methyl-2-oxazoline[J]. Chemical World, 2010, 51(4): 240-242. (in Chinese) |
| [37] |
OHSHIMA T, IWASAKI T, MASHIMA K. Direct conversion of esters, lactones, and carboxylic acids to oxazolines catalyzed by a tetranuclear zinc cluster[J]. Chemical Communications, 2006(25): 2711-2713. DOI:10.1039/b605066b |
| [38] |
SAKAKURA A, KONDO R, ISHIHARA K. Molybdenum oxides as highly effective dehydrative cyclization catalysts for the synthesis of oxazolines and thiazolines[J]. Organic Letters, 2005, 7(10): 1971-1974. DOI:10.1021/ol050543j |
| [39] |
REDDY L R, SARAVANAN P, COREY E J. A simple stereocontrolled synthesis of salinosporamide A[J]. ChemInform, 2004, 35(39). |
| [40] |
PARAB Y, SHUKLA S, SHAH R. Microwave irradiated synthesis and characterization of 1, 4-phenylene bis-oxazoline form bis-(2-hydroxyethyl) terephthalamide obtained by depolymerization of poly(ethylene terephthalate)(PET) bottle[J]. Current Chemistry Letters, 2012, 1(2): 81-90. DOI:10.5267/j.ccl.2012.3.003 |
| [41] |
ZARZYKA I. Foamed polyurethane plastics of reduced flammability[J]. Journal of Applied Polymer Science, 2018, 135(4): 45748. DOI:10.1002/app.45748 |
| [42] |
SEGL'A P, MIKLOž D, JAMNICKY M, et al. Formation of n-hydroxyalkylpyridine-2-carbox-amidines and 2-pyridinyl-2-oxazolines in the coordination sphere of nickel(ii)[J]. Journal of Coordination Chemistry, 1999, 48(1): 15-31. DOI:10.1080/00958979908024360 |
| [43] |
贾卫国, 李丹丹, 赵成安. 噁唑啉类化合物及其制备方法和应用: CN104447601A[P]. 2015-03-25
|
| [44] |
CHARVILLE H, JACKSON D A, HODGES G, et al. The uncatalyzed direct amide formation reaction-mechanism studies and the key role of carboxylic acid H-bonding[J]. European Journal of Organic Chemistry, 2011, 2011(30): 5981-5990. DOI:10.1002/ejoc.201100714 |
| [45] |
窦文静. 草酸二甲酯水解反应动力学的研究[D]. 天津: 天津大学, 2013 DOU Wenjing. Study on the hydrolysis kinetics of dimethyl oxalate[D]. Tianjin: Tianjin University, 2013 (in Chinese) |
| [46] |
徐艳, 吴英远, 张毅民, 等. 草酸二乙酯水解宏观动力学研究[J]. 化学反应工程与工艺, 2000, 16(3): 216-220, 227. XU Yan, WU Yingyuan, ZHANG Yimin, et al. Studies on hydrolysis macroscopic kinetics of diethyl oxalate into oxalic acid[J]. Chemical Reaction Engineering and Technology, 2000, 16(3): 216-220, 227. (in Chinese) |
| [47] |
鲁成祥. 双噁唑啉扩链尼龙6及其共混改性研究[D]. 成都: 四川大学, 2007 LU Chengxiang. Investigation on the chain extension of polyamide 6 with bis(2-oxazoline) and the blending modification of polyamide[D]. Chengdu: Sichuan University, 2007 (in Chinese) |
| [48] |
XU Q, LI Z. A facile synthesis of 2-oxazolines using a PPh3-DDQ system[J]. Tetrahedron Letters, 2009, 50(49): 6838-6840. |
 2025, Vol. 42
2025, Vol. 42