漆酶(Laccase,EC 1.10.3.2)是一类多铜氧化酶,在植物和微生物中广泛存在,由于其作用底物特异性不高,其应用领域非常广泛,可用于污染物降解(如农药、抗生素等)、染料脱色、食品加工以及化学合成等方面[1]。基于漆酶的来源不同,可将漆酶分成3大类,植物型、细菌型和真菌型[2],除真菌型漆酶外,其它两型的漆酶氧化还原电位较低(﹤ 1.3 V),导致其在非酚类底物的催化降解中效率不高,通常需要有小分子介质物质参与反应[3]。由于漆酶都是糖蛋白结构,其活性和结构容易受外界环境的影响,例如环境温度、pH值以及底物的离子强度都会影响其活性,导致其催化性能降低,在实际应用中具有局限性。此外,作为生物来源的蛋白类化合物,其提取纯化过程复杂、成本较高,也导致其广泛使用受到限制[4]。为了克服这些缺点,人们努力寻找和开发漆酶的类似物。近年来,基于纳米材料的酶模拟物(纳米酶)因其与天然酶相比具有易生产性、可控性、可长期储存、更高稳定性以及价格更低等优点受到了高度关注[5, 6]。例如Liang等[7]利用核苷酸与铜配位制备了一种Cu/GMP漆酶类似物,该复合物可催化各种漆酶底物如氯酚、对苯二酚、肾上腺素等,而且比天然漆酶具有更好的催化效率,同时,也表现出更好的稳定性和对反应条件的耐受性。Wang等[8]利用不同寡核苷酸作为稳定剂制备的铂纳米颗粒(Pt NPs) 也表现出对多种漆酶底物的良好的催化性能,酶动力学研究表明Pt NPs对2, 4-DP的亲和力是天然漆酶的3倍。由此可见,一些金属氧化物基纳米材料由于自身的氧化还原特性具备了氧化酶的功能,同时可以克服天然酶不稳定及制备复杂等缺点。
金属锰元素具有独特的电子结构3d54s2和可变的价位(3-~7+),Mn3O4、Mn2O3和MnO2是常见的高性能锰氧化物(MnOx),被认为是高效的氧化催化剂[9]。一方面MnOx能够使自身电子形成移动电子环境,有利于攻击或者还原一些底物[10],另一方面,锰是自然界中大量存在的金属元素,是地壳中存在量第3丰富的过渡金属元素,对环境友好、价格低廉[11]。在许多环境污染物的转化和去除研究中MnOx已经显示了重要作用[12]。在这些MnOx中,基于Mn3O4的独特的结构特征(2个Mn3+和1个Mn2+)和特殊的理化性质受到了研究者广泛的关注,例如,Mn3O4在催化甲苯的氧化降解中表现出较其他锰氧化物更高的反应活性和降解能力[13]。Mn3O4在分子氧的媒介条件下具有催化碳氢化合物氧化的能力[14],此外,Mn3O4还被发现具有多酚氧化酶类似物的活性[15]。最近,MnO2纳米颗粒被证明在污水处理过程中表现出类漆酶的催化活性,在介质ABTS存在情况下可以高效催化降解污水中的17β-雌二醇[16]。但是,有关Mn3O4纳米颗粒是否具有类漆酶的活性至今未见有研究报道。
本研究通过化学沉淀法制备了Mn3O4纳米颗粒,以漆酶的经典底物2, 4-二氯苯酚(2, 4-DP)作为反应指示物考察了Mn3O4的氧化还原活性,并在有无反应介质存在的条件下评价了Mn3O4去除水溶液中染料污染物吖啶橙(AO)的能力。同时研究了不同的反应条件对催化过程的影响以及催化行为的Michaelis-Menten动力学。
1 实验部分 1.1 实验材料与试剂双氧水(H2O2, 质量分数为30%)购自天津丰川化学试剂科技有限公司。盐酸(HCl, 质量分数为36%)购自利安隆博华(天津)医药化学有限公司。氯化钠(NaCl)、硫酸钠(Na2SO4)、三氯化铁六水合物(FeCl3 ·6H2O)、氯化亚铁四水合物(FeCl2 ·4H2O)、结晶三氯化铝(AlCl3 ·6H2O)、氯化钾(KCl)、氢氧化钠(NaOH)、氨水(NH3 ·H2O, 质量分数为25%~28%)、无水磷酸二氢钠(NaH2PO4)、无水磷酸氢二钠(Na2HPO4)购自上海阿拉丁生化科技有限公司。无水碳酸钠(Na2CO3)购自天津市北方天医化学试剂厂。硫酸铜五水合物(CuSO4 ·5H2O)购自上海麦克林生物科技有限公司。结晶乙酸钠(CH3COONa ·3H2O)购自天津市元立化工有限公司。一水硫酸锰(MnSO4 ·H2O), 2, 4-二氯苯酚(2, 4-DP)和4-氨基安替比林(4-AAP)购自天津希恩斯生化科技有限公司。1-羟基苯并三唑(HBT)购自上海能源化工有限公司。吖啶橙(AO),漆酶(from Trametes versicolor,3000 units ·g-1) 购自北京索莱宝生物科技有限公司。研究中使用的所有化学品均未进一步纯化。
1.2 实验与表征测试仪器实验仪器:电热鼓风干燥箱(DGG-101-1S, 天津市天宇实验仪器有限公司);电子分析天平(ISO 9001,德国赛多利斯公司);pH计(PH400,上海安莱立思仪器科技有限公司); 台式高速离心机(L500-A,湘仪离心机仪器有限公司);紫外-可见分光光度计(UV-1700, 日本岛津公司); ORP复合电极(雷磁501,上海仪电科学仪器股份有限公司)。
表征测试仪器:场发射扫描电子显微镜(Apreo S,美国FEI公司);X射线衍射仪(Smartlab,日本理学公司);纳米粒度及Zeta电位仪(Zetasizer Nano,英国马尔文仪器公司)。
1.3 实验方法 1.3.1 Mn3O4的制备Mn3O4纳米颗粒的制备依据文献[17]进行。将0.67 g MnSO4 ·H2O溶解在20 mL超纯水中,在快速磁力搅拌下,向溶液中加入8 mL NH3 ·H2O反应30 min,随后向上述溶液中滴加5 mL 10%H2O2水溶液,浅棕色沉淀物逐渐被氧化成棕黑色,整个反应在60 ℃下进行。搅拌1 h后,将混合物离心去除上清液,60 ℃鼓风干燥30 min,所得粉末进行扫描电镜观察和XRD测定。制备过程中涉及的反应如下:
| $ \mathrm{MnSO}_4+2 \mathrm{NH}_3 \cdot \mathrm{H}_2 \mathrm{O}=\mathrm{Mn}(\mathrm{OH})_2+\left(\mathrm{NH}_4\right)_2 \mathrm{SO}_4 $ | (1) |
| $ 3 \mathrm{Mn}(\mathrm{OH})_2+\mathrm{H}_2 \mathrm{O}_2=\mathrm{Mn}_3 \mathrm{O}_4+4 \mathrm{H}_2 \mathrm{O} $ | (2) |
通过酚类化合物与4-AAP的显色反应测定Mn3O4的漆酶活性[18]。首先,将300 μL 4-AAP (1 g ·L-1) 和300 μL 2, 4-DP (1 g ·L-1)与2.4 mL磷酸盐缓冲液(pH=6, 0.05 mol ·L-1) 混合。然后,将10 μL Mn3O4水分散体(3 g ·L-1)添加到混合物中,并在25 ℃下孵育1 h。将混合物13 000 r ·min-1离心5 min后,使用紫外-可见分光光度计测定上清液在510 nm处的吸光度。
1.3.3 pH值和温度对Mn3O4催化活性的影响应用单因素实验设计考察了pH值和温度对Mn3O4催化活性的影响。pH值的影响在3~9的范围内考察:将10 μL Mn3O4悬液添加到不同pH值的反应体系中,由磷酸盐缓冲液(2.4 mL, 0.05 mol ·L-1) 调整pH值到预设值(范围在3~9之间),在25 ℃下孵育1 h,然后13 000 r ·min-1离心5 min,测定上清液在510 nm处的吸光度。温度的影响在25~75 ℃的范围内考察:反应体系的pH值设定在6.0,反应体系的组成与pH值的影响考察体系相同,只是孵育在不同的温度下进行。每组设3个平行管,取其平均值,选取各因素中吸光度最高的一组为最适宜pH值或最适宜温度。
1.3.4 Mn3O4催化活性的动力学考察为了考察Mn3O4纳米颗粒浓度对初始反应速率的影响,将不同体积(10~90 μL)的Mn3O4悬液(3 g ·L-1) 添加到由4-AAP与2, 4-DP和磷酸盐缓冲液组成的反应体系中(pH值为6.0),采用紫外-可见分光光度计时间测量模式,以0.5 s的时间间隔扫描5 min,得到510 nm处吸光度值随时间的变化曲线, 曲线斜率即催化反应速率[19]。
为了考察底物浓度对初始反应速率的影响,在最适宜pH值和室温下,固定反应体系中Mn3O4悬液(3 g ·L-1)的体积为10 μL,指示剂浓度4-AAP为220 μg ·mL-1,调整底物2, 4-DP的浓度从0.12~1.2 mmol ·L-1成倍增加。应用紫外-可见分光光度计记录反应体系在510 nm处吸光度值,绘制5 min内的时间-吸光度值变化曲线,获得酶反应速率。
以反应速率倒数对底物浓度倒数作图, 得Lineweaver-Burk曲线, 根据米氏方程(3)求出米氏常数(Km) 和最大反应速率(Vmax),并与漆酶相比较。
| $ \frac{1}{v}=\frac{K_{\mathrm{m}}+[S]}{V_{\max }[S]}=\frac{K_{\mathrm{m}}}{V_{\max }} \frac{1}{[S]}+\frac{1}{V_{\max }} $ | (3) |
式(3)中:v表示表观初始反应速率;Vmax表示初始最大反应速率;[S]表示底物浓度;Km为米氏常数。
1.3.5 Mn3O4的储存稳定性考察将Mn3O4纳米颗粒与漆酶保存在超纯水中,用相对酶活来评估Mn3O4纳米颗粒和漆酶在4 ℃及室温条件下10 d内的储存稳定性。Mn3O4纳米颗粒和漆酶的初始活性定义为100%,按照1.3.2的测定方法每隔一定的时间间隔分别测定两者的相对酶活。
1.3.6 Mn3O4纳米颗粒对吖啶橙的去除作用在40 mL浓度为20 mg ·L-1的吖啶橙(AO)溶液中加入40 mg Mn3O4粉末,pH值调至6.0,将其置于室温下摇床,分别在5、15、30、60 min取样3 mL,13 000 r ·min-1离心5 min取上清测定490 nm处的吸光度,计算去除效率R。
| $ R=\left(\rho_0-\rho_{\mathrm{e}}\right) / \rho_0 \times 100 \% $ | (4) |
式(4)中:ρ0和ρe(g ·L-1)分别是上清液中的初始和最终AO浓度。
实验中发现此反应体系中AO的去除效率较低。考虑到漆酶在实际应用中由于其自身氧化还原电位低于反应底物时,其催化效率会大大降低,而氧化还原介质的加入可以加快电子穿梭,使得体系的氧化还原电位提高,进而促进催化反应的进行[20, 21]。常用的氧化还原介质有ABTS、HBT和草香醛的化合物,其中HBT是一种无色的氧化还原介质,不会干扰底物的吸光度值测定,并且可以被漆酶氧化成苯氧基自由基,该自由基具有较高的氧化还原电势。因此,在AO脱色反应体系中,加入了HBT,使终浓度达2 mmol ·L-1,并测定了体系中加入HBT前后的氧化还原电位值(氯化银电极法),以及AO在490 nm处的吸光度。
为了评估Mn3O4的重复使用性,在完成1次去除实验后,用超纯水将Mn3O4纳米颗粒洗涤3次后投入新鲜的反应液中,进行下一轮的循环使用,重复上述步骤6次。每组设3个平行管,计算其平均值。
1.3.7 Mn3O4纳米颗粒在模拟染料废水中的应用染料废水中通常含有不同种类的盐和金属离子,这会影响废水中污染物的吸附和降解。为了探究不同环境介质对Mn3O4纳米颗粒降解吖啶橙的影响,在上述反应体系中加入不同种类的盐和金属离子,使其终浓度为1 mmol ·L-1,将其置于摇床反应30 min,取样离心分离后,测定上清液中的AO浓度,计算AO去除率。此外,我们还研究了Mn3O4纳米颗粒在真实水样中(自来水和池塘水)对吖啶橙的去除效果。
2 结果与讨论 2.1 Mn3O4表征结果合成的Mn3O4纳米颗粒的XRD衍射峰如图 1所示,对应于(112)、(103)、(211)、(220)、(105)、(321)、(224) 和(400) 晶面的强峰与Mn3O4标准图谱JCPDS no. 24-0734相符[22]。扫描电镜(SEM)图(图 2)显示Mn3O4纳米颗粒粒度均匀,粒径在50 nm左右,有部分团聚现象。
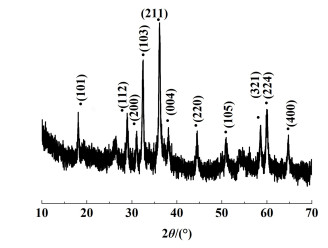
|
| 图 1 Mn3O4的X射线衍射图 Fig.1 XRD patterns of Mn3O4 |
| |
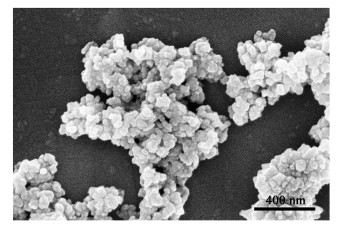
|
| 图 2 Mn3O4的扫描电镜图 Fig.2 SEM images of Mn3O4 |
| |
以2, 4-DP为底物考察了Mn3O4的漆酶样催化活性。2, 4-DP的氧化产物可与4-AAP反应生成粉红色产物,在510 nm处表现出特征吸收,而单独2,4-DP和4-AAP在510 nm处无吸收峰,因此可以用510 nm处的吸光度值来表征Mn3O4的漆酶样活性,该反应原理如图 3(a)所示。图 3(b)为Mn3O4纳米颗粒和漆酶分别与2, 4-DP反应后在显色剂4-AAP存在下的显色产物照片。
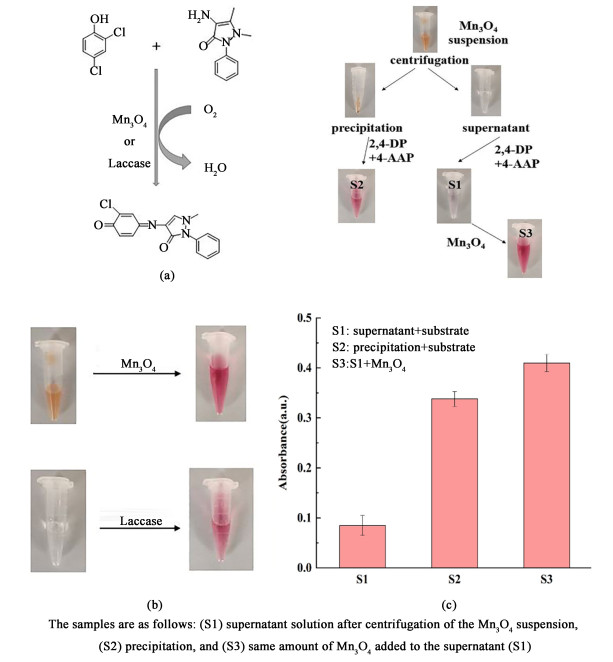
|
| 图 3 (a) Mn3O4和漆酶催化2, 4-DP与4-AAP的反应方程式;(b)发色产物照片; (c) Mn3O4浸出实验的照片和紫外可见表征 Fig.3 (a) Reaction equation of 2, 4-DP and 4-AAP catalyzed by Mn3O4 or laccase; (b) photo of chromogenic product; (c) photographic and UV-vis characterization of the leaching experiment |
| |
为了证明Mn3O4纳米颗粒产生的漆酶样活性并非反应体系中游离的Mn2+离子所致,将Mn3O4纳米颗粒悬浮液以13 000 r ·min-1离心5 min后测试上清液的催化活性[图 3(c)],结果显示上清液没有催化活性,而沉淀物在再分散后表现出特征性的漆酶样活性。将Mn3O4纳米颗粒再添加到上清液中会导致在510 nm处出现高吸光度峰[图 3(c)],表明漆酶样活性来自Mn3O4纳米颗粒,而非游离的Mn2+。
2.3 pH值和温度对Mn3O4催化活性的影响pH值不仅会改变Mn3O4及底物表面电荷的分布,同时还对Mn3O4的氧化还原电位具有很大影响。通常,锰氧化物的氧化还原电位随着pH值的增加而降低[23]。因此考察了不同pH值条件下Mn3O4的催化活性。由图 4可以看出,尽管在pH=3的酸性条件下,Mn3O4的氧化还原电位相对较高,但却没有表现出良好的催化活性,这可能是由于Mn3O4[如图 4(b)]所示,等电点为3.4和2,4-DP(pKa=7.6~8.0[24])此时都带正电,两者发生静电排斥作用,不利于反应过程中的电子转移[25]。随着pH值不断增大,Mn3O4的表面带负电荷,与底物的静电吸引作用导致其催化活性快速上升,并在pH值为6~7时表现出最佳催化作用。当pH>7时,Mn3O4的氧化还原电位降低以及与底物之间静电排斥作用综合导致了催化活性的快速下降。与Mn3O4相比,天然漆酶在pH值为5~6时具有相对较高的酶活。说明漆酶对微酸性环境有比较好的适应能力,过酸或者过碱条件都会影响漆酶的蛋白构象,致使其酶活的丧失。综合考虑实际应用,最终选择了pH=6为Mn3O4的最适宜反应pH值。
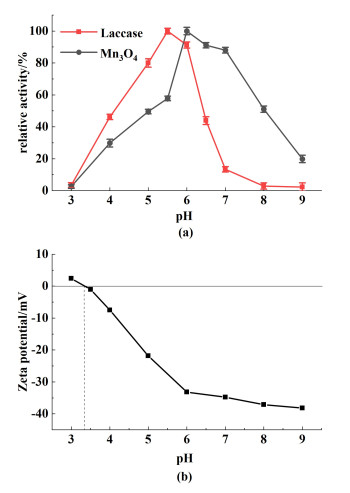
|
| 图 4 (a) 反应pH值对Mn3O4催化活性的影响; (b) Mn3O4在不同pH的Zeta电位图 Fig.4 (a) The effect of pH on the catalytic activity of Mn3O4; (b) Zeta potential of Mn3O4 at different pH |
| |
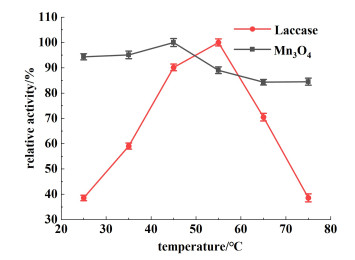
图 5显示了不同温度对Mn3O4和漆酶催化活性的影响。
|
| 图 5 反应温度对Mn3O4催化活性的影响 Fig.5 The effect of temperature on the catalytic activity of Mn3O4 |
| |
从图 5中可以看出,随着温度的升高,天然漆酶的催化活性增加,并且在55 ℃表现出最佳催化作用,这是由于升高温度能够增加底物分子的动能,提高酶反应活性[26]。但超过55 ℃之后,漆酶的活性迅速下降,到75 ℃时酶活下降到30%,说明天然漆酶因其固有的蛋白结构特点受到温度的影响较大,其最适温度范围只在1个较小的区间(45~55 ℃)。与天然漆酶相比,Mn3O4的催化活性在25~75 ℃范围内都保持在80%以上,特别是在室温范围内(25~35 ℃)其催化活性都维持在95%左右,表明Mn3O4纳米酶有一个较好的温度适应能力,为实际应用提供了便利。考虑到实际应用,在后续实验中选择室温作为最适反应温度。
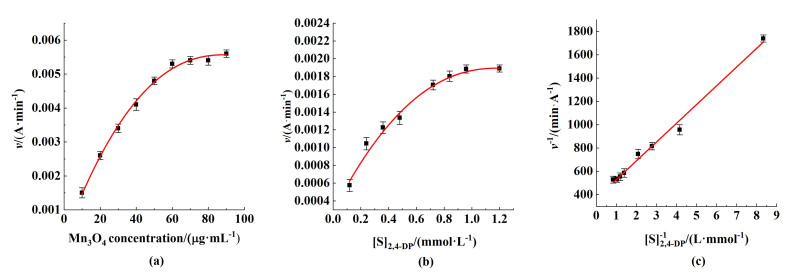
2.4 Mn3O4催化活性的动力分析图 6(a)显示了Mn3O4浓度对反应速率的影响。
|
| 图 6 Mn3O4的稳态动力学测定(a)Mn3O4浓度对反应速率的影响;(b)底物浓度对反应速率的影响;(c)Mn3O4催化2, 4-DP和4-AAP反应的Line weaver-Burk图 Fig.6 Steady-state kinetic assays of Mn3O4 (a)the effect of Mn3O4 concentration on reaction rate; (b) the effect of substrate concentration on reaction rate and (c) the Line weaver-Burk plot for 2, 4-DP and 4-AAP catalyzed by Mn3O4 |
| |
从图 6中可以看出,在底物浓度固定的情况下,当Mn3O4在低浓度区间(10~50 μg ·mL-1)变化时,随着Mn3O4浓度的增加,底物与Mn3O4纳米颗粒的接触机率增加,反应速率增大。该浓度区间内,反应速率与纳米颗粒浓度呈直线相关关系(y=0.000081x+0.000850,R2=0.9898)。当Mn3O4浓度继续增加时,其反应速率呈缓慢增长趋势。这符合酶促反应的一般规律[27]。
在Mn3O4浓度不变的情况下,底物浓度对反应速率的影响呈双矩形曲线[如图 6(b)所示],表明Mn3O4纳米颗粒遵循Michaelis-Menten模型。具体表现为:底物在低浓度区间时,反应速度随底物浓度的增加而迅速加快,两者呈线性关系,表现为一级反应。当底物浓度在0.72~1.00 mmol ·L-1之间时,可以明显观察到反应速度增速减小,表现为混合级反应。
Km值是酶的特征性常数,只与酶的性质有关。Km值越小,酶与底物的亲和力越大。Kcat是酶动力学常数,表示在底物浓度处于饱和状态下酶催化生成产物的速率。Kcat越大,说明酶转化底物的速率越快[19]。从图 6(c)可以看出,对于Mn3O4,底物浓度的倒数与反应速率的倒数呈直线关系(y=162.15x+361.57,R2=0.9918)。通过米氏方程计算动力学参数,结果显示在表 1中。从表 1中可以看出,尽管漆酶(Km=0.19 mmol ·L-1) 的Km低于Mn3O4 (Km=0.44 mmol ·L-1),但令人满意的是,Mn3O4的Vmax、Kcat和Kcat ·Km-1值比漆酶大得多,表明合成制备的Mn3O4比天然漆酶分子具有更高的催化效率。
| 催化剂 | Km/ (mol·L-1) |
Vmax/ (A·min-1) |
Kcat/ min-1 |
(Kcat·Km-1)/ (L·mol-1·min-1) |
| Mn3O4 | 0.44 | 0.002 765 | 2.77×10-4 | 6.17×10-4 |
| 漆酶 | 0.19 | 0.000 034 | 3.40×10-6 | 1.72×10-5 |
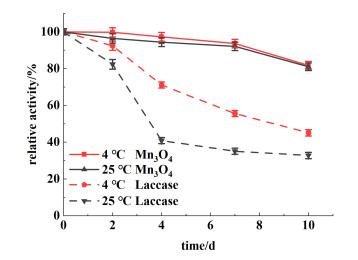
通常,天然酶分子的储存需要较严苛的条件,如低温、冷冻或冻干等条件,而无机金属纳米酶可以具有比蛋白酶类更好的稳定性。如图 7所示,Mn3O4纳米颗粒水溶液在室温(25 ℃)或4 ℃条件下储存10 d,其总体催化活性仅损失了20%。与此形成对照地是天然漆酶水溶液储存在室温(25 ℃)或4 ℃条件下10 d,其总体催化活性损失了70%。因此,与天然漆酶相比,Mn3O4纳米颗粒具有更好的储存稳定性。
|
| 图 7 天然漆酶和Mn3O4的储存稳定性 Fig.7 Storage stability of natural laccase and Mn3O4 |
| |
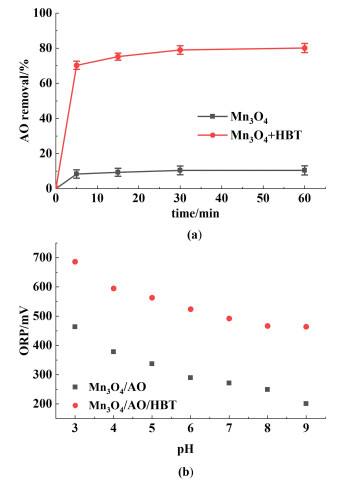
图 8显示了Mn3O4对水溶液中吖啶橙(AO)的去除效率。
|
| 图 8 (a) 反应时间对AO去除效率的影响(AO浓度20 mg ·L-1,Mn3O4量40 mg,HBT 2 mmol ·L-1, pH=6);(b)单独Mn3O4在不同pH下AO溶液中的ORP值以及加入HBT之后的ORP值 Fig.8 (a) The effect of reaction time on AO removal efficiency at room temperature (AO concentration 20 mg ·L-1, Mn3O4 40 mg, HBT 2 mmol ·L-1, pH=6); (b)ORP values of Mn3O4 alone in AO solution at different pH and that after adding HBT |
| |
从图 8(a)中可以看出,无介质的Mn3O4体系中,当pH=6时,对AO的去除效率仅为10%,这可能是因为此条件下的Mn3O4的自身氧化还原电位较低,如图 8(b)所示不足300 mV,导致其无法有效氧化降解AO。当加入反应介质HBT后,氧化还原电位达到523 mV, Mn3O4对AO的降解效率提高至80%,表明HBT作为氧化还原介质起到了重要作用。受漆酶-介体系统催化机理的启发[28],本研究提出了HBT介导Mn3O4纳米颗粒催化氧化AO的机制。首先,HBT结合在Mn3O4表面形成前体配合物,电子从HBT转移到Mn3O4,随后释放出HBT+和Mn2+,HBT+再通过去质子化形成苯氧基自由基中间体[18]以攻击染料分子AO,导致其降解。最后,氧气得到Mn2+的电子还原为水,Mn2+被氧化为Mn3+,实现Mn3O4纳米酶的催化循环。
进行了6个循环实验以研究Mn3O4纳米酶的可重复使用性。如图 9所示,Mn3O4在3个循环中表现出高活性。虽然之后Mn3O4纳米酶对AO的去除效率随着循环使用次数的增加而下降,但其下降速率较为缓慢。出现这种现象的原因可能是由于在完成1次循环使用后,只对Mn3O4表面进行了AO的洗涤,但并未进行有效脱吸,多次循环后,过量的AO使得HBT与Mn3O4纳米酶接触受阻,导致AO去除效率下降。但总体来说,Mn3O4纳米酶具有良好的循环使用性能。
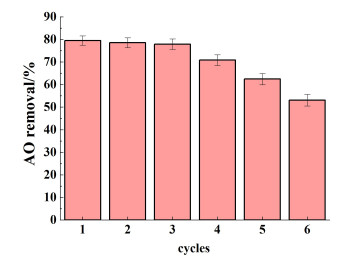
|
| 图 9 Mn3O4的重复使用性 Fig.9 Reusability of Mn3O4 |
| |
图 10显示了不同种类的钠盐和金属离子对AO去除效率的影响。
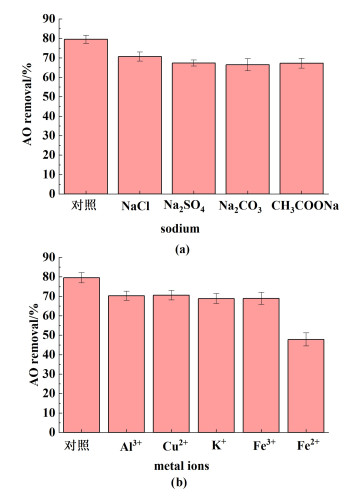
|
| 图 10 (a) 钠盐对AO去除效率的影响;(b)金属离子对AO去除效率的影响(AO浓度20 mg ·L-1,Mn3O4量40 mg,HBT 2 mmol ·L-1, pH=6) Fig.10 (a) The effect of sodium on the removal efficiency of AO; (b) Effect of metal ions on the removal efficiency of AO (AO 20 mg ·L-1, Mn3O4 40 mg, HBT 2 mmol ·L-1, pH=6) |
| |
从图 10中可以看出, 这些物质导致Mn3O4纳米颗粒对AO的降解效率出现不同程度的下降。这可能是由于它们会与HBT竞争Mn3O4纳米颗粒表面的亲和位点,阻碍HBT与Mn3O4的接触。另外Fe2+还可能与Mn3O4发生氧化还原反应,影响Mn3O4与HBT之间的电子转移[29],进一步导致降解效率显著下降。
此外,我们还研究了Mn3O4纳米颗粒在真实水样中对AO的降解效果。
从表 2中可以看出,Mn3O4在自来水和池塘水中对AO的降解效率都明显下降,这是由于实际水样中存在干扰物质,例如离子或自由基清除剂[30]。但相比于漆酶,Mn3O4纳米酶仍然具有良好的抗干扰能力,这也意味着Mn3O4纳米酶具有潜在的实际应用价值。
| 催化剂 | AO去除效率/% | ||
| 超纯水 | 自来水 | 池塘水 | |
| Mn3O4漆酶 | 79.53 | 52.61 | 36.37 |
| 69.59 | 18.78 | 12.02 | |
本研究使用简单的化学沉淀法制备了Mn3O4纳米颗粒,通过应用漆酶的典型底物2, 4-DP检测表明其具有良好的漆酶催化活性,与天然漆酶相比,该纳米酶具有更好的热稳定性和良好的室温储存稳定性。Michaelis-Menten动力学实验表明在相同的质量浓度下,Mn3O4对2, 4-DP具有更高的催化速率。Mn3O4与HBT的结合使用可以有效降解水溶液中的AO,去除过程中的ORP监测证实苯氧基自由基的产生提高了Mn3O4-HBT系统的氧化能力。因此,Mn3O4材料作为一种漆酶类纳米酶,制备简单,成本低廉,在染料废水处理中具有良好的应用前景。
| [1] |
赖超凤, 李爽, 彭丽丽, 等. 漆酶及其在有机合成中应用的研究进展[J]. 化工进展, 2010, 29(7): 1300-1308. LAI Chaofeng, LI Shuang, PENG Lili, et al. Progress of applications of laccase in organic synthesis[J]. Chemical Industry and Engineering Progress, 2010, 29(7): 1300-1308. (in Chinese) |
| [2] |
徐鑫, 张国庆, 胡渤洋, 等. 真菌漆酶及其介体系统: 来源、机理与应用[J]. 生物技术进展, 2020, 10(1): 30-39. XU Xin, ZHANG Guoqing, HU Boyang, et al. Fungal laccases and their mediator systems: Sources, mechanisms and applications[J]. Current Biotechnology, 2020, 10(1): 30-39. (in Chinese) |
| [3] |
CAÑAS A I, CAMARERO S. Laccases and their natural mediators: Biotechnological tools for sustainable eco-friendly processes[J]. Biotechnology Advances, 2010, 28(6): 694-705. DOI:10.1016/j.biotechadv.2010.05.002 |
| [4] |
龚睿, 孙凯, 谢道月. 真菌漆酶在绿色化学中的研究进展[J]. 生物技术通报, 2018, 34(4): 24-34. GONG Rui, SUN Kai, XIE Daoyue. Applications of fungal laccase in green chemistry[J]. Biotechnology Bulletin, 2018, 34(4): 24-34. (in Chinese) |
| [5] |
WEI M, LEE J, XIA F, et al. Chemical design of nanozymes for biomedical applications[J]. Acta Biomaterialia, 2021, 126: 15-30. DOI:10.1016/j.actbio.2021.02.036 |
| [6] |
WU J, WANG X, WANG Q, et al. Nanomaterials with enzyme-like characteristics (nanozymes): Next-generation artificial enzymes (Ⅱ)[J]. Chemical Society Reviews, 2019, 48(4): 1004-1076. DOI:10.1039/C8CS00457A |
| [7] |
LIANG H, LIN F, ZHANG Z, et al. Multicopper laccase mimicking nanozymes with nucleotides as ligands[J]. ACS Applied Materials & Interfaces, 2017, 9(2): 1352-1360. |
| [8] |
WANG Y, HE C, LI W, et al. Catalytic performance of oligonucleotide-templated Pt nanozyme evaluated by laccase substrates[J]. Catalysis Letters, 2017, 147(8): 2144-2152. DOI:10.1007/s10562-017-2106-5 |
| [9] |
XU H, YAN N, QU Z, et al. Gaseous heterogeneous catalytic reactions over Mn-based oxides for environmental applications: A critical review[J]. Environmental Science & Technology, 2017, 51(16): 8879-8892. |
| [10] |
DURÁN F G, BARBERO B P, CADÚS L E, et al. Manganese and iron oxides as combustion catalysts of volatile organic compounds[J]. Applied Catalysis B: Environmental, 2009, 92(1/2): 194-201. |
| [11] |
MARTIN S T. Precipitation and dissolution of iron and manganese oxides[J]. Environmental Catalysis, 2005, 1: 61-82. |
| [12] |
ZHANG H, WEBER E J. Identifying indicators of reactivity for chemical reductants in sediments[J]. Environmental Science & Technology, 2013, 47(13): 6959-6968. |
| [13] |
KIM S C, SHIM W G. Catalytic combustion of VOCs over a series of manganese oxide catalysts[J]. Applied Catalysis B: Environmental, 2010, 98(3/4): 180-185. |
| [14] |
LI X, ZHOU L, GAO J, et al. Synthesis of Mn3O4 nanoparticles and their catalytic applications in hydrocarbon oxidation[J]. Powder Technology, 2009, 190(3): 324-326. DOI:10.1016/j.powtec.2008.08.010 |
| [15] |
SINGH M, KAUR M, SANGHA M K, et al. Comparative evaluation of manganese oxide and its graphene oxide nanocomposite as polyphenol oxidase mimics[J]. Materials Today Communications, 2021, 27: 102237. DOI:10.1016/j.mtcomm.2021.102237 |
| [16] |
WANG X, LIU J, QU R, et al. The laccase-like reactivity of manganese oxide nanomaterials for pollutant conversion: Rate analysis and cyclic voltammetry[J]. Scientific Reports, 2017, 7: 7756. DOI:10.1038/s41598-017-07913-2 |
| [17] |
崔国星, 朱建伟, 张启卫. 硫酸锰氧化法制备Mn3O4的研究[J]. 矿冶工程, 2008, 28(4): 72-76. CUI Guoxing, ZHU Jianwei, ZHANG Qiwei. Study of preparation of manganic manganous oxide from manganese sulfate by oxidation[J]. Mining and Metallurgical Engineering, 2008, 28(4): 72-76. DOI:10.3969/j.issn.0253-6099.2008.04.021 (in Chinese) |
| [18] |
GE Z, WU B, SUN T, et al. Laccase-like nanozymes fabricated by copper and tannic acid for removing malachite green from aqueous solution[J]. Colloid and Polymer Science, 2021, 299(10): 1533-1542. DOI:10.1007/s00396-021-04867-w |
| [19] |
钟平方, 彭惠民, 彭方毅, 等. 漆酶催化酚类、苯胺类化合物的动力学分析及其测定废水中邻苯二酚的应用研究[J]. 环境科学, 2010, 31(11): 2673-2677. ZHONG Pingfang, PENG Huimin, PENG Fangyi, et al. Kinetic analysis of laccase catalyze phenolic and aniline compounds and detecting catechol in wastewater[J]. Environmental Science, 2010, 31(11): 2673-2677. (in Chinese) |
| [20] |
卢蓉, 夏黎明. 漆酶氧化还原介质系统的作用机理及其应用[J]. 纤维素科学与技术, 2004, 12(1): 37-44. LU Rong, XIA Liming. Advances in research and application of laccase mediator system[J]. Journal of Cellulose Science and Technology, 2004, 12(1): 37-44. (in Chinese) |
| [21] |
ANDREU G, VIDAL T. Laccase from Pycnoporus cinnabarinus and phenolic compounds: Can the efficiency of an enzyme mediator for delignifying kenaf pulp be predicted?[J]. Bioresource Technology, 2013, 131: 536-540. DOI:10.1016/j.biortech.2013.01.033 |
| [22] |
LI Y, QU J, GAO F, et al. In situ fabrication of Mn3O4 decorated graphene oxide as a synergistic catalyst for degradation of methylene blue[J]. Applied Catalysis B: Environmental, 2015, 162: 268-274. DOI:10.1016/j.apcatb.2014.06.058 |
| [23] |
REMUCAL C K, GINDER-VOGEL M. A critical review of the reactivity of manganese oxides with organic contaminants[J]. Environmental Science Processes & Impacts, 2014, 16(6): 1247-1266. |
| [24] |
XIE T, DYRSSEN D. Simultaneous determination of partition coefficients and acidity constants of chlorinated phenols and gualacols by gas chromatography[J]. Analytica Chimica Acta, 1984, 160: 21-30. DOI:10.1016/S0003-2670(00)84505-5 |
| [25] |
LIN K, LIU W, GANT J. Oxidative removal of bisphenol A by manganese dioxide: Efficacy, products, and pathways[J]. Environmental Science & Technology, 2009, 43(10): 3860-3864. |
| [26] |
孔晓燕, 林坤德. 漆酶催化转化溴酚类化合物的动力学研究[J]. 浙江工业大学学报, 2014, 42(3): 344-348. KONG Xiaoyan, LIN Kunde. Transformation kinetics of bromophenols by laccase[J]. Journal of Zhejiang University of Technology, 2014, 42(3): 344-348. DOI:10.3969/j.issn.1006-4303.2014.03.024 (in Chinese) |
| [27] |
胡平平, 付时雨. 漆酶催化活性中心结构及其特性研究进展[J]. 林产化学与工业, 2001, 21(3): 69-75. HU Pingping, FU Shiyu. Advances in the studies on structure of catalytic active site and characteristics of laccase[J]. Chemistry & Industry of Forest Products, 2001, 21(3): 69-75. (in Chinese) |
| [28] |
CANTARELLA G, GALLI C, GENTILI P. Free radical versus electron-transfer routes of oxidation of hydrocarbons by laccase/mediator systems[J]. Journal of Molecular Catalysis B: Enzymatic, 2003, 22(3/4): 135-144. |
| [29] |
谢道月, 刘琦, 汪珺, 等. MnO2纳米酶催化ABTS的显色反应及其在Fe2+和Pb2+检测中的应用[J]. 环境化学, 2019, 38(12): 2843-2850. XIE Daoyue, LIU Qi, WANG Jun, et al. Chromogenic reaction of ABTS catalyzed by MnO2 nanozyae and its application in the visual detection of Fe2+ and Pb2+[J]. Environmental Chemistry, 2019, 38(12): 2843-2850. (in Chinese) |
| [30] |
DADIGALA R, BANDI R, ALLE M, et al. Effective fabrication of cellulose nanofibrils supported Pd nanoparticles as a novel nanozyme with peroxidase and oxidase-like activities for efficient dye degradation[J]. Journal of Hazardous Materials, 2022, 436: 129165. |
 2025, Vol. 42
2025, Vol. 42





