2. 深圳太太药业有限公司, 广东 深圳 518057
2. Shenzhen Taitai Pharmaceutical Industry Co. Ltd., Shenzhen 518057, Guangdong, China
由于胰岛素自身对温度敏感且易酶解的性质,市售临床剂型均为皮下注射使用的注射剂。尽管胰岛素注射给药可以获得稳定确切的降糖效果,但长期频繁注射会导致脂肪增生等一系列严重的副作用[1]。为克服胰岛素注射给药带来的问题,近几十年来,一系列具有避免胰岛素在消化道内降解的功能的纳米载体制剂成为了非注射胰岛素制剂的研究热点,相关的载体包括脂质体[2]、纳米球[3]和微乳[4]等。相比于其它载体,微乳具有制备方法简单、工艺温和的优点,能使药物活性得以最大限度保持[5]。此外,微乳液滴中的药物分散度更高,易于在肠道吸收。
基于(伪)三元相图中微乳区域来筛选处方是常用的微乳处方筛选方法[6],通常先以空白微乳的(伪)三元相图确定其处方组成,然后直接加入胰岛素,得到含药微乳[7-9]。由于蛋白质与离子型表面活性剂之间具有电荷作用,与非离子型表面活性剂之间具有疏水相互作用[10]和界面膜处的置换作用[11],表面活性剂与蛋白质的混合体系表现出与单一表面活性剂或蛋白质体系不同的性质[12]。此外,蛋白质作为生物大分子通常具有表面活性[13],胰岛素作为生物大分子药物,也应当具有类似表面活性剂的性质。因此,空白微乳中加入胰岛素会改变微乳中表面活性剂的组成,相应的(伪)三元相图也会发生改变,得到的微乳剂不仅不再是其最佳成分组成,而且还有可能影响胰岛素微乳的稳定性。然而迄今,尚未有人对此问题进行过关注并开展相应的研究。
本研究以生物相容性好、食品和药品中应用广泛的Span-80和Tween-80混合作为表面活性剂,以廉价易得、低毒性的无水乙醇为助表面活性剂,IPM为油相,胰岛素溶液(胰岛素以1%的质量比溶解在pH=2.5的柠檬酸缓冲液中)为水相,分别绘制空白微乳和胰岛素微乳的(伪)三元相图,对两者的(伪)三元相图进行比较并分析产生差异的原因。本研究的主要工作见图 1。
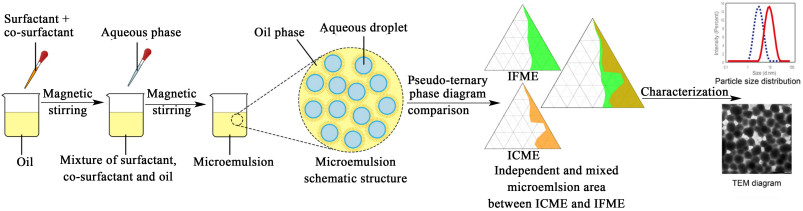
|
| 图 1 胰岛素微乳的制备和表征 Fig.1 Preparation and characteristic evaluation of insulin-contained microemulsion |
| |
胰岛素(25 IU ·kg-1,徐州万邦金桥制药有限公司);Tween-80(化学纯,北京索莱宝科技有限公司);Span-80(化学纯,天津希恩思生化科技有限公司);IPM(化学纯,上海阿拉丁生化科技股份有限公司);柠檬酸(分析纯,天津市风船化学试剂科技有限公司);磷酸氢二钠(分析纯,天津博迪化工股份有限公司);无水乙醇(分析纯,天津市元立化工有限公司);亚甲基蓝(化学纯,天津市科密欧化学试剂有限公司);苏丹红Ⅳ(化学纯,天津希恩思生化科技有限公司);磷钨酸水合物(化学纯,萨恩化学技术(上海)有限公司);蒸馏水(天津市西青区永清源蒸馏水经营部)。
1.1.2 仪器透射电子显微镜(JEM-1400F,日本电子株式会社);激光粒度仪(ZEN3600,英国马尔文仪器有限公司);台式低速离心机(TDZ4-WS,湖南湘仪仪器有限公司);智能恒温磁力搅拌器(ZNCL-GS,河南爱博特科技发展有限公司)。
1.2 实验方法 1.2.1 Span-80和Tween-80质量比筛选按Span-80和Tween-80质量比[w(SPAN-80) ∶w(TWEEN-80)]10 ∶0、9 ∶1、8 ∶2、7 ∶3、6 ∶4、5 ∶5、4 ∶6、3 ∶7、2 ∶8,1 ∶9和0 ∶10分别称取两者混合物共2.4 g,各加入0.8 g无水乙醇,300 r ·min-1下分别搅拌2 min,然后分别加入到4.8 g IPM中,300 r ·min-1下继续搅拌2 min,使体系混合均匀。在持续搅拌下缓慢滴加胰岛素柠檬酸缓冲溶液(Insulin-contained citrate buffer, ICCB, pH=2.5,胰岛素质量分数为1%)作为微乳的内水相,直到体系初次出现浑浊,记录此时ICCB的质量分数。用不含胰岛素的柠檬酸缓冲液(Insulin-free citrate buffer, IFCB)代替ICCB,重复上述实验。
1.2.2 (伪)三元相图绘制用水相滴定法绘制(伪)三元相图。按照Span-80和Tween-80最佳配比配制复配表面活性剂,将其和助表面活性剂无水乙醇按一定质量比(Km)混合作为表面活性剂相,将表面活性剂相与IPM保持总质量为4 g,分别按两者质量比为10 ∶0,9 ∶1,8 ∶2,7 ∶3,6 ∶4,5 ∶5,4 ∶6,3 ∶7,2 ∶8,1 ∶9和0 ∶10混合,各体系在300 r ·min-1搅拌状态下缓慢滴加ICCB直到初次变浑浊,得到滴加终点的三相比例,用Origin 2018绘制(伪)三元相图。按此方法绘制Km值分别为3,4和5的(伪)三元相图。用IFCB代替ICCB,重复上述实验。
1.2.3 微乳类型测定用电导法确定微乳的类型。按最佳处方比例混合Span-80、Tween-80、无水乙醇和IPM至总质量为8 g,搅拌状态下逐滴加入ICCB,记录不同ICCB含量(质量分数,下同)下体系的电导率。用IFCB代替ICCB,重复上述实验。
1.2.4 微乳形态考察将覆有普通碳膜的200目铜网以碳膜面向上水平放置在滤纸上,向铜网滴1滴胰岛素微乳,自然干燥后,将铜网以碳膜面向上转移至玻璃板上,向铜网滴1滴2%磷钨酸水溶液进行染色,20 min后用滤纸吸走多余染色液,自然干燥后用TEM观察形态。另量取适量胰岛素微乳于比色杯中,用激光粒度仪测定粒径,测定过程中不稀释样品,设置折光系数为1.434。用空白微乳代替胰岛素微乳,重复上述实验。
1.2.5 微乳稳定性考察将制得的空白微乳和胰岛素微乳装于2 mL离心管中,在室温以3 000×g下离心1 h,观察微乳的破乳与分层状态。
2 结果与讨论 2.1 Span-80和Tween-80质量比筛选2种表面活性剂Span-80和Tween-80质量比对微乳内水相质量分数的影响如图 2所示。
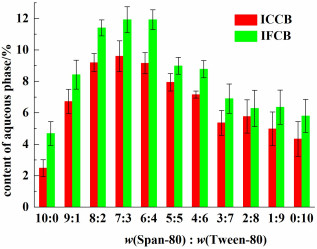
|
| 图 2 Span-80和Tween-80不同质量比对应的ICCB和IFCB含量(质量分数,n=3) Fig.2 ICCB and IFCB content under different ratios of Span-80: Tween-80 (mass fraction, n=3) |
| |
Span-80与Tween-80复合使用后,微乳中ICCB和IFCB含量均有提高。在同样的w(SPAN-80) ∶w(TWEEN-80)下,ICCB含量普遍比IFCB含量低。当w(SPAN-80) ∶w(TWEEN-80)=7 ∶3时,ICCB和IFCB含量均最高,此时,与单独使用Span-80和Tween-80相比,ICCB质量分数分别提高331.8%和137.5%,IFCB质量分数分别提高175.0%和120.0%。这是因为Tween-80和Span-80分子中的羟基和羰基使两者之间形成氢键,增加了油水界面膜强度,使得微乳能够包载更多的水相[14]。
w(SPAN-80) ∶w(TWEEN-80)=7 ∶3时ICCB和IFCB质量分数都最高,这意味着可实现最高的载药量,因此视为最适宜复配比例并保持这一比例进行后续研究。
2.2 胰岛素的加入对微乳(伪)三元相图的影响不同Km值下空白微乳加入胰岛素后的(伪)三元相图变化如图 3所示,阴影部分代表微乳区。为更直观地说明2种(伪)三元相图的微乳区域差异,将2种(伪)三元相图进行了重叠处理。
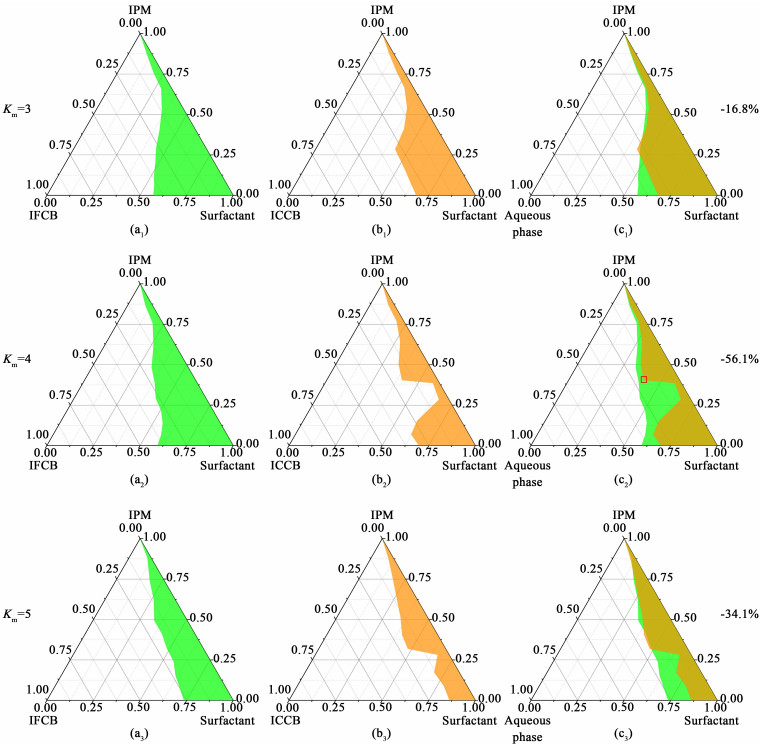
|
| 图 3 不同Km值下空白微乳加入胰岛素后的(伪)三元相图微乳区域变化:(a)空白微乳(伪)三元相图;(b)胰岛素微乳(伪)三元相图;(c)2种(伪)三元相图重叠 Km=3时面积降低16.8%;Km=4时面积降低56.1%;Km=5时面积降低34.1%) Fig.3 Changes of microemulsion region in pseudo-ternary phase diagram after adding insulin into IFME under different Km: (a) IFME; (b)ICME; (c)Overlapping of IFME and ICME pseudo-ternary phase diagram (Km=3 group decreased by 16.8%; Km=4 group decreased by 56.1%; Km=5 group decreased by 34.1%) |
| |
由图 3可知,胰岛素微乳区域面积小于空白微乳,当Km=3,4和5时,胰岛素微乳区域面积相比空白微乳分别下降16.8%、56.1%和34.1%。这意味着体系中ICCB含量低于IFCB,这与2.1部分“在同样的w(SPAN-80) ∶w(TWEEN-80)下ICCB含量普遍比IFCB低”的实验结果形成相互印证。
空白微乳中加入胰岛素后微乳区域面积降低的原因在于,微乳体系处于非常微妙的平衡中,这一平衡的达成是各组分的含量和理化性质相互作用的结果。微乳区域的左侧边界代表着微乳体系平衡的临界点,当胰岛素携带其固有的理化性质被加入到原有体系后,将会和原有组分发生相互作用,导致原有的平衡被打破,临界点发生移动,即微乳区域发生改变。相关的因素分析如下:(1)从内水相角度考虑,胰岛素是水溶性蛋白,其在微乳中的分布大部分集中于内水相,这会使得内水相的粘度增加,降低油水界面膜的流动性[15],导致微乳的稳定性变差,内水相含量降低;(2)从表面活性剂角度考虑,其和蛋白质易发生疏水相互作用[10]或在界面膜处发生置换[11],影响原有体系的界面组成,降低了微乳的形成能力;(3)从胰岛素自身的角度考虑,其在pH=2.5的溶液中带正电,具有与电解质相同的盐析作用,使得表面活性剂在内水相中的有效浓度降低,影响了水-表面活性剂氢键的形成,从而使得内水相含量降低[7]。更为重要的是,很多药物分子以及多糖和蛋白质具有表面活性作用[13, 16],且带电蛋白在静电力的作用下倾向集中于界面膜附近[17],胰岛素在微乳体系中存在于内水相中靠近界面膜的区域,其本身的表面活性作用与表面活性剂相互影响[4],干扰了微乳的相行为。以上因素共同导致微乳区域左侧边界总体右移,微乳区域面积减小。
对比空白微乳区域,胰岛素微乳区域左侧边界还出现了转折点,这是胰岛素加入前后,新旧平衡临界点差异最明显的展示,它的出现进一步减小了胰岛素微乳区域和空白微乳区域的交集,这意味着在空白微乳区域内筛选的处方可能不能落在胰岛素微乳区域内,直接强行制备胰岛素微乳后稳定性不佳,甚至不能形成微乳。因此现有文献普遍采用的仅以空白微乳(伪)三元相图筛选胰岛素微乳处方的方法是不严谨的,应充分研究胰岛素的加入对微乳体系的影响,结合空白微乳和胰岛素微乳的(伪)三元相图筛选处方。
在微乳区域内的某些组成下,水相的体积远超油的体积,此时体系虽仍澄清透明,但显然不是W/O微乳,而是形成了O/W微乳[18]。胰岛素是水溶性蛋白,只有W/O微乳才能将其包封在内核中起到保护作用,因此在微乳区域内筛选处方时,应选择合适的油水体积比以保证得到W/O微乳。当Km=4时能保证微乳类型为W/O的同时获得较高的内水相含量。综合考虑载药量和油水体积比,选择Km=4,表面活性剂相和油相质量比为1 ∶1时的处方作为最佳处方(图 3中红色方框处),此时ICCB质量分数可达19.2%。
2.3 微乳类型测定不同内水相质量分数下微乳体系的电导率如图 4所示。当内水相质量分数低于20%时,2种微乳体系的电导率随内水相含量增加以极小的幅度缓慢上升。当IFCB质量分数大于30%时,微乳的电导率上升速度迅速加快。为节约胰岛素,并未测定ICCB质量分数高于30%时的电导率。

|
| 图 4 不同ICCB和IFCB质量分数下微乳的电导率(n=3) Fig.4 Microemulsion conductivity under different content (mass fraction) of ICCB and IFCB (n=3) |
| |
在以油相为连续相的W/O微乳中,水相分散在油相中,液滴之间相互隔绝,带电离子不能跨液滴自由运动,难以形成贯穿整个微乳体系的电流回路,因此电导率极低,可以断定制备的胰岛素微乳为W/O型。
2.4 微乳形态考察空白微乳和胰岛素微乳TEM图像如图 5所示。两者均近似于球形且分布均匀,其中空白微乳粒径小于胰岛素微乳。

|
| 图 5 TEM图像:(a)空白微乳;(b)胰岛素微乳 Fig.5 TEM graph: (a)IFME; (b)ICME) |
| |
激光粒度仪测得的空白微乳和胰岛素微乳粒径如图 6所示,粒径呈正态分布,大小和TEM图像读数接近。
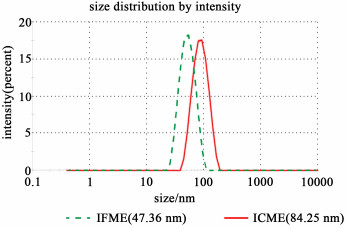
|
| 图 6 粒径分布(空白微乳和胰岛素微乳) Fig.6 Droplet size distribution of IFME and ICME |
| |
当胰岛素存在时,微乳粒径变大,意味着其形成和稳定能力下降,反映在(伪)三元相图中就是微乳区域面积下降,与2.2部分实验结果一致。Chen等[19]和Li等[20]研究发现α-亚麻酸存在于油相中时,O/W微乳的粒径会增大。Sharma等[4]发现W/O微乳加入胰岛素后,平均粒径由104.8 nm增至161.7 nm,这是因为胰岛素具有表面活性作用,改变了原体系的平衡状态,导致粒径增大。实际上,由于微乳处在非常微妙的平衡中,胰岛素的加入会从增加内水相黏度,改变表面活性剂的界面组成和微乳的相行为等多个方面共同影响粒径,甚至当多个药物分子共同存在于同一微乳内水相中时,空间作用也会导致微乳粒径变大[21]。
2.5 微乳稳定性考察在3 000×g下离心1 h后,空白微乳和胰岛素微乳均未出现分层,如图 7(a)所示。为了更直观地对比稳定微乳和失稳微乳离心后的状态,向稳定微乳中加入NaCl使其破乳,离心后的状态如图 7(b)所示,微乳出现了明显的分层。这一对比说明本研究制备的微乳具有良好的稳定性。

|
| 图 7 离心后的微乳状态对比:(a)稳定状态的微乳;(b)破乳后的微乳 Fig.7 Comparison of microemulsion after centrifugation: (a) stable microemulsion; (b) demulsified microemulsion |
| |
| $ \Delta {G_{\rm{f}}} = \gamma \Delta A{\rm{ }} - {\rm{ }}T\Delta S $ | (1) |
式(1)中:ΔGf是微乳的生成自由能;γ是油水界面张力;ΔA是油水界面面积的变化;T为温度;ΔS为熵变。
在微乳形成过程中,油水混合是熵增过程,表面活性剂的加入导致油水界面张力极小,即使ΔA较大,4种因素的综合作用仍能使生成自由能为负值,因此微乳的形成是自发的,且最终体系是热力学稳定的。
3 结论通过绘制空白微乳和胰岛素微乳的(伪)三元相图,直观展示了胰岛素的加入对微乳的影响,这一影响的内在原因是胰岛素打破了微乳体系原有的平衡状态,外在体现是微乳的粒径和内水相含量等方面发生变化。这一结果说明在制备胰岛素微乳时应充分考虑胰岛素对微乳的影响,在空白微乳(伪)三元相图的基础上进一步绘制胰岛素微乳的(伪)三元相图,以得到更加准确的最佳处方。
依据(伪)三元相图,筛选了胰岛素微乳的最佳处方,并对制备的胰岛素微乳进行了表征。根据其类型,形态和稳定性等方面的研究结果可以判断微乳剂可以将胰岛素包封在内水相中,并依然保持良好的分散性及稳定性,说明微乳作为口服胰岛素的载体有利于提高生物利用度。
本研究定性分析了胰岛素的加入对微乳体系的影响,对其他多肽和蛋白质类微乳的制备也有一定的指导意义。而胰岛素作为类表面活性物质,如何量化其乳化能力和其与微乳各组分之间的相互作用,需要进一步研究,以更深入地探索其对微乳体系的影响。
| [1] |
JI L, SUN Z, LI Q, et al. Lipohypertrophy in China: Prevalence, risk factors, insulin consumption, and clinical impact[J]. Diabetes Technology & Therapeutics, 2017, 19(1): 61-67. |
| [2] |
LI Z, PAULSON A T, GILL T A. Encapsulation of bioactive salmon protein hydrolysates with chitosan-coated liposomes[J]. Journal of Functional Foods, 2015, 19: 733-743. DOI:10.1016/j.jff.2015.09.058 |
| [3] |
BABU V R, PATEL P, MUNDARGI R C, et al. Developments in polymeric devices for oral insulin delivery[J]. Expert Opinion on Drug Delivery, 2008, 5(4): 403-415. DOI:10.1517/17425247.5.4.403 |
| [4] |
SHARMA G, WILSON K, VAN DER WALLE C F, et al. Microemulsions for oral delivery of insulin: Design, development and evaluation in streptozotocin induced diabetic rats[J]. European Journal of Pharmaceutics and Biopharmaceutics: Official Journal of Arbeitsgemeinschaft Fur Pharmazeutische Verfahrenstechnik e V, 2010, 76(2): 159-169. |
| [5] |
SAMAN S, REZA H M, MAHMOOD B, et al. Synthesis, characterization, toxicity and morphology assessments of newly prepared microemulsion systems for delivery of valproic acid[J]. Journal of Molecular Liquids, 2021, 338: 116625. DOI:10.1016/j.molliq.2021.116625 |
| [6] |
MOGHIMIPOUR E, SALIMI A, LEIS F. Preparation and evaluation of tretinoin microemulsion based on pseudo-ternary phase diagram[J]. Advanced Pharmaceutical Bulletin, 2012, 2(2): 141-147. |
| [7] |
LI Y, YOKOYAMA W, XU S, et al. Formation and stability of W/O microemulsion formed by food grade ingredients and its oral delivery of insulin in mice[J]. Journal of Functional Foods, 2017, 30: 134-141. DOI:10.1016/j.jff.2017.01.006 |
| [8] |
CILEK A, CELEBI N, TIRNAKSIZ F, et al. A lecithin-based microemulsion of rh-insulin with aprotinin for oral administration: Investigation of hypoglycemic effects in non-diabetic and STZ-induced diabetic rats[J]. International Journal of Pharmaceutics, 2005, 298(1): 176-185. DOI:10.1016/j.ijpharm.2005.04.016 |
| [9] |
WATNASIRICHAIKUL S, DAVIES N M, RADES T, et al. Preparation of biodegradable insulin nanocapsules from biocompatible microemulsions[J]. Pharmaceutical Research, 2000, 17(6): 684-689. DOI:10.1023/A:1007574030674 |
| [10] |
吴劲轩, 夏文银, 夏川林, 等. 磷脂与食品中蛋白质相互作用机制及对蛋白质特性的影响研究进展[J]. 食品工业科技, 2020, 41(17): 345-351. WU Jinxuan, XIA Wenyin, XIA Chuanlin, et al. Interaction mechanism between phospholipids and food proteins and effect on protein properties: A review[J]. Science and Technology of Food Industry, 2020, 41(17): 345-351. (in Chinese) |
| [11] |
刘静, 徐桂英. 表面活性剂与蛋白质相互作用的研究进展[J]. 日用化学工业, 2003, 33(1): 29-32. LIU Jing, XU Guiying. Progress of study of interaction between protein and surfactant[J]. China Surfactant Detergent & Cosmetics, 2003, 33(1): 29-32. (in Chinese) |
| [12] |
宋熙熙. 蛋白质-表面活性剂相互作用及酶催化反应的量热学研究[D]. 杭州: 浙江大学, 2008 SONG Xixi. Calorimetric study on protein-surfactant interaction and enzyme-catalyzed reaction[D]. Hangzhou: Zhejiang University, 2008 (in Chinese) |
| [13] |
OHADI M, SHAHRAVAN A, DEHGHANNOUDEH N, et al. Potential use of microbial surfactant in microemulsion drug delivery system: A systematic review[J]. Drug Design, Development and Therapy, 2020, 14: 541-550. DOI:10.2147/DDDT.S232325 |
| [14] |
邹华生, 陈江凡, 陈文标. 油包水微乳液体系的稳定性分析[J]. 华南理工大学学报(自然科学版), 2008, 36(3): 32-36. ZOU Huasheng, CHEN Jiangfan, CHEN Wenbiao. Stability analysis of water-in-oil microemulsion system[J]. Journal of South China University of Technology (Natural Science Edition), 2008, 36(3): 32-36. (in Chinese) |
| [15] |
徐胜男. 油包水微乳的制备及特性研究[D]. 江苏无锡: 江南大学, 2011 XU Shengnan. Preparation and characteristics of water-in-oil microemulsion[D]. Jiangsu Wuxi: Jiangnan University, 2011 (in Chinese) |
| [16] |
LAWRENCE M J, REES G D. Microemulsion-based media as novel drug delivery systems[J]. Advanced Drug Delivery Reviews, 2000, 45(1): 89-121. |
| [17] |
PINERO J, BHUIYAN L B, BRATKO D. Electrostatic interactions of charged dipolar proteins in reverse micelles[J]. The Journal of Chemical Physics, 2004, 120(24): 11941-11947. |
| [18] |
黄芬, 唐年初, 郭贯新, 等. 食品级大豆油W/O微乳的制备研究[J]. 食品工业科技, 2010, 31(2): 280-282, 285. HUANG Fen, TANG Nianchu, GUO Guanxin, et al. Preparation of food-grade soybean oil microemulsion[J]. Science and Technology of Food Industry, 2010, 31(2): 280-282, 285. (in Chinese) |
| [19] |
CHEN B, HOU M, ZHANG B, et al. Enhancement of the solubility and antioxidant capacity of α-linolenic acid using an oil in water microemulsion[J]. Food & Function, 2017, 8(8): 2792-2802. |
| [20] |
LI Q, DANG L, LI S, et al. Preparation of α-linolenic-acid-loaded water-in-oil-in-water microemulsion and its potential as a fluorescent delivery carrier with a free label[J]. Journal of Agricultural and Food Chemistry, 2018, 66(49): 13020-13030. |
| [21] |
MATZKE S F, CREAGH A L, HAYNES C A, et al. Mechanisms of protein solubilization in reverse micelles[J]. Biotechnology and Bioengineering, 1992, 40(1): 91-102. |
| [22] |
FROELICH A, OSMAŁEK T, JADACH B, et al. Microemulsion-based media in nose-to-brain drug delivery[J]. Pharmaceutics, 2021, 13(2): 201. |
 2025, Vol. 42
2025, Vol. 42





