近年来,低相对分子质量有机凝胶剂(LMOGs)受到了广泛的关注[1, 2]。它们可以在特定的溶剂中通过分子间非共价相互作用(如氢键、π-π相互作用和范德华力)自组装形成三维网络结构[3-5]。这种网络结构可以将溶剂分子固定形成有机凝胶[6],在软纳米材料方面具有巨大应用前景[7]。然而,LMOGs在发光领域的应用却是有限的。主要原因之一是许多荧光团容易出现聚集引起的淬灭(ACQ)效应[8],这就限制了利用荧光团去构建荧光有机凝胶剂的发展。幸运的是,Tang等[9]提出了“聚集诱导发光”(AIE)的概念,指出在聚集状态下,由于分子内运动受限[8],体系会出现强烈的荧光发射。这意味着荧光团ACQ效应的主导地位可以被AIE效应所取代,设计具有AIE特性的荧光有机凝胶引起了极大的关注[10, 11]。这些荧光有机凝胶在发射方面可以表现出光谱红移或蓝移、光信号增强或淬灭等变化[12],在荧光传感器[13, 14]、光能转换[15]、光控药物释放[16]和光捕获材料[17]等方面有着广泛的应用。
香豆素作为一类重要的有机杂环化合物,其具有独特的荧光特性平台[18, 19],在离子检测、生物成像等方面应用非常广泛[20-23]。但是在聚集状态下,香豆素衍生物容易出现ACQ效应[24],从而限制了它们的应用。然而,近几年有研究者发现可以将香豆素作为荧光团用于构建具有AIE特性的有机凝胶。比如,Hu等[25]构建了一种长烷基链酰腙香豆素有机凝胶OGC用于顺序检测和分离有毒离子,OGC在热溶液状态下显示出非常弱的荧光,而在凝胶状态下显示出强烈的黄绿色荧光,这被认为是AIE效应;Yang等[26]报道了一种香豆素基吡唑啉衍生物有机凝胶用于Fe3+检测及细胞成像,这种有机凝胶在凝胶状态下显示出蓝色荧光。因此,我们可以将便于分子内运动的成胶基团引入香豆素骨架来构建有机凝胶剂[8],通过成胶来造成分子内运动受限,最终得到具有AIE特性的香豆素类有机凝胶,为香豆素衍生物在聚集状态下的应用提供一种方法。尽管已有研究者利用香豆素作为荧光团来设计有机凝胶剂,但是在分子构建上,都是利用连接桥将荧光团和成胶基团进行连接[25-27]。然而,还没有用酰胺在香豆素骨架上直接引入成胶基团来构建具有AIE特性的香豆素类有机凝胶剂的报道。本研究合成了2种具有AIE特性的香豆素类有机凝胶剂cou-C8b和cou-C10b。在7-羟基香豆素-3-羧酸的基础上,首次用酰胺在羧基位点直接引入长链烷氧基苯类成胶基团进行构建。以香豆素环作为荧光团,利用羟基与酰胺之间的氢键、香豆素环之间的π-π相互作用和烷氧基链之间的范德华力提供自组装的驱动力。同时,这些非共价相互作用可以造成分子内运动受限,从而可以从有机凝胶中观察到AIE效应。结果表明,2种凝胶剂在一些醇类溶剂(包括乙醇、异丙醇、正丁醇、叔丁醇和叔戊醇)和丙酮中有很好的胶凝能力,此外,cou-C8b还可以在乙酸乙酯中形成凝胶。另外,体系在热溶液状态下基本没有或很弱的荧光,而在凝胶状态下却出现很强的黄色荧光,表现出明显的AIE效应。有趣的是,2种凝胶剂均表现出可逆酸/碱响应性能,加入NaOH溶液后凝胶结构塌陷并呈现出明亮的青蓝色荧光;然后再加入HCl溶液,样品可以再次成胶并恢复原始的黄色荧光。
1 实验部分 1.1 试剂与仪器2, 4-二羟基苯甲醛,米氏酸,乙酸铵(CH3COONH4),1-溴正辛烷,1-溴正癸烷,无水硫酸镁(MgSO4),1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(EDCI ·HCl),1-羟基苯并三唑一水物(HOBt ·H2O),无水N, N-二甲基甲酰胺(DMF)购自天津希恩思奥普德科技有限公司;4-(Boc-氨基)苯酚购自上海毕得医药科技股份有限公司;三氟乙酸(TFA)购自上海麦克林生化科技有限公司;N, N-二异丙基乙胺(DIEA)购自安徽泽升科技有限公司;碳酸钾(K2CO3),乙腈(MeCN),氢氧化钠,二氯甲烷(DCM),石油醚,乙酸乙酯购自天津市江天化工技术股份有限公司。所有试剂均为分析纯,无需进一步纯化即可使用。
1H NMR和13C NMR在Bruker Avance III型液体核磁共振谱仪上测试,氘代试剂为氘代二甲基亚砜和氘代四氢呋喃。高分辨率质谱(HRMS)在1290 UPLC/micrOTOF-Q II光谱仪上测试。扫描电子显微镜(SEM)图像在Regulus 8100上观察。傅里叶变换红外光谱(FT-IR)在Nicolet 6700型红外光谱仪上测试。X-射线衍射(XRD)图在Smartlab型衍射仪上获得。UV-vis吸收和荧光光谱分别在Persee TU-1810APC和Hitachi F-2500荧光分光光度计上获得。所有计算均使用Gaussian 09 C Program[28]通过密度泛函理论(DFT)在Becke的3个参数杂化泛函B3LYP和6-31G(d)水平基组上进行。此外,Multiwfn Software[29]和VMD Program[30]用于分子轨道的可视化和分析。
1.2 合成路线合成路线如图 1所示。
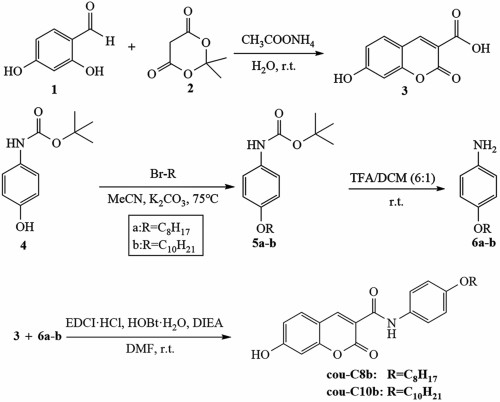
|
| 图 1 cou-C8b和cou-C10b的合成路线 Fig.1 Synthetic route of cou-C8b and cou-C10b |
| |
化合物3按文献方法[31]制备:将2, 4-二羟基苯甲醛(6.5 g,47.06 mmol)、米氏酸(7.75 g,53.77 mmol)和乙酸铵(0.75 g,9.73 mmol)加入到120 mL去离子水中,反应液在室温下剧烈搅拌4 h。然后用盐酸调节pH值至2~3,过滤得到沉淀。沉淀用蒸馏水洗涤并干燥,得到黄灰色固体3 (9.14 g,收率:94.21%),无需纯化即可投入下一步反应。
1H NMR (400 MHz, DMSO-d6) δ 12.86 (s, 1H), 11.06 (s, 1H), 8.69 (s, 1H), 7.75 (d, J=8.6 Hz, 1H), 6.85 (dd, J=8.6, 2.3 Hz, 1H), 6.74 (d, J=2.2 Hz, 1H)。13C NMR (101 MHz, DMSO-d6) δ 164.38, 158.07, 157.45, 149.87, 132.50, 114.49, 112.94, 111.08, 102.26。
1.2.2 (4-辛烷氧基苯基)氨基甲酸叔丁酯(5a)和(4-癸烷氧基苯基)氨基甲酸叔丁酯(5b)的合成化合物5a(或 5b)按文献方法[32]制备:将4- (Boc-氨基)苯酚(3.14 g,15 mmol)和K2CO3(4.15 g,30 mmol)加入到乙腈(75 mL)中,温度升高至75 ℃,缓慢加入1-溴正辛烷(3.19 g,16.5 mmol)[或1-溴正癸烷(3.65 g,16.5 mmol)],然后恒温反应10 h。冷却至室温后有固体析出,加入二氯甲烷(75 mL)溶解固体,然后混合液用水(2×30 mL)洗涤并分液。有机相用无水MgSO4干燥并真空浓缩得到粗品。粗产物通过柱层析纯化(洗脱剂:石油醚/乙酸乙酯,30 ∶1,体积分数)得到白色固体5a(3.48 g,收率:72.20%)[或白色固体5b(3.99 g,收率:76.13%)]。
化合物5a:1H NMR (400 MHz, DMSO-d6) δ 9.09 (s, 1H), 7.32 (d, J=8.4 Hz, 2H), 6.85-6.77 (m, 2H), 3.89 (t, J=6.5 Hz, 2H), 1.66 (h, J=7.6, 7.1 Hz, 2H), 1.46 (s, 9H), 1.38 (d, J =7.2 Hz, 2H), 1.28 (d, J=10.2 Hz, 9H), 0.91-0.83 (m, 3H)。
化合物5b:1H NMR (400 MHz, DMSO-d6) δ 9.10 (s, 1H), 7.32 (d, J=8.4 Hz, 2H), 6.85-6.77 (m, 2H), 3.88 (t, J=6.5 Hz, 2H), 1.73-1.60 (m, 2H), 1.46 (s, 9H), 1.39 (s, 2H), 1.27 (d, J=10.0 Hz, 12H), 0.90-0.82 (m, 3H)。
1.2.3 4-辛烷氧基苯胺(6a)和4-癸烷氧基苯胺(6b)的合成化合物6a(或6b)按文献[32]方法制备:将化合物5a(1.61 g,5 mmol)[或5b(1.75 g,5 mmol)]加入到体积比为6 ∶1的二氯甲烷与三氟乙酸的混合液(42 mL)中,料液在室温下搅拌反应2 h。反应用5%NaOH溶液(40 mL)进行淬灭。然后反应液用5%NaOH溶液调pH值至10左右并分液,水相用二氯甲烷(2×20 mL)萃取,合并有机相并用无水MgSO4干燥,真空浓缩,得到棕色固体6a(1.07 g,收率:96.75%)[或棕色固体6b(1.19 g,收率:95.46%)],无需纯化即可投入下一步反应。
化合物6a:1H NMR (400 MHz, DMSO-d6) δ 6.62 (d, J=8.5 Hz, 2H), 6.49 (d, J=8.4 Hz, 2H), 4.70-4.65 (m, 2H), 3.79 (t, J=6.5 Hz, 2H), 1.62 (q, J=7.0 Hz, 2H), 1.38 (d, J=7.9 Hz, 2H), 1.32-1.22 (m, 8H), 0.90-0.83 (m, 3H)。13C NMR (101 MHz, DMSO-d6) δ 150.48, 142.74, 115.79, 115.39, 68.37, 31.72, 29.41, 29.26, 29.15, 26.06, 22.55, 14.41。
化合物6b:1H NMR (400 MHz, DMSO-d6) δ 6.70-6.63 (m, 2H), 6.60-6.53 (m, 2H), 5.43 (s, 2H), 3.81 (t, J=6.5 Hz, 2H), 1.68-1.58 (m, 2H), 1.42-1.29 (m, 2H), 1.26 (d, J=5.7 Hz, 12H), 0.90-0.82 (m, 3H)。13C NMR (101 MHz, DMSO-d6) δ 150.49, 142.74, 115.80, 115.40, 68.39, 31.77, 29.49, 29.43, 29.40, 29.29, 29.16, 26.05, 22.56, 14.40。
1.2.4 目标产物cou-C8b和cou-C10b的合成将化合物3(0.62 g,3 mmol),化合物6a(0.73 g,3.3 mmol)[或6b(0.82 g,3.3 mmol)],EDCI ·HCl(0.75 g,3.9 mmol),HOBt ·H2O(0.60 g,3.9 mmol)和DIEA(1.16 g,9 mmol)加入到无水DMF(30 mL)中,混合液在室温下搅拌反应5 h。混合液用大量水(70 mL)稀释,然后用二氯甲烷(3×50 mL)萃取。合并的有机相用无水MgSO4干燥并真空浓缩。粗产物利用氧化硅柱层析纯化(洗脱剂:石油醚/乙酸乙酯, 体积分数8 ∶1),得到黄色固体cou-C8b(0.65 g,收率:52.92%)[或黄色固体cou-C10b(0.67 g,收率:51.05%)]。2个化合物均为首次报道。
1.3 凝胶性能测试凝胶剂的凝胶性能测试和临界胶凝浓度(CGC)通过“试管倒置法”[33]进行研究。将已知量的凝胶剂和适量的溶剂加入到密封试管中,加热至固体完全溶解,然后冷却至室温。将试管翻转并观察溶液流动情况。如果溶液不流动,则意味着凝胶剂形成了有机凝胶,记为G;如果溶液部分流动,代表着形成了部分凝胶,记为PG;当胶凝剂在溶剂达到沸点温度下也不溶解,记为I;如果试管中液体仍为透明溶液,记为S;如果试管中混合物在加热状态下溶解而冷却后析出沉淀,则记为P。溶胶-凝胶转变温度(Tgel)通过“降落”法[34]测试。
2 结果与讨论 2.1 目标产物确认以氘代二甲基亚砜和氘代四氢呋喃为溶剂,对目标产物进行了1H NMR、13C NMR和HRMS-ESI的表征,结果如图 2和图 3所示。
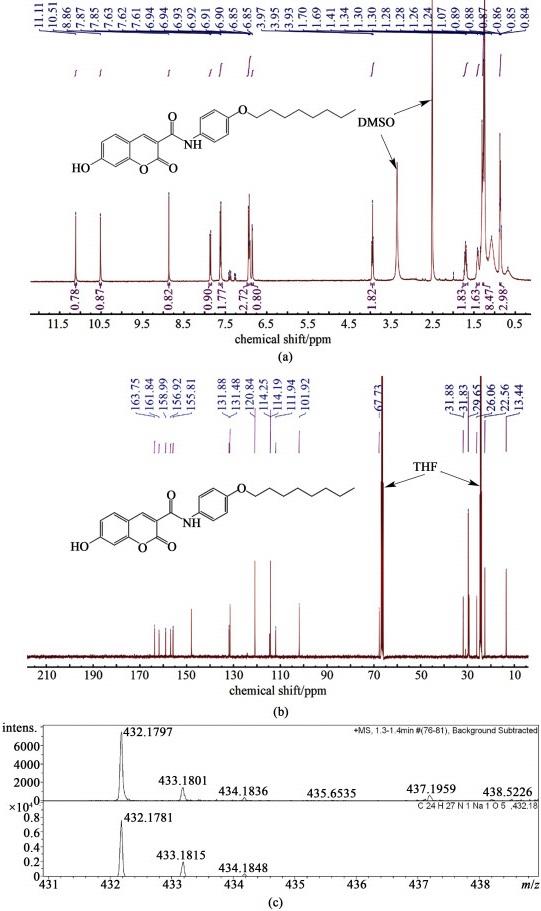
|
| 图 2 目标产物cou-C8b的(a) 核磁氢谱; (b) 核磁碳谱; (c) 高分辨率质谱 Fig.2 (a) 1H NMR; (b) 13C NMR; (c) HRMS-ESI of cou-C8b of cou-C8b |
| |
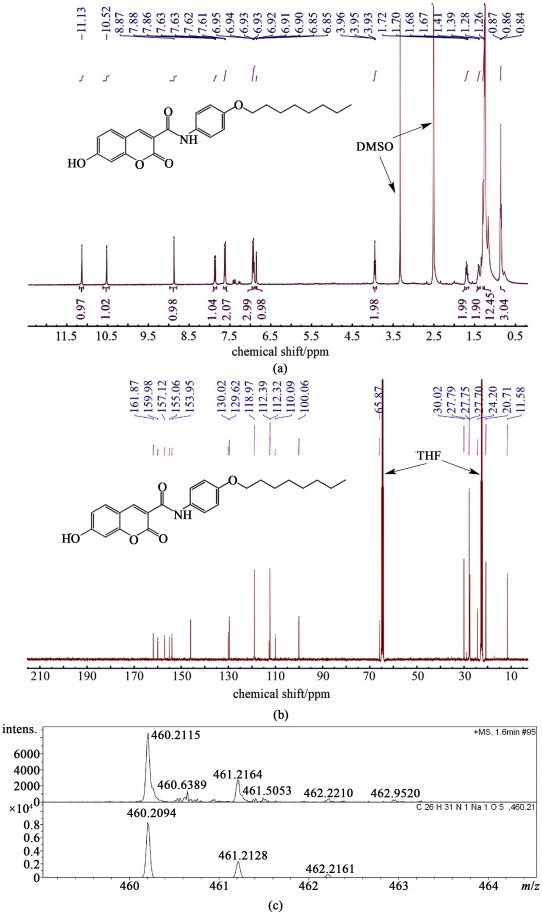
|
| 图 3 目标产物cou-C10b的(a) 核磁氢谱; (b) 核磁碳谱; (c) 高分辨率质谱 Fig.3 (a) 1H NMR; (b) 13C NMR; (c) HRMS-ESI of cou-C10b |
| |
化合物cou-C8b:1H NMR (400 MHz, DMSO-d6) δ 11.11 (s, 1H), 10.51 (s, 1H), 8.86 (s, 1H), 7.86 (d, J=8.6 Hz, 1H), 7.65-7.58 (m, 2H), 6.98-6.88 (m, 3H), 6.85 (d, J=2.3 Hz, 1H), 3.95 (t, J=6.5 Hz, 2H), 1.70 (p, J=6.8 Hz, 2H), 1.40 (d, J=7.9 Hz, 2H), 1.28 (s, 8H), 0.88-0.85 (m, 3H)。13C NMR (101 MHz, THF-d8) δ 163.75, 161.84, 158.99, 156.92, 155.81, 131.88, 131.48, 120.84, 114.25, 114.19, 111.94, 101.92, 67.73, 31.83, 29.65, 26.06, 22.56, 13.44。HRMS (ESI) calcd. for C24H27NNaO5 [M+Na]+: 432.178 1; found: 432.179 7。
图 2的1H NMR中,δ=11.11、10.51和3.95分别对应香豆素上的羟基氢、酰胺氢和烷氧基链上与氧相连的第1个亚甲基氢;图 2的13C NMR中,δ=163.75和67.73分别对应酰胺的碳和烷氧基链上与氧相连的第1个亚甲基的碳;并且,cou-C8b分子的[M+Na]+相对分子质量计算值为432.178 1,而高分辨率质谱测量值为432.179 7,测量值与计算值基本一致;因此可以判断cou-C8b分子被成功合成。
化合物cou-C10b:1H NMR (400 MHz, DMSO-d6) δ 11.13 (s, 1H), 10.52 (s, 1H), 8.87 (s, 1H), 7.87 (d, J=8.6 Hz, 1H), 7.66-7.59 (m, 2H), 6.96-6.89 (m, 3H), 6.85 (d, J=2.3 Hz, 1H), 3.95 (t, J=6.5 Hz, 2H), 1.69 (q, J=6.9 Hz, 2H), 1.40 (d, J=8.3 Hz, 2H), 1.28 (s, 12H), 0.86 (s, 3H)。13C NMR (101 MHz, THF-d8) δ 161.87, 159.98, 157.12, 155.06, 153.95, 130.02, 129.62, 118.97, 112.39, 112.32, 110.09, 100.06, 65.87, 30.02, 27.79, 24.20, 20.71, 11.58。HRMS (ESI) calcd. for C26H31NNaO5 [M+Na]+: 460.209 4; found: 460.211 5。
图 3的1H NMR中,δ=11.13、10.52和3.95分别对应香豆素上的羟基氢、酰胺氢和烷氧基链上与氧相连的第1个亚甲基氢;图 3的13C NMR中,δ=161.87和65.87分别对应酰胺的碳和烷氧基链上与氧相连的第1个亚甲基的碳;并且cou-C10b分子的[M+Na]+相对分子质量计算值为460.209 4,而高分辨率质谱测量值为460.211 5,测量值与计算值非常接近;因此可以判断cou-C10b分子成功合成。
2.2 凝胶剂的凝胶性能根据文献描述的“试管倒置法”[33]研究了凝胶剂cou-C8b和cou-C10b在15种不同的有机溶剂中的胶凝能力,并通过“降落法”[34]测试了溶胶-凝胶转变温度(Tgel),结果见表 1。2种凝胶剂均对多种醇类溶剂(包括乙醇、异丙醇、正丁醇、叔丁醇和叔戊醇)和丙酮有很好的胶凝能力,并且cou-C8b还可以在乙酸乙酯中形成凝胶。同时,还测试了在各种成胶系统中的临界胶凝浓度(CGC)和相转变温度(Tgel)。cou-C8b在叔戊醇中表现出最低的CGC(7.7 g ·L-1)和较高的Tgel (53 ℃),而cou-C10b则在异丙醇中表现出最低的CGC(6.3 g ·L-1)和最高的Tgel (54 ℃)。这表明叔戊醇和异丙醇分别是cou-C8b和cou-C10b的最适宜成胶溶剂,这可能与烷基链的长度有关。后续我们主要对cou-C8b的叔戊醇凝胶和cou-C10b的异丙醇凝胶进行研究。此外,通过加热-冷却处理可实现溶液-凝胶的多次循环转变,2种凝胶剂形成的凝胶在室温下非常稳定。
| 溶剂 | CGC/(g·L-1) | Tgel/℃ | |||
| cou-C8b | cou-C10b | cou-C8b | cou-C10b | ||
| 甲苯 | I | I | |||
| 苯胺 | S | S | |||
| 二氯甲烷 | I | I | |||
| 二氯乙烷 | I | I | |||
| 乙醇 | G(9.1) | G(8.3) | 51 | 49 | |
| 异丙醇 | G(9.1) | G(6.3) | 57 | 54 | |
| 正丁醇 | G(10) | G(11.1) | 43 | 46 | |
| 叔丁醇 | G(8.3) | G(9.1) | 51 | 40 | |
| 叔戊醇 | G(7.7) | G(16.7) | 53 | 47 | |
| THF | S | P | |||
| DMF | S | P | |||
| DMSO | S | P | |||
| 乙腈 | I | I | |||
| 乙酸乙酯 | G(14.3) | P | 46 | ||
| 丙酮 | G(20) | PG(40) | 41 | 43 | |
| a S=溶解;P=沉淀;I=不溶;G=凝胶;PG=部分凝胶。 | |||||
为了探究凝胶的自组装机制,我们首先对cou-C8b的粉末和叔戊醇干凝胶、cou-C10b的粉末和异丙醇干凝胶进行了FT-IR测试,如图 4所示。
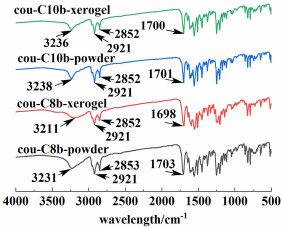
|
| 图 4 cou-C8b和cou-C10b粉末/干凝胶的红外光谱 Fig.4 Infrared spectra of cou-C8b and cou-C10b powder/xerogel |
| |
在粉末中cou-C8b和cou-C10b的O—H特征峰分别出现在3 231和3 238 cm-1,而在干凝胶中相应的特征峰向低波数方向移动(分别为3 211和3 236 cm-1)。此外,对于C=O特征峰,cou-C8b和cou-C10b在粉末中依次出现在1 703和1 701 cm-1处,而干凝胶中特征峰仍然表现为轻微的低波数方向移动(分别为1 698和1 700 cm-1)。这种结果表明自组装过程中O—H和C=O可能参与分子间氢键的形成[27],氢键可能是促进自组装过程的驱动力之一。另一方面,在粉末和干凝胶状态下,cou-C8b和cou-C10b中CH2的不对称和对称伸缩振动峰基本不变(cou-C8b粉末中为2 921和2 853 cm-1,干凝胶中为2 921和2 852 cm-1;cou-C10b粉末和干凝胶中均为2 921和2 852 cm-1),表明自组装过程中长链烷基在范德华力作用下排列紧密[26]。
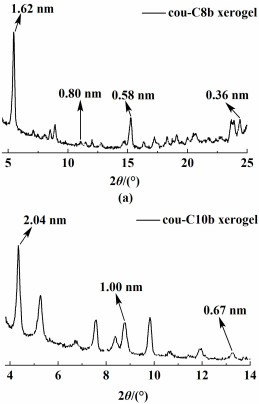
2.3.2 XRD分析X-射线衍射(XRD)实验用来获取cou-C8b叔戊醇干凝胶和cou-C10b异丙醇干凝胶的自组装过程中分子堆积信息,结果如如图 5所示。
|
| 图 5 (a) cou-C8b干凝胶和(b) cou-C10b干凝胶的XRD光谱 Fig.5 XRD spectra of (a) cou-C8b xerogel and (b) cou-C10b xerogel |
| |
由图 5可知,2种干凝胶均有尖锐的衍射峰,cou-C8b叔戊醇干凝胶在2θ=5.46°、11.02°和15.26°的d值分别为1.62、0.80和0.58 nm,而cou-C10b异丙醇干凝胶在2θ=4.34°、8.80°和13.26°的d值则分别为2.04、1.00和0.67 nm,2种干凝胶的d值均符合(1/1) ∶(1/2) ∶(1/3),这种结果说明分子间可能存在层状堆积结构[12, 35],因为超分子凝胶体系中凝胶结构与周围环境密切相关,干凝胶体系的排列方式与成胶后的排列相似,但是也可能存在一定的区别。此外,cou-C8b叔戊醇干凝胶在2θ=24.4°时对应的d值为0.36 nm,这意味着香豆素环之间存在π-π堆积[10, 26],长烷基链之间通过范德华力相互缠绕。
2.3.3 SEM分析通过SEM对cou-C8b和cou-C10b的异丙醇凝胶和叔戊醇凝胶的微观形貌分别进行了观察,结果如图 6所示。为了便于观察和比较,选择了4种凝胶样品均在1 200倍的放大倍数下的SEM图片。cou-C8b的异丙醇凝胶和叔戊醇凝胶都表现出长带形且边缘带刺的结构,宽度均约40~50 μm。空间结构为明显的无规则层状网络结构,其中的孔隙用于固定和捕获溶剂分子。但是相比于异丙醇凝胶,cou-C8b的叔戊醇凝胶表面更为光滑且空间交错更为紧密。cou-C10b的异丙醇凝胶和叔戊醇凝胶也表现出长带状且边缘带刺的结构,但是叔戊醇凝胶的宽度只有约10~20 μm,比其他3种凝胶的尺寸均更小。此外,cou-C10b异丙醇凝胶的长带形结构比其他3种凝胶更卷曲。2种凝胶剂形成的凝胶样品在微观形貌的差别表明碳链长度和成胶选用的溶剂种类对凝胶形貌均有影响。

|
| 图 6 SEM图 Fig.6 SEM images |
| |
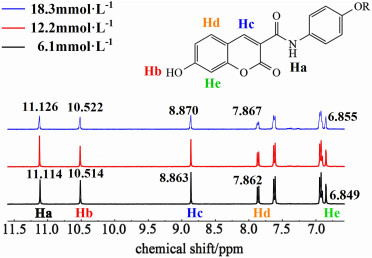
1H NMR是用来研究分子自组装驱动力的有效工具,在高浓度下,芳香族质子的化学位移能够反映π-π相互作用[36]。因此,我们以cou-C8b为例,测量了其在DMSO-d6中的浓度依赖性1H NMR光谱来进一步探究自组装的驱动力,结果如图 7所示。
|
| 图 7 cou-C8b在DMSO-d6中不同浓度下的1H NMR光谱 Fig.7 1H NMR spectra of cou-C8b in DMSO-d6 at different concentrations |
| |
cou-C8b的浓度从6.1增大到18.3 mmol ·L-1的过程中,酰胺上的Ha质子和羟基上的Hb质子均向低场移动,表明存在氢键参与凝胶剂的自组装过程。另一方面,香豆素环上的质子(Hc、Hd和He)也出现一定程度的低场移动,表明香豆素环之间的π-π相互作用也促进了自组装过程。
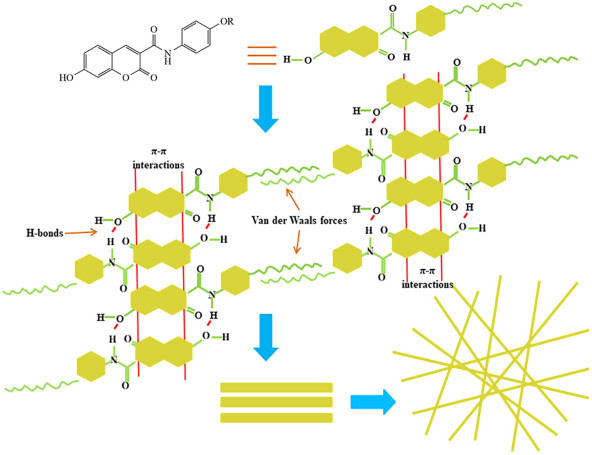
因此,根据上述FT-IR、XRD、SEM和浓度依赖性1H NMR光谱的结果,我们推测了有机凝胶剂cou-C8b和cou-C10b在溶剂中可能的自组装机制,如图 8所示。有机凝胶剂以头尾交替排列的形式进行层状堆积;其中氢键可能存在于羟基和酰胺之间,香豆素环之间通过π-π相互作用进行堆叠,而尾部的长烷基链则通过范德华力相互缠绕。
|
| 图 8 cou-C8b和cou-C10b可能的自组装机制示意图 Fig.8 Schematic diagram of the possible self-assembly mechanism of cou-C8b and cou-C10b |
| |
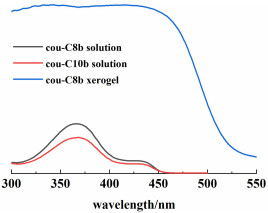
测量了cou-C8b和cou-C10b在异丙醇溶液中(10-5 mol ·L-1)的紫外-可见吸收光谱,如图 9所示。
|
| 图 9 cou-C8b和cou-C10b在溶液中的紫外-可见吸收光谱以及cou-C8b干凝胶的紫外-可见漫反射光谱 Fig.9 UV-Vis absorption spectra of cou-C8b and cou-C10b in solution and UV-Vis diffuse reflectance spectra of cou-C8b xerogel |
| |
2种化合物均在367和430 nm处出现2个吸收峰。367 nm处的较强吸收峰归因于共轭骨架的π-π*跃迁,430 nm处较弱的吸收峰则是香豆素和烷氧基苯环之间的分子内电荷转移(ICT)。为了进一步说明凝胶体系中π-π作用的存在,图 9中也给出了cou-C8b干凝胶的紫外-可见漫反射光谱。干凝胶中最大的紫外吸收峰出现在416 nm处,比溶液中的最大吸收峰红移了49 nm。干凝胶体系与超分子凝胶体系在空间结构的排列上有一定的相似性,因此干凝胶相比于溶液中的最大吸收峰红移,在一定程度上可以说明凝胶体系中可能存在π-π相互作用。
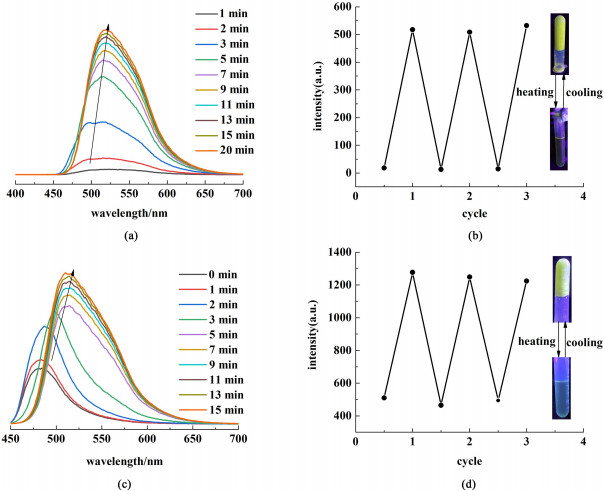
此外,对cou-C8b的叔戊醇凝胶和cou-C10b的异丙醇凝胶从溶液态到凝胶态转变过程的荧光光谱变化进行了研究,如图 10(a)和图 10(c)所示。2种体系在热溶液态表现为基本没有或很弱的荧光,随着温度慢慢降低,溶液态逐渐转变为凝胶态并且伴随着荧光强度的增加和波长的红移,表现出显著的AIE效应。然而,cou-C10b的异丙醇凝胶红移现象较为明显,红移了31 nm;而cou-C8b的叔戊醇凝胶红移较小,红移约为7 nm;这可能是因为凝胶结构中存在π-π相互作用,溶剂极性的增加使得电子跃迁的能量减小,红移程度更为明显。另一方面,如图 10(b)和图 10(d)所示,通过加热-冷却处理可实现溶液-凝胶的多次循环转变。图 10(b)和图 10(d)中给出了选取的某一时刻的荧光强度(cou-C8b为5 min凝胶样品,cou-C10b为10 min凝胶样品),结果证明了凝胶在加热和冷却循环中的可逆性。插图是在365 nm紫外灯下样品在溶胶态和凝胶态的荧光照片,可以看出溶液态基本没有或很弱的荧光,凝胶态则呈现出明亮的黄色荧光,清楚地呈现出凝胶的AIE效应。
|
| 图 10 (a) cou-C8b的叔戊醇凝胶(10 g ·L-1)从热溶液态冷却至凝胶态的荧光光谱变化(λex=368 nm);(b) cou-C8b的叔戊醇凝胶(10 g ·L-1)在加热-冷却循环中的荧光可逆性,插图是紫外灯下溶液态和凝胶态的荧光照片;(c) cou-C10b的异丙醇凝胶(10 g ·L-1)从热溶液态冷却至凝胶态的荧光光谱变化(λex=432 nm);(d) cou-C10b的异丙醇凝胶(10 g ·L-1)在加热-冷却循环中的荧光可逆性,插图是紫外灯下溶液态和凝胶态的荧光照片 Fig.10 (a) The fluorescence spectra change of cou-C8b tert-amyl alcohol gel (10 g ·L-1) from the hot sol state to the gel state (λex=368 nm); (b) the fluorescence reversibility of cou-C8b tert-amyl alcohol gel (10 g ·L-1) in heating-cooling cycles and the insets showed the fluorescence photos of the sol state and gel state under ultraviolet light; (c) the fluorescence spectra change of cou-C10b isopropanol gel (10 g ·L-1) from the hot sol state to the gel state (λex=432 nm); (d) the fluorescence reversibility of cou-C10b isopropanol gel (10 g ·L-1) in heating-cooling cycles and the insets showed the fluorescence photos of the sol state and gel state under ultraviolet light |
| |
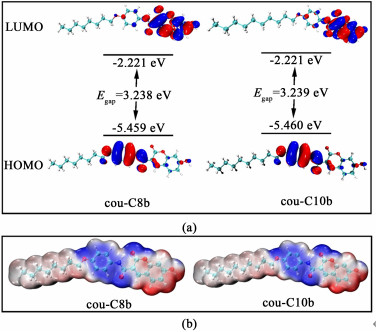
为了进一步探究2种凝胶剂的发光机理,我们使用B3LYP/6-31G(d)基组通过密度泛函理论(DFT)对分子结构进行了理论计算[28]。我们在优化的分子结构基础上进一步研究了分子轨道的分布情况,并且提取了静电势面,结果如图 11所示。
|
| 图 11 (a) 基于优化几何结构的cou-C8b和cou-C10b的HOMO和LUMO分布;(b) cou-C8b和cou-C10b的静电势图,颜色编码为红色代表强负,蓝色代表强正 Fig.11 (a) HOMO and LUMO distributions of cou-C8b and cou-C10b based on the optimized geometry; (b) the electrostatic potential diagram for cou-C8b and cou-C10b, and the color is coded as red for strong negative whereas blue for strong positive |
| |
cou-C8b和cou-C10b的电子分布基本一样,最高占据分子轨道(HOMO)的电子密度主要分布在与长烷基链相连的苯环上,而最低未占分子轨道(LUMO)的电子密度则主要分布在香豆素基团中。2种分子轨道基本没有重叠,显示出明显的离域状态。HOMO和LUMO的这种分布情况表明分子存在ICT效应,这也可以从图 11(b)的静电势能图中看出来,其中的负电区域主要在香豆素基团上,而长烷基链苯环上则主要为正电区域。
另外,我们可以看出2种分子的最优结构在空间呈现为平面结构,其中长烷基链苯环与香豆素基团中间以酰胺键相连,其中的C—N单键可以自由旋转。因此我们猜测了2种凝胶剂AIE特性的可能原因。在非聚集体结构中,当分子从激发态返回基态时,电子跃迁伴随的能量转移可以通过单键旋转等非辐射跃迁的方式进行消耗,从而呈现为弱荧光或无荧光现象。然而在聚集体结构中,分子由于自组装形成了有机凝胶,而凝胶的层状堆叠形式表明分子间非共价相互作用的存在。因此氢键、π-π相互作用和范德华力的存在限制了包括分子内单键的自由旋转等分子内运动[10],从而能量只能以辐射跃迁的方式进行转移,宏观上表现为AIE效应。
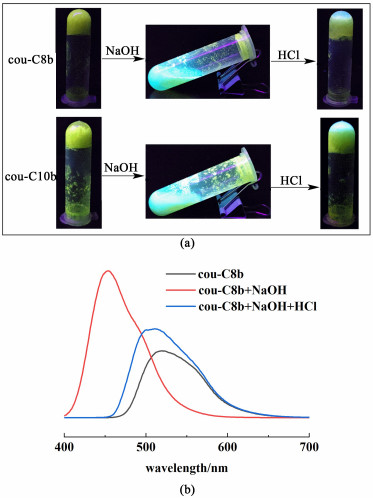
2.6 可逆酸/碱响应性能由凝胶剂cou-C8b和cou-C10b形成的有机凝胶表现出明显的可逆酸/碱响应性能。由叔戊醇制备的2种凝胶样品在365 nm紫外灯下显示为黄色荧光,然后加入少量NaOH溶液(1 mol ·L-1, 100 μL)后,我们发现凝胶结构塌陷并且在紫外灯下呈现为明亮的青蓝色荧光。有趣的是,在塌陷的凝胶样品中加入等量HCl溶液(1 mol ·L-1, 100 μL),2种凝胶样品可以再次成胶,并且在紫外灯下基本恢复至原始的黄色荧光,如图 12(a)所示。
|
| 图 12 (a) 2种凝胶剂的叔戊醇凝胶对酸/碱的可逆响应;(b) cou-C8b的叔戊醇凝胶(10 g ·L-1)在用碱/酸处理后的荧光光谱变化 Fig.12 (a) The reversible response of the tert-amyl alcohol gel of the two organogelators to base/acid; (b) the fluorescence spectra change of the tert-amyl alcohol gel of cou-C8b (10 g ·L-1) after base/acid treatment ase/acid treatment |
| |
另外,我们以cou-C8b的叔戊醇凝胶样品为例,测试了在用碱/酸处理后凝胶样品的荧光变化,结果如图 12(b)所示。
cou-C8b的叔戊醇凝胶在原始凝胶状态下的最大发射波长为519 nm,而碱处理之后则出现在454 nm处,蓝移66 nm并且伴随着荧光强度的显著增强。然后加酸处理后,凝胶结构再次恢复的状态下最大发射波长为511 nm,基本恢复至原始状态。可能的原因是加入碱溶液,OH-会夺取羟基H质子,破坏作为自组装驱动力的氢键而导致凝胶塌陷。其次,香豆素上的羟基被夺去H质子后的氧原子则带上负电,其供电子能力增强,从而使分子在受到激发后产生更强的荧光发射强度和蓝移现象。然而继续加入酸溶液则会消耗掉之前碱溶液的OH-,羟基H质子得以恢复,因此可以再次形成氢键作为驱动力进行自组装,凝胶样品得以恢复。
3 结论总之,以7-羟基香豆素-3-羧酸为基础,首次用酰胺在羧基位点直接引入不同长链烷氧基苯类成胶基团,设计并合成了2种具有AIE特性的香豆素类有机凝胶剂cou-C8b和cou-C10b。得到的2种凝胶剂可以在一些醇类溶剂(包括乙醇、异丙醇、正丁醇、叔丁醇和叔戊醇)和丙酮有很好的胶凝能力。此外,cou-C8b还可以在乙酸乙酯中形成凝胶, 并且通过加热-冷却处理可实现溶液-凝胶的多次循环转变。推测出羟基与酰胺之间的氢键、香豆素环之间的π-π相互作用和长烷基链之间的范德华力可能促进了自组装行为。光学实验表明体系在从溶液态到凝胶态的转变过程中,荧光强度显著增加并且波长红移,表现出明显的AIE效应。通过DFT方法的计算结果解释了AIE效应可能是由于分子间非共价相互作用限制了单键旋转等分子内运动。有趣的是,2种凝胶剂形成的有机凝胶均表现出可逆酸碱响应性能,先加碱溶液后再加酸溶液至凝胶样品中,凝胶结构先塌陷后恢复,同时体系的荧光则由黄色变成青蓝色最后恢复为原始黄色。这种结果表明这类凝胶剂可能在发光纳米结构器件的制造中具有潜在的应用价值。
| [1] |
SHAN Y, TAN L, ZHONG C, et al. Gelation-induced emission enhancement in a "butterfly"-shaped π-conjugated organogelator and its reversible response to acid/base[J]. Tetrahedron Letters, 2017, 58(35): 3461-3465. DOI:10.1016/j.tetlet.2017.07.073 |
| [2] |
JUNG J H, LEE S A, LEE J H, et al. Coumarin-based organogel formed at different solvent compositions and their luminescent properties[J]. Bulletin of the Korean Chemical Society, 2014, 35(12): 3668-3670. DOI:10.5012/bkcs.2014.35.12.3668 |
| [3] |
JI W, YUAN C, WANG F, et al. Deciphering the structure-property relationship in coumarin-based supramolecular organogel materials[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2020, 597: 124744. DOI:10.1016/j.colsurfa.2020.124744 |
| [4] |
YU G, YAN X, HAN C, et al. Characterization of supramolecular gels[J]. Chemical Society Reviews, 2013, 42(16): 6697-6722. DOI:10.1039/c3cs60080g |
| [5] |
JI W, YUAN C, ZILBERZWIGE-TAL S, et al. Metal-ion modulated structural transformation of amyloid-like dipeptide supramolecular self-assembly[J]. ACS Nano, 2019, 13(6): 7300-7309. DOI:10.1021/acsnano.9b03444 |
| [6] |
PIEPENBROCK M O M, LLOYD G O, CLARKE N, et al. Metal- and anion-binding supramolecular gels[J]. Chemical Reviews, 2010, 110(4): 1960-2004. DOI:10.1021/cr9003067 |
| [7] |
STEED J W. Supramolecular gel chemistry: Developments over the last decade[J]. Chemical Communications, 2011, 47(5): 1379-1383. DOI:10.1039/C0CC03293J |
| [8] |
LI Z, JI X, XIE H, et al. Aggregation-induced emission-active gels: Fabrications, functions, and applications[J]. Advanced Materials, 2021, 33(33): e2100021. DOI:10.1002/adma.202100021 |
| [9] |
LUO J, XIE Z, LAM J W, et al. Aggregation-induced emission of 1-methyl-1, 2, 3, 4, 5-pentaphenylsilole[J]. Chemical Communications, 2001(18): 1740-1741. DOI:10.1039/b105159h |
| [10] |
CHEN Y, GONG G, FAN Y, et al. A novel AIE-based supramolecular polymer gel serves as an ultrasensitive detection and efficient separation material for multiple heavy metal ions[J]. Soft Matter, 2019, 15(34): 6878-6884. DOI:10.1039/C9SM01177C |
| [11] |
EXTERNBRINK M, RIEBE S, SCHMUCK C, et al. A dual pH-responsive supramolecular gelator with aggregation-induced emission properties[J]. Soft Matter, 2018, 14(30): 6166-6170. DOI:10.1039/C8SM01190G |
| [12] |
LALITHA K, NAGARAJAN S. Strongly fluorescent organogels and self-assembled nanostructures from pyrene coupled coumarin derivatives: Application in cell imaging[J]. Journal of Materials Chemistry B, 2015, 3(28): 5690-5701. DOI:10.1039/C5TB00694E |
| [13] |
SUN J, XUE P, SUN J, et al. Strong blue emissive nanofibers constructed from benzothizole modified tert-butyl carbazole derivative for the detection of volatile acid vapors[J]. Journal of Materials Chemistry C, 2015, 3(34): 8888-8894. DOI:10.1039/C5TC02012C |
| [14] |
FAN J, CHANG X, HE M, et al. Functionality-oriented derivatization of naphthalene diimide: A molecular gel strategy-based fluorescent film for aniline vapor detection[J]. ACS Applied Materials & Interfaces, 2016, 8(28): 18584-18592. |
| [15] |
XIANG W, HUANG W, BACH U, et al. Stable high efficiency dye-sensitized solar cells based on a cobalt polymer gel electrolyte[J]. Chemical Communications, 2013, 49(79): 8997-8999. DOI:10.1039/c3cc44555k |
| [16] |
LIN Q, BAO C, FAN G, et al. 7-Amino coumarin based fluorescent phototriggers coupled with nano/bio-conjugated bonds: Synthesis, labeling and photorelease[J]. Journal of Materials Chemistry, 2012, 22(14): 6680-6688. DOI:10.1039/c2jm30357d |
| [17] |
ZHANG M, WEI J, ZHANG Y, et al. Multi-stimuli-responsive fluorescent switching properties of anthracene-substituted acylhydrazone derivative[J]. Sensors and Actuators B: Chemical, 2018, 273: 552-558. DOI:10.1016/j.snb.2018.06.085 |
| [18] |
HUANG Y, ZHANG Y, YUAN Y, et al. Organogelators based on iodo 1, 2, 3-triazole functionalized with coumarin: Properties and gelator-solvent interaction[J]. Tetrahedron, 2015, 71(14): 2124-2133. DOI:10.1016/j.tet.2015.02.044 |
| [19] |
WANG K, SUN P, CHAO X, et al. A coumarin Schiff's base two-photon fluorescent probe for hypochlorite in living cells and zebrafish[J]. RSC Advances, 2018, 8(13): 6904-6909. DOI:10.1039/C8RA00093J |
| [20] |
SINGH A, RAMANATHAN G. Red fluorescence protein chromophore inspired selective optical chemosensor for Cu2+ and Hg2+ metal ions[J]. Journal of Luminescence, 2017, 182: 220-225. DOI:10.1016/j.jlumin.2016.10.024 |
| [21] |
SHANGGUAN M Q, JIANG X, LU Z, et al. A coumarin-based fluorescent probe for hypochlorite ion detection in environmental water samples and living cells[J]. Talanta, 2019, 202: 303-307. DOI:10.1016/j.talanta.2019.04.074 |
| [22] |
HE X, CHEN H, XU C, et al. Ratiometric and colorimetric fluorescent probe for hypochlorite monitor and application for bioimaging in living cells, bacteria and zebrafish[J]. Journal of Hazardous Materials, 2020, 388: 122029. DOI:10.1016/j.jhazmat.2020.122029 |
| [23] |
YANG Q, ZHONG X, CHEN Y, et al. A mitochondria-targeted fluorescent probe for hypochlorite sensing and its application in bioimaging[J]. The Analyst, 2020, 145(8): 3100-3105. DOI:10.1039/D0AN00245C |
| [24] |
REN F, LIU Z, LEI Y, et al. Coumarin-substituted pyrrole derivatives with aggregation-enhanced emission characteristics for detecting the glass transition temperature of polymers[J]. Dyes and Pigments, 2021, 188: 109222. DOI:10.1016/j.dyepig.2021.109222 |
| [25] |
HU J, YIN Z, GUI K, et al. A novel supramolecular polymer gel-based long-alkyl-chain-functionalized coumarin acylhydrazone for the sequential detection and separation of toxic ions[J]. Soft Matter, 2020, 16(4): 1029-1033. DOI:10.1039/C9SM02270H |
| [26] |
YANG Y, YANG C, ZHANG Y, et al. Novel coumarin-based pyrazoline derivatives organogels for Fe3+ detection and application in cell imaging[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2021, 624: 126798. DOI:10.1016/j.colsurfa.2021.126798 |
| [27] |
YANG Y, YANG C, ZHANG Y, et al. Synthesis and self-assembly of coumarin-chalcone derivatives organogels[J]. Colloid and Interface Science Communications, 2021, 41: 100374. DOI:10.1016/j.colcom.2021.100374 |
| [28] |
FRISCH M J, TRUCKS G W, SCHLEGEL H B, et al. Gaussian 09, Revision C. 01[CP]. Gaussian Incorporated, Wallingford CT, 2016
|
| [29] |
LU T, CHEN F. Multiwfn: A multifunctional wavefunction analyzer[J]. Journal of Computational Chemistry, 2012, 33(5): 580-592. DOI:10.1002/jcc.22885 |
| [30] |
HUMPHREY W, DALKE A, SCHULTEN K. VMD: Visual molecular dynamics[J]. Journal of Molecular Graphics, 1996, 14(1): 33-38, 27-28. DOI:10.1016/0263-7855(96)00018-5 |
| [31] |
ALVIM J J, DIAS R L A, CASTILHO M S, et al. Preparation and evaluation of a coumarin library towards the inhibitory activity of the enzyme gGAPDH from Trypanosoma cruzi[J]. Journal of the Brazilian Chemical Society, 2005, 16(4): 763-773. DOI:10.1590/S0103-50532005000500014 |
| [32] |
SHEPHERD C, HADZIFEJZOVIC E, SHKAL F, et al. New routes to functionalize carbon black for polypropylene nanocomposites[J]. Langmuir: the ACS Journal of Surfaces and Colloids, 2016, 32(31): 7917-7928. DOI:10.1021/acs.langmuir.6b02013 |
| [33] |
YANG Y, LIANG C, YANG C, et al. A novel coumarin-derived acylhydrazone Schiff base gelator for synthesis of organogels and identification of Fe3[J]. Spectrochimica Acta Part A, Molecular and Biomolecular Spectroscopy, 2020, 237: 118391. DOI:10.1016/j.saa.2020.118391 |
| [34] |
ABDALLAH D J, WEISS R G. n-alkanes gel n-alkanes (and many other organic liquids)[J]. Langmuir, 2000, 16(2): 352-355. DOI:10.1021/la990795r |
| [35] |
LIU Y, XU Z, ZHANG J, et al. Tuning morphology and functionality of two-component self-assembly induced by H-bond and π-π stacking[J]. Dyes and Pigments, 2019, 170: 107586. DOI:10.1016/j.dyepig.2019.107586 |
| [36] |
WU J, FECHTENKÖTTER A, GAUSS J, et al. Controlled self-assembly of hexa-peri-hexabenzocoronenes in solution[J]. Journal of the American Chemical Society, 2004, 126(36): 11311-11321. DOI:10.1021/ja047577r |
 2025, Vol. 42
2025, Vol. 42





