2. 天津大学化工学院, 天津 300072
2. School of Chemical Engineering and Technology, Tianjin University, Tianjin 300072, China
CHF3是生产制冷剂CHClF2时的副产物[1],具有极高的全球温室效应潜值(GWP),其温室效应潜值约为CO2的14 800倍。CHClF2是生产四氟乙烯(TFE)、聚四氟乙烯(PTFE)及其它氢氟烃(HFCs)的基本原料[2],用于TFE和PTFE等的生产,而使用CHClF2导致CHF3的排放将长期持续。
目前CHF3主要采用高温焚烧处置,处理成本较高。在此背景下,近年CHF3资源化转化研究越来越受到关注,主要的CHF3资源化转化技术包括直接作三氟甲基化试剂[3]、制备三氟碘甲烷[4]、裂解制备含氟烯烃[5]、共裂解制备偏氟乙烯[6]和氟氯交换制备卤代烃[7]。迄今为止,分离纯化CHF3的方法主要集中在深冷精馏、吸收分离[8, 9]、膜分离技术[10]和吸附技术[11, 12]。与其它技术相比,吸附分离技术具有低能耗、无毒副作用、操作简单和自动化程度高等优点[13-15]。
根据实际CHClF2生产系统,CHClF2粗分塔排放气组成(体积分数,下同)为CHF3:97%,N2∶3%。CHF3和N2的动力学直径分别为0.492和0.364 nm,两者动力学直径相近;CHF3分子极化率为2.82×10-24 cm3[16],N2分子极化率为1.76×10-24 cm3[17],两者极化率较为接近,一般的吸附剂对它们进行定向分离效率比较低。分子筛和微孔碳都具有刚性结构,结构调控及官能团修饰手段有限,导致定向分离的性能提升空间小。然而MOFs相对活性炭和分子筛来说,具有良好的可修饰性,可根据分子大小来调控孔径,并且MOFs可以增加功能位点,实现气体定向分离。Zaworotko及其同事证明了SIFSIX-3-Ni通过静电相互作用在穿透组成为10/5/85(C2H2/CO2 /He)混合气体系中可以将CO2完全去除掉[18]。
本课题组前期通过单组分静态吸附及双组分穿透实验验证了SIFSIX-3-Ni具有分离CHF3/N2的良好性能,经测定CHF3和N2在SIFSIX-3-Ni上吸附等温线为Langmuir型,其吸附等温线参数见表 1。笔者借助Aspen adsorption软件对CHF3/N2变压吸附过程进行了模拟研究,首先确定了吸附压力和进料流量,然后在此基础上讨论分析了吸附时间、均压时间、降压时间以及真空度对φ(CHF3)和回收率的影响,获得CHF3/N2在SIFSIX-3-Ni上最适宜吸附分离的工艺条件。
| 组分 | IP1/(mol·g-1) | IP2/bar-1 | CMT/s-1 |
| CHF3 | 8.30×10-4 | 0.674 | 0.020 5 |
| N2 | 4.50×10-5 | 0.112 | 0.027 9 |
| 注:IP1为气体组分的吸附量,IP2为Langmuir Ⅰ模型常数,CMT为传质因子。 | |||
在仿真过程中,进行了以下假设[19]:(1) 假设气体是理想气体;(2) 数值求解方法为迎风差分法(UDS1);(3) 气体在吸附床内流动不考虑轴向扩散;(4) 用Ergun方程描述沿吸附床的压降和气体速度;(5) 吸附动力学用线性驱动力(LDF)模型近似;(6) 吸附行为用Langmuir等温线模型描述。
基于理想气体假设的组分平衡方程和总体质量平衡方程分别在式(1)和式(2)中给出[20]。
| $ \begin{aligned} -\frac{\partial}{\partial z}\left(\varepsilon_{\mathrm{b}} D_{\mathrm{ax}} \frac{\partial c_i}{\partial z}\right) & +\frac{\partial\left(v_{\mathrm{g}} c_i\right)}{\partial z}+\left[\varepsilon_{\mathrm{b}}+\left(1-\varepsilon_{\mathrm{b}}\right) \varepsilon_{\mathrm{p}}\right] \frac{\partial c_i}{\partial t} \\ & +\rho_{\mathrm{p}}\left(1-\varepsilon_{\mathrm{b}}\right) \frac{\partial q_i}{\partial t}=0 \end{aligned} $ | (1) |
| $ \begin{gathered} \frac{\partial\left(v_{\mathrm{g}} c\right)}{\partial z}+\left[\varepsilon_{\mathrm{b}}+\left(1-\varepsilon_{\mathrm{b}}\right) \varepsilon_{\mathrm{p}}\right] \frac{\partial c}{\partial t} \\ +\rho_{\mathrm{p}}\left(1-\varepsilon_{\mathrm{b}}\right) \frac{\partial q}{\partial t}=0 \end{gathered} $ | (2) |
式(1)和式(2)中:vg为气相空塔速度,m·s-1;ci为组分i的浓度,mol·L-1;εi为吸附床层空隙率;εp为吸附剂颗粒孔隙率;ρp为吸附剂密度kg·m-3;q为气体吸附量,mol·g-1;Dax为轴向扩散系数,m2·s-1;z为轴向坐标,t为时间。
轴向色散系数由式(3)和式(4)计算。
| $ D_{\mathrm{ax}}=0.73 D_{\mathrm{m}}+\frac{v_{\mathrm{g}} R_{\mathrm{p}}}{\varepsilon_{\mathrm{b}}\left[1+\left(9.49 \varepsilon_{\mathrm{b}} D_{\mathrm{m}}\right) /\left(2 v_{\mathrm{g}} R_{\mathrm{p}}\right)\right]} $ | (3) |
| $ D_{\mathrm{m}}=\frac{0.01013 T^{1.75} \sqrt{\left(1 / M_{\mathrm{A}}+1 / M_{\mathrm{B}}\right)}}{P\left(\sqrt[3]{D_{\mathrm{v}, \mathrm{~A}}}+\sqrt[3]{D_{\mathrm{v}, \mathrm{~B}}}\right)} $ | (4) |
式(3)和式(4)中:Dm为分子扩散系数,m2·s-1;rp为吸附剂颗粒半径。
压降由公式(5)给出的Ergun方程估计。
| $ -\frac{\partial p}{\partial z}=\frac{150 \mu\left(1-\varepsilon_{\mathrm{b}}\right)^2}{\varepsilon_{\mathrm{b}}^3\left(2 r_{\mathrm{p}} \varphi\right)^2} v_{\mathrm{g}}+1.75 \frac{\left(1-\varepsilon_{\mathrm{b}}\right) M \rho_{\mathrm{g}}}{2 r_{\mathrm{p}} \varphi \varepsilon_{\mathrm{b}}^3} v_{\mathrm{g}}^2 $ | (5) |
式(5)中:φ为吸附剂形状因子;μ为动力学黏度,Ns·m-1;M为相对分子质量,g·mol-1;ρg为气相密度,kg·m-3;Re为雷诺数。
采用Langmuir吸附等温线,见公式(6)。
| $ w_i=\frac{I_{\mathrm{P} 1} p_i}{1+I_{\mathrm{P} 2} p_i} $ | (6) |
式(6)中:wi为组分i的平衡负载,mol·g-1,pi为组分i的平衡分压,bar。IP1和IP2为等温线参数。
气相热量平衡方程见公式(7)。
| $ \begin{gathered} -k_{\mathrm{g}}\left(\frac{\partial^2 T_{\mathrm{g}}}{\partial z^2}\right)+C_{\mathrm{vg}} v_{\mathrm{g}} \rho_{\mathrm{g}}\left(\frac{\partial T_{\mathrm{g}}}{\partial z}\right)+\varepsilon_{\mathrm{b}} C_{\mathrm{vg}} \rho_{\mathrm{g}}\left(\frac{\partial T_{\mathrm{g}}}{\partial t}\right)+ \\ p\left(\frac{\partial v_{\mathrm{g}}}{\partial z}\right)+C_{\mathrm{HT}, \mathrm{ap}}\left(T_{\mathrm{g}}-T_{\mathrm{s}}\right)+\left(\frac{4 H_{\mathrm{w}}}{D_{\mathrm{B}}}\right)\left(T_{\mathrm{g}}-T_0\right)=0 \end{gathered} $ | (7) |
式(7)中:Cvg为气相热容,J·(mol·K)-1;DB为吸附床内径,m;kg为气相热导率,W·(m·K)-1;CHT,ap为气固相传热系数,W·(m2·K)-1;T0为床壁内侧温度,K;Ts为固相温度,K;Hw为气壁传热系数,W·(m2·K)-1。
固相热量平衡方程:
| $ \begin{gathered} -k_{\mathrm{s}}\left(\frac{\partial^2 T_{\mathrm{s}}}{\partial z^2}\right)+\rho_{\mathrm{s}} C_{\mathrm{ps}}\left(\frac{\partial T_{\mathrm{s}}}{\partial t}\right)+\rho_{\mathrm{s}} \sum\limits_{i=1}^n\left(C_{\mathrm{pa}, i} w_i\right)\left(\frac{\partial T_{\mathrm{s}}}{\partial t}\right)+ \\ \rho_{\mathrm{s}} \sum\limits_{i=1}^n\left[\Delta H_i\left(\frac{\partial w_i}{\partial t}\right)-C_{\mathrm{HT}, \mathrm{ap}}\left(T_{\mathrm{g}}-T_{\mathrm{s}}\right)\right]=0 \end{gathered} $ | (8) |
式(8)中:ks为固相热导率,W·(m·K)-1;ρs为固体的堆积密度,kg·m-3;Cpa, i为组分i气体等压热容,J·(mol·K)-1;Tg为气相温度,K;Cps为固相热容,J·(mol·K)-1。
线性驱动力(LDF)用式(9)表示[21]。
| $ \frac{\partial q_i}{\partial t}=C_{\mathrm{MT} i}\left(q_i^*-q_i\right) $ | (9) |
式(9)中:qi为组分i的吸附量,mol·g-1;qi*为组分i的饱和吸附量,mol·g-1;CMTi为组分i的吸附速率常数,s-1。
| 参数 | 单位 | 数值 |
| 吸附床高度 | m | 2.1 |
| 吸附床内径 | m | 0.14 |
| 粒子间空隙 | m3·m-3 | 0.32 |
| 堆积密度 | kg·m-3 | 494.0 |
| 颗粒尺寸 | m | 1×10-4 |
PSA循环包含以下几个步骤:(1) 吸附(AD):原料气在吸附压力下连续送入吸附床,重组分CHF3被吸附在吸附床上,N2作为轻组分流出;(2) 均压降(ED):吸附步骤结束以后,床层1压力高,且床层1的吸附量即将达到饱和。为了实现压力的转移,回收利用保存在高压吸附塔内的机械能,气体从床层1的顶部流向床层2;(3) 逆放(BD):床层1逆向排放,将从床底排出的高浓度CHF3作为产品气收集起来;(4) 抽真空(VU):使用真空泵对床层1进行再生,同样对解吸下来的CHF3作为产品气进行回收;(5) 均压升(ER):此步骤与均衡降步骤同时进行,床层2的高压力气体流入处在低压的床层1中,使其床层压力上升;(6) 升压(FR):床层1通过原料气进一步加压,在此步骤结束时,床层1的压力达到吸附压力。
图 1为CHF3和N2在SIFSIX-3-Ni上的吸附等温线。

|
| 图 1 CHF3和N2在SIFSIX-3-Ni上的吸附等温线(288 K) Fig.1 Adsorption isotherms of CHF3 and N2 on SIFSIX-3-Ni at 288 K |
| |
图 1显示了CHF3在1.5~3.0 bar下吸附等温线迅速上升。在7 bar和288 K条件下,CHF3的吸附量达到1.03 mmol·g-1。在相同条件下,N2的吸附量为0.171 mmol·g-1。说明与N2相比,SIFSIX-3-Ni与CHF3具有更强的亲和力。使用Langmuir Ⅰ模型对吸附数据进行了拟合。在288 K下的吸附等温线与Langmuir Ⅰ模型拟合良好,三氟甲烷的吸附等温线与Langmuir Ⅰ模型的拟合度为98.70%,氮气的吸附等温线与Langmuir Ⅰ模型的拟合度为98.55%。
图 2为设计的PSA流程图。

|
| 图 2 PSA系统流程图 Fig.2 Schematic diagram of PSA system |
| |
F1为进料端口,VF为进料阀,TF为进料缓冲罐,VF1为通向床层1的进料阀,VL1为床层1产出的轻组分气体控制阀,VH1为床层1产出的重组分气体控制阀,VF2为通向床层2的进料阀,VL2为床层2产出的轻组分气体控制阀,VH2为床层2产出的重组分气体控制阀,Vpurge为均压阀,TL为轻组分气体缓冲罐,VL为轻组分气体出口阀,L1为轻组分气体出料端口,TH为重组分气体缓冲罐,VH为重组分气体出口阀,H1为重组分气体出料端口。
表 3为其对应的时序表。表 3中,AD为吸附,ED为均压降,BD为逆放,VU为抽真空,ER为均压升,FR为升压。
| Time/s | Bed 1 | Bed 2 |
| 165 | AD | VU |
| 22 | ED | ER |
| 95 | BD | FR |
| 165 | VU | AD |
| 22 | ER | ED |
| 95 | FR | BD |
为了验证模型的正确性,本研究对实际穿透实验与模型穿透实验结果进行比对。使用Aspen adsorption软件进行吸附塔模型建立,采用穿透实验吸附床的尺寸,并且设置进气条件与穿透实验保持一致。另外进气之前,设置He填充吸附塔。Aspen adsorption模拟的穿透实验与实际穿透实验对比如图 3所示。

|
| 图 3 实际穿透实验与模拟值对比图 Fig.3 Comparison between experiment of breakthrough and simulation |
| |
虽然穿透曲线的形状略有不同,但对利用搭建模型模拟结果和实际穿透实验结果进行对比,两者穿透曲线形状基本吻合。从这方面来看,模型最终的穿透浓度与实验浓度相对应,证实了本研究建立的模型的有效性。
图 4为1个循环周期相对应的压力变化。

|
| 图 4 1个循环周期的压力图 Fig.4 Pressure diagram of one cycle |
| |
结合PSA系统流程图,在AD步骤中(F1→VF→TF→VF1→Bed1→VL1→TL→VL→L1),将原料气以1.5 bar的压力通入到吸附床中,CHF3吸附在床上。随着吸附时间的延长,吸附剂逐渐饱和。AD步骤后,床层1进入ED步骤(Bed1→Bed2)。在此步骤中,CHF3的吸附前沿进一步向前移动,提高吸附剂利用效率。为了解吸杂质,床层压力降低到大气压。在步骤BD中(Bed1→VH1→TH→VH→H1),吸附的CHF3被解吸,气相中的CHF3浓度增加。解吸的CHF3作为产品气排出床外。VU步骤(Bed1→VH1→TH→VH→H1)旨在使吸附剂充分再生。随着床层使用真空泵抽负压,流出的CHF3也作为产品气收集起来。之后,床层2的高压气体流入到床1中,提高床层1的压力,回收高压气体能量,这是ER步骤(Bed2→Bed1)的作用。最后FR步骤(F1→VF→TF→VF1→Bed1)是使用原料气将床层压力提高到吸附压力。在这2个步骤中,床中的杂质浓度保持在较低水平,为下一个循环中的吸附步骤做准备。
3 结果与分析 3.1 吸附压力的影响在实际的PSA工艺中,吸附压力是影响某一吸附质在吸附床中吸附能力的决定性因素之一。为此,以CHClF2生产系统CHClF2粗分塔排放气实际组成CHF3 97%,N2 3%为原料气的成分,进料温度设置为288 K,进料流量设置为0.6 m3·h-1。图 5显示了吸附压力在1.5~4.5 bar之间对φ(CHF3)和回收率的影响。

|
| 图 5 吸附压力对φ(CHF3)以及回收率的影响 Fig.5 Effect of adsorption pressure on the purity and recovery of CHF3 |
| |
结果显示,吸附压力在1.5 bar时,φ(CHF3)即可达到灭火剂级别(99%)。考虑到提高吸附压力会导致运行成本的显著增加,所以吸附压力设定为1.5 bar。
3.2 进料流量的影响进料流量是影响产品φ(CHF3)和回收率的重要操作参数。随着进料流量在恒定的循环时间内增加,床身利用率得到提高。图 6展示了进料流量在0.4~1.6 m3·h-1下对φ(CHF3)和回收率的影响。

|
| 图 6 进料流量对φ(CHF3)以及回收率的影响 Fig.6 Effect of feed flow on purity and recovery of CHF3 |
| |
在进料流量为0.6 m3·h-1时,φ(CHF3)达到99.03%,且回收率在90%以上。继续增大流量虽然可以增加产品体积分数,但是会导致CHF3的回收率过快衰减。因此,进料流量定为0.6 m3·h-1。
3.3 吸附时间的影响在PSA循环中,CHF3的吸附通过AD步骤发生在吸附剂孔表面。吸附时间对PSA性能影响很大,吸附时间越长,富集气(产品气CHF3)的回收率越低,产品体积分数越高。但是,过长的吸附时间会导致接近热力学平衡状态,从而降低分离选择性。有必要为吸附剂提供足够的停留时间,以获得所需的φ(CHF3)。因此,期望找到最适宜的相(气固)接触时间,并通过模拟研究吸附时间对产品性能指标的影响。图 7显示了吸附时间对φ(CHF3)和回收率的影响。

|
| 图 7 吸附时间对(a) φ(CHF3)和回收率以及(b) CHF3在吸附床层中的轴向分布的影响 Fig.7 Effect of adsorption time on (a) purity and recovery of CHF3 and (b) axial distribution of CHF3 in the adsorption bed |
| |
随着吸附时间从145增加到185 s, φ(CHF3)从98.96%增加到99.08%,回收率从94.78%下降到93.40%,CHF3在床层上的吸附量从0.603升至0.611 mmol·g-1。AD步骤中,原料气中的CHF3在通过床层1时优先被吸附。随着吸附时间的增加,塔内进料气体的量增加,吸附床内CHF3的吸附前沿前移,传质区穿透,导致吸附质流失,从而降低了回收率。同时,因为塔内CHF3的吸附前沿向上移动,吸附床的CHF3的固相含量增加,也就是说塔内CHF3的固相含量随吸附时间增加而升高,最终提高了产品体积分数。
3.4 均压时间的影响通过连接高压吸附床和低压吸附床,可以实现压力均衡。ED步骤和ER步骤总是成对出现。该因素具有传递压力和回收储存在高压柱中的机械能的优点。图 8显示了均压时间对φ(CHF3)和回收率的影响。
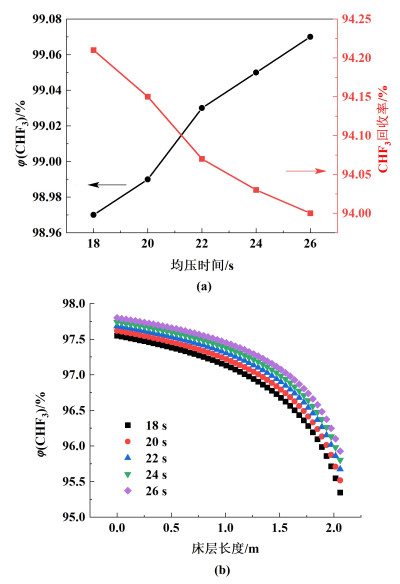
|
| 图 8 均压时间对(a) φ(CHF3)和回收率以及(b) CHF3在吸附床中的轴向分布的影响 Fig.8 Effect of pressure equalizing time on (a) purity and recovery of CHF3 and (b) axial distribution of CHF3 in the adsorption bed |
| |
从图 8(a)和图 8(b)可以看出,随着压力均衡时间的增加,φ(CHF3)增加,但CHF3回收率的趋势却相反。压力平衡时间从18增加到26 s, φ(CHF3)从98.97%增加到99.07%,回收率从94.21%下降到94.00%,CHF3在塔内的气相浓度由97.55%增加到97.80%。在该步骤中,CHF3的吸附前沿进一步向前移动,更多的CHF3被吸附在床上,这就使CHF3的浓度增加。均压时,部分未被吸附的CHF3从床层1流向床层2,这导致CHF3的回收率降低。
3.5 逆放时间的影响逆放时间对φ(CHF3)和回收率的影响如图 9所示。

|
| 图 9 逆放时间对(a) φ(CHF3)和回收率以及(b) CHF3在吸附床中的轴向分布的影响 Fig.9 Effect of reverse release time on (a) the purity and recovery of CHF3 and (b) the axial distribution of CHF3 in the adsorption bed |
| |
随着逆放时间从85增加到105 s, φ(CHF3)从98.99%增加到99.06%,回收率从94.52%下降到93.71%。原因是在逆放过程中,吸附在床层上的CHF3不断被解吸。随着逆放时间的增加,吸附剂解吸会更加充分,从吸附床底部流出解吸的CHF3量会增加,使产品气体积分数提高。但BD步骤和FR步骤是相互耦合的,FR步骤CHF3的进料量比BD步骤解吸的CHF3的量要大,所以CHF3的回收率随着逆放时间的增加而降低。
3.6 解吸压力的影响强吸附组分的解吸、吸附剂的再生及其循环吸附稳定性主要取决于解吸压力。由于重端产品中φ(CHF3)期望尽可能高,因此在PSA循环配置中应用了不进行轻端产品清洗的VU步骤。研究了再生压力在0.08~0.12 bar范围内对工艺性能的影响。结果如图 10所示。

|
| 图 10 解吸压力对(a) φ(CHF3)和回收率以及(b) CHF3在吸附床中的轴向分布的影响 Fig.10 Effect of desorption pressure on (a) purity and recovery of CHF3 and (b) axial distribution of CHF3 in the adsorption bed |
| |
不同解吸压力下φ(CHF3)和回收率的变化趋势如图 10(a)所示。压力越低,CHF3的回收率越高。这是由于吸附剂在此条件下具有较好的再生性能。图 10(b)为CHF3在吸附床层中的轴向分布。CHF3的浓度随着解吸压力的升高而降低。较低的压力促进了床层的再生,并使产品中的N2含量极低。而解吸压力越低,系统能耗越大。在0.10 bar条件下,φ(CHF3)达到最佳值(99.03%),CHF3回收率为94.07%。
4 结论为了模拟CHF3/N2的分离过程,采用Aspen adsorption软件对PSA工艺进行了模拟。讨论并分析了吸附压力、进料流量和真空度等参数对φ(CHF3)和回收率的影响,评价了PSA体系的分离性能。PSA模拟结果表明,吸附压力1.5 bar、进料流量0.6 m3·h-1、吸附时间165 s,均压时间22 s,逆放时间95 s,真空度0.1 bar,这个条件下φ(CHF3)在99%以上(灭火剂级),回收率超过90%。综上所述,PSA模拟证实了SIFSIX-3-Ni对CHF3/N2混合物具有良好的分离性能。此外,这项工作为设计和筛选用于CHF3/N2分离和回收应用的吸附材料提供了一种有效的策略。
| [1] |
PANTZALI M N, MOUZA A A, PARAS S V. Pollutant emissions management in an existing plant: The CHF3 case[J]. Chemical Engineering & Technology, 2005, 28(2): 187-192. |
| [2] |
韩文锋, 靳碧波, 周强, 等. 三氟甲烷(HFC-23)的资源化转化利用[J]. 化工进展, 2014, 33(2): 483-492. HAN Wenfeng, JIN Bibo, ZHOU Qiang, et al. Conversion and resource utilization of waste CHF3 gas[J]. Chemical Industry and Engineering Progress, 2014, 33(2): 483-492. (in Chinese) |
| [3] |
MAZLOOMI Z, BANSODE A, BENAVENTE P, et al. Continuous process for production of CuCF3 via direct cupration of fluoroform[J]. Organic Process Research & Development, 2014, 18(8): 1020-1026. |
| [4] |
韩文锋, 习苗, 王志昆, 等. La对CHF3和I2气相合成CF3I催化剂性能的影响[J]. 高校化学工程学报, 2016, 30(6): 1372-1379. HAN Wenfeng, XI Miao, WANG Zhikun, et al. Promotional effects of La on Rb-K/AC catalysts in CF3I synthesis via CHF3 and I2 gas-phase reaction[J]. Journal of Chemical Engineering of Chinese Universities, 2016, 30(6): 1372-1379. (in Chinese) |
| [5] |
王刚. 三氟甲烷裂解制备四氟乙烯和六氟丙烯的研究[D]. 杭州: 浙江大学, 2015 WANG Gang. Study on pyrolysis of trifluoromethane to tetrafluoroethvlene and hexafluoropropylene[D]. Hangzhou: Zhejiang University, 2015 (in Chinese) |
| [6] |
CHENG Y, WANG J, HAN W, et al. Catalytic coupling of CH4 with CHF3 for the synthesis of VDF over LaOF catalyst[J]. Greenhouse Gases: Science and Technology, 2018, 8(3): 587-602. DOI:10.1002/ghg.1769 |
| [7] |
HAN W, WANG J, CHEN L, et al. Reverting fluoroform back to chlorodifluoromethane and dichlorofluoromethane: Intermolecular Cl/F exchange with chloroform at moderate temperatures[J]. Chemical Engineering Journal, 2019, 355: 594-601. DOI:10.1016/j.cej.2018.08.135 |
| [8] |
LIM J S, PARK K H, LEE B G, et al. Phase equilibria of CFC alternative refrigerant mixtures. binary systems of trifluoromethane (HFC-23) + 1, 1, 1, 2-tetrafluoroethane (HFC-134a) and trifluoromethane (HFC-23) + 1, 1, 1, 2, 3, 3, 3-heptafluoropropane (HFC-227ea) at 283.15 and 293.15 K[J]. Journal of Chemical & Engineering Data, 2001, 46(6): 1580-1583. |
| [9] |
SHARIATI A, PETERS C J. High-pressure phase equilibria of systems with ionic liquids[J]. The Journal of Supercritical Fluids, 2005, 34(2): 171-176. DOI:10.1016/j.supflu.2004.11.011 |
| [10] |
RUAN X, DAI Y, DU L, et al. Further separation of HFC-23 and HCFC-22 by coupling multi-stage PDMS membrane unit to cryogenic distillation[J]. Separation and Purification Technology, 2015, 156: 673-682. DOI:10.1016/j.seppur.2015.10.064 |
| [11] |
SHIFLETT M B, CORBIN D R, ELLIOTT B A, et al. Sorption of trifluoromethane in zeolites and ionic liquid[J]. The Journal of Chemical Thermodynamics, 2013, 64: 40-49. DOI:10.1016/j.jct.2013.04.018 |
| [12] |
SHIFLETT M B, CORBIN D R, ELLIOTT B A, et al. Sorption of trifluoromethane in activated carbon[J]. Adsorption, 2014, 20(4): 565-575. DOI:10.1007/s10450-014-9601-4 |
| [13] |
YAN H, FU Q, ZHOU Y, et al. CO2 capture from dry flue gas by pressure vacuum swing adsorption: A systematic simulation and optimization[J]. International Journal of Greenhouse Gas Control, 2016, 51: 1-10. DOI:10.1016/j.ijggc.2016.04.005 |
| [14] |
MALEK A, FAROOQ S. Hydrogen purification from refinery fuel gas by pressure swing adsorption[J]. AIChE Journal, 1998, 44(9): 1985-1992. DOI:10.1002/aic.690440906 |
| [15] |
SUSARLA N, HAGHPANAH R, KARIMI I A, et al. Energy and cost estimates for capturing CO2 from a dry flue gas using pressure/vacuum swing adsorption[J]. Chemical Engineering Research and Design, 2015, 102: 354-367. DOI:10.1016/j.cherd.2015.06.033 |
| [16] |
COLLETTE T W. Prediction of molecular properties with mid-infrared spectra and interferograms[J]. Applied Spectroscopy, 2001, 55(8): 1067-1078. DOI:10.1366/0003702011952974 |
| [17] |
GUO Y, HU J, LIU X, et al. Scalable solvent-free preparation of[Ni3(HCOO)6] frameworks for highly efficient separation of CH4 from N2[J]. Chemical Engineering Journal, 2017, 327: 564-572. DOI:10.1016/j.cej.2017.06.141 |
| [18] |
CHEN K, SCOTT H, MADDEN D, et al. Benchmark C2H2/CO2 and CO2/C2H2 separation by two closely related hybrid ultramicroporous materials[J]. Chem, 2016, 1(5): 753-765. DOI:10.1016/j.chempr.2016.10.009 |
| [19] |
FU Q, ZHOU Y, SHEN Y, et al. R23/R22 separation and recovery using the DIST-PSA hybrid system[J]. Industrial & Engineering Chemistry Research, 2017, 56(1): 331-341. |
| [20] |
SUN W, SHEN Y, ZHANG D, et al. A systematic simulation and proposed optimization of the pressure swing adsorption process for N2/CH4 separation under external disturbances[J]. Industrial & Engineering Chemistry Research, 2015, 54(30): 7489-7501. |
| [21] |
LOPES F V S, GRANDE C A, RIBEIRO A M, et al. Adsorption of H2, CO2, CH4, CO, N2 and H2O in activated carbon and zeolite for hydrogen production[J]. Separation Science and Technology, 2009, 44(5): 1045-1073. DOI:10.1080/01496390902729130 |
 2025, Vol. 42
2025, Vol. 42





