2. 西南科技大学生物质材料教育部工程研究中心, 四川 绵阳 621010
2. Engineering Research Center of Biomass Materials (Ministry of Education), Southwest University of Science and Technology, Sichuang, Mianyang 621010, China
随着全球能源需求的不断增加,传统化石燃料的大量使用和工业炼制导致大气中CO2浓度不断上升,对全球生态环境造成了严重威胁[1, 2]。若能对CO2进行综合利用,则能变废为宝、一举两得。近年来,电催化CO2还原(ECR)利用电场驱动,可将CO2转化为高附加值化学品,已引起越来越多研究者的关注[3]。在众多的CO2电催化还原产物中,CO又备受青睐,因其是费托合成工艺的重要原料,又具有选择性高、易于从产物中分离、分离成本低等优点。但是,CO2的化学惰性导致其难以被电化学还原。因此,迫切需要开发绿色、高效的电催化剂,以帮助实现CO2的电化学还原。
到目前为止,研究者已经开发了诸多面向ECR应用的催化剂,包括贵金属/金属氧化物、金属单原子催化剂、分子分散催化剂等。研究发现,催化剂的种类、形貌和结构是决定ECR选择性和活性的关键性因素[4]。Au和Ag基等贵金属催化剂表现出较好的ECR活性,但其价格昂贵,且需要较高的过电势才能达到高选择性[5]。Hatsukade等[6]研究了Ag箔的ECR性能,发现其选择性依赖于阴极电势的大小。在-1.0~-1.2 V vs. RHE范围内,Ag箔的CO选择性最佳,CO的法拉第效率(FECO)可达约90%;但是,需要施加更大的过电位(>900 mV)才能达到更高选择性,这大大限制了Ag催化剂的实际应用。近些年,非贵金属单原子催化剂(如Ni、Co和Fe基)对于ECR反应表现出优良的特性,在确保选择性和活性的同时还可有效降低过电位和原料成本,如Zhang等[7]设计了一种Ni单原子催化剂(SA-Ni@NC),在-0.6 V电位下可达86.2%的FECO以及7.8 mA ·cm-2的CO分电流密度。但是单原子催化剂的合成过程较为复杂,且其高表面易导致在电化学过程中发生聚集,从而限制其活性和选择性进一步提升[8]。因此,仍需开发低成本、低过电位、高活性和高选择性的ECR催化剂[9]。
分子分散催化剂(MDE)是将具有明确活性位点的分子催化剂装载于固态载体如碳材料上制备成的催化剂,具有结构可控、较高的电子转移效率及易于分离等优点;MDE分散性良好,可通过调控分子中心金属的配位环境或配体结构来提升ECR的活性和选择性[10]。目前,以三联吡啶、卟啉、酞菁等为主的杂环芳烃作为配体与多种过渡金属相结合的分子电催化剂已被广泛应用于ECR中[11, 12]。但与酞菁配体相比,卟啉、三联吡啶作为配体与金属形成络合物时,存在合成过程复杂、稳定性较差、产率较低等缺点。而金属酞菁因其合成容易、化学稳定性良好、成本低和金属中心位点明确等特点,越来越引起ECR研究者的注意。Chen等[13]设计了以氨基和羟基作为供电子基团修饰酞菁镍的催化剂,通过调控中心金属位点的电子密度提升ECR选择性,在-0.58~-0.90 V vs. RHE范围内FECO高达90%以上。Choi等[14]将酞菁钴作为分子催化剂固载于石墨烯载体上,在-0.69 V时FECO达到最高,仅接近于80%,CO分电流密度达到3.3 mA ·cm-2,这是因为当金属酞菁固载于碳材料上时容易发生聚集,导致接近活性中心的电子传递能力下降,在一定程度上阻碍中心位点的暴露,从而导致ECR活性和选择性的下降。此外,酞菁的聚集也导致其溶解度降低,进而造成加工上的困难[15]。因此,除了通过金属酞菁外围的取代基的调整来改善其π共轭体系的电子结构、从而增加电子密度和提高金属位点的催化活性,还需要考虑取代基的空间位阻对酞菁分子聚集程度的影响,以尽量避免酞菁的聚集,更充分地暴露活性位点,从而更大程度地提升ECR性能。
根据目前关于酞菁分子的修饰基团研究,长链烷氧基作为一种极性较弱的配体,具有较大的空间位阻,可在一定程度上减小酞菁的聚集程度;同时,其具有较强的供电子效应[16],可以调控中心活性位点电子结构、增加中心金属位点的电子密度,从而提高电催化剂的选择性[13, 17]。此外,长链烷氧基具有疏水性[18],有利于为催化剂创造疏水空间,一方面,使得CO2更易于扩散在催化位点上,有助于反应的进行和活性的提升;另一方面,可有效减缓催化剂长时间接触电解液而在表面上形成碳酸氢盐结晶,利于提升催化剂的稳定性[19]。基于此,本研究以不同链长的烷氧基对酞菁镍加以修饰,合成β-己氧基酞菁镍(NiPc-6)和β-十二烷氧基酞菁镍(NiPc-12);将所合成的NiPc-6和NiPc-12及市售的酞菁镍(无烷氧基,NiPc-0)分别固载于碳纳米管上,制备出催化剂NiPc-6/CNT、NiPc-12/CNT和NiPc-0/CNT(统称“NiPc/CNT”),对其形貌和结构进行表征,并探究烷氧基团及其碳链长度对ECR性能的影响。
1 实验部分 1.1 仪器与试剂 1.1.1 仪器CHI 660E电化学工作站(上海辰华仪器限公司),CG9790Plus气相色谱(浙江福立分析仪器股份有限公司),Ag-AgCl电极(天津高仕睿联科技有限公司),Pt电极(天津高仕睿联科技有限公司),101-0AB电热鼓风干燥箱(北京林茂科技有限公司),KQ-200KDE型高功率数控超声波清洗器(昆山市超声仪器有限公司),H1850台式高速离心机(长沙高新技术产业开发区湘仪离心机仪器有限公司),Nicolet 800红外光谱仪(美国尼高力仪器公司),LabRAM HR拉曼光谱仪(法国赫瑞柏仪器有限公司),SIGMA 500场发射扫描电子显微镜(德国卡尔蔡司公司),Zetasizer Nano S90高灵敏纳米粒度分析仪(英国马尔文仪器有限公司),JEM 2100 F透射电子显微镜(日本电子株式会社),80T能谱仪(上海牛津仪器科技有限公司),ESCALAB 250Xi X射线光电子能谱(XPS,赛默飞世尔科技公司),AVANCE III核磁共振波谱仪(德国布鲁克公司)。
1.1.2 试剂和材料4-己氧基邻苯二甲腈(>95.0%)、4-十二烷氧基邻苯二甲腈(>95.0%)购自上海梯希爱化成工业发展有限公司;氯化镍(99%)、1, 8-二氮杂二环[5.4.0]十一碳-7-烯(DBU,99%)购自上海麦克林生化科技有限公司;乙醇(AR)购自成都市科隆化学品有限公司;N, N-二甲基甲酰胺(DMF,AR)、碳酸氢钾(AR)购自成都金山化学试剂有限公司;Nafion溶液(5.0%)购自武汉市舒洋建材有限公司;酞菁镍(NiPc-0,98%)购自上海毕得医药科技有限公司;39BC疏水碳纸购自日本东丽株式会社。
1.2 催化剂的制备催化剂的制备过程如图 1所示。将4 mmol 4-己氧基邻苯二甲腈和1 mmol无水氯化镍溶解于25 mL乙醇中,在50 ℃时加入1 mL DBU,在140 ℃下搅拌12 min以进行溶剂热反应。该反应中产生的强碱对邻苯二腈的氰基进行亲核攻击,形成金属酞菁。将反应体系冷却至室温后,加入80 mL乙醇,搅拌30 min,过滤收集所得产物,再用0.5 mol ·L-1的H2SO4和乙醇的混合液(体积比为3 ∶2)洗涤3次。所得固体样品在真空烘箱中60 ℃干燥过夜,得到NiPc-6。NiPc-12的合成步骤与上述相同,原料用4-十二烷氧基邻苯二腈代替4-己氧基邻苯二甲腈即可。
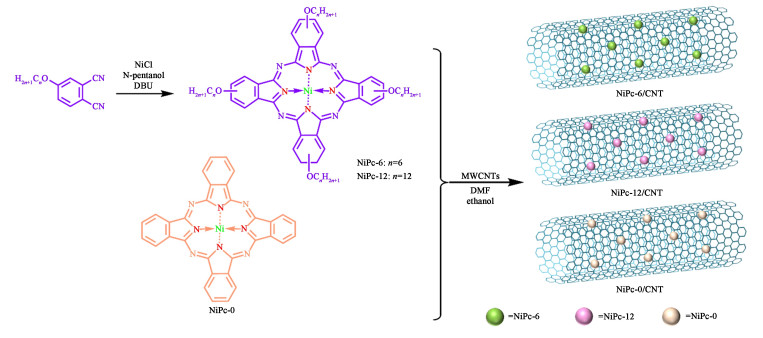
|
| 图 1 NiPc/CNT催化剂的合成路线 Fig.1 Synthetic route of NiPc/CNT catalysts |
| |
分别取NiPc(NiPc-6、NiPc-12和NiPc-0)各2 mg分散在含有0.5 mg ·mL-1多壁碳纳米管(MWCNTs)的DMF分散液中,加入20 mL乙醇溶剂超声,在9 000 r ·min-1下离心15 min除去上层清液,干燥过夜得到NiPc/CNT。
1.3 工作电极的制备将3 mg NiPc/CNT催化剂与480 μL乙醇和20 μL Nafion溶液混合,超声分散后制备成油墨,滴涂在疏水碳纸上作为工作电极。
1.4 催化剂的表征采用红外光谱、紫外光谱及拉曼光谱仪测定催化剂的分子结构,红外光谱扫描范围为4 000~400 cm-1,分辨率为4 cm-1,光谱扫描64次;紫外光谱扫描波长范围为300~800 nm;拉曼光谱测试波长为532 nm;采用纳米粒度激光散射仪分析催化剂的粒度分布、分散和聚集状态等信息,测量范围0.3 nm~10 μm;采用扫描电子显微镜对材料形貌进行观测,加速电压为0.1~30.0 kV;采用透射电子显微镜和能谱仪进行材料的TEM测试并获得元素分布图像,加速电压为200 kV;XPS分析材料的元素组成和化学价态,所有元素的结合能均参考C 1s(284.8 eV)进行电荷校准。
1.5 ECR性能测试在绝对密封的H型电解池中,进行ECR性能测试,以Nafion 117为离子交换膜。采用三电极体系在电化学工作站上进行测试,以Pt片(1 cm×1 cm)作为对电极,以饱和Ag/AgCl电极作为参比电极,负载催化剂的碳纸作为工作电极,电解液为0.5 mol ·L-1 KHCO3溶液。在测试之前,首先向阴极室通入至少30 min CO2,使电解液中CO2达到饱和,气体流量控制在40 mL ·min-1。所施加电压均需要转化为可逆氢电极电势,如式(1)所示。ECR产生的气体产物经气相色谱仪进行检测,用式(2)计算法拉第效率(FE)。
| $ E(v s . \mathrm{RHE})=E(v s . \mathrm{Ag} / \mathrm{AgCl})+0.0591 \mathrm{pH}+0.197 $ | (1) |
| $\mathrm{FE}=\frac{n x_i F p V_{\mathrm{CO}_2}}{R T I} \times 100 \% $ | (2) |
式(1)中:n为CO2还原成CO转移电子数(n=2);xi为产物CO或H2的物质的量;F为法拉第常数(96 485 C ·mol-1);p为大气压(101.3 kPa);VCO2为二氧化碳气体流量,mL ·min-1;I为稳定时的电流,A;R为理想气体常数(8.314 J ·mol-1 ·K-1);T为电解温度(298.15 K)。根据Tafel方程计算Tafel斜率,如式(3)所示。
| $ \eta=b\left|J_{\mathrm{CO}}\right| $ | (3) |
催化产物的法拉第效率与电流密度(J)之积为产物的分电流密度(Jproduct)。其中:JCO为产物CO的分电流密度(mA ·cm-2);η为过电位(V);b为Tafel斜率。在-1.3 V下施加5.0 mV ·s-1幅值电压,在0.1~100 kHz频率范围内测量电化学阻抗(EIS)。以二甲基亚砜(DMSO)为内标,采用核磁共振(NMR)对液体产物进行定量分析。
2 结果与讨论 2.1 NiPc的结构与形貌分析采用红外光谱、UV-vis、纳米粒度测试、SEM、XPS等手段对NiPc的分子结构及形貌等进行表征。图 2(a)为NiPc的红外光谱图,与NiPc-0相比,NiPc-6和NiPc-12在2 923 cm-1附近出现了新的吸收峰,为酞菁分子环上外接饱和C—H的伸缩振动峰;NiPc-6和NiPc-12在1 240 cm-1附近的吸收峰为C—O—C的特征吸收峰[20],表明NiPc-6和NiPc-12上存在饱和碳链烷氧基团。3种催化剂在1 610 cm-1附近的吸收峰均为苯环骨架的特征吸收峰,说明NiPc-6和NiPc-12与NiPc-0保持了相同的芳香结构。此外,在3种催化剂中均未显示反应物邻苯二甲腈在2 230 cm-1处的特征吸收峰[13],证明芳香化合物的特征吸收峰全部源自于酞菁环。因此,NiPc-6和NiPc-12的红外表征结果与合成的目标结构一致。图 2(b)为NiPc在氯仿溶剂中的紫外-可见光吸收光谱图。由图 2(b)可知,NiPc的紫外吸收光谱明显分为2个强吸收带,分别为300~400 nm处的B带和600~700 nm处的Q带。分子轨道理论表明,Q带的吸收峰来源于酞菁环体系的价电子π-π*跃迁[21],可进一步确定酞菁化合物的合成。NiPc-6和NiPc-12分别在674.9和673.7 nm处出现Q带吸收峰,此为酞菁单分子的特征峰,且与NiPc-0在677.2 nm处的峰位置相比均发生了红移,这是由于取代基的供电子效应导致;3种催化剂中,623.3、623.8和620.2 nm处的肩峰均是由于酞菁分子在氯仿溶液中发生H型聚集作用所导致,即酞菁环之间由于π-π堆积作用使得其分子呈面对面排列[22]。这种聚集作用越强,会导致酞菁单分子的吸收强度越小,越不利于NiPc中心金属位点的充分暴露。NiPc-6的单分子数量吸收强度最大,表明其相较于NiPc-12和NiPc-0具有最小的聚集程度[23]。此外,采用纳米粒度激光散射测试来进一步探究NiPc的聚集程度,结果如图 2(c)所示。NiPc-12、NiPc-6和NiPc-0的平均粒径分别为248.8、201.5和241.7 nm,NiPc-6的平均粒径明显小于NiPc-12和NiPc-0,说明NiPc-6在3种催化剂中具有最小的聚集程度。图 2(d)所示的SEM图进一步证明了此结果,NiPc-6呈现出形状不规则的球状簇,与NiPc-0和NiPc-12相比,NiPc-6的聚集程度更轻微。上述结果表明,当酞菁环上引入了长链烷氧基后,一定的空间位阻作用导致酞菁的聚集减弱,中心金属位点能更充分地暴露出来;但取代基的碳链过长可能又会造成分子间的相互纠缠,使得酞菁的聚集现象加重。即3种催化剂中NiPc-6的聚集程度最小,使得更多的中心Ni活性位点暴露,更有利于提升电催化ECR的活性。
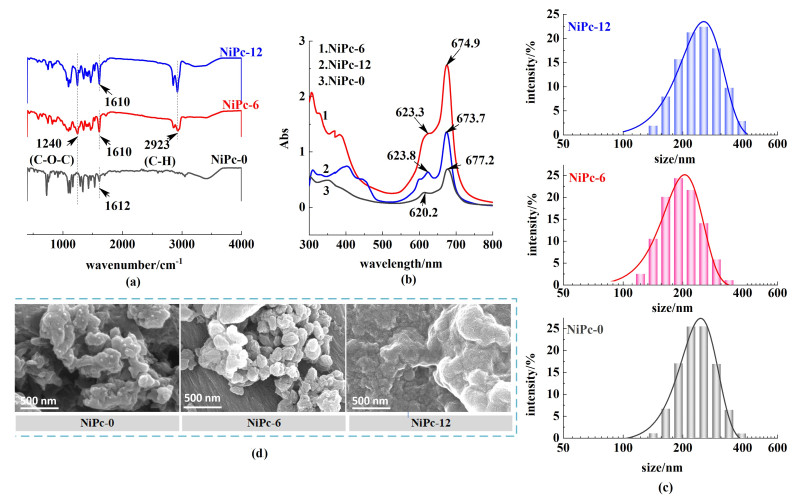
|
| 图 2 (a) NiPc的红外光谱;(b) NiPc在氯仿溶液中的紫外光谱;(c) NiPc的粒径分布图;(d) NiPc的SEM图 Fig.2 Characterizations of the NiPc; (a) IR spectra; (b) UV-vis spectra in chloroform; (c) The particle size distribution; (d) SEM images |
| |
催化剂分子中的碳、氮种类和金属中心价态对其电催化活性有重要影响,因此对NiPc进行了深入的XPS分析。图 3(a)为NiPc的XPS全谱图,3种催化剂均包含C、O、N和Ni 4种元素。图 3(b)显示的为催化剂的C 1s谱,其中NiPc-6和NiPc-12位于286.0 eV处的峰可归属于C—O—C键,进一步证明烷氧基成功引入到酞菁镍环上。图 3(c)的N 1s谱中显示,3种催化剂中均含有Ni—N(398.5 eV),表明中心Ni位成功与酞菁大环上的N配位。图 3(d)为催化剂的Ni 2p谱,其中855.6和872.7 eV处的峰可归属于Ni 2p3/2和Ni 2p1/2的响应信号,表明3种催化剂中的Ni均主要以+2价的形式存在[24]。此外,相较于NiPc,NiPc-6和NiPc-12的Ni 2p谱图的峰值均向低结合能方向移动了0.3 eV,表明取代基烷氧基团的供电子效应导致了中心金属Ni位的电子密度增强[25]。因此,供电子基团修饰的NiPc-6和NiPc-12作为电催化剂可有效地提高ECR选择性。
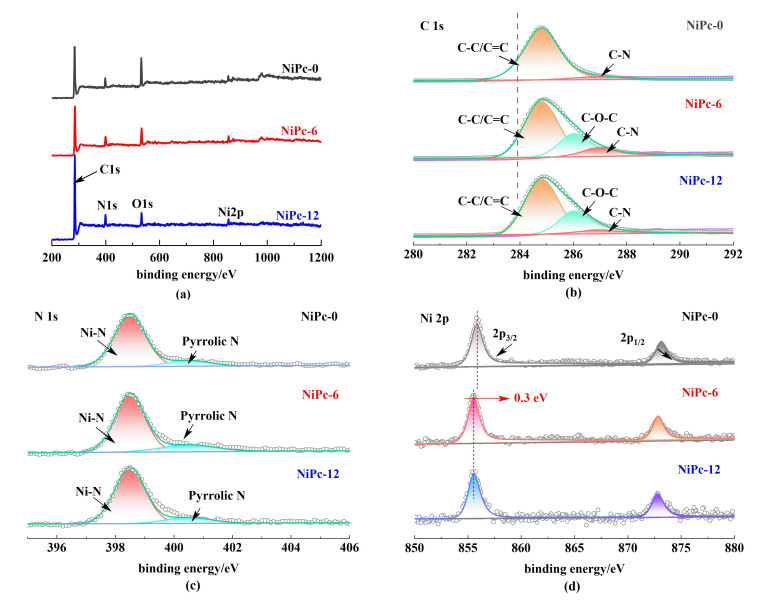
|
| 图 3 (a) NiPc的XPS全谱;(b)~(d) NiPc的C 1s、N 1s和Ni 2p图谱 Fig.3 (a) XPS survey of NiPc; XPS spectra for the (b) C 1s, (c) N 1s, and (d)Ni 2p region of NiPc |
| |
通过拉曼光谱、UV-vis以及TEM对NiPc/CNT进行结构和形貌表征。图 4(a)和图 4(c)的拉曼光谱显示,NiPc-6和NiPc-12在1 545 cm-1处均显示了C—N=C的拉曼特征峰;此外,NiPc-6/CNT和NiPc-12/CNT的拉曼谱图上均未观察到NiPc-6和NiPc-12的特征峰,只保留了MWCNT的特征信号,这表明NiPc与MWCNTs之间通过非共价π-π堆叠作用而结合,其强电子相互作用在一定程度上阻碍了NiPc的一些振动[26]。图 4(b)和图 4(d)分别显示了NiPc-6/CNT和NiPc-12/CNT的TEM图、TEM暗场图像以及EDS元素映射图。从图 4(b)和图 4(d)中可清晰观察到碳纳米管的形貌,NiPc-6/CNT和NiPc-12/CNT的管壁直径分别为17.1和24.2 nm,说明NiPc-6/CNT的分散效果更好。此结果进一步说明,NiPc-12/CNT在碳纳米管上发生了更明显的聚集,使得管壁明显增厚,对其催化活性和电荷传输性能会产生不利影响。暗场图像及EDS图则表明NiPc中各元素在碳纳米管上呈均匀分布状态。
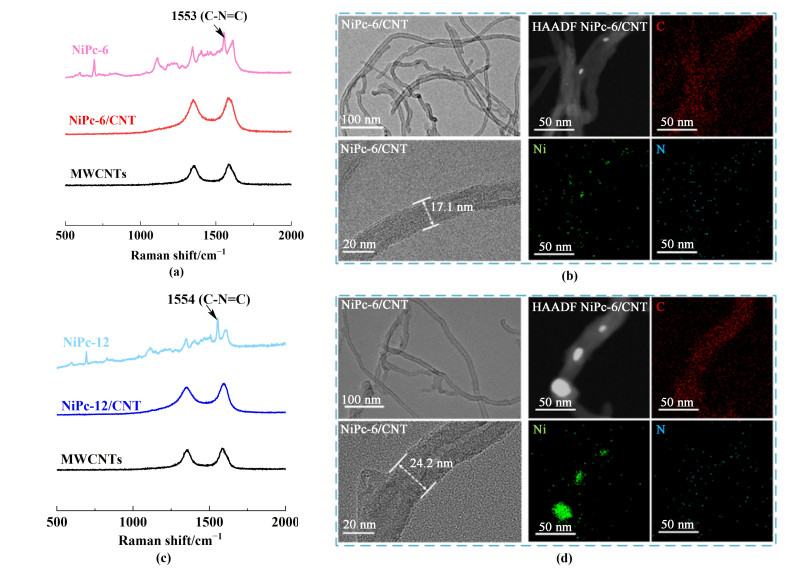
|
| 图 4 (a) NiPc-6、NiPc-6/CNT和MWCNTs的拉曼光谱;(b) NiPc-6/CNT的TEM图、HAADF-TEM暗场图和EDS元素分布图;(c) NiPc-12、NiPc-12/CNT和MWCNTs的拉曼光谱;(d) NiPc-12/CNT的TEM图、HAADF-TEM暗场图和EDS元素分布图 Fig.4 (a) Raman spectra of NiPc-6, NiPc-6/CNT and MWCNTs; (b) TEM images, HAADF-TEM images, and the EDS elemental mapping of NiPc-6/CNT; (c) Raman spectra of NiPc-12, NiPc-12/CNT, and MWCNTs; (d) TEM images, HAADF-TEM images, and the EDS elemental mapping of NiPc-12/CNT |
| |
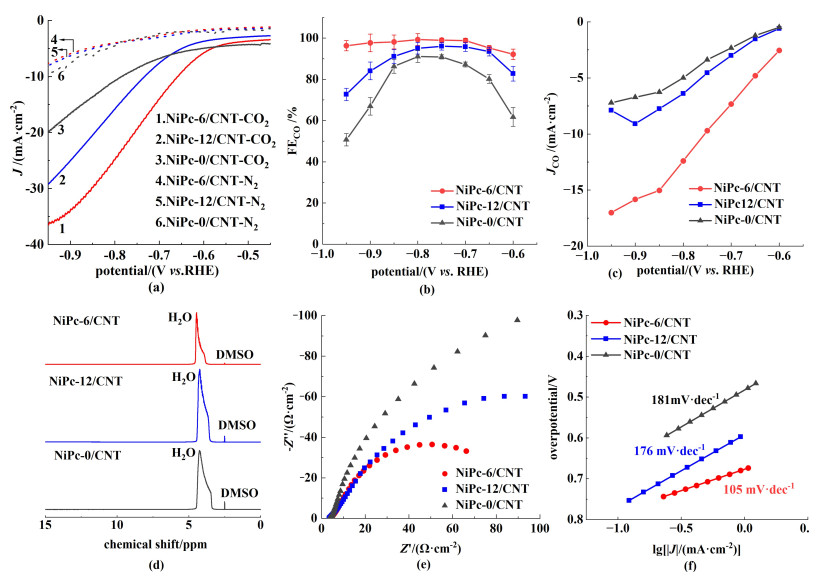
在H型三电极体系中,以CO2饱和的0.5 mol ·L-1 KHCO3作为电解液,评估了不同NiPc/CNT的ECR性能。图 5(a)给出了3种NiPc/CNT分别在CO2饱和、N2饱和的电解液中的线性扫描伏安(LSV)曲线,结果显示,NiPc/CNT在CO2饱和电解液中产生的电流密度均远大于N2饱和电解液中产生的电流密度,表明其对ECR具有明显的催化活性。在饱和N2条件下,3种催化剂的电流密度均较小且在-0.80~0 V的电位范围内十分相近,这与文献[13]结果一致。但随着阴极电势降低,出现了NiPc-0/CNT的电流密度偏大的现象,这可能是由于电解体系的系统误差导致。此外,在饱和CO2条件下,NiPc-6/CNT的电流密度高于NiPc-12/CNT和NiPc-0/CNT,说明己氧基修饰的NiPc-6/CNT作为催化剂时能更显著地提升活性。图 5(b)为不同电位下NiPc/CNT电催化CO2还原时产物的FE,通过气相色谱在线分析,说明该反应的产物仅有CO和H2。由图 5(b)可知,在-0.95~-0.60 V电位范围下,NiPc-6/CNT表现出最高的FECO,说明其选择性最佳,因为NiPc-6/CNT除了拥有能提升中心Ni位点的电子密度的供电子基团外,还具有最小的聚集程度,易使中心Ni位点更充分暴露。随着施加的阴极电势绝对值的增加,NiPc-6/CNT的FECO呈现出先逐步增加后略微下降的趋势。即:当阴极电势在-0.75 V时,NiPc-6/CNT的FECO为98.12%,在-0.80 V时增加到99.3%,而当阴极电势进一步降低时,NiPc-6/CNT的选择性虽略有下降,但仍能保持在95%以上,相比于目前已报道的ECR催化剂在-1.0~-0.5 V范围内FECO均在80%~95%[11-14],该催化剂的性能较为优异。对于NiPc-12/CNT,其FECO随施加的阴极电势绝对值的增加呈现先升高后显著下降的趋势。即:在-0.75 V时,其FECO最高,但仅达到96%;而NiPc-0/CNT也仅在-0.75 V时达到FECO峰值,约为90%,明显低于NiPc-6/CNT和NiPc-12/CNT。这些结果出现的原因,既有供电子取代基的作用,导致中心Ni位的电子密度增加而提升了催化性能;又有取代基空间位阻的影响,过大的位阻致使NiPc/CNT的分散程度降低,阻碍了中心金属位点的充分暴露,一定程度上导致了催化性能的降低。因此,巧妙地设计并优化取代基及其长度十分重要。图 5(c)给出了产物CO的分电流密度(JCO),NiPc-6/CNT在最适宜电位下的JCO可达12.41 mA ·cm-2,远高于NiPc-12/CNT和NiPc-0/CNT,进一步说明了NiPc-6/CNT具有最佳的催化活性。图 5(d)的1H NMR图谱中只检测到H2O的单峰,表明NiPc/CNT在ECR过程中并未产生液相产物。
|
| 图 5 NiPc/CNT催化剂在H电解池中的ECR性能:(a) 在饱和CO2和N2的0.5 mol ·L-1 KHCO3溶液中的LSV曲线,扫描速率为50 mV ·s-1;(b)在不同电位下电解20 min后的FECO;(c) CO的分电流密度;(d) 催化剂在电解后电解液的1H NMR;(e) EIS曲线;(f) Tafel斜率 Fig.5 ERC performance of NiPc/CNT catalysts in the H-cell: (a) LSV profiles in CO2 and N2-saturated 0.5 mol ·L-1 KHCO3 solutions at a scan rate of 50 mV ·s-1; (b) FECO at different potentials, which was measured after the electrolysis for 20 min; (c) CO partial current densities; (d) 1H NMR of electrolyte after electrolysis; (e) EIS profiles; (f) Tafel slopes |
| |
此外,参照Hasan等[27]的研究方法,对NiPc/CNT进行了电化学阻抗测试(EIS),图 5(e)中展示了由EIS测试得到的Nyquist图谱。通常,圆弧半径越小,电荷传递阻抗越低,催化剂在反应过程中的相对阻力越小,反应动力学过程越迅速,同时具有越高的催化活性。因此,由图 5(e)可知,NiPc-6/CNT具有最低的电荷转移电阻,表明一定碳链长度的取代基有利于提升催化剂分子的电荷传输能力。
图 5(f)给出了NiPc/CNT的Tafel斜率,以进一步分析催化剂的ECR反应动力学过程。电催化还原CO2生成CO主要包括以下3步:(1)CO2获取H+与e-,生成*COOH中间体;(2)*COOH中间体再次获取H+与e-生成*CO;(3)*CO从催化剂表面脱附形成CO。由于CO2的化学惰性导致其活化过程中能量势垒较大,因此ECR的速率决定步骤为生成*COOH中间体的过程,且该过程又可以分为2种途径:第1种途径为CO2经过质子耦合电子转移过程形成*COOH;第2种途径为CO2通过电子去耦与质子转移形成*COOH[28]。Tafel斜率的大小既可反映ECR的动力学快慢,又可判断其速率决定步骤即生成*COOH中间体的具体途径。图 5(f)中,NiPc-6/CNT、NiPc-12/CNT和NiPc-0/CNT的Tafel斜率分别为105、176和161 mV ·dec-1,均接近或大于118 mV ·dec-1,表明NiPc-6/CNT在ECR中具有最快的反应动力学过程;且对于3种催化剂而言,其ECR速率决定步骤的途径均为CO2经过质子耦合电子转移形成*COOH的过程。
图 5(e)和图 5(f)的结果进一步说明,NiPc-6/CNT因其修饰基团的供电子效应和一定的空间位阻,降低了催化剂在吸附、转化和反应产物解离等步骤中的相对阻力,并提高了电荷传输能力,因而提升了催化活性。由于受到研究条件的限制,本研究在催化剂的微观结构方面的理论分析还有待进一步提高,未来将尽量采取更全面的分析测试方法或理论和实验相结合的方式来提高研究的深度和水平。
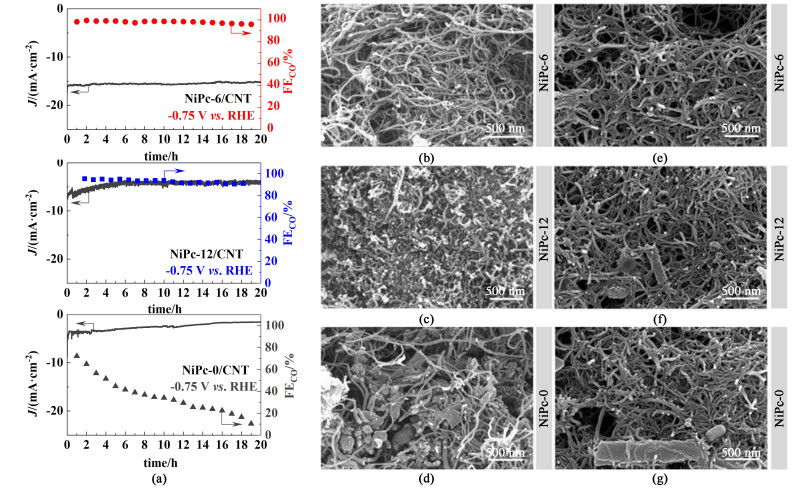
电催化剂的稳定性是评估其是否可以实际应用的一个重要指标。将3种NiPc/CNT进行20 min计时安培测试,结果如图 6。将NiPc-6/CNT、NiPc-12/CNT和NiPc-0/CNT分别在-0.75 V下进行电解,在20 min的电解过程中,NiPc-6/CNT和NiPc-12/CNT均比NiPc-0/CNT的电流密度更稳定,且FECO亦未明显衰减;而NiPc-0/CNT在20 min电解后的电流密度和FECO衰减均相对显著。这些结果表明,NiPc-6/CNT和NiPc-12/CNT上修饰的长链烷氧基官能团提高了催化剂的疏水性,不仅有利于CO2分子在电极上的扩散、使反应容易进行,还在使用过程中避免了催化剂长时间接触溶剂而形成结晶,有利于催化剂稳定性能的提升。由此可见,虽然NiPc-12/CNT中更严重的聚集现象会对ECR的活性和选择性产生不利影响,却几乎不会影响催化剂的稳定性和耐久性。此外,由催化剂制备的工作电极在电解20 min前后的形貌如图 6(b)~图 6(g)所示。与电解前相比,3种催化剂在电解后的形貌均未明显变化,说明其在电解过程中的结构基本保持不变,图 6(a)中的ECR性能包括电流密度和FECO有所下降并非催化剂的形貌结构改变所致。
|
| 图 6 (a) NiPc/CNT在-0.75 V vs. RHE电压下连续20 min电解的稳定性评估;(b)~(d) NiPc/CNT工作电极电解前的SEM,(d)~(g) NiPc/CNT工作电极电解后的SEM图 Fig.6 Stability evaluation of NiPc/CNT by chronoamperometric test at -0.75 V vs. RHE for continuous 20 h. (b)—(d) The SEM images of NiPc/CNT working electrodes before electrolysis; (e)—(g) The SEM images of NiPc/CNT working electrodes after electrolysis |
| |
本研究设计合成了不同长链烷氧基修饰的酞菁镍催化剂,以MWCNTs为载体,制备得到不同NiPc/CNT,并评估了它们在ECR中的性能。结果表明,NiPc-6/CNT催化剂具有优异的选择性和活性,在-0.80 V电位下,FECO可达到99.3%,JCO达到12.41 mA ·cm-2;且随着阴极电势进一步下降,其FECO虽略有下降但仍能保持在95%以上。NiPc-6/CNT催化剂的良好性能主要得益于饱和长碳链烷氧基作为修饰基团所带来的2个方面的优势:一方面,烷氧基的供电子效应增加了金属活性位点的电子密度,从而提高了催化剂的活性和选择性;另一方面,NiPc-6/CNT的修饰基团具有一定的空间位阻,能在一定程度上减少酞菁分子的聚集,即可增强催化剂分散性,更有利于催化活性和选择性的提升。此外,长链基团的疏水性也增强了催化剂的稳定性。本研究设计的催化剂制备工艺简单,成本低廉,在电化学领域中具有广泛的应用前景,有望应用于膜电极上实现工业级电流密度,有助于促进该技术在实际工业生产中的应用。
| [1] |
MOHSIN M, ABBAS Q, ZHANG J, et al. Integrated effect of energy consumption, economic development, and population growth on CO2 based environmental degradation: A case of transport sector[J]. Environmental Science and Pollution Research, 2019, 26(32): 32824-32835. DOI:10.1007/s11356-019-06372-8 |
| [2] |
彭立山, 魏子栋. 高性能电解水电极催化材料的设计及产品工程[J]. 化学进展, 2018, 30(1): 14-28. PENG Lishan, WEI Zidong. Design and product engineering of high-performance electrode catalytic materials for water electrolysis[J]. Progress in Chemistry, 2018, 30(1): 14-28. (in Chinese) |
| [3] |
张少阳, 商阳阳, 赵瑞花, 等. 电催化还原二氧化碳制一氧化碳催化剂研究进展[J]. 化工进展, 2022, 41(4): 1848-1857. ZHANG Shaoyang, SHANG Yangyang, ZHAO Ruihua, et al. Research progress on catalysts for electrocatalytic reduction of carbon dioxide to carbon monoxide[J]. Chemical Industry and Engineering Progress, 2022, 41(4): 1848-1857. (in Chinese) |
| [4] |
GONG L, ZHANG D, LIN C, et al. Catalytic mechanisms and design principles for single-atom catalysts in highly efficient CO2 conversion[J]. Advanced Energy Materials, 2019, 9(44): 1902625. DOI:10.1002/aenm.201902625 |
| [5] |
WOLDU A R. From low to high-index facets of noble metal nanocrystals: A way forward to enhance the performance of electrochemical CO2 reduction[J]. Nanoscale, 2020, 12(16): 8626-8635. DOI:10.1039/D0NR01412E |
| [6] |
HATSUKADE T, KUHL K P, CAVE E R, et al. Insights into the electrocatalytic reduction of CO2 on metallic silver surfaces[J]. Physical Chemistry Chemical Physics: PCCP, 2014, 16(27): 13814-13819. DOI:10.1039/C4CP00692E |
| [7] |
ZHANG C, FU Z, ZHAO Q, et al. Single-atom-Ni-decorated, nitrogen-doped carbon layers for efficient electrocatalytic CO2 reduction reaction[J]. Electrochemistry Communications, 2020, 116: 106758. DOI:10.1016/j.elecom.2020.106758 |
| [8] |
梁凤霞. 多相化分子催化剂的制备及其二氧化碳电催化性能研究[D]. 长沙: 湖南大学, 2021 LIANG Fengxia. Preparation of heterogeneous molecular catalysts and their electrocatalytic properties for carbon dioxide[D]. Changsha: Hunan University, 2021 (in Chinese) |
| [9] |
YANG Z, CHEN J, QIU L, et al. Molecular engineering of metal complexes for electrocatalytic carbon dioxide reduction: From adjustment of intrinsic activity to molecular immobilization[J]. Angewandte Chemie (International Ed in English), 2022, 61(44): e202205301. DOI:10.1002/anie.202205301 |
| [10] |
JIANG Z, ZHANG Z, LI H, et al. Molecular catalyst with near 100% selectivity for CO2 reduction in acidic electrolytes[J]. Advanced Energy Materials, 2023, 13(6): 2203603. DOI:10.1002/aenm.202203603 |
| [11] |
BAO W, HUANG S, TRANCA D, et al. Molecular engineering of CoⅡ porphyrins with asymmetric architecture for improved electrochemical CO2 reduction[J]. ChemSusChem, 2022, 15(8): e202200090. DOI:10.1002/cssc.202200090 |
| [12] |
WANG X, FU Y, TRANCA D, et al. Regulating the spin state of nickel in molecular catalysts for boosting carbon dioxide reduction[J]. ACS Applied Energy Materials, 2021, 4(3): 2891-2898. DOI:10.1021/acsaem.1c00269 |
| [13] |
CHEN K, CAO M, LIN Y, et al. Ligand engineering in nickel phthalocyanine to boost the electrocatalytic reduction of CO2[J]. Advanced Functional Materials, 2022, 32(10): 2111322. DOI:10.1002/adfm.202111322 |
| [14] |
CHOI J, WAGNER P, GAMBHIR S, et al. Steric modification of a cobalt phthalocyanine/graphene catalyst to give enhanced and stable electrochemical CO2 reduction to CO[J]. ACS Energy Letters, 2019, 4(3): 666-672. DOI:10.1021/acsenergylett.8b02355 |
| [15] |
LI R, ZHANG X, ZHU P, et al. Electron-donating or-withdrawing nature of substituents revealed by the electrochemistry of metal-free phthalocyanines[J]. Inorganic Chemistry, 2006, 45(5): 2327-2334. DOI:10.1021/ic051931k |
| [16] |
MORI S, SHIBATA N. Synthesis and application of trifluoroethoxy-substituted phthalocyanines and subphthalocyanines[J]. Beilstein Journal of Organic Chemistry, 2017, 13: 2273-2296. DOI:10.3762/bjoc.13.224 |
| [17] |
GUO X, LI C, WANG W, et al. Electronic effects on polypyridyl Co complex-based water reduction catalysts[J]. RSC Advances, 2021, 11(39): 24359-24365. DOI:10.1039/D1RA02435C |
| [18] |
HAMAMOTO Y, HIRAO Y, KUBO T. Biradicaloid behavior of a twisted double bond[J]. The Journal of Physical Chemistry Letters, 2021, 12(19): 4729-4734. DOI:10.1021/acs.jpclett.1c00664 |
| [19] |
ZHANG L, FENG J, LIU S, et al. Atomically dispersed Ni-Cu catalysts for pH-universal CO2 electroreduction[J]. Advanced Materials, 2023, 35(13): e2209590. DOI:10.1002/adma.202209590 |
| [20] |
SILLA J M, DUARTE C J, FREITAS M P, et al. Theoretical and infrared studies on the conformational isomerism of trans-2-bromo-alkoxycyclohexanes[J]. Spectrochimica Acta Part A, Molecular and Biomolecular Spectroscopy, 2011, 81(1): 359-362. DOI:10.1016/j.saa.2011.06.023 |
| [21] |
SALIH AǦIRTAŞ M. Highly soluble phthalocyanines with hexadeca tert-butyl substituents[J]. Dyes and Pigments, 2008, 79(3): 247-251. DOI:10.1016/j.dyepig.2008.03.004 |
| [22] |
KAN J, CHEN Y, GAO J, et al. Synthesis, self-assembly, and semiconducting properties of phenanthroline-fused phthalocyanine derivatives[J]. Journal of Materials Chemistry, 2012, 22(31): 15695-15701. DOI:10.1039/c2jm32358c |
| [23] |
杜俊儒. 不同取代基金属酞菁的合成表征及光谱性质研究[D]. 河北秦皇岛: 燕山大学, 2013 DU Junru. Synthesis, characterization and spectral properties of metal phthalocyanines with different substitutions[D]. Hebei Qinhuangdao: Yanshan University, 2013 (in Chinese) |
| [24] |
GOTO Y, TANIGUCHI K, OMATA T, et al. Formation of Ni3C nanocrystals by thermolysis of nickel acetylacetonate in oleylamine: Characterization using hard X-ray photoelectron spectroscopy[J]. Chemistry of Materials, 2008, 20(12): 4156-4160. DOI:10.1021/cm703644x |
| [25] |
LI N, SI D, WU Q, et al. Boosting electrocatalytic CO2 reduction with conjugated bimetallic Co/Zn polyphthalocyanine frameworks[J]. CCS Chemistry, 2023, 5(5): 1130-1143. DOI:10.31635/ccschem.022.202201943 |
| [26] |
MA D, HAN S, CAO C, et al. Remarkable electrocatalytic CO2 reduction with ultrahigh CO/H2 ratio over single-molecularly immobilized pyrrolidinonyl nickel phthalocyanine[J]. Applied Catalysis B: Environmental, 2020, 264: 118530. DOI:10.1016/j.apcatb.2019.118530 |
| [27] |
HASAN M R, HAMID S B A, BASIRUN W J. Charge transfer behavior of graphene-titania photoanode in CO2 photoelectrocatalysis process[J]. Applied Surface Science, 2015, 339: 22-27. DOI:10.1016/j.apsusc.2015.02.162 |
| [28] |
HOSSAIN M D, HUANG Y, YU T, et al. Reaction mechanism and kinetics for CO2 reduction on nickel single atom catalysts from quantum mechanics[J]. Nature Communications, 2020, 11: 2256. DOI:10.1038/s41467-020-16119-6 |
 2024, Vol. 41
2024, Vol. 41





