2. 华南理工大学化学与化工学院, 广州 510640
2. School of Chemistry and Chemical Engineering, South China University of Technology, Guangzhou 510640, China
药物从研发到上市通常都需要经历漫长的周期,而药物的理化与生化性质与治疗效果密切相关。例如,药物的水溶性影响其在人体内的生物利用度,许多药物因水溶性差而无法在人体内发挥出理想的治疗效果[1];药物稳定性则会对药物的有效性和安全性产生重要影响[2]。此外,一些药物具有较明显的不良反应,使其临床应用受到限制[3]。为改善药物活性成分(Active pharmaceutical ingredient, API)的性质,药学家们开发了各种技术,如降低粒径[4]、多晶型[5]、多组分晶体[6]、共无定形[7]等。其中基于晶体工程的多组分晶体是一种常见和有效的策略[8],且已有药物多组分晶体获批上市[9]。
多组分晶体是由2种及以上物质按照一定化学计量比,通过分子或离子间相互作用形成的具有晶体结构的物质[10]。药物多组分晶体不改变API的分子结构,仅通过引入合适的配体就能达到改善药物理化性质的目的,具有广阔的应用前景。多组分晶体可分为溶剂化物、盐和共晶,盐和共晶的组分在常温下均为固体,两者的区别在于盐中的不同组分间发生了质子转移,共晶则没有。但溶剂化物中至少含有1种溶剂,溶剂化物对改善API理化性质的效果不佳并存在潜在毒性[11],因此,对药物多组分的研究主要集中于盐和共晶。药物多组分晶体被广泛用于改善API的溶解性和溶出速率[12, 13],且在改善API的稳定性[14]、吸湿性[15]、机械性能[16]等方面也具有良好的效果。
在开发药物多组分晶体的过程中,筛选出能与API形成多组分晶体的配体是至关重要的一步。传统的高通量实验筛选在时间、精力和实验室资源上是昂贵的[17]。近年,研究人员探索出多种配体虚拟筛选方法,如超分子合成子及氢键倾向[18, 19]、分子互补性分析[20]、汉森溶解度参数(HSP)[21]、分子表面静电势(MEPS)[22, 23]、基于真实溶剂的类导体筛选模型(COSMO-RS)[6, 24]及各类机器学习方法[25-27]等,有效节约了实验成本并提高了筛选效率,对于缩短药物多组分晶体的开发周期具有积极意义。作者开发了1种基于偏最小二乘(PLS)回归分析的多参数配体预测筛选模型,用于预测环丙沙星的多组分晶体,总体准确率最高可达85%[28],但该模型尚未用于预测其他药物多组分晶体。
左氧氟沙星(Levofloxacin, LEV)是应用最广泛的氟喹诺酮类药物之一,用于治疗由敏感菌引起的呼吸系统感染、泌尿系统感染、消化系统感染等。尽管LEV具有优良的水溶性[29]和抗菌活性,但在大剂量或长时间服用的情况下,仍会产生一些不良反应[30],如胃肠道反应、中枢神经系统反应和皮肤过敏反应等,这些不良反应在一定程度上限制了LEV的应用。目前,已有通过形成多组分晶体以提高LEV的抗菌活性、进而降低给药剂量以减少不良反应的案例报道[31-33],但对于LEV多组分晶体的配体筛选仍缺乏1套系统有效的方法。为此,本研究采用作者新近开发的PLS预测模型[28],高效筛选与LEV形成多组分晶体的配体,以指导LEV多组分晶体的制备;同时,对制备的样品进行结构表征,并评价多组分晶体样品的稳定性和抗菌活性。
1 实验材料和方法 1.1 材料左氧氟沙星(LEV)、对乙酰氨基酚(APAP)、己二酸(ADA)、L-天冬氨酸(ASP)、异烟肼(INH)、异烟酰胺(ISO)、山柰酚(KAE)、烟酰胺(NIC)、对氨基水杨酸(PASA)、原儿茶酸(PCA)、吡嗪酰胺(PYR)、磺胺噻唑(ST)、磺胺-5-甲氧嘧啶(STX)、替硝唑(TDZ)和溴化钾购自上海阿拉丁生化科技股份有限公司;没食子酸(GAL)、甘氨酸(GLY)和L-缬氨酸(VAL)购自上海麦克林生化科技股份有限公司;阿魏酸(FRA)购自上海源叶生物科技有限公司;无水乙醇购自广东光华科技股份有限公司;胰蛋白胨大豆肉汤培养基和琼脂粉购自广东环凯微生物科技有限公司。所有试剂均为分析纯。实验中使用的水均为去离子水,抗菌性能测试中使用的水均为经过高温灭菌处理的超纯水。
1.2 预测参数和分子描述符计算 1.2.1 预测参数和分子描述符的选取选取3种常用且具有不同理论基础的预测参数和3种分子描述符用于模型预测。3种参数化方法基于不同的理论基础,且具有一定的互补性。HSP是1种简单的用于表征API与配体分子混溶性的参数,是多组分晶体形成的先决条件之一,若2种物质的总溶解度参数差Δδt<7 MPa0.5时,可认为具有良好混溶性,Δδt值越小,形成多组分晶体的倾向越大[34]。但HSPs缺乏考虑分子氢键、堆积、构象、形状大小以及稳定性等因素。MEPS是1种基于原子电荷密度计算的参数,用于表征分子间氢键相互作用倾向,若API与配体间的氢键相互作用能与纯物质的氢键相互作用能之差ΔE越负,形成多组分晶体的倾向越大[22]。然而MEPS是粗糙、近似的,没有明确的判断标准。COSMO-RS是1种基于量子化学的平衡热力学工具,基于COSMO-RS方法计算的剩余焓Hex可表征2种物质分子间的亲和力,若API与配体的Hex越负,形成多组分晶体的倾向越大;若Hex<-1 kJ·mol-1,则基本不可能形成多组分晶体[6]。
分子描述符中,平均相对分子质量(MA)被认为与结晶时的扩散速率有关,MA越小,越有利于分子扩散促进晶相形成[35]。API与配体的氢键供体和氢键受体数目差之和(ΣHBC)反映分子内氢键供体和氢键受体的数量差异,ΣHBC越小,API与配体间可能的氢键取向越少,越有利于形成单一的晶体结构[35]。API和配体分子的环数(Rings)则与π-π堆叠有关[36],后者是维持多组分晶体结构的1种分子间相互作用。MA、ΣHBC和Rings的计算方法见式(1)~式(3)[35, 36]。
| $\begin{aligned} & M_{\mathrm{A}}=\frac{M(\mathrm{API})+M(\text{配体})}{2} \end{aligned}$ | (1) |
| $\Sigma \mathrm{HBC}=\left|n_{\mathrm{API} \text {, 供体}}-n_{\mathrm{API} \text{, 受体}}\right|+\left|n_{\text{配体, 供体}}-n_{\text {配体, 受体}}\right|$ | (2) |
| $R=R(\mathrm{API})+R(\text{配体})$ | (3) |
此外,对于形成多组分晶体的体系,计算API与配体的ΔpKa值。通过酸与碱之间是否发生质子转移可以判断盐或共晶的形成,在盐的形成过程中会发生质子的转移,而在共晶的形成过程中则不发生质子转移。由式(4)计算酸和碱的pKa差值。
| $\Delta \mathrm{p} K_{\mathrm{a}}=\mathrm{p} K_{\mathrm{a}}(\text{碱})-\mathrm{p} K_{\mathrm{a}}(\text{酸})$ | (4) |
根据ΔpKa可判断API与配体形成盐或共晶的倾向。一般当ΔpKa>3时,API与配体更容易形成盐;当ΔpKa<0时,更容易形成共晶;而当ΔpKa介于0~3之间时,两者均有可能发生,无法判断形成盐还是共晶[37]。对于本实验体系,将LEV视为碱,将配体视为酸。
1.2.2 预测参数的分子模拟计算采用分子结构建模和模拟进行MEPS和COSMO-RS计算,具体如下。
(1) MEPS计算:先将API和配体分子结构导入Gaussian09软件,采用密度泛函理论(Density Function Theory, DFT)方法,在B3LYP水平和6-31 G++基组[36]下进行分子结构几何优化计算,再将结构优化后的分子导入MultiWfn 3.8软件,分析映射到0.001 a.u.电子密度等值面上的分子表面静电势极值点,结果通过VMD 1.9.3软件可视化。
(2) COSMO-RS计算:先将API和配体分子结构导入COSMOTmoleX 4.6软件,采用BP-TZVPD-FINE/def2-TZVPD参数化方法对分子结构进行几何优化,生成分子的σ-轮廓文件,再将分子的σ-轮廓文件导入COSMOthermX 21.0软件,采用BP-TZVP参数化方法计算API与配体以1∶1化学计量比在25 ℃时的Hex值。
1.3 多组分晶体配体预测筛选分别采用单一HSP、单一COSMO-RS方法和7个PLS模型(表 1)预测LEV与候选配体组成的体系能否形成多组分晶体。对于单一COSMO-RS方法,Hex<-1 kJ·mol-1的体系预测为阳性[6],反之为阴性;对于单一HSP方法,Δδt<7 MPa0.5的体系预测为阳性,反之为阴性。对于PLS模型,其基本形式见式(5)。
| $Y=F\left(X_1, X_2, \cdots, X_n\right)=b_0+\sum\nolimits_{i=1}^n b_i X_i$ | (5) |
| 模型 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| X1 | Δδt | ΔE | Δδt | Δδt | Δδt | Δδt | Δδt |
| X2 | ΔE | Hex | Hex | ΔE | ΔE | ΔE | ΔE |
| X3 | Hex | Hex | Hex | Hex | |||
| X4 | ΣHBC | Rings | AV.MW | ||||
| b0 | 0.404 6 | 0.323 9 | 0.370 6 | 0.346 7 | 0.215 1 | 0.375 5 | 0.473 9 |
| b1 | 0.002 2 | -0.005 5 | -0.007 0 | -0.006 7 | -0.004 1 | -0.006 7 | -0.005 8 |
| b2 | -0.017 5 | -0.029 5 | -0.036 6 | -0.005 4 | -0.002 2 | -0.006 1 | -0.006 7 |
| b3 | -0.030 8 | -0.032 5 | -0.031 0 | -0.031 6 | |||
| b4 | 0.035 9 | -0.010 7 | -0.000 7 | ||||
| YT | 0.65 | 0.60 | 0.60 | 0.60 | 0.60 | 0.60 | 0.60 |
计算LEV-配体体系的预测参数和分子描述符后,将其代入预测模型计算Y值。若体系的Y值大于阳性判断阈值YT,则该体系预测为阳性,反之为阴性。各PLS模型的自变量和系数见表 1[28]。
1.4 多组分晶体制备采用液体辅助研磨、混悬和旋蒸3种方法制备多组分晶体样品,具体如下。
(1) 液体辅助研磨法:准确称取原料药200 mg和特定摩尔比的配体,置于氧化锆球磨罐中,用微量移液枪加入60 μL无水乙醇,用行星球磨机以转速300 r·min-1在室温下研磨30 min,干燥过夜使溶剂挥发完全得到粉末样品。
(2) 混悬法:准确称取原料药100 mg和特定摩尔比的配体,混悬于2 mL溶剂中,置于磁力搅拌器上搅拌24 h后过滤,干燥过夜使溶剂挥发完全得到粉末样品。
(3) 旋蒸法:准确称取原料药100 mg和特定摩尔比的配体,溶于足量的溶剂中,然后在旋转蒸发仪上以转速100 r·min-1、温度60 ℃、真空度0.1 MPa将溶剂蒸发,干燥过夜使溶剂挥发完全得到粉末样品。
将干燥后的粉末样品密封储存于-20 ℃条件下,用于后续结构表征和性能测试实验。
1.5 样品结构表征采用粉末X射线衍射仪(D8 ADVANCE,德国Bruker AXS)表征样品的物相变化。测试条件为:取50~100 mg样品置于石英样品台上,设置扫描范围为5°~40°(2θ),扫描速度为0.1 s·步-1,扫描步长为0.02°。铜靶辐射波长为1.541 8 Å,加速电压和电流分别为40 kV和40 mA。
采用差示扫描量热仪(DSC250,美国TA Instruments)表征样品的热行为。测试条件为:准确称量3~5 mg原料药或样品,放入氧化铝坩埚,将待测样品压实,盖上坩埚盖。测试在氮气氛围中进行,氮气流量为50 mL·min-1,程序控制体系从室温升温至320 ℃,升温速率为10 ℃·min-1。
采用傅里叶变换红外光谱仪(Tensor 27,德国Bruker)表征样品内部的官能团变化。测试前,先将溴化钾充分研磨并置于烘箱中30 min使其完全去除水分,再将约1 mg待测样品粉末均匀分散于约50 mg溴化钾中,然后将混合物压制成均匀半透明至透明圆片状,扫描400~4 000 cm-1范围内的红外光谱,设置扫描分辨率为4 cm-1,每个光谱采集32次扫描。
1.6 预测模型性能评价确定各样品形成多组分晶体的结果后,结合预测结果和实验结果,统计真阳性(TP)、真阴性(TN)、假阳性(FP)和假阴性(FN)体系的数目,通过式(6)~式(10)计算模型的总体准确率(TA)、阳性准确率(PA)、阴性准确率(NA)、灵敏度(SN)和特异性(SP)[28]。
| $\mathrm{TA}=\frac{\mathrm{TP}+\mathrm{TN}}{\mathrm{TP}+\mathrm{FP}+\mathrm{TN}+\mathrm{FN}} \times 100 \%$ | (6) |
| $\mathrm{PA}=\frac{\mathrm{TP}}{\mathrm{TP}+\mathrm{FP}} \times 100 \%$ | (7) |
| $\mathrm{NA}=\frac{\mathrm{TN}}{\mathrm{TN}+\mathrm{FN}} \times 100 \%$ | (8) |
| $\mathrm{SN}=\frac{\mathrm{TP}}{\mathrm{TP}+\mathrm{FN}} \times 100 \%$ | (9) |
| $\mathrm{SP}=\frac{\mathrm{TN}}{\mathrm{FP}+\mathrm{TN}} \times 100 \%$ | (10) |
将原料药和粉末样品分别敞口放置于25 ℃/相对湿度95%的高湿条件(使用饱和碳酸钾溶液获得)和25 ℃/相对湿度75%的加速条件(使用饱和氯化钠溶液获得)的密闭玻璃容器中避光储存。通过PXRD测试放置不同天数样品的衍射图谱,以评价多组分晶体样品的吸湿稳定性。对于储存于25 ℃/相对湿度95%条件下的样品,分别于第0、第5和第10 d时称质量,设空敞口瓶的质量为m0,放置样品后第0 d时敞口瓶的质量为m1,放置若干天后敞口瓶的质量为m2,根据式(11)计算样品的吸湿率。
| $\text{吸湿率}=\frac{m_2-m_1}{m_1-m_0} \times 100 \%$ | (11) |
采用Kirby-Bauer琼脂扩散法[38],测试多组分晶体样品的体外抗菌性能。液体培养基的配制步骤为:称取3 g胰蛋白胨大豆肉汤(TSB)培养基,加入无菌水100 mL,搅拌并加热煮沸至完全溶解,分装至若干试管。琼脂培养基的配制步骤为:称取15 g TSB培养基和10 g琼脂粉,加入无菌水500 mL,搅拌并加热煮沸至完全溶解。将液体培养基和琼脂培养基放置于121 ℃高压蒸汽灭菌器中灭菌15 min。待琼脂培养基冷却至50 ℃左右时,分装至若干平板。选用大肠杆菌(革兰氏阴性)和金黄色葡萄球菌(革兰氏阳性)为实验菌种,用接种环将菌株接种于液体培养基,放置于(37±0.5) ℃振荡培养箱中培养24 h,至肉汤浑浊。取100 μL菌液用无菌PBS稀释100倍,再取100 μL稀释后的菌液均匀涂布于琼脂平板上,放置于(37±0.5) ℃培养箱中培养1 h,取出平板。配制不同浓度的样品溶液,将无菌空白药敏纸片均匀放置于平板上,滴加20 μL样品溶液润湿纸片,分别设置空白对照(乙醇)和原料药对照,静置2 min待溶剂挥发完全,将平板倒置,放置于(37±0.5) ℃培养箱中培养24 h,观察纸片周围透明区域(抑菌圈)的大小。每组实验重复进行3次。
2 实验结果与讨论 2.1 左氧氟沙星多组分晶体的预测筛选分别计算LEV与17种候选配体所组成体系的预测参数和分子描述符,具体结果见表 2。由表 2,采用单一HSP、单一COSMO-RS方法和7个PLS模型,分别预测LEV与17种候选配体组成的体系能否形成多组分晶体,并将最终预测结果及实验结果(2.2)整理为图 1,阳性和阴性结果分别以“√”和“-”表示。可见LEV-PYR体系在所有预测模型中都被预测为阴性,表明LEV与PYR基本不可能形成多组分晶体。而LEV与ADA、FRA、GAL、KAE、PASA和PCA组成的体系在所有PLS模型中都被预测为阳性,表明上述6种配体最有可能与LEV形成多组分晶体。其余体系在不同模型中的预测结果各不相同,它们能否形成多组分晶体存在较大的不确定性,需要通过后续实验验证。
| 配体 | Δδt/MPa0.5 | -ΔE/(kJ·mol-1) | -Hex/(kJ·mol-1) | MA | Rings | ΣHBC |
| ADA | 3.67 | 29.79 | 9.15 | 253.76 | 4 | 8 |
| APAP | 2.93 | 23.12 | 4.45 | 256.27 | 5 | 7 |
| ASP | 0.77 | 38.69 | -0.46 | 247.24 | 4 | 7 |
| FRA | 0.98 | 23.77 | 8.02 | 277.78 | 5 | 8 |
| GAL | 13.16 | 54.69 | 23.35 | 265.75 | 5 | 7 |
| GLY | 0.75 | 36.27 | 1.96 | 218.22 | 4 | 6 |
| INH | 1.67 | 23.42 | -0.16 | 249.26 | 5 | 7 |
| ISO | 2.73 | 21.26 | -0.07 | 241.75 | 5 | 7 |
| KAE | 12.16 | 53.17 | 22.32 | 323.80 | 7 | 8 |
| NIC | 2.73 | 17.58 | -0.18 | 241.75 | 5 | 7 |
| PASA | 10.59 | 37.52 | 11.88 | 257.25 | 5 | 6 |
| PCA | 8.28 | 46.63 | 17.97 | 257.75 | 5 | 7 |
| PYR | 7.01 | 8.99 | 0.04 | 242.24 | 5 | 8 |
| ST | 0.82 | 27.76 | 2.45 | 308.34 | 6 | 8 |
| STX | 0.29 | 16.24 | 1.63 | 320.84 | 6 | 7 |
| TDZ | 1.29 | 0.00 | -0.50 | 304.32 | 5 | 13 |
| VAL | 4.75 | 21.29 | -1.65 | 239.26 | 4 | 6 |
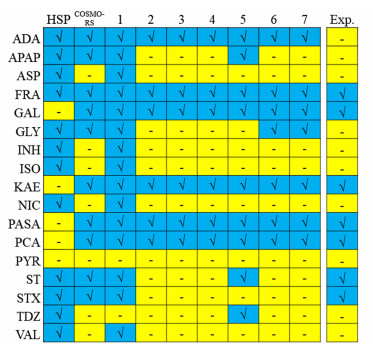
|
| 图 1 各模型对左氧氟沙星与候选配体形成多组分晶体的预测结果 Fig.1 Predicted results of each model on multi-component crystal formation of LEV and selected co-formers |
| |
采用液体辅助研磨法,以化学计量比1∶1制备了LEV与17种配体的多组分固体样品,原料药LEV、8种可能形成多组分晶体的配体及其多组分固体样品的PXRD图谱见图 2。可见在5°~40°的2θ范围内,原料药LEV在6.62°、9.63°、13.04°、15.81°、19.41°、26.33°和26.66°处呈现出特征衍射峰。8个多组分固体样品出现了不同于原料药LEV及对应配体的新衍射峰,以“*”表示,表明这些样品中形成了新相,可能形成了多组分晶体,但需要通过后续表征验证。其余9个样品的衍射图谱则与原料药LEV的衍射图谱基本相同,表明这些样品在制备过程中,配体发生了无定形化,而LEV的晶型保持不变,样品中无新的晶相形成,仍为物理混合物。
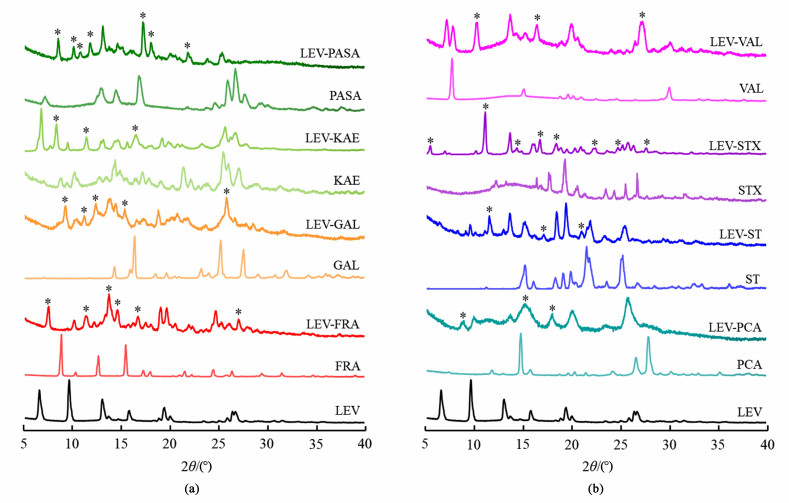
|
| 图 2 原料药左氧氟沙星、配体及出现新衍射峰样品的PXRD图谱 Fig.2 PXRD patterns of raw LEV, co-formers and samples with new diffraction peaks |
| |
通过PXRD初步分析,LEV与FRA、GAL、KAE、PASA、PCA、ST、STX和VAL制备的样品中形成了新相,存在形成多组分晶体的可能性。采用DSC对上述8个样品进行进一步表征测试,所有样品及原料药LEV的DSC曲线见图 3,并标示了熔融吸热峰对应的温度。
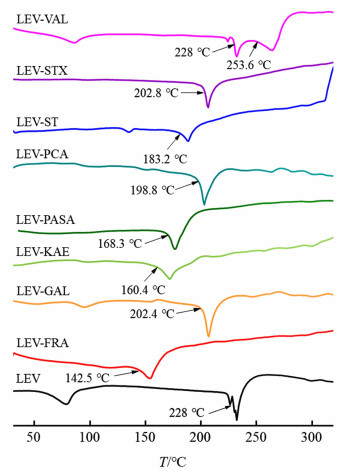
|
| 图 3 样品及原料药左氧氟沙星的DSC曲线 Fig.3 DSC curves of raw LEV and samples |
| |
由图 3可见,原料药LEV呈现出单个尖锐的熔融吸热峰,对应的熔点为228.0 ℃,与文献报道值[15]基本一致。样品LEV-VAL在>125 ℃范围呈现出2个熔融吸热峰,对应熔点分别为228.0和253.6 ℃,基本与LEV和VAL的熔点一致,表明LEV和VAL仍以两相形式存在,并未形成单一新相,样品仍为物理混合物。其余7个样品均呈现单一熔融吸热峰,且其对应的的熔点与LEV及对应配体的熔点都不相同,表明在这些样品中形成了单一的新相。结合PXRD表征结果,上述7个样品形成多组分晶体的可能性较大。
2.2.3 FT-IR表征结果分析为分析样品中LEV与配体分子间的相互作用,对DSC分析中呈现单一熔融吸热峰的7个样品进行了FT-IR分析,原料药LEV、7个样品及对应物理混合物的FT-IR光谱见图 4。可见原料药LEV在1 725.3 cm-1处呈现1强吸收峰,对应于C=O基团的伸缩振动。1 400~1 600 cm-1范围内的吸收峰对应于LEV苯环骨架的振动。由于LEV分子内哌嗪环两端的N原子均为叔胺形式,不存在N—H基团,原料药LEV及物理混合物[图 4(b)]在700~750 cm-1范围内无对应的弯曲振动吸收峰。
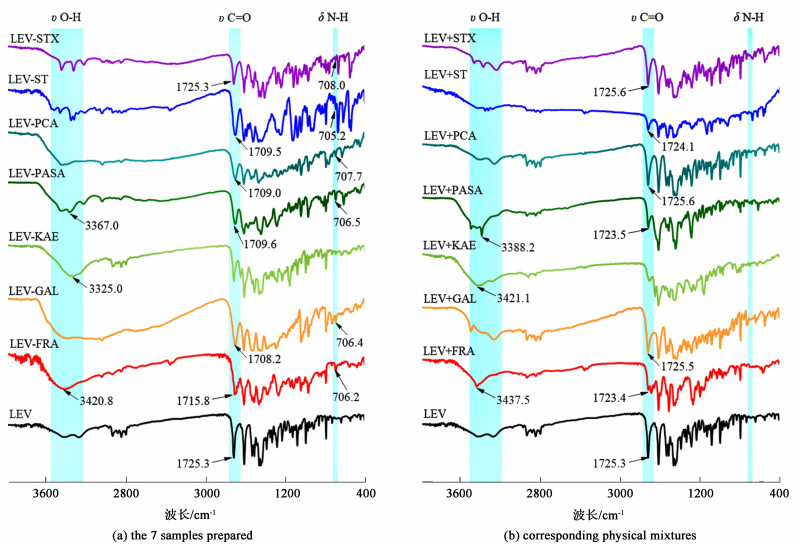
|
| 图 4 原料药左氧氟沙星,(a) 7个制备的样品及(b) 对应物理混合物的FT-IR光谱 Fig.4 FT-IR spectrums of raw LEV, (a) the 7 samples prepared and (b) corresponding physical mixtures |
| |
由图 4可见,与原料药LEV及物理混合物相比,除LEV-KAE外,其余6个样品的C=O基团的振动吸收峰均发生了不同程度的偏移,且都从1 725 cm-1向低波数偏移到1 709~1 715 cm-1范围,表明样品中的C=O基团产生了氢键相互作用。同时,上述6个样品在705~710 cm-1处出现了1新的弱吸收峰,该峰对应于仲胺N—H键的弯曲振动,表明LEV分子中的N原子由叔胺形式转变为仲胺形式,可见LEV与配体分子间发生了质子转移,质子从配体转移到LEV的N原子上。具体而言,对于样品LEV-FRA、LEV-GAL、LEV-PASA和LEV-PCA,质子由配体分子中的COOH基团提供;对于样品LEV-ST和LEV-STX,质子由配体分子中的SO2NH基团提供。上述变化表明,LEV与FRA、GAL、PASA、PCA、ST和STX形成了盐。而在样品LEV-KAE中,尽管未观察到上述变化,其O—H伸缩振动吸收峰从3 421.1 cm-1处向低波数偏移至3 325.0 cm-1处,表明KAE分子中的O—H基团与LEV分子产生了氢键相互作用,与LEV形成了共晶。在已形成盐的样品LEV-PASA中,也观察到这一相互作用,与物理混合物相比,样品LEV-PASA的O—H伸缩振动吸收峰从3 388.2 cm-1处向低波数偏移至3 367.0 cm-1处,表明PASA分子中的O—H基团与LEV分子可能存在氢键相互作用。
为确认成盐样品中质子转移的具体位置,计算了LEV分子的表面静电势图,见图 5。可见LEV分子中酮羰基O原子、羧基O原子、F原子以及哌嗪环末端的N原子附近的表面静电势较负,为良好氢键受体,其余原子则为不良氢键受体。在良好氢键受体中,仅有哌嗪环末端的N原子可接受质子转移,由叔胺结构转变为伯胺结构,因此能与含有COOH等酸性基团的分子形成盐。
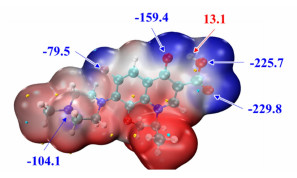
|
| 图 5 LEV的分子表面静电势(kJ·mol-1) Fig.5 Molecular surface electrostatic potential (kJ·mol-1) of LEV |
| |
此外,计算LEV与上述7种配体的ΔpKa值,见表 3。可见,LEV与GAL、PASA、ST和STX的ΔpKa>3,结合FT-IR表征结果,可确定4种配体与LEV形成盐;LEV与FRA和PCA的ΔpKa接近但不足3,但考虑到FRA、GAL、PASA和PCA分子结构中都含有COOH基团,与LEV的相互作用类似,也基本可确定FRA和PCA与LEV形成盐。LEV与KAE的ΔpKa为1.03,介于0~3之间,然而KAE分子中酚羟基的酸性极弱,几乎不可能电离,可由此确定LEV与KAE形成共晶。
| 配体 | pKa | ΔpKa |
| LEV | 7.37 | — |
| FRA | 4.58 | 2.79 |
| GAL | 4.33 | 3.04 |
| KAE | 6.34 | 1.03 |
| PASA | 3.58 | 3.79 |
| PCA | 4.45 | 2.92 |
| ST | 2.19 | 5.18 |
| STX | 1.54 | 5.83 |
LEV与17种候选配体形成多组分晶体的预测结果和实验结果(Exp.)见图 1。结合预测结果和实验结果,计算不同PLS模型的性能指标,并与单一HSP和单一COSMO-RS方法比较,各预测模型对17个体系预测的各项性能指标见图 6。可见各模型性能的优劣顺序为:模型2=模型3=模型4>COSMO-RS>模型6=模型7≈模型5>模型1>HSP。对于实验体系,单一HSP方法的性能最差,其总体准确率和阳性准确率仅为23.53%和25%,且特异性仅为10%。单一COSMO-RS方法的总体准确率和阳性准确率可高达82.35%和70%。可见,单一COSMO-RS方法对实验体系仍具有较大优势。
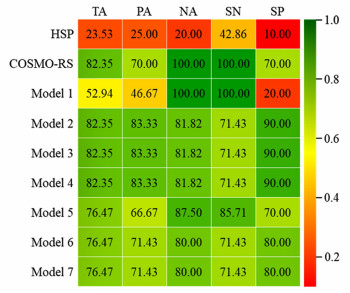
|
| 图 6 各预测模型对17个体系的准确率(TA、PA、NA)、灵敏度和特异性 Fig.6 Accuracy (TA, PA, NA), SN and SP of each prediction model on the 17 systems |
| |
与单一参数方法相比,模型2~4的总体准确率为82.35%,与单一COSMO-RS方法的总体准确率相同,而其阳性准确率和特异性分别为83.33%和90%,比单一COSMO-RS方法有所提高,表明在单一COSMO-RS方法的基础上引入HSP方法和MEPS方法有助于提高预测模型的性能。但由于单一COSMO-RS方法本身对实验体系已具有较高性能,在引入HSP方法和MEPS方法后,预测模型性能提高的幅度有限。此外,模型2~4的各项性能指标完全相同,这表明COSMO-RS方法贡献了大部分准确率,在预测模型中起决定性作用;而HSP方法和MEPS方法对准确率的贡献基本相同且都较小,在预测模型中起辅助性作用。
四参数模型5~7在三参数模型4的基础上,分别引入了分子描述符MA、Rings和ΣHBC。对于实验体系,模型5~7的总体准确率均为76.47%,模型5的阳性准确率和特异性比模型6和模型7稍低,而阴性准确率和灵敏度比模型6和模型7稍高。但与模型2~4相比,模型5~7的各项性能指标均明显下降。通过对比各体系在模型2~4和在模型5~7中的预测值,发现实验阴性体系LEV-APAP、LEV-GLY和LEV-TDZ在模型2~4中的预测结果为阴性;然而LEV-APAP和LEV-TDZ在模型5、LEV-GLY在模型6和模型7中的预测结果为阳性。上述假阳性体系的出现使得模型5~7的性能有所下降。可见,将模型2~4应用于LEV多组分晶体的筛选更为可行,其中模型3对环丙沙星体系[28]和LEV体系的总体准确率均>80%,其余各项性能指标也处于较高水平。因此,HSP/COSMO-RS双参数预测模型具有较好的普适性,有望推广到其他氟喹诺酮类以及分子中具有类似基团(如哌嗪)的药物多组分晶体的预测和筛选。
2.4 稳定性评价分别在25 ℃/相对湿度75%的加速条件和25 ℃/相对湿度95%的高湿条件下评价了原料药LEV和实验制备样品的吸湿稳定性。对在25 ℃/相对湿度75%条件下储存不同天数的样品进行PXRD测试,由图 7可见,样品LEV-KAE、LEV-PASA、LEV-ST、LEV-STX及原料药LEV的衍射图谱在21 d内基本保持不变,表现出良好的稳定性。样品LEV-FRA的衍射峰大部分保持不变,仅个别衍射峰有所减弱。样品LEV-GAL的衍射峰位置基本保持不变,但随着储存时间的增加,其衍射图谱中衍射峰的形状由尖锐变钝,表明其在储存过程中结晶度有所下降。样品LEV-PCA在储存7 d后的衍射图谱产生了较大变化,即在湿度较高的环境中储存较短时间即发生相变。可见,在制备的7种多组分晶体中,LEV-FRA、LEV-GAL和LEV-PCA的稳定性比原料药LEV稍差。
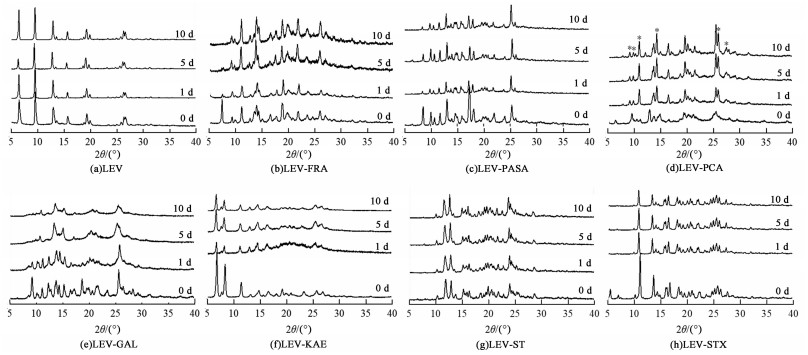
|
| 图 7 LEV和多组分晶体样品在25 ℃/相对湿度75%的PXRD图谱 Fig.7 PXRD patterns of LEV and multi-component crystal samples at 25 ℃/75% RH |
| |
对在25 ℃/相对湿度95%条件下储存不同天数的样品进行PXRD测试,由图 8可见,样品LEV-KAE、LEV-PASA、LEV-ST、LEV-STX及原料药LEV的衍射图谱在10 d内基本保持不变,在更高的湿度条件下仍表现出优越的稳定性。样品LEV-GAL的衍射图谱在此条件下发生的变化与其在25 ℃/相对湿度75%条件下发生的变化基本相同,均表现为结晶度的下降。样品LEV-FRA和LEV-PCA在此条件下发生了较明显的相变,两者的衍射图谱仅在储存1 d后即出现了新衍射峰,且LEV-PCA相变后的衍射图谱与其在25 ℃/相对湿度75%条件下相变后的衍射图谱基本相同。
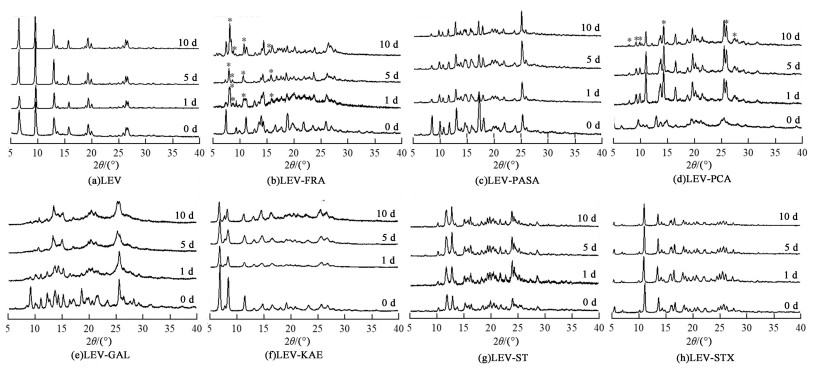
|
| 图 8 LEV和多组分晶体样品在25 ℃/相对湿度95%的PXRD图谱 Fig.8 PXRD patterns of LEV and multi-component crystal samples at 25 ℃/95% RH |
| |
样品在25 ℃/相对湿度95%下储存5和10 d时的吸湿率见图 9,可见,除LEV-FRA和LEV-PCA外,包括原料药LEV在内的其余样品在储存10 d时的吸湿率均低于2.5%,表现出优越的稳定性。样品LEV-FRA和LEV-PCA在储存10 d时的吸湿率分别约为5%和8%,表明这2种样品在储存过程中发生了部分吸湿,导致其发生了相变。但样品LEV-FRA和LEV-PCA发生相变后的衍射图谱与原料药LEV及对应配体的衍射图谱仍存在较大差别,可见,这2种样品在储存期间吸收水分转化为了水合物,但并未发生相分离。
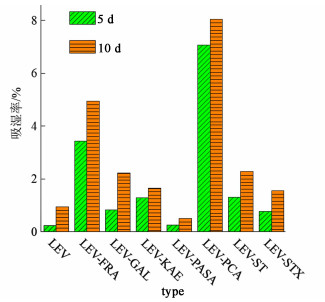
|
| 图 9 样品储存于25 ℃/相对湿度95%下5和10 d时的吸湿率 Fig.9 Hygroscopicity of samples stored at 25 ℃/95% RH for 5 and 10 days |
| |
综上所述,实验制备的7种LEV多组分晶体样品在储存过程中均未发生相分离。LEV-FRA和LEV-PCA的稳定性比原料药LEV稍差,具有一定的吸湿性,吸湿后转化为水合物;LEV-GAL相对不易吸湿,但其结晶度会随着储存时间的增加而小幅下降。其余4种多组分晶体样品在引入配体后仍保持优越的稳定性及结晶度,这对于开发稳定性良好的LEV多组分晶体具有一定的参考价值。
2.5 体外抗菌性能评价为探究LEV多组分晶体的抗菌性能,分别配制浓度为0.1、0.2和0.3 mmol·L-1的样品溶液,采用Kirby-Bauer琼脂扩散法测试样品对革兰氏阴性菌和革兰氏阳性菌的抗菌活性,其中革兰氏阴性菌选用大肠杆菌,革兰氏阳性菌选用金黄色葡萄球菌。样品的抗菌活性高低通过纸片周围透明区域(抑菌圈)的直径大小来表示,不同样品对大肠杆菌和金黄色葡萄球菌的抑菌圈直径见图 10,与原料药LEV对比,“*”表示差异显著(0.01<p<0.05),“ **”表示差异十分显著(p<0.01),“ ***”表示差异极显著(p<0.001)。
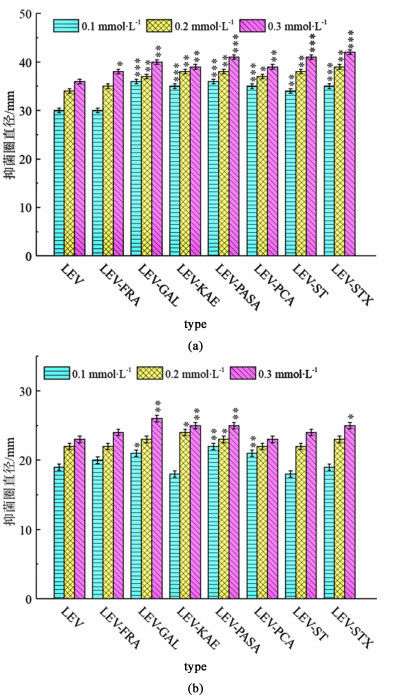
|
| 图 10 样品对(a) 大肠杆菌和(b) 金黄色葡萄球菌的抑菌圈直径 Fig.10 The diameter of inhibitory zones of samples on (a) E. coli and (b) S. aureus |
| |
由图 10可见,抑菌圈的直径随着样品溶液浓度的增大而扩大。在对大肠杆菌的抗菌性能测试中[图 10(a)],原料药LEV在不同浓度水平下的抑菌圈直径分别为30、34和36 mm。7种多组分晶体样品的平均抑菌圈直径相比原料药LEV分别扩大了3%(LEV-FRA)、13%(LEV-GAL)、12%(LEV-KAE)、15%(LEV-PASA)、11%(LEV-PCA)、13%(LEV-ST)和16%(LEV-STX)。除LEV-FRA外,其余样品的抑菌圈都明显扩大,在不同浓度水平下的抑菌圈直径普遍>35 mm。其中,LEV-STX盐对大肠杆菌的抑菌效果最好,这是由于STX是1种磺胺类抗菌药物,对大肠杆菌具有较高的抗菌活性,在与LEV形成盐后,两者产生了协同抗菌作用。LEV-ST盐对大肠杆菌也具有较好的抑菌效果,但与LEV-STX盐相比,其抑菌圈直径稍小,这可能是由于磺胺类药物ST仅对肺炎球菌和链球菌具有较好的抑制效果,其抗菌谱不如STX广泛。
在对金黄色葡萄球菌的抗菌性能测试中[图 10(b)],原料药LEV在不同浓度水平下的抑菌圈直径分别为19、22和23 mm,明显小于其对大肠杆菌的抑菌圈。这可能是由于LEV属于后期第2代氟喹诺酮类药物,而氟喹诺酮类药物自后期第2代开始才具有革兰氏阳性菌的抗菌活性,因此,LEV对革兰氏阳性菌的抗菌性能不如其对革兰氏阴性菌的抗菌性能。7种多组分晶体样品的平均抑菌圈直径相比原料药LEV分别扩大了3.13%(LEV-FRA)、9.38%(LEV-GAL)、4.69%(LEV-KAE)、9.38%(LEV-PASA)、3.13%(LEV-PCA)、0%(LEV-ST)和4.69%(LEV-STX)。盐LEV-GAL和LEV-PASA的抑菌圈扩大明显,盐LEV-FRA和LEV-ST的抑菌圈扩大则不明显。可见,FRA和ST对革兰氏阳性菌的抑制效果较差,与LEV形成多组分形成盐后难以提高其抗菌活性。
综上所述,对于大肠杆菌,LEV-STX的抗菌性能最好,其次是LEV-GAL、LEV-PASA和LEV-ST;对于金黄色葡萄球菌,LEV-GAL和LEV-PASA的抗菌性能最好。值得注意的是,尽管盐LEV-GAL和LEV-PASA对2种细菌的抑菌圈均明显扩大,但其配体GAL不属于抗菌药物,PASA也仅对结核杆菌有效而对其他细菌无效。这可能是由于上述配体与LEV形成盐后,配体本身并未提供额外的抗菌活性,但提高了LEV的水溶性与渗透性,使抑菌圈扩大。可见,选择合适的配体与抗菌药物制备多组分晶体,可有效提高药物的抗菌性能,从而提高药物的生物利用度。
3 结论采用PLS预测模型,以LEV为模型药物,预测可能与LEV形成多组分晶体的配体,以指导LEV多组分晶体的制备,并探究了样品的稳定性和体外抗菌活性。结论如下。
(1) PLS模型预测结果表明,17种候选配体中,6种配体最有可能与LEV形成多组分晶体。实验结果表明,FRA、GAL、PASA、PCA、ST和STX与LEV成功制备成盐,KAE与LEV成功制备成共晶,API与配体化学计量比均为1∶1。
(2) 预测与实验结果对比分析表明,COSMO-RS方法对多参数预测模型的准确性起决定性作用,MEPS和HSP方法对多参数预测模型的准确性起辅助性作用。HSP/COSMO-RS双参数预测模型对所选体系的总体准确率和阳性准确率分别为82.4%和83.3%,具有较好的普适性。
(3) 稳定性测试结果表明,实验制备的7种LEV多组分晶体样品在25 ℃/相对湿度75%和25 ℃/相对湿度95%条件下储存一定时间均不发生相分离。除LEV-FRA和LEV-PCA发生吸湿外,其余5种样品的吸湿稳定性与稳定性良好的原料药相当。
(4) 体外抗菌性能测试结果表明,对于大肠杆菌,7种样品的抑菌圈相比于原料药LEV均显著扩大,其中LEV-STX的抗菌性能最好,其抑菌圈直径扩大了16%。对于金黄色葡萄球菌,LEV-GAL和LEV-PASA的抗菌性能最好,两者抑菌圈直径均扩大9.38%。所制备的样品预期在实现与原料药同等抗菌活性的前提下,可有效降低给药剂量,减少不良反应。
| [1] |
BABU N J, NANGIA A. Solubility advantage of amorphous drugs and pharmaceutical cocrystals[J]. Crystal Growth & Design, 2011, 11(7): 2662-2679. |
| [2] |
孙晶晶, 贾丽娜, 林波, 等. 药物-药物共晶的研究进展[J]. 化工学报, 2021, 72(2): 828-840. SUN Jingjing, JIA Lina, LIN Bo, et al. Research advances of drug-drug co-crystals[J]. CIESC Journal, 2021, 72(2): 828-840. (in Chinese) |
| [3] |
YIN H, WU N, ZHOU B, et al. Slow-release drug-drug cocrystals of oxaliplatin with flavonoids: Delaying hydrolysis and reducing toxicity[J]. Crystal Growth & Design, 2021, 21(1): 75-85. |
| [4] |
LIVERSIDGE G G, CONZENTINO P. Drug particle size reduction for decreasing gastric irritancy and enhancing absorption of naproxen in rats[J]. International Journal of Pharmaceutics, 1995, 125(2): 309-313. DOI:10.1016/0378-5173(95)00148-C |
| [5] |
赵绍磊, 王灵宇, 吴送姑. 药物多晶型的研究进展[J]. 化学工业与工程, 2018, 35(3): 12-21. ZHAO Shaolei, WANG Lingyu, WU Songgu. Progress in the research of pharmaceutical polymorph[J]. Chemical Industry and Engineering, 2018, 35(3): 12-21. DOI:10.13353/j.issn.1004.9533.20182003 (in Chinese) |
| [6] |
WU D, ZHANG B, YAO Q, et al. Evaluation on cocrystal screening methods and synthesis of multicomponent crystals: A case study[J]. Crystal Growth & Design, 2021, 21(8): 4531-4546. |
| [7] |
FAEL H, DEMIREL A L. Indomethacin co-amorphous drug-drug systems with improved solubility, supersaturation, dissolution rate and physical stability[J]. International Journal of Pharmaceutics, 2021, 600: 120448. DOI:10.1016/j.ijpharm.2021.120448 |
| [8] |
HOSSAIN MITHU M S, ECONOMIDOU S, TRIVEDI V, et al. Advanced methodologies for pharmaceutical salt synthesis[J]. Crystal Growth & Design, 2021, 21(2): 1358-1374. |
| [9] |
WANG X, DU S, ZHANG R, et al. Drug-drug cocrystals: Opportunities and challenges[J]. Asian Journal of Pharmaceutical Sciences, 2021, 16(3): 307-317. DOI:10.1016/j.ajps.2020.06.004 |
| [10] |
BERRY D J, STEED J W. Pharmaceutical cocrystals, salts and multicomponent systems; intermolecular interactions and property based design[J]. Advanced Drug Delivery Reviews, 2017, 117: 3-24. DOI:10.1016/j.addr.2017.03.003 |
| [11] |
BLAGDEN N, DE MATAS M, GAVAN P T, et al. Crystal engineering of active pharmaceutical ingredients to improve solubility and dissolution rates[J]. Advanced Drug Delivery Reviews, 2007, 59(7): 617-630. |
| [12] |
VASILEV N A, SUROV A O, VORONIN A P, et al. Novel cocrystals of itraconazole: Insights from phase diagrams, formation thermodynamics and solubility[J]. International Journal of Pharmaceutics, 2021, 599: 120441. |
| [13] |
齐锦伟, 张坤飞, 韩健, 等. 水飞蓟宾与水杨酸、丁香酸、水杨酰胺的共晶[J]. 化学工业与工程, 2023, 40(1): 138-146. QI Jinwei, ZHANG Kunfei, HAN Jian, et al. Cocrystals of silybin with salicylic acid, syringic acid and salicylamide[J]. Chemical Industry and Engineering, 2023, 40(1): 138-146. DOI:10.13353/j.issn.1004.9533.20223011 (in Chinese) |
| [14] |
FANDIÑO O E, REVIGLIO L, LINCK Y G, et al. Novel cocrystals and eutectics of the antiprotozoal tinidazole: Mechanochemical synthesis, cocrystallization, and characterization[J]. Crystal Growth & Design, 2020, 20(5): 2930-2942. |
| [15] |
SHINOZAKI T, ONO M, HIGASHI K, et al. A novel drug-drug cocrystal of levofloxacin and metacetamol: Reduced hygroscopicity and improved photostability of levofloxacin[J]. Journal of Pharmaceutical Sciences, 2019, 108(7): 2383-2390. |
| [16] |
JOSHI T V, SINGARAJU A B, SHAH H S, et al. Structure-mechanics and compressibility profile study of flufenamic acid: Nicotinamide cocrystal[J]. Crystal Growth & Design, 2018, 18(10): 5853-5865. |
| [17] |
龚俊波, 孙杰, 王静康. 面向智能制造的工业结晶研究进展[J]. 化工学报, 2018, 69(11): 4505-4517. GONG Junbo, SUN Jie, WANG Jingkang. Research progress of industrial crystallization towards intelligent manufacturing[J]. CIESC Journal, 2018, 69(11): 4505-4517. (in Chinese) |
| [18] |
SWAPNA B, MADDILETI D, NANGIA A. Cocrystals of the tuberculosis drug isoniazid: Polymorphism, isostructurality, and stability[J]. Crystal Growth & Design, 2014, 14(11): 5991-6005. |
| [19] |
DELORI A, GALEK P T A, PIDCOCK E, et al. Quantifying homo- and heteromolecular hydrogen bonds as a guide for adduct formation[J]. Chemistry-A European Journal, 2012, 18(22): 6835-6846. |
| [20] |
FÁBIÁN L. Cambridge structural database analysis of molecular complementarity in cocrystals[J]. Crystal Growth & Design, 2009, 9(3): 1436-1443. |
| [21] |
MOHAMMAD M A, ALHALAWEH A, VELAGA S P. Hansen solubility parameter as a tool to predict cocrystal formation[J]. International Journal of Pharmaceutics, 2011, 407(1/2): 63-71. |
| [22] |
MUSUMECI D, HUNTER C A, PROHENS R, et al. Virtual cocrystal screening[J]. Chemical Science, 2011, 2(5): 883-890. |
| [23] |
GRECU T, HUNTER C A, GARDINER E J, et al. Validation of a computational cocrystal prediction tool: Comparison of virtual and experimental cocrystal screening results[J]. Crystal Growth & Design, 2014, 14(1): 165-171. |
| [24] |
ROCA-PAIXãO L, CORREIA N T, AFFOUARD F. Affinity prediction computations and mechanosynthesis of carbamazepine based cocrystals[J]. CrystEngComm, 2019, 21(45): 6991-7001. |
| [25] |
MSWAHILI M E, LEE M J, MARTIN G L, et al. Cocrystal prediction using machine learning models and descriptors[J]. Applied Sciences, 2021, 11(3): 1323. |
| [26] |
LEE M J, KIM J Y, KIM P, et al. Novel cocrystals of vonoprazan: Machine learning-assisted discovery[J]. Pharmaceutics, 2022, 14(2): 429. |
| [27] |
WANG D, YANG Z, ZHU B, et al. Machine-learning-guided cocrystal prediction based on large data base[J]. Crystal Growth & Design, 2020, 20(10): 6610-6621. |
| [28] |
ZHENG Z, DENG Y, XIE W, et al. Co-former screening method for multicomponent crystals based on partial least squares regression: A case study of ciprofloxacin[J]. Crystal Growth & Design, 2023, 23(5): 3244-3257. |
| [29] |
ZHANG J, YANG X, HAN Y, et al. Measurement and correlation for solubility of levofloxacin in six solvents at temperatures from 288.15 to 328.15 K[J]. Fluid Phase Equilibria, 2012, 335: 1-7. |
| [30] |
单爱莲, 赵桂元, 钱思源. 左氧氟沙星不良反应的国内外文献个案调查与分析[J]. 中国临床药理学杂志, 2012, 28(3): 212-217. SHAN Ailian, ZHAO Guiyuan, QIAN Siyuan. Investigation and analysis the adverse drug reaction of levofloxacin on domestic and foreign case report[J]. The Chinese Journal of Clinical Pharmacology, 2012, 28(3): 212-217. (in Chinese) |
| [31] |
NUGRAHANI I, SULAIMAN M R, EDA C, et al. Stability and antibiotic potency improvement of levofloxacin by producing new salts with 2, 6- and 3, 5-dihydroxybenzoic acid and their comprehensive structural study[J]. Pharmaceutics, 2022, 15(1): 124. |
| [32] |
NUGRAHANI I, LAKSANA A N, UEKUSA H, et al. New organic salt from levofloxacin-citric acid: What is the impact on the stability and antibiotic potency?[J]. Molecules (Basel, Switzerland), 2022, 27(7): 2166. |
| [33] |
ISLAM N U, UMAR M N, KHAN E, et al. Levofloxacin cocrystal/salt with phthalimide and caffeic acid as promising solid-state approach to improve antimicrobial efficiency[J]. Antibiotics, 2022, 11(6): 797. |
| [34] |
GREENHALGH D J, WILLIAMS A C, TIMMINS P, et al. Solubility parameters as predictors of miscibility in solid dispersions[J]. Journal of Pharmaceutical Sciences, 1999, 88(11): 1182-1190. |
| [35] |
CHAMBERS L I, GROHGANZ H, PALMELUND H, et al. Predictive identification of co-formers in co-amorphous systems[J]. European Journal of Pharmaceutical Sciences, 2021, 157: 105636. |
| [36] |
DENG Y, DENG W, HUANG W, et al. Norfloxacin co-amorphous salt systems: Effects of molecular descriptors on the formation and physical stability of co-amorphous systems[J]. Chemical Engineering Science, 2022, 253: 117549. |
| [37] |
马坤, 高静, 马磊. 药物的共晶与盐[J]. 中国药科大学学报, 2012, 43(5): 475-480. MA Kun, GAO Jing, MA Lei. Pharmaceutical cocrystals and salts[J]. Journal of China Pharmaceutical University, 2012, 43(5): 475-480. (in Chinese) |
| [38] |
LIU L, ZOU D, ZHANG Y, et al. Pharmaceutical salts/cocrystals of enoxacin with dicarboxylic acids: Enhancing in vitro antibacterial activity of enoxacin by improving the solubility and permeability[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2020, 154: 62-73. |
 2024, Vol. 41
2024, Vol. 41





