近年来,为了应对不断攀升的全球能源需求和化石能源过度使用造成的环境污染的双重挑战,寻找一种可持续的清洁能源势在必行[1, 2]。氢能作为一种理想的清洁能源,由于其零碳排放、来源广泛、热值高等优点,正逐步成为全球能源转型发展的重要载体之一[3, 4]。相对于通过化石燃料的燃烧和重整等制氢方式,利用太阳能、风能和核能等清洁能源产生电能进行的电解水制氢具有原料广泛易得、绿色清洁、产品纯度高的优点,将逐步成为未来制氢行业的核心技术[5, 6]。
目前,成本问题是限制电解水制氢行业发展的关键因素。为了降低电解水制氢技术成本,需要进一步提高制氢效率[7]。析氧反应(OER)由于其四步质子耦合电子转移非常缓慢,导致过电位高、效率低,成为了限制电解水效率最具挑战性的问题[8, 9]。因此制备高效低成本且稳定的OER催化剂成为了研究人员的研究重点[10]。
贵金属材料及其复合材料具有电解稳定性好、过电位低等优点,但储量较少、造价昂贵等问题,限制了其在工业上的广泛应用[11]。相对贵金属,部分非贵金属及其化合物具有成本低、抗腐蚀性强、制备简单等优点,受到研究人员的青睐。经过近年来的深入研究,研究人员发现在碱性条件下以镍、钴、铁为主体的过渡金属的合金、氧化物、氢氧化物、硫化物、磷化物均表现出优异的催化性能[12]。Zhu等[13]以硼氢化钠为还原剂一步还原混合镍、铁盐溶液制备得到了无定形镍铁合金Ni2Fe1,在1 mol ·L-1 KOH溶液中10 mA ·cm-2析氧过电位仅为190 mV,Tafel斜率为70 mV ·dec-1。Li等[14]在尖晶石NiCo2O4中构建纳米异质结构和产生氧空位,利用Ni与Co之间的协同作用产生了优异的OER活化中心,在1 mol ·L-1 NaOH溶液中10 mA ·cm-2析氧过电位为270 mV,Tafel斜率为39 mV ·dec-1。Dai等[15]通过溶剂热法成功制备碳纳米管负载的镍铁层状双金属氢氧化物(NiFe LDH/CNT),在1 mol ·L-1 KOH溶液中10 mA ·cm-2析氧过电位为300 mV,Tafel斜率仅为31 mV ·dec-1。Zhou等[16]通过阳离子交换法成功合成了Fe掺杂的Ni(OH)2和Co(OH)2纳米片,在1 mol ·L-1 KOH溶液中10 mA ·cm-2析氧过电位仅为245 mV,Tafel斜率为61 mV ·dec-1。Li等[17]通过电沉积法和碱蚀刻处理合成了含缺陷的D-NiFeAl-LDHs电催化剂,在1 mol ·L-1 KOH溶液中10 mA ·cm-2析氧过电位仅为262 mV,Tafel斜率为41.67 mV ·dec-1;Lu等[18]采用水热法在泡沫镍基底上原位生长NiFe LDH纳米片,均呈现出优异的OER活性,在0.1 mol ·L-1 KOH溶液中10 mA ·cm-2析氧过电位为255 mV,Tafel斜率为50 mV ·dec-1。Chen等[19]利用水热法在不锈钢基底上生长NiS纳米片,利用金属硫化物半导体的特性,使其OER活性得到显著提高,在0.1 mol ·L-1 KOH溶液中10 mA ·cm-2析氧过电位为297 mV,Tafel斜率为47 mV ·dec-1。Wang等[20]在泡沫镍表面合成了NiCo2O4/Ni2P核壳纳米锥阵列,利用“核”和“壳”之间的协同作用显著提升了催化性能,在1 mol ·L-1 KOH溶液中10 mA ·cm-2析氧过电位仅为250 mV,Tafel斜率为58 mV ·dec-1。在众多催化剂研究中,镍铁基催化剂凭借其优异的OER催化性能和稳定性得到了研究人员的青睐,其优异的催化性能主要归因于镍与铁的协同作用[21, 22]。目前非贵金属催化剂制备需要长时间的水热与高压反应,存在制备时间过长、制备方法繁琐的劣势,限制了其在工业上的应用。而纳米催化剂粉末需要黏结剂与基体相连,在工业碱性电解水生产中难以保证其稳定性。因此寻找一种工业化生产过渡金属OER催化剂的理想方式仍是亟待解决的难题[23]。
本研究采用一种条件温和、工艺简单的方法制备出兼具高活性与高稳定性的过渡金属OER催化剂。以电沉积的方式在商用镍网上制备出镍铁合金析氧电催化剂,避免了黏结剂使用导致稳定性低的问题。通过调控镀层质量、镀液浓度、退火温度等手段改变电极催化剂的镀层形貌、催化性能、稳定性,制备出了多级多孔枝晶状结构镀层,具有较大电化学活性面积、优异的OER催化活性和较快的催化反应动力学。
1 实验部分 1.1 实验材料六水合氯化镍(NiCl2 ·6H2O)为分析纯,购自北京百灵威科技有限公司; 四水合氯化亚铁(FeCl2 ·4H2O)为分析纯,购自上海源叶生物科技有限公司; 氯化铵(NH4Cl)、浓硫酸(H2SO4)、氢氧化钾(KOH)、无水乙醇(C2H6O)均为分析纯,购自天津市科密欧化学试剂有限公司; 异丙醇(C3H8O)为分析纯,购自上海麦克林生化科技有限公司; 200目镍网(N6)购自康威金属丝网制品有限公司;高纯镍片(厚度0.3 mm)购自盛世达金属材料有限公司; 杜邦Nafion溶液(D520, 5%)、河森铱黑(Ir) 购自上海河森电气有限公司; 去离子水(≥3 MΩ ·cm) 购自天津市永清源蒸馏水经营部。
1.2 样品制备采用电沉积法进行镍铁合金电极制备。制备方法为:将镍网(1 cm×1 cm)依次浸入1 mol ·L-1硫酸、无水乙醇、去离子水中进行超声清洗15 min后备用。按镍铁质量比为3 ∶1,将0.444 4 g NiCl2 ·6H2O(0.037 5 mol ·L-1)、0.124 3 g FeCl2 ·4H2O(0.012 5 mol ·L-1)、5.35 g NH4Cl溶解于50 mL去离子水中,得到电镀液。以清洗后的镍网作为阴极,以高纯镍片(3 cm×3 cm)作为阳极,在200 mA ·cm-2电流密度下室温电沉积30 min,得到沉积量为40 mg ·cm-2的镍铁合金电极,将制备好的电极用去离子水冲洗干净,在60 ℃烘箱中真空干燥。类似地,在镍铁质量比恒为3 ∶1但不同镍和铁离子浓度的镀液中制备了不同电沉积量的镍铁合金电极。根据合金电极制备过程中电镀液金属离子浓度和镀层沉积量不同,将电极命名为NiFe-c-m,其中,c表示金属离子Ni2+浓度,m表示镀层沉积量。如NiFe-0.0375-40表明电镀液中Ni2+浓度为0.037 5 mol ·L-1,镀层沉积量为40 mg ·cm-2的镍铁合金电极。
用退火法对电极NiFe-0.0375-40进行了进一步处理。将电极材料放入管式炉(OTF-1200X)中,置于H2/Ar混合气(H2体积分数为5%)氛围中,在500 ℃下进行30 min退火处理,待电极冷却到室温后将电极取出,将电极命名为NiFe-0.0375-40-500。
将商用Ir催化剂负载在镍网上作为对比。取5.00 mg铱黑,加入400 μL去离子水、600 μL异丙醇、15 μL杜邦Nafion溶液(D520, 5%)配置为催化剂墨水,超声分散1 h使催化剂分散均匀,将其均匀喷涂在清洁镍网表面,通过分析天平称量镍网质量以控制喷涂时间,得到实际Ir负载量约为0.5 mg ·cm-2的Ir/Ni电极。
1.3 样品物理表征采用X射线衍射仪(XRD,D8 Focus,Bruker)表征了电催化剂的晶体结构和结晶度。采用场发射扫描电子显微镜(SEM,S-4800)对样品的表面形貌进行表征,并使用X射线能谱分析仪(EDS,EDAX,AMETEK)进行样品的元素分析。利用X射线光电子能谱(XPS,Thermo Fisher Scientific 250Xi)对样品进行表面化学分析。
1.4 电化学性能测试电极电化学性能采用电化学工作站(CHI760)连接的传统三电极体系进行表征。将测试电极作为工作电极,Pt片(3 cm×3 cm)为对电极,饱和甘汞电极(SCE)为参比电极,在1.00 mol ·L-1 KOH溶液中进行了测试。本研究所报道的电位均为相对于可逆氢电极(RHE)的电位,转化公式为:ERHE=ESCE+0.2412+0.059 pH。对电极进行10圈循环伏安(CV)活化,扫描速率为100 mV ·s-1,电位区间为1.0~2.0 V。活化过程结束后,扫描速率5 mV ·s-1,在1.2~1.8 V电位区间内使用线性扫描伏安法(LSV)研究电极的OER催化活性,并计算相应的Tafel斜率。本研究所有LSV曲线均采用85% IR补偿法进行校正。电化学阻抗谱(EIS)在100 kHz~0.1 Hz频率下进行测试,偏置电位为1.50 V,振幅为10 mV。电化学活性面积(ECSA)通过循环伏安法进行测试,并计算出相应的双电层电容(Cdl)。在80 ℃、30% KOH、500 mA ·cm-2恒定电流密度的工业电解水条件下进行电极材料稳定性测试,利用电压表实时记录工作电极电位随时间的变化。
2 结果与讨论为了确定催化剂的晶体结构,本研究对其XRD谱图(图 1)进行了分析。空白镍网在44.5°、51.9°和76.0°的3个强衍射峰分别代表了面心立方晶体Ni的(111)、(200)和(220)晶面。经过电沉积的电极与空白镍网具有相似的衍射峰,表明了催化剂镀层中含有Ni元素。同时,催化剂的衍射峰略微左移,可能是由于Fe元素的加入[24]。经过退火处理的电极并未观察到新的衍射峰,仅衍射峰强度增大,表明了退火处理使镀层表面结晶度增加,但并未发生明显结构变化。
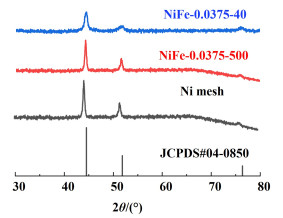
|
| 图 1 各电极的XRD谱图 Fig.1 XRD patterns of each electrodes |
| |
空白镍网[图 2(a)]具有表面光滑、结构稳定、耐腐蚀性强的特点,因此选用其作为电沉积的基体。在电沉积过程中,阴极基体上发生Ni2+和Fe2+的还原反应,使电镀液中的过渡金属离子沉积到镍网表面。
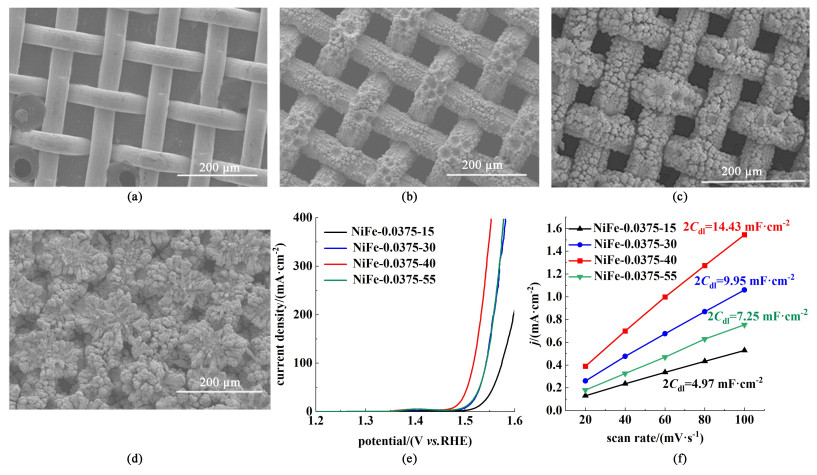
|
| 图 2 (a) 空白镍网; (b) NiFe-0.0375-30; (c) NiFe-0.0375-40; (d) NiFe-0.0375-55的扫描电镜图;(e) 不同沉积量电极的极化曲线;(f)双电层电容曲线 Fig.2 SEM of (a) blank nickel mesh; (b) NiFe-0.0375-30; (c) NiFe-0.0375-40 and (d) NiFe-0.0375-55; (e) polarisation curves of electrodes with different deposition qualities; (f) Cdl of different electrodes |
| |
电催化剂沉积量是影响电极表面形貌和催化活性的重要因素。电极表面形貌随沉积量不断变化,如图 2(a)~图 2(d)所示,基体表面先沉积形成小颗粒状形貌,在此基础上继续生长,逐步形成更丰富的疏松多孔的多级颗粒状形貌。基体表面镍铁沉积量较少时,如图 2(b)所示,仅部分区域出现多孔形貌,大部分区域并未形成。基体表面沉积量过大时,如图 2(d)所示,镀层过厚,导致气孔被堵塞,部分多孔形貌消失。
由极化曲线[图 2(e)]可知,电极性能随沉积量呈现先增加后减少的趋势,沉积量为40 mg ·cm-2得到的镍铁合金电极的性能最优。由电极双电层电容曲线[图 2(f)]可知,双电层电容Cdl同样呈现先增加后减少的趋势。由于电极的双电层电容Cdl与电极的电化学活性面积(ECSA)呈正相关[25],因此可以通过比较电极的双电层电容来近似比较电极的电化学活性面积。综上所述,在沉积量为40 mg ·cm-2的条件下,制备的镍铁合金电极具有丰富的沉积层形貌和较大的电化学活性面积,从而具备优秀的催化活性。因此,最佳镍铁合金电极沉积量为40 mg ·cm-2。
电沉积制备镍铁合金电极过程中,金属离子浓度对电极的表面形貌、电化学活性面积、催化活性有重要影响。在不同金属浓度的电解液中进行电沉积,得到如图 3(a)~图 3(c)所示的电极表面结构。在恒定电流密度下,当电解液中金属离子浓度足够高,基体表面的浓度与电解液主体浓度基本一致,基体表面几乎同时进行电沉积,因此电极表面形貌基本呈平整无孔状,如图 3(a)所示。当镀液中金属离子浓度很低时,电沉积过程中在基体表面和电解液主体之间逐渐形成浓度梯度。当基体表面附近的金属离子消耗殆尽,浓度接近0,金属离子会在已发生电沉积的位置优先沉积,生长成多孔枝晶状的镀层,镀层结构如图 3(c)所示。实验结果表明,随镀液浓度降低,电极表面颗粒变小,多孔枝晶形貌更为显著。
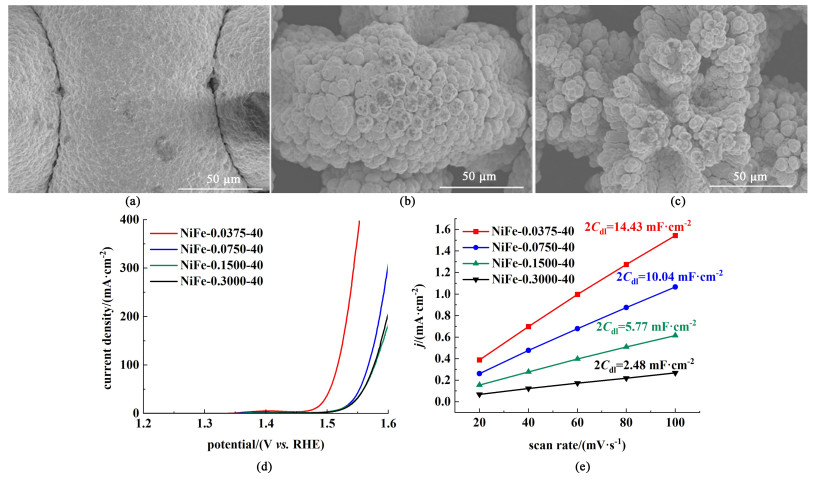
|
| 图 3 (a) NiFe-0.3000-40;(b) NiFe-0.1500-40;(c) NiFe-0.0375-40的扫描电镜图;(d) 不同镀液金属离子浓度制得电极的极化曲线;(e) 双电层电容曲线 Fig.3 SEM of (a) NiFe-0.3000-40; (b) NiFe-0.1500-40; (c) NiFe-0.0375-40; (d) polarisation curves of electrodes with different concentration of metal ions in plating solution; (e) Cdl of different electrodes |
| |
由极化曲线[图 3(d)]可知,电极性能与电解液浓度呈现明显的负相关趋势,在0.037 5 mol ·L-1 NiCl2、0.012 5 mol ·L-1 FeCl2电沉积条件下得到的多孔镍铁电极的性能是最优的。电极双电层电容曲线[图 3(e)]表明,Cdl呈现与电镀液金属离子浓度负相关的趋势。由此得知,降低电镀液中的金属离子浓度,可以使多孔镍铁电极具有更丰富的沉积层结构,更大的电化学活性面积,从而具备更优秀的催化活性。
实验中尝试过将电镀液浓度进一步降低,但由于金属离子的降低会导致电沉积速率下降,从而导致整个电沉积过程时间增长,加大了电沉积过程的电能消耗。此外,金属浓度过低时,电沉积得到的电极材料在催化性能和电化学活性面积增加的同时镀层强度和稳定性较差,难以作为电极材料进行电解水OER反应。综合考虑后,使用0.037 5 mol ·L-1 NiCl2,0.012 5 mol ·L-1 FeCl2作为最适宜的电镀液条件。
电沉积过程中,镀液中的Ni2+和Fe2+不断沉积在基体表面,形成了多级多孔的枝晶状阵列形貌[图 4(a)~图 4(c)]。该种形貌为OER过程中氧气气泡的脱附提供了传递通道,有利于气泡的快速脱除,提高了OER反应的整体效率[26]。此外,枝晶阵列直接与镍网基体相连,为电化学反应过程中的电子传递提供了通路。电极丰富的结构还有效提升了电极比表面积,为OER反应提供了更多的活性位点,从而有效提升了催化活性。EDS mapping表明Ni与Fe元素在电极表面分布均匀[图 4(d)~图 4(f)]。

|
| 图 4 (a)~(c) 不同放大倍数的NiFe-0.0375-40扫描电镜图;(d)~(f) Ni、Fe的元素映射图 Fig.4 (a)—(c) SEM of NiFe-0.0375-40 at different magnifications; (d)—(f) Elemental mapping of Ni, Fe |
| |
利用XPS对电催化剂的详细化学成分与氧化态进行了分析。镍铁合金电极的XPS测量光谱表明了电极中存在Ni与Fe元素,该结果与EDS分析结果一致。Ni 2p光谱[图 5(a)]在852.5和869.7 eV处的解卷积峰对应于Ni0[27],在855.0和873.0 eV处的解卷积峰分别对应Ni2+的2p3/2和2p1/2[28],而860.8和879.7 eV的解卷积峰则对应于它们各自的卫星峰(表示为Sat.),表明了NiO和Ni(OH)2的存在[26]。此外,与Ni单质相比,Ni 2p的XPS峰向较低的结合能移动,表明在NiFe合金中与Fe元素具有较强的电子相互作用[29]。在Fe 2p光谱[图 5(b)]中,解卷积峰分别分布在707.4、711.2和712.5 eV,对应于Fe0、Fe2+和Fe3+[30]。
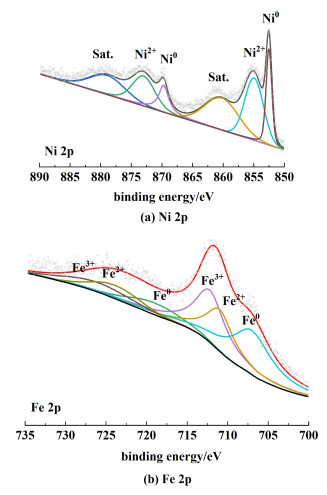
|
| 图 5 高分辨NiFe合金(a) Ni 2p和(b) Fe 2p的XPS谱图 Fig.5 XPS spectra of high-resolution NiFe alloys (a) Ni 2p and (b) Fe 2p |
| |
由图 6(a)可知,通过电沉积制备的NiFe-0.0375-40具有最优的催化活性,其起始电位仅为1.45 V,并且在10 mA ·cm-2的电流密度下析氧过电位仅为250 mV,明显优于Ir/Ni电极所需的293 mV,远优于未掺入Fe元素的多孔镍电极以及空白镍网。此外,由图 6(b)可知,NiFe-0.0375-40的Tafel斜率仅为35.8 mV ·dec-1,远低于图 6(b)中其他电极,说明其具有较快的析氧反应动力学。
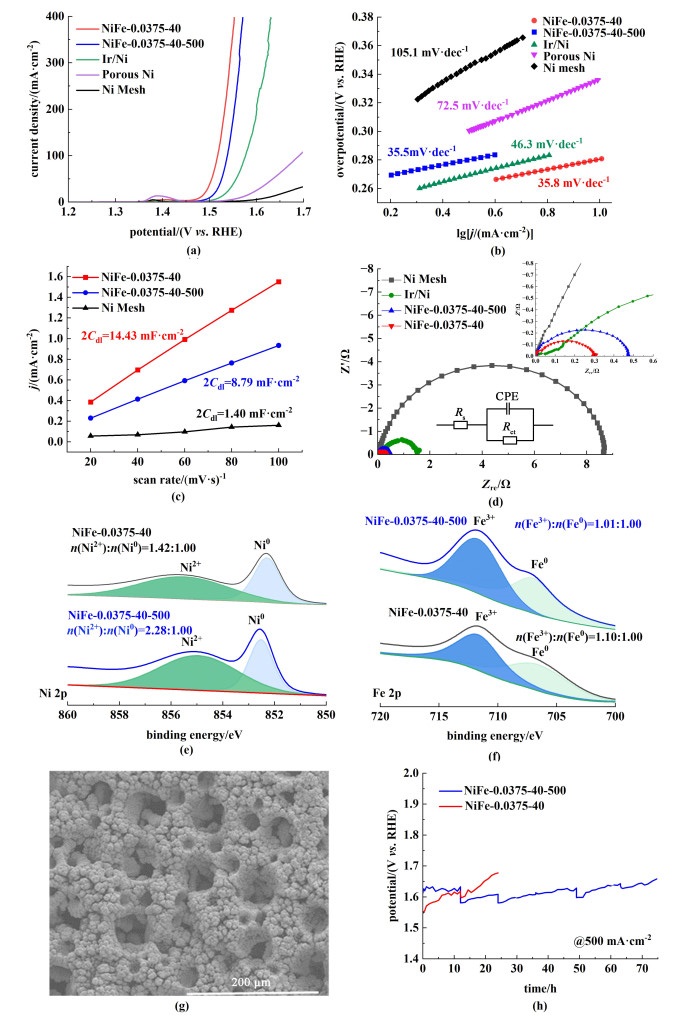
|
| 图 6 不同电极的(a) 极化曲线;(b) Tafel曲线;(c) 双电层电容曲线;(d) Nyquist曲线;(e) 退火前后镍铁合金电极的Ni 2p;(f) 退火前后镍铁合金电极的Fe 2p的XPS谱图;(g) NiFe-0.0375-40-500扫描电镜图;(h) 80 ℃,30%KOH溶液中退火前后电极的计时电位曲线 Fig.6 (a) Polarisation curves; (b) Tafel curves; (c) Bilayer capacitance curves; (d) Nyquist curves of different electrodes; (e) XPS spectra of Ni 2p; (f) Fe 2p of NiFe electrodes before and after annealing; (g) SEM image of NiFe-0.0375-40-500; (h) Chronopotential curves of the electrode before and after annealing in 30% KOH solution at 80 ℃ |
| |
相较于空白镍网的光滑表面,经过电沉积的电极具有丰富的多级多孔结构,有效提高了电极的比表面积。利用循环伏安法测得了电极的双电层电容(Cdl),结果如图 6(c)所示。经过电沉积,电极NiFe-0.0375-40的电化学活性面积增加到空白镍网的10倍,从而有效提升了电极催化性能。
由电化学阻抗谱测得的Nyquist图[如图 6(d)] 可知,各电极的Nyquist曲线在高频区均呈明显的半圆,对应电荷转移电阻(Rct)。Rct值与电极的界面电荷转移过程有关,是评价OER电催化活性的关键因素[31]。结果表明,NiFe-0.0375-40(0.32 Ω) 的Rct值远小于Ir/Ni电极(1.51 Ω)以及空白镍网(8.63 Ω),说明镍铁合金电极拥有最快的催化反应动力学[32]。
为了在保留电极多级多孔形貌和催化活性的基础上提升电极长期稳定性,本研究在500 ℃下对电极进行了退火处理,得到了电极NiFe-0.0375-40-500,电极表面形貌如图 6(g)所示,多级多孔形貌依然存在。由图 6(e)可知,退火后Ni2+与Ni0的解卷积峰峰面积之比从1.42 ∶1.00上升到2.28 ∶1.00,由于Ni2+容易被氧化为NiOOH,而NiOOH可以作为OER的活性位点,因此理论上Ni2+增加更有利于提升OER反应中析氧的催化活性[33, 34]。由图 6(f)可知,退火后Fe3+与Fe0的解卷积峰面积之比从1.10 ∶1.00变为1.01 ∶1.00,Fe3+和Fe0比例基本不变。但退火后电化学活性面积有所下降,为退火前的60%,导致电极催化活性下降。综合而言,NiFe-0.0375-40-500虽然催化性能略微衰减,但仍优于Ir/Ni电极。由图 6(d)可知,NiFe-0.0375-40-500(0.47 Ω)的Rct值远小于Ir/Ni电极(1.51 Ω)以及空白镍网(8.63 Ω), 同时其Tafel斜率仅为35.5 mV ·dec-1,与退火前相近,仍具有较快的析氧反应动力学。
在80 ℃、30% KOH溶液、500 mA ·cm-2的工业电解水条件下对电极进行稳定性测试,结果如图 6(h)所示。未经过退火的NiFe-0.0375-40电极在高温强碱性条件下稳定性较差,电极电位在24 h内就由1.55上升到1.68 V,性能出现显著衰减,因而未进行后续测试。经过退火后的NiFe-0.0375-40-500电极电位稳定在1.6 V左右,运行75 h后,电极电位上升至1.65 V,衰减速率仅为0.6 mV ·h-1,表明退火处理有效提升了电极在高温强碱下的稳定性,为工业电解水的应用提供了可能。
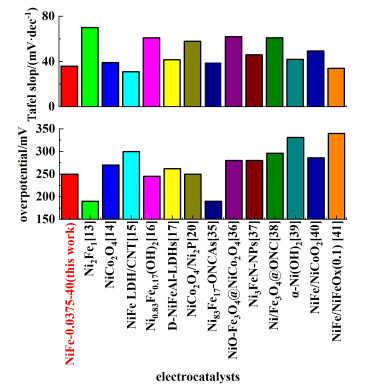
本研究将NiFe-0.0375-40与其他文献报道的过渡金属基OER催化剂性能进行了对比,如图 7所示。NiFe-0.0375-40在10 mA ·cm-2电流密度下过电位较低,同时具有较低的Tafel斜率,在众多过渡金属基OER催化剂[13-17, 20, 35-41]中表现突出。
采用一种条件温和、工艺简单的电沉积方法制备出兼具高活性与高稳定性的过渡金属OER电催化剂。该电极具有丰富的镀层结构和较大的电化学活性面积,催化活性超过了商用Ir催化剂和许多报道过的过渡金属OER催化剂。降低镀液金属离子浓度的方法有效改变了电极的镀层形貌,提升了电极的OER催化活性。经过退火处理的电极在工业电解水条件下水电解稳定运行75 h并未出现显著衰减,表现出良好的稳定性。该电极的成功制备为改变电极表面镀层形貌、提高电极催化活性提供了新的思路,为工业碱性电解水制氢用电极提供了一种新的选择。
| [1] |
BURTON N A, PADILLA R V, ROSE A, et al. Increasing the efficiency of hydrogen production from solar powered water electrolysis[J]. Renewable and Sustainable Energy Reviews, 2021. DOI:10.1016/j.rser.2020.110255 |
| [2] |
CHEN Z, YUN S, WU L, et al. Waste-derived catalysts for water electrolysis: Circular economy-driven sustainable green hydrogen energy[J]. Nano-Micro Letters, 2022. DOI:10.1007/s40820-022-00974-7 |
| [3] |
DUNN S. Hydrogen futures: Toward a sustainable energy system[J]. International Journal of Hydrogen Energy, 2002, 27(3): 235-264. DOI:10.1016/S0360-3199(01)00131-8 |
| [4] |
HUANG J H, XIE Y, YAN L, et al. Decoupled amphoteric water electrolysis and its integration with Mn-Zn battery for flexible utilization of renewables[J]. Energy & Environmental Science, 2021, 14(2): 883-889. |
| [5] |
KHATIB F N, WILBERFORCE T, IJAODOLA O, et al. Material degradation of components in polymer electrolyte membrane (PEM) electrolytic cell and mitigation mechanisms: A review[J]. Renewable and Sustainable Energy Reviews, 2019, 111: 1-14. DOI:10.1016/j.rser.2019.05.007 |
| [6] |
廖龙飞, 李明雨, 尹永利, 等. 碱性水电解制氢催化剂研究进展[J]. 工业催化, 2023, 31(2): 7-17. LIAO Longfei, LI Mingyu, YIN Yongli, et al. Research progress on catalysts of alkaline water electrolysis for hydrogen production[J]. Industrial Catalysis, 2023, 31(2): 7-17. (in Chinese) |
| [7] |
林逍. 钴基电解水析氧催化剂的制备、表征及性能研究[D]. 上海: 中国科学院大学(中国科学院上海应用物理研究所), 2019 LIN Xiao. Preparation, characterization and properties of cobalt-based catalysts for hydrogen production from electrolytic water[D]. Shanghai: Shanghai Institute of Applied Physics, Chinese Academy of Sciences, 2019 (in Chinese) |
| [8] |
LI C, ZHAO J, XIE L, et al. Surface-adsorbed carboxylate ligands on layered double hydroxides/metal-organic frameworks promote the electrocatalytic oxygen evolution reaction[J]. Angewandte Chemie International Edition, 2021, 60(33): 18129-18137. DOI:10.1002/anie.202104148 |
| [9] |
GONG M, DAI H. A mini review of NiFe-based materials as highly active oxygen evolution reaction electrocatalysts[J]. Nano Research, 2015, 8(1): 23-39. DOI:10.1007/s12274-014-0591-z |
| [10] |
CHEN G, MA T, LIU Z, et al. Efficient and stable bifunctional electrocatalysts Ni/NixMy (M=P, S) for overall water splitting[J]. Advanced Functional Materials, 2016, 26(19): 3314-3323. DOI:10.1002/adfm.201505626 |
| [11] |
QIAN Q, LI Y, LIU Y, et al. Ambient fast synthesis and active sites deciphering of hierarchical foam-like trimetal-organic framework nanostructures as a platform for highly efficient oxygen evolution electrocatalysis[J]. Advanced Materials, 2019. DOI:10.1002/adma.201901139 |
| [12] |
MCCRORY C C L, JUNG S, PETERS J C, et al. Benchmarking heterogeneous electrocatalysts for the oxygen evolution reaction[J]. Journal of the American Chemical Society, 2013, 135(45): 16977-16987. DOI:10.1021/ja407115p |
| [13] |
FU S, SONG J, ZHU C, et al. Ultrafine and highly disordered Ni2Fe1 nanofoams enabled highly efficient oxygen evolution reaction in alkaline electrolyte[J]. Nano Energy, 2018, 44: 319-326. DOI:10.1016/j.nanoen.2017.12.010 |
| [14] |
LI J, CHU D, DONG H, et al. Boosted oxygen evolution reactivity by igniting double exchange interaction in spinel oxides[J]. Journal of the American Chemical Society, 2020, 142(1): 50-54. DOI:10.1021/jacs.9b10882 |
| [15] |
GONG M, LI Y, WANG H, et al. An advanced Ni-Fe layered double hydroxide electrocatalyst for water oxidation[J]. Journal of the American Chemical Society, 2013, 135(23): 8452-8455. DOI:10.1021/ja4027715 |
| [16] |
ZHOU Q, CHEN Y, ZHAO G, et al. Active-site-enriched iron-doped nickel/cobalt hydroxide nanosheets for enhanced oxygen evolution reaction[J]. ACS Catalysis, 2018, 8(6): 5382-5390. DOI:10.1021/acscatal.8b01332 |
| [17] |
LI H, ZHANG L, WANG S, et al. Accelerated oxygen evolution kinetics on NiFeAl-layered double hydroxide electrocatalysts with defect sites prepared by electrodeposition[J]. International Journal of Hydrogen Energy, 2019, 44(54): 28556-28565. DOI:10.1016/j.ijhydene.2019.09.155 |
| [18] |
LU Z, XU W, ZHU W, et al. Three-dimensional NiFe layered double hydroxide film for high-efficiency oxygen evolution reaction[J]. Chemical Communications, 2014, 50(49): 6479-6482. DOI:10.1039/C4CC01625D |
| [19] |
CHEN J, REN J, SHALOM M, et al. Stainless steel mesh-supported NiS nanosheet array as highly efficient catalyst for oxygen evolution reaction[J]. ACS Applied Materials & Interfaces, 2016, 8(8): 5509-5516. |
| [20] |
WANG L, GU C, GE X, et al. Anchoring Ni2P sheets on NiCo2O4 nanocone arrays as optimized bifunctional electrocatalyst for water splitting[J]. Advanced Materials Interfaces, 2017. DOI:10.1002/admi.201700481 |
| [21] |
KANG Q, LAI D, TANG W, et al. Intrinsic activity modulation and structural design of NiFe alloy catalysts for an efficient oxygen evolution reaction[J]. Chemical Science, 2021, 12(11): 3818-3835. DOI:10.1039/D0SC06716D |
| [22] |
ZHAO J, ZHANG J, LI Z, et al. Recent progress on NiFe-based electrocatalysts for the oxygen evolution reaction[J]. Small, 2020. DOI:10.1002/smll.202003916 |
| [23] |
葛升, 闵洛夫, 费洪达, 等. 一步电沉积制备高活性高稳定镍铁合金析氧电催化剂[J]. 化学工业与工程, 2022, 39(2): 41-49. GE Sheng, MIN Luofu, FEI Hongda, et al. Highly efficient and durable Ni-Fe alloy catalyst towards OER via one-step electrodeposition[J]. Chemical Industry and Engineering, 2022, 39(2): 41-49. (in Chinese) |
| [24] |
LI D, KOIKE M, WANG L, et al. Regenerability of hydrotalcite-derived nickel-iron alloy nanoparticles for syngas production from biomass tar[J]. ChemSusChem, 2014, 7(2): 510-522. DOI:10.1002/cssc.201300855 |
| [25] |
FAN K, CHEN H, JI Y, et al. Nickel-vanadium monolayer double hydroxide for efficient electrochemical water oxidation[J]. Nature Communications, 2016. DOI:10.1038/ncomms11981 |
| [26] |
LIM D, OH E, LIM C, et al. Bimetallic NiFe alloys as highly efficient electrocatalysts for the oxygen evolution reaction[J]. Catalysis Today, 2020, 352: 27-33. DOI:10.1016/j.cattod.2019.09.046 |
| [27] |
ZHANG X, XU H, LI X, et al. Facile synthesis of nickel-iron/nanocarbon hybrids as advanced electrocatalysts for efficient water splitting[J]. ACS Catalysis, 2016, 6(2): 580-588. DOI:10.1021/acscatal.5b02291 |
| [28] |
BI S, GENG Z, WANG Y, et al. Multi-stage porous nickel-iron oxide electrode for high current alkaline water electrolysis[J]. Advanced Functional Materials, 2023. DOI:10.1002/adfm.202214792 |
| [29] |
SIVANANTHAM A, SHANMUGAM S. Graphitic carbon-NiCo nanostructures as efficient non-precious-metal electrocatalysts for the oxygen reduction reaction[J]. ChemElectroChem, 2018, 5(14): 1937-1943. DOI:10.1002/celc.201800081 |
| [30] |
GE Z, WANG F, GUO J, et al. Low-cost and multi-level structured NiFeMn alloy@NiFeMn oxyhydroxide electrocatalysts for highly efficient overall water splitting[J]. Inorganic Chemistry Frontiers, 2021, 8(11): 2713-2724. DOI:10.1039/D1QI00215E |
| [31] |
ZHOU T, LIU Z, YANG B, et al. Dealloying fabrication of hierarchical porous nickel-iron foams for efficient oxygen evolution reaction[J]. Frontiers in Chemistry, 2022. DOI:10.3389/fchem.2022.1047398 |
| [32] |
SONG S, FU Y, YIN F, et al. NiFe-based tungstate@layered double hydroxide heterostructure supported on graphene as efficient oxygen evolution reaction catalyst[J]. Materials Today Chemistry, 2023. DOI:10.1016/j.mtchem.2022.101369 |
| [33] |
LIM D, KONG H, KIM N, et al. Oxygen-deficient NiFe2O4 spinel nanoparticles as an enhanced electrocatalyst for the oxygen evolution reaction[J]. ChemNanoMat, 2019, 5(10): 1296-1302. DOI:10.1002/cnma.201900231 |
| [34] |
WU L, NING M, XING X, et al. Boosting oxygen evolution reaction of (Fe, Ni)OOH via defect engineering for anion exchange membrane water electrolysis under industrial conditions[J]. Advanced Materials, 2023. DOI:10.1002/adma.202306097 |
| [35] |
LIU P, CHEN B, LIANG C, et al. Tip-enhanced electric field: A new mechanism promoting mass transfer in oxygen evolution reactions[J]. Advanced Materials, 2021. DOI:10.1002/adma.202007377 |
| [36] |
YAN G, LI G, TAN H, et al. Spinel-type ternary multimetal hybrid oxides with porous hierarchical structure grown on Ni foam as large-current-density water oxidation electrocatalyst[J]. Journal of Alloys and Compounds, 2020. DOI:10.1016/j.jallcom.2020.155662 |
| [37] |
JIA X, ZHAO Y, CHEN G, et al. Water splitting: Ni3FeN nanoparticles derived from ultrathin NiFe-layered double hydroxide nanosheets: An efficient overall water splitting electrocatalyst[J]. Advanced Energy Materials, 2016. DOI:10.1002/aenm.201502585 |
| [38] |
LIU G, YAO R, ZHAO Y, et al. Encapsulation of Ni/Fe3O4 heterostructures inside onion-like N-doped carbon nanorods enables synergistic electrocatalysis for water oxidation[J]. Nanoscale, 2018, 10(8): 3997-4003. DOI:10.1039/C7NR09446A |
| [39] |
GAO M, SHENG W, ZHUANG Z, et al. Efficient water oxidation using nanostructured α-nickel-hydroxide as an electrocatalyst[J]. Journal of the American Chemical Society, 2014, 136(19): 7077-7084. DOI:10.1021/ja502128j |
| [40] |
SHI R, WANG J, WANG Z, et al. Unique NiFe NiCoO2 hollow polyhedron as bifunctional electrocatalysts for water splitting[J]. Journal of Energy Chemistry, 2019, 33: 74-80. DOI:10.1016/j.jechem.2018.08.016 |
| [41] |
ZHU K, LI M, LI X, et al. Enhancement of oxygen evolution performance through synergetic action between NiFe metal core and NiFeOx shell[J]. Chemical Communications, 2016, 52(79): 11803-11806. DOI:10.1039/C6CC04951F |
 2024, Vol. 41
2024, Vol. 41