2. 宁波工程学院新能源学院, 浙江 宁波 315336
2. School of New Energy, Ningbo University of Technology, Zhejiang, Ningbo 315336, China
随着世界新能源需求的不断增长与环境污染问题日益突显,全球市场对可持续、高能效和环境友好的新型清洁能源体系的需求日益迫切[1]。建立以可再生能源为代表的新能源结构体系取代化石能源供应系统已成为全球性共识。氢气(H2)凭借其高能量密度和热效率受到广泛关注。它具备可持续生产、无生物毒性、地壳元素含量丰富以及应用场景广泛等优势,被视为理想的能源载体。发展可再生能源驱动的电解制氢技术,是实现传统产业深度脱碳并实现能源结构转型的关键途径[2]。然而,目前被广泛关注的传统水电解制氢技术路线仍面临诸多挑战:其中尤为关键的是由高电解能耗导致的绿氢制取成本问题,制约了其大规模技术推广。而相比能耗高(>4.5 kWh ·Nm-3)、反应动力学迟缓、技术经济性相对较低的传统电解水制氢技术路径,小分子电催化氧化绿色合成高附加值化学品偶联制氢技术路径正得到越来越多的关注[3]。
这一新兴的高效绿色氢能生产技术具有其独特优势[4]:首先,用于替代传统析氧反应的小分子电催化氧化反应具有更低的理论平衡电位(< 1.23 V vs. SHE)和理想的反应动力学优势,因此能够实现反应能耗的显著下降(< 3 kWh ·Nm-3)和产氢效率的有效提升;其次,由于阳极反应过程中摒除了析氧反应,避免了由氧气渗透至产氢侧而导致的潜在安全风险;最后,相比只能将阳极氧气产物直接排空的电解水制氢过程,小分子电催化氧化反应路线在阳极侧能够实现高值化学品电化学绿色合成,从而有效平抑制氢成本。近期成会明团队[5]将抗坏血酸小分子电催化氧化反应与电解制氢过程有效结合,在铁单原子催化剂2.5%Fe@KJ(一种炭黑Ketjen black, KJ)作用下,抗坏血酸的高活性烯醇结构仅需1.1 V的电压即能实现2 A ·cm-2的工业级电流密度,且能耗仅为传统电解制氢方法的一半(2.63 kWh ·Nm-3)。谢毅团队[6]则基于甘油电催化氧化联产制氢反应体系,开发了一种双功能三元NiVRu-层状双氢氧化物纳米阵列催化剂。在1 A ·cm-2的工业电流密度条件下,产物甲酸和氢气的法拉第效率分别可达80%和96%。这为大规模H2和HCOOH生产及高效电催化剂设计提供了新见解。段昊泓团队[7]以CoOOH作为阳极催化活性位点,通过电催化氧化葡萄糖分子成功制备甲酸盐并联产制氢,与传统的纯水制氢路径相比起活电位降低了接近200 mV(以Ag/AgCl为参比电极)。总之,在氢能领域,低反应能耗的高值化学品电催化合成偶联制氢路线已成为了广受关注的前沿研究热点,为绿色氢能的市场化推广提供了切实可行的技术方案。而高稳定性、高能效阳极电催化材料,是上述新型技术路线得以有效实现的核心关键。
本综述重点聚焦于目前广受关注的醇类小分子[包括一元醇(甲醇、乙醇)和多元醇(乙二醇、丙三醇)]电催化氧化制高附加值化学品偶联制氢反应,概述了醇类小分子电催化氧化反应机制,系统性地归纳总结了适用于醇类小分子电解制氢体系的高性能阳极催化材料体系设计策略,探讨了醇类小分子电催化氧化反应中尚存的挑战并展望了该领域未来的可能发展方向。
1 阳极催化剂设计 1.1 醇类小分子电催化氧化反应机制醇类小分子氧化反应(Alcohol oxidation reaction, AOR)的理论电位与OER(Oxygen evolution reaction, OER)所需的1.23 V相比要小得多,但通常AOR涉及多个电子的转移,且固有的动力学较为缓慢,演变路径也较为复杂。因此,为了降低过电位,提高产物选择性并加快反应速率,为小分子氧化反应设计高效催化剂是非常重要的。从本质来说,全面研究AOR反应机理是设计出高性能催化剂的关键。近年来,特别是在非贵金属催化材料与醇类小分子作用的反应机理方面,已经取得了一些实质性的进展。有关研究人员提出了多种反应机理,包括亲核氧化反应机理(Nucleophile oxidation reaction, NOR)、表面吸附机理(Surface adsorption mechanism, SAM)和晶格氧参与机理(Lattice oxygen participation mechanism, LOM)[8]。
醇类小分子氧化过程中涉及到亲核基团羟基这一官能团的参与,因此醇氧化反应AORs包含亲核氧化反应。从本质上讲,NOR是一种脱氢反应,使亲核试剂失去质子和电子,此种NOR反应机制在Ni基AOR中研究较为广泛。在镍基催化剂对乙醇的氧化(Ethanol oxidation reaction, EOR)实验中,Wang等[9]提出了一种经典的两步反应机制。以β-Ni(OH)2为例,在一系列原位测试技术中发现,促进NOR反应的催化活性相为β-Ni(OH)O。β-Ni(OH)2的NOR过程为电诱导催化剂脱氢和同时发生的NOR脱氢。如图 1(a)所示,一边是带有羟基的醇类分子(亲核)脱氢发生氧化反应,这是一个自发的反应,当外加电位为1.35~1.45 V,此时羟基上脱去的氢原子与催化位点结合,填补β-Ni(OH)O的空缺,即发生反应β-Ni(OH)O + HNu+ + eNu- = β-Ni(OH)2;而β-Ni(OH)O的形成是外加电位增大到1.5 V时,由催化剂β-Ni(OH)2脱氢得到,此时发生变化β-Ni(OH)2 + OH- = β-Ni(OH)O + H2O+e-。
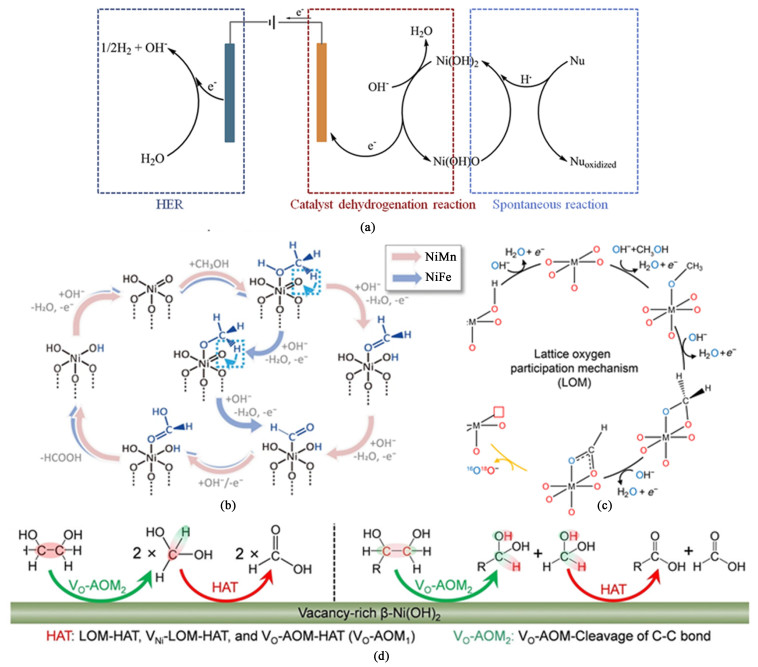
|
| 图 1 (a) β-Ni(OH)2的NOR机理示意图[9];(b) MOR中双功能SAM示意图[10];(c) LOM示意图[11];(d) 在VR-β-Ni(OH)2表面VDOR路径示意图(HAT表示氢原子传输(Hydrogen atom transfer),VDOR表示邻二醇氧化反应(Vicinal diol oxidation reaction),VR-β-Ni(OH)2表示表面富氧空位的催化剂β-Ni(OH)2[12] Fig.1 (a) Schematic diagram of the NOR mechanism of β-Ni(OH)2[9]; (b) Schematic diagram of a bifunctional SAM in MOR[10]; (c) Proposed schematic diagram for LOM[11]; (d) Schematic diagram of the VDOR path on the surface of VR-β-Ni(OH)2, where HAT represents hydrogen atom transfer, VDOR represents vicinal diol oxidation reaction, and VR-β-Ni(OH)2 represents the catalyst β-Ni(OH)2 with oxygen-rich vacancies on the surface[12] |
| |
对于镍基催化剂,原位重构形成的镍的氢氧化物被视为醇类氧化反应的起始步骤。Feng等[10]根据实验和计算研究提出了一种基于NiⅡ(OH)2/NiⅢ—OOH可逆氧化还原转化和甲醇氧化反应(Methanol oxidation reaction, MOR)的循环途径[图 1(b)],可作为了解过渡金属基催化剂和直链一元醇/多元醇之间作用机理的一个窗口。这个过程中所形成的协同活性位点包括NiⅢ和邻近亲电性的活性氧物种NiⅢ—O,两者共同促进了自发和非自发的MOR过程。这种双功能机制为高选择性形成甲酸盐和NiⅢ—OOH暂时性的存在提供了合理的解释。使用动态原位拉曼光谱技术,研究人员观察到了NiMn-LDHs在一定电位区间发挥催化作用的过程中伴随着NiⅢ—OOH的有限生成和短暂存在[图 1(b)]:在1.37~1.52 V的开路电位(Open circuit potential, OCP)范围条件下测量得到拉曼光谱中NiⅢ—O特征峰(强度反映对应物质生成量)在1.37 V左右最为显著(生成量的有限性),并且随着应用电位从从1.52降到1.12 V,NiⅢ—O的特征峰强度逐渐减弱并消失(存在的暂时性)。这些观察表明,在MOR催化过程中,NiMn-LDH(Layered double hydroxide, LDH)中的元素Ni价态在Ⅱ和Ⅲ之间发生转化;与此同时,位于600 cm-1处的MnⅢ—O特征峰强度保持相对恒定,表明其中Mn不参与氧化还原转化。在此基础上再结合理论计算,可知醇类分子的吸附位点是NiⅡ—O,吸附于其上的醇类分子及中间体的氧化还原机制见图 1(b)。而Mn2+的关键作用在于捕获中间体脱离掉的H*,在2种金属的协同作用下,CH2O*→CHO* + H*所需跨越的能垒会显著降低,从而推动反应进程,改善催化性能。此表面吸附机理成为设计以Ni基为代表的多价态过渡金属催化剂时需参考的指导性原理之一。
Xu及其团队[11]基于对MOR的实验探究,采用18O同位素标记法,为AOR过程中晶格氧参与理论提供了严谨的实验支撑。由前述分析可知,在SAM中,吸附在含氧催化剂表面的醇类分子在经过两步脱氢形成醛基*CHO后,利用中心吸附位点对来自碱性电解液中OH-的吸附,先后受到2次OH-的攻击而形成羧基从催化位点上脱附。同样是甲醇分子在含氧催化剂表面氧化形成*CHO,而在LOM[图 1(c)]中,利用第2种金属的掺杂对含氧金属催化剂中心金属离子(Ni3+、Fe3+等)电子结构的改变,来推动催化剂中晶格氧的O 2p带中心向费米能级靠近,使晶格氧得到活化。氧化性的增强使该催化剂更易于参与AOR:催化位点上的活性氧可与醇脱氢形成的醛直接结合成羧基脱离催化剂表面。
上述机理可以很好地解释醇氧化得到与之对应碳数的高价值羧酸或羧酸盐产品的反应机理,但对于含有2个羟基基团及以上的乙二醇、丙三醇等多元醇而言,在氧化过程中不可避免地会涉及到由于C—C键断裂而得到甲酸/甲酸盐等更低碳数的产物,因此要控制多元醇氧化产物的选择性还需要对C—C键断裂机理加以深入探究。乙二醇和丙三醇的C—C键断裂机理可归为一类模型,即R-CHOH-CH2OH经过氧化得到R-COOH和HCOOH的过程[图 1(d)],可以用亲电氧介导机制(Electrophilic oxygen-mediated mechanisms, EOM)来解释[12]。LOM中晶格氧活化后氧化性增强,直接参与到醛基向羧基转换的氧化过程。富含氧空位的催化剂表面带正电,与醇类分子中的供电子基团羟基之间形成强相互作用力(类似于AOM),此时催化剂表面的晶格氧对醇类分子的攻击强度足以断裂C—C键,并参与2种多元醇小分子的氧化。
综上,针对部分过渡金属基催化剂对AOR的催化作用机理的阐述可以适当延伸至其他过渡金属基乃至贵金属基催化剂的反应机制,以上提及的AOM、SAM和TOM 3种AOR机制能够为醇电催化氧化偶联制氢体系阳极催化材料的设计提供思路。
1.2 贵金属基催化剂研究进展贵金属(Pt、Ru和Ir等)对于AOR具有较高的催化活性,在催化过程中通常展现出较高电流密度和低Tafel斜率[13]。根据Sabatier原理,催化剂(提供活性反应位点)与反应物(或中间产物)之间的结合能不应太强或太弱[14],而在催化剂吸附性能的火山曲线中贵金属(Pt、Pd、Rh和Ru等)靠近曲线顶部,意味着其拥有高活性,对反应中间产物吸附能适中[15]。然而,贵金属资源稀缺,成本高,并且工作过程中伴随有溶解、团聚和中毒等问题。为解决上述问题,研究者们从比活性、质量活性、电化学活性比表面积(Electrochemical surface area, ECSA)、稳定性和法拉第效率(Faradaic efficiency, FE)等方面入手,降低过电位,寻找合适的解决方案,试图解决催化剂失活问题,以期实现醇类小分子电解偶联制氢技术的商业推广[16]。
1.2.1 一元醇电催化氧化偶联制氢目前公认性能较好的甲醇电催化氧化催化剂多为主流的铂族金属(Pt和Ru等),但受反应中间体CO*的毒化作用而极易失活[17],因此需要开发具有高毒化抗性或能够有效抑制强吸附型反应中间体生成的新型催化剂。引入第2种金属构建一种双金属结构已被理论计算结果证实为一种行之有效的催化剂设计策略[18],并在实验研究中得到了多次验证。比如Lu及其团队[19]合成的超薄无定形/金属间异相PtPbBi纳米片(A/IMC PtPbBi NSs),由于其独特的异质界面以及所暴露出的丰富的活性位点,在AOR中呈现出优异的电催化性能。在MOR和EOR性能测试中,其质量活性分别为商用Pt/C催化剂的13.2和14.5倍。根据密度泛函理论(Density functional theory, DFT)计算结果可知,在协同效应的加持下,多元金属组成的无定形/异相晶体结构极大地优化了中间体与催化位点间的吸附/解吸附过程所需能量,电子从催化剂向关键中间产物*CH2OH的传输速度加快,从而提高了甲醇氧化的催化活性。Liu等[20]则采用脱合金法合成了一种具备三维的PtCu纳米框架的双功能催化剂,同样验证了Pt基双金属结构对一元醇类小分子氧化反应催化性能提升的有效性。在含1 mol ·L-1 KOH和0.5 mol ·L-1 CH3CH2OH的电解环境中,以Hg/HgO和碳棒分别为参比电极和对电极,PtCu NF/C(Nickel foam, NF)的乙醇氧化电位(0.754 V)要低于商用Pt/C的0.794 V。在双金属结构催化剂设计策略的基础上,考虑到要兼顾贵金属原子利用效率和金属原子间距调控,我们课题组[21]近期基于α-MnO2纤维表面上的原位重构引入Ru原子阵列合成催化剂Ru-MAC/MnO2,用于甲醇电催化氧化制备甲酸甲酯(Methyl formate, MF)。与OER所需电位1.23 V相比,甲醇电催化氧化制备甲酸甲酯的理论反应电位仅需0.06 V[22],可有效降低反应所需电压[图 2(a)]。得益于金属-金属[Ru-(O)-Ru]和金属-载体[Ru-(O)-Mn]电子相互作用的耦合,以及Ruδ+活性中心与反应中间体适中的结合能,Ru-MAC/MnO2具备稳定的电子结构和物理结构[图 2(b)]。在经过组分优化后的电解液体系(1.0 mol ·L-1 H2SO4的甲醇溶液)中,实现了甲醇选择性电催化氧化在百毫安级别电流密度下长达100 h的高效运行,展示出了高达87%的甲酸甲酯选择性和810.6 mmol ·g-1 ·h-1的甲酸甲酯产率;该产率相比于已经报道的热催化和光催化制备路径的产率分别提高了10倍和100倍。结合甲醇氧化过程中的反应机理[图 2(c)],甲醇生成MF的氧化过程中关键中间体产物为* H2C-(OH)2(CH2O*和1个水分子结合),但为了减少中间体CO*的生成,即防止CH3OH分子由于大量水分子对C—H键的攻击而完全脱氢,要控制好电解环境中水含量,因此选择1.0 mol ·L-1 H2SO4的甲醇溶液作为电解液可视为催化剂抗毒化性能显著改善的原因之一。另外一个原因在于活性位点Ru原子对有效反应中间体吸附性能合适,而与致毒中间体CO*的结合能提高,避免了CO*中间体向活性位点的扩散,降低了活性组分毒化的可能性,在Ru-MAC/MnO2界面处更倾向于实现甲酸选择性氧化制备甲酸甲酯的反应途径。
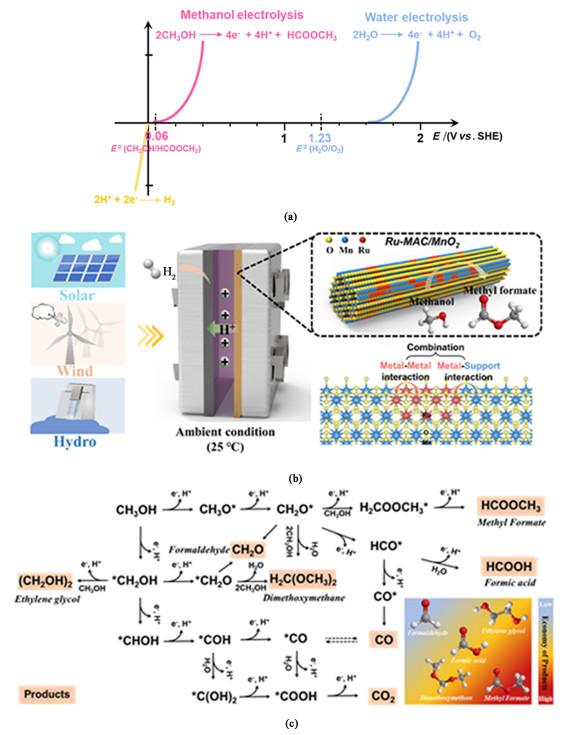
|
| 图 2 (a) 析氧反应与甲醇氧化为甲酸甲酯的电位比较;(b) 甲醇选择性电催化制备甲酸甲酯氧化路径的示意图[21];(c) 甲醇电解氧化反应机理以及相关产物商业价值的对比[21] Fig.2 (a) Comparison of the potential of the oxygen evolution reaction and the oxidation of methanol to methyl formate; (b) Schematic diagram of the oxidation pathway of methyl formate by selective electrocatalysis of methanol[21]; (c) Comparison of methanol electrolytic oxidation reaction mechanism and commercial value of related products[21] |
| |
在多元醇(乙二醇和甘油等)电催化氧化偶联制氢体系阳极催化剂的设计中,Pd、Ag和Ru等元素也同样常见。具有代表性的是Shi等[23]基于泡沫镍采用一步法原位合成了PdAg/NF来作为乙二醇氧化的阳极催化剂,在含有乙二醇的电解液中的活性要远优于在纯水中的表现,两者反应起活电位相差近1 V[图 3(a)],同时该电解体系在0.9 V电压下实现了对乙醇酸产物92%的法拉第效率[图 3(b)]。在多元醇氧化电解偶联制氢体系中,如何控制C—C键的断裂至关重要。上述研究中巧妙地利用了乙二醇(Ethylene glycol, EG)在Pd位点脱氢和乙醇酸产物在Ag原子上适中的脱附能,抑制了C—C键的进一步断裂[图 3(c)和图 3(d)]。以此拓展,如要提高多元醇氧化成甲酸盐的活性和选择性,则要设计出与C2和C3这些中间产物之间脱附能较高的催化剂,促进C—C键的断裂。如Xie及其团队[6]就是通过掺入Ru原子对Ni基LDH催化剂的本征电子结构进行了调整,降低了NiⅡ向甘油氧化反应GOR中活性位点NiⅢ转换和C—C键断裂的能垒[图 3(e)],进而实现了对甲酸盐80%的法拉第效率。
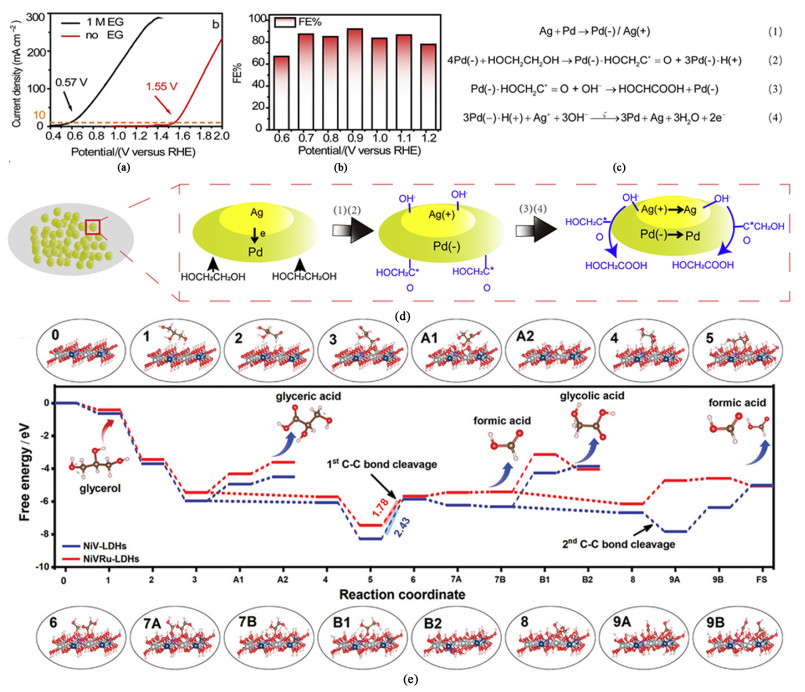
|
| 图 3 (a) PdAg/NF在0.5 mol ·L-1 KOH中添加和无添加1 mol ·L-1乙二醇的LSV曲线,扫速为5 mV ·s-2[23];(b) PdAg/NF在不同电压下2 h计时电流测试后生成乙醇酸的法拉第效率FEs[23];(c)和(d) PdAg/NF表面乙二醇氧化反应机制示意图[23];(e) GOR在NiV-LDHs和NiRuV-LDHs表面的自由能图示以及中间体在NiVRu-LDHs上的吸附构型[6] Fig.3 (a) LSV curves of PdAg/NF with and without 1 mol ·L-1 EG in 0.5 mol ·L-1 KOH at a scan rate of 5 mV ·s-2[23]; (b) FEs of glycolic acid generated by PdAg/NF after 2 h chronoamperometry test at different voltages[23]; (c) and (d) Schematic diagram of the reaction mechanism of EGOR on the surface of PdAg/NF[23]; (e) Diagram of the free energy of GOR on the surface of NiV-LDHs and NiRuV-LDHs and the adsorption configuration of the intermediates on NiVRu-LDHs[6] |
| |
贵金属基催化剂在醇类小分子电解催化偶联制氢应用中的最大优势在于催化活性高,表 1总结了近期报道的贵金属在AOR中的性能。贵金属催化剂尽管展示出了较好的活性,但是其长周期稳定性低以及较高的铂系金属用量仍然是该领域面临的问题。如何在保持现有高催化活性的条件下进一步降低贵金属的用量,以金属单原子或者团簇实现高性能AOR是有望解决以上问题的未来研究热点。
| 阳极催化剂 | 电解液 | 参比电极电位 | 阳极电压/(V vs. RHE) | 氧化产物 | 产物选择性FE |
| Pt/N-MoSe2@MHCS[33] | 0.5 mol·L-1 H2SO4+1.0 mol·L-1 CH3OH | SCE@0.2412 V | 0.59V@10 mA·cm-2 | ||
| A/IMC PtPbBi NSs[19] | 1.0 mol·L-1 KOH+1.0 mol·L-1 CH3OH | SCE@0.2412 V | 0.4V@10 mA·cm-2 | ||
| PtCu NF/C[20] | 1.0 mol·L-1 KOH + 0.5 mol·L-1 CH3CH2OH | SCE@0.2412 V | 0.754V@10 mA·cm-2 | CH3COO- | 98.2%@-0.78 V |
| RhNiFe-P/N[34] | 1.0 mol·L-1 KOH+0.5 mol·L-1 CH3CH2OH | SCE@0.2412 V | 1.36V@50 mA·cm-2 | CH3COO- | ≈95%@1.55 V |
| Pd3Pb@2.9%Pt[35] | 1.0 mol·L-1 KOH+1.0 mol·L-1 CH3CH2OH | Hg/HgO@0.0977 V | 0.55V@10 mA·cm-2 | CH3COO- | 98%@0.724 V |
| Ru1-Pt3Ni/NF[36] | 2.0 mol·L-1 KOH+2.0 mol·L-1 CH3CH2OH | Hg/HgO@0.0977 V | 0.60V@350 mA·cm-2 | CH3COO- | 100%@0.6 V |
| PdAg/NF[23] | 0.5 mol·L-1 KOH+1.0 mol·L-1 CH2OHCH2OH |
Hg/HgO@0.0977 V | 0.57V@10 mA·cm-2 | CH2OHCOO- | 92%@0.9 V |
| NiVRu-LDHs NAs/NF[6] | 1.0 mol·L-1 KOH + 0.1 mol·L-1 CH2OHCHOHCH2OH |
Hg/HgO@0.0977 V | 1.41V@ mA·cm-2 | CH3COO- | 80%@1.933 V |
| CNTs@CoO-Ni(OH)2[25] | 1.0 mol·L-1 KOH+1.0 mol·L-1 CH3OH | Hg/HgO@0.0977 V | 1.24V@10 mA·cm-2 | HCOO- | 96.87%@1.8 V |
| h-NiSe/CNTs/CC[37] | 1.0 mol·L-1 KOH+1.0 mol·L-1 CH3OH | Ag/AgCl@0.197 V | 1.37V@10 mA·cm-2 | HCOO- | (97.97 ± 1.85)%@1.62 V |
| LiFeⅡ(H2O)2[BP2O8]·H2O[38] | 1.0 mol·L-1 KOH+0.1 mol·L-1 CH3OH | Hg/HgO@0.0977 V | 1.42V@10 mA·cm-2 | HCOO- | 99%@1.46 V |
| Ni-NF-Af[39] | 1.0 mol·L-1 KOH+0.5 mol·L-1 CH3OH | Ag/AgCl@0.197 V | 1.33V@10 mA·cm-2 | HCOO- | 92%@1.65 V |
| NiSnPH@OOH/CC[40] | 1.0 mol·L-1 KOH+1.0 mol·L-1 CH3OH | Hg/HgO@0.0977 V | 1.39V@10 mA·cm-2 | HCOO- | ≈100%@1.7 V |
| NiFe-LDH/NiFe-HAB/C[28] | 1.0 mol·L-1 KOH+3.0 mol·L-1 CH3OH | SCE@0.2412 V | 1.42V@10 mA·cm-2 | HCOO- | 98%@20mA·cm-2 |
| Ni3B/Ni[41] | 1.0 mol·L-1 KOH+1.0 mol·L-1 CH3OH | Hg/HgO@0.0977 V | 1.38V@10 mA·cm-2 | HCOO- | 99.81%@100mA·cm-2 |
| NiGd@N-C/NF[42] | 1.0 mol·L-1 KOH+3.0 mol·L-1 CH3OH | Ag/AgCl@0.197 V | 1.35V@10 mA·cm-2 | HCOO- | 95.8%@1.8 V |
| Co3O4-x/NF-P[43] | 1.0 mol·L-1 KOH+1.0mol·L-1 CH3OH | Hg/HgO@0.0977 V | 1.318V@10 mA·cm-2 | HCOO- | >95%@10mA·cm-2 |
| NiTeO3/Ni[44] | 1.0 mol·L-1 KOH+0.5 mol·L-1 CH3OH | Hg/HgO@0.0977 V | 1.42V@50 mA·cm-2 | HCOO- | 90.4%@-2.1 V |
| ZnCo-LDH/CF[45] | 1.0 mol·L-1 KOH+3.0 mol·L-1 CH3OH | SCE@0.2412 V | 1.43V@40 mA·cm-2 | HCOO- | >96%@1.38 V |
| poly[Ni(salen)]ATV[46] | 1.0 mol·L-1 NaOH+1.0 mol·L-1 CH3OH | Ag/AgCl@0.197 V | 0.59V@14.1 mA·cm-2 | HCOO-, CO2 | |
| Ni97Bi3[47] | 1.0 mol·L-1 KOH+1.0 mol·L-1 CH3OH | Ag/AgCl@0.197 V | 0.51V@10 mA·cm-2 | ||
| NiPx-R[48] | 1.0 mol·L-1 KOH+0.5 mol·L-1 CH3OH | Ag/AgCl@0.197 V | 1.49V@100 mA·cm-2 | HCOO- | |
| O-rich ultrathin NiO[49] | 1.0 mol·L-1 KOH+0.5 mol·L-1 CH3OH | Ag/AgCl@0.197 V | 0.90V@85.3 mA·cm-2 | ||
| CoNi-PHNs[26] | 1.0 mol·L-1 KOH+1.0 mol·L-1 CH3CH2OH | SCE@0.2412 V | 1.39V@10 mA·cm-2 | CH3COO- | 94%@1.75 V |
| NiOOH-CuO/CF[50] | 1.0 mol·L-1 KOH+1.0 mol·L-1 CH3CH2OH | Ag/AgCl@0.197 V | 1.347V@200 mA·cm-2 | CH3COO- | 79.1%@200mA·cm-2 |
| NiSe2[51] | 1.0 mol·L-1 KOH+0.1 mol·L-1 EG | Hg/HgO@0.0977 V | 1.6V@95 mA·cm-2 | HCOO- | 80%@600mA·cm-2 |
| Co, Cl-NiS[29] | 1.0 mol·L-1 KOH+0.1 mol·L-1 EG | Hg/HgO@0.0977 V | 1.34V@100 mA·cm-2 | HCOO- | 92%@400mA·cm-2 |
| Pt/N-MoSe2@MHCS refers to mesoporous hollow carbon spheres (MHCS) covered with N-doped MoSe2 attached to Pt nanoparticles; A/IMC PtPbBi NSs refers to amorphous/intermetallic PtPbBi heterophase-structure nanosheets; poly[Ni(salen)]ATV refers to activated poly N, N′-bis(salicylidene)-ethylenediaminonickel(Ⅱ) complex, activated poly [Ni(salen)]; SCE stands for saturated calomel electrode. | |||||
廉价过渡金属因其丰富的资源储量、电催化活性提升空间大而受到研究者们的青睐[24]。近几十年来,很多工作都侧重于对由二元及以上的过渡金属组合所制备催化剂进行研究,从原子排列、电子结构、局部金属配位和缺陷浓度等角度入手进行阳极催化剂的设计,以增强对特定电催化反应的活性。其中Co、Ni和Fe基电催化剂因其低成本和丰富的地壳储备量,常以两两组合的形式用于醇类小分子电解催化偶联制氢系统中阳极催化剂的设计。
1.3.1 一元醇电催化氧化偶联制氢在CoNi基催化剂方面,Ji及其团队[25]利用模板辅助法和电沉积法在碳纳米管(Carbon nanotubes, CNTs)表面合成了具有超薄CoO镀层的Ni(OH)2纳米片阵列CNTs@CoO-Ni(OH)2。首先,中空垂直排列的CNTs有利于电化学活性比表面积的扩大,为快速的传质和电子传输过程提供低阻通道;其次,Ni(OH)2纳米片和超薄CoO涂层间的协同效应有利于活性位点NiⅢOOH的形成,从而降低甲醇氧化所需的电位。得益于上述优势,CNTs@CoO-Ni(OH)2表现出优越的MOR性能,在含1.0 mol ·L-1甲醇的H型碱性电解池中,仅需要1.36 V就能够实现100 mA ·cm-2的电流密度;此外,在1.8 V的高电压下甲酸盐的法拉第效率接近100%。Zhai等[26]以超薄CoNi-MOF(Metal organic framework, MOF)纳米片[图 4(a)]作为前驱体合成CoNi基氢氧化物纳米片CoNi-PHNs(Perforated hydroxide nanosheet, PHN)[图 4(b)],并以此为阳极催化剂,以CoS2-MoS2为阴极催化剂,在含1 mol ·L-1乙醇碱性电解液的双电极体系中,在1.75 V的大电压条件下,实现对乙酸盐高达94.1%的法拉第效率;同时,在1.39 V的电位下能够达到10 mA ·cm-2的电流密度[图 4(c)]。与Co、Ni单金属基穿孔氢氧化物纳米片(Co-PHNs和Ni-PHNs)以及CoNi基层状双金属氢氧化物(CoNi-LDH)相比, 其EOR活性显著增强,这得益于CoNi双金属间的协同效应作用之外,还可归功于催化剂特殊的多孔纳米片结构。分子动力学模拟结果表明[图 4(d)、图 4(e)和图 4 (f)],纳米片表面2 nm大小的孔径有利于乙醇分子的通过,致使乙醇分子在纳米孔附近积累,加速了乙醇分子的传输以及其与催化位点的结合,从而增强了CoNi-PHNs对EOR的催化活性。
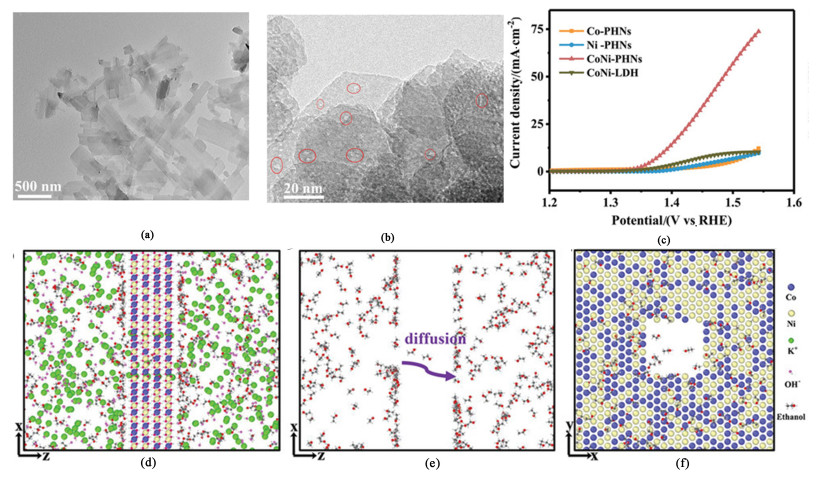
|
| 图 4 (a) 和(b) CoNi-MOFs和CoNi-PHNs的TEM图像[26];(c) EOR中各种催化剂的标准极化曲线[26];(d) 含2 nm孔洞的CoNi PHNs中CH3CH2OH、K+和OH-的分布状态[26];(e) 乙醇分子穿过2 nm纳米孔的模拟示意图[26];(f)乙醇分子在孔洞附近富集的模拟示意图[26] Fig.4 (a) and (b) TEM images of CoNi-MOFs and CoNi-PHNs[26]; (c) Normalized polarization curves for various catalysts in EOR[26]; (d) Distribution states of CH3CH2OH, K+ and OH- in CoNi PHNs with 2 nm holes[26]; (e) Schematic diagram of ethanol molecule crossing a 2 nm nanopore[26]; (f) Simulated schematic diagram of ethanol molecule enrichment near the hole[26] |
| |
基于NiFe双金属的催化剂在直链一元醇电催化氧化中的研究同样也取得了一定的进展。Peng等[27]利用超快溶液燃烧技术在泡沫镍NF表面原位合成了催化剂Fe2O3/NiO,这种方法有助于构建稳定的电子传输结,并能够快速制得高度分散的界面[图 5(a)]。经X射线光电子能谱(XPS)分析证实,在FeNi氧化物异质结形成后,Fe2O3和NiO之间存在强烈的电子相互作用。这种强相互电子作用改变了Fe-NF-500(500 mA ·cm-2电流状态下工作的催化剂Fe2O3/NiO)中NiO的电子态。如图 5(b)所示,Ni 2p峰在异质结形成后其结合能出现负向偏移,意味着Ni原子由于电子转移而化合价升高得到活性物种NiⅢ。异质结界面处的协同效应对Ni电子状态的调整进而优化了甲醇在催化位点处的吸附能,从而实现了对MOR的高效催化。以含1.0 mol ·L-1甲醇和1.0 mol ·L-1 KOH的溶液作为电解液,以Fe-NF-500催化剂作为阳极,MoNi4催化剂作为阴极搭建电解槽进行双电极测试。甲醇在大电流条件下进行选择性氧化,甲酸盐的法拉第效率高达98%[图 5(c)],达到500 mA ·cm-2的电流密度仅需施加1.654 V的电位[图 5(d)]。同样利用NiFe基催化剂中异质结界面处电子结构变化原理的还有Song及其团队[28]通过电沉积法和水热法合成的NiFe-LDH/NiFe-HAB异质结催化剂[图 5(e)]。不同的是,这项工作实现对MOR高反应活性的原理是通过改变OER决速步,提高这一过程的反应能垒[图 5(f)],即利用NiFe-HAB(Hexylaminobenzene, HAB, 己氨基苯)对NiFe-LDH电子结构的调整,使得OER决速步由OOH*的形成变为O*的形成,且能垒提高,从而钝化了NiFe-LDH对OER的活性。
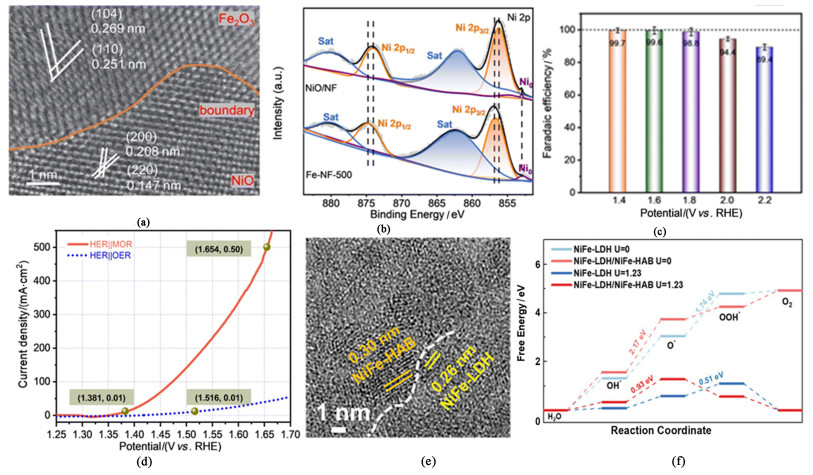
|
| 图 5 (a) Fe-NF-500的STEM-HAADF图[27];(b) Ni 2p的XPS能谱图[27];(c) 对不同电压条件下甲酸盐产物法拉第效率的计算结果[27];(d) 催化剂Fe-NF-500和MoNi4在1.0 mol ·L-1 KOH中添加和无添加1.0 mol ·L-1甲醇的 Fig.5 STEM-HAADF images of the catalyst Fe-NF-500[27]; (b) XPS spectra of Ni 2p in Fe-NF-500[27]; (c) FEs of formate products under different voltage conditions[27]; (d) LSV curves of catalysts Fe-NF-500 and MoNi4 with and without 1.0 mol ·L-1 methanol in 1.0 mol ·L-1 KOH (30% iR compensation)[27]; (e) HRTEM images of NiFe-LDH/NiFe-HAB/CF[28]; (f) Gibbs free energy variation of NiFe-LDH and NiFe-LDH/NiFe-HAB surface OER at external bias voltages U of 0 and 1.23 V, respectively[28] |
| |
LSV曲线(30% iR补偿)[27];(e) NiFe-LDH/NiFe-HAB/CF的HRTEM图[28];(f) 在外部偏置电压U分别为0和1.23 V条件下,NiFe-LDH和NiFe-LDH/NiFe-HAB表面OER的吉布斯自由能变化[28]
1.3.2 多元醇电催化氧化偶联制氢廉价过渡金属基催化剂在直链多元醇电催化氧化体系中同样也大多以Ni、Co和Fe为催化剂的主要成分,利用元素之间的协同效应,辅以微结构设计、掺杂等策略的应用,从而在多元醇类小分子电催化氧化偶联制氢中实现催化性能的提升。Ni等[29]基于NiS纳米片对其进行Co和Cl共掺杂,制得催化剂Co, Cl-NiS超薄纳米片[图 6(a)]。一方面利用CoⅢ和NiⅢ双催化位点提升催化性能,另一方面利用电负性大的Cl原子对NiCo原子核周围电子的吸引促进NiⅡ和CoⅡ向高价态的活性中间体转换,从而提高了催化剂对EGOR(Ethylene glycol oxidation reaction, EGOR)的催化活性。在以含1.0 mol ·L-1 KOH和0.1 mol ·L-1 EG的溶液为电解液,分别以Hg/HgO和碳棒为参比电极和对电极的H型电解槽中,大于400 mA ·cm-2的电流密度下EG向甲酸盐的选择性氧化FE可达92%,实现100 mA ·cm-2仅需1.34 V[图 6(b)]。与其他催化剂相比,Co, Cl-NiS对EGOR的催化性能优异的另一个关键原因在于,EG电氧化过程中,Ni3S2中的S会与Cl发生共刻蚀,即S从纳米片表面溶出,而在Ni3S2晶格内部形成了大量的硫空位;该变化促使Ni3S2原位重构为富缺陷的Ni3S2@NiOOH(简写为NiSV@NiOOH),伴随Co的掺入,得到具备催化活性的Co-NiSV@Co-NiOOH。由态密度(Density of states, DOS)计算结果可知,Co-NiSV@Co-NiOOH与Co-NiS@Co-NiOOH、NiS@NiOOH相比,其d带中心要更高[图 6(c)],根据d带中心理论,这意味着催化位点Co-NiSV@Co-NiOOH中反键能带被电子填充的更少,与反应中间体的结合能更小[图 6(d)],从而加快了EG向甲酸盐的氧化过程。同样实现了多元醇对甲酸盐高选择性的CoNi基催化剂的有关研究产出的还有Zhang及其团队[30],针对甘油氧化GOR这一典型的亲核氧化反应,设计了一种双相异质结构纳米线Ni3N/Co3N-NWs[图 6(e)],实现了对甲酸盐生产的高选择性(94.6%)。在含0.1 mol ·L-1甘油的双极电解槽中分别仅需要1.26和1.34 V的电压即可达到50和200 mA ·cm-2的电流密度[图 6(f)]。更重要的是,以此搭建的电解槽在经过200 h的稳定性测试后,在2.01 V的电压条件下仍然可以达到1 A ·cm-2的工业级电流密度。
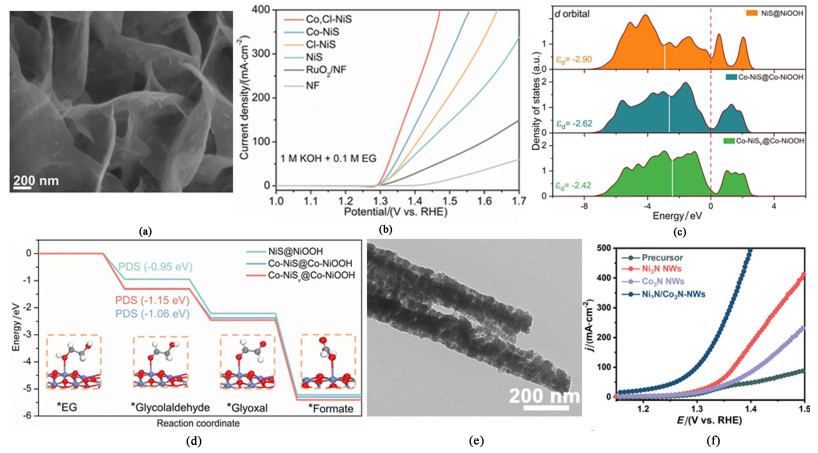
|
| 图 6 (a) Co, Cl-NiS的SEM图像[29];(b) EGOR中各种催化剂的LSV曲线[29];(c) NiS@NiOOH,Co-NiS@Co-NiOOH和Co-NiSv@Co-NiOOH的DOS图[29];(d)0电位时EGOR分别在NiS@NiOOH,Co-NiS@Co-NiOOH和Co-NiSv@Co-NiOOH表面的吉布斯自由能变化以及在Co-NiSv@Co-NiOOH表面EG主要的分子构型变化示意图[29];(e) Ni3N/Co3N-NWs的TEM图像[30];(f) GOR中各种催化剂的LSV曲线[30] Fig.6 (a) SEM image of the catalyst Co, Cl-NiS[29]; (b) LSV curves of various catalysts in EGOR[29]; (c) DOS results of NiS@NiOOH, Co-NiS@Co-NiOOH and Co-NiSv@Co-NiOOH[29]; (d) Schematic diagram of the Gibbs free energy changes of EGOR on the surface of NiS@NiOOH, Co-NiS@Co-NiOOH and Co-NiSv@Co-NiOOH at zero potential, and the main molecular configuration changes of EG on the surface of Co-NiSv@Co-NiOOH[29]; (e) TEM image of Ni3N/Co3N-NWs[30]; (f) LSV curves of various catalysts in GOR[30] |
| |
除了上述基于双金属结构的催化剂设计策略之外,Wen及其团队[31]利用高熵合金(High entropy alloy, HEA)的策略,即5种及以上金属成分组装在一起,以碳布为衬底合成了HEA-CoNiCuMnMo NPs[图 7(a)]。在以含1.0 mol ·L-1 KOH和0.1 mol ·L-1甘油的溶液为电解液,分别以Hg/HgO和碳棒为参比电极和对电极的三电极电解槽中,该催化剂仅需要1.25 V的电位即可驱动10 mA ·cm-2的电流密度[图 7(b)],对生成甲酸盐的法拉第效率超过90%[图 7(c)]。研究人员利用一种基于机器学习的蒙特卡罗模拟算法推测高熵合金催化剂HEA-CoNiCuMnMo NPs的催化位点并非一般催化剂的高价态过渡金属活性物种(Ni-OOH和CoNi-OOH等),而是与Mo、Ni和Mn相邻的Mo位点。在利用过渡金属与非金属元素组合制备用于醇类小分子电催化氧化偶联制氢阳极催化剂的研究方面,Cabot等[32]就基于Ni和Se 2种元素设计了针对乙二醇选择性氧化制备甲酸盐的阳极催化剂[图 7(d)]。引入的Se元素能够改变Ni的电子结构,使得催化位点NiOOH-SeO4中Ni的d带相对于费米能级更高,反键态能量相对于费米能级更高,因此被占据的程度更低,成键更稳定;进而使得催化位点与小分子的化学结合作用更强,吸附所需能量更少,加快了催化过程,从而改善了催化剂对EGOR的催化活性[图 7(e)]。在含1 mol ·L-1 EG的碱性三电极电解槽中(分别以Hg/HgO和铂片为参比电极和对电极),该催化反应输出50 mA ·cm-2的电流密度时仅需要施加1.395 V的电位,经过10 h的计时电流测试(恒定电压为1.6 V)后测得对其主要产物甲酸盐的法拉第效率大于80%[图 7(f)]。
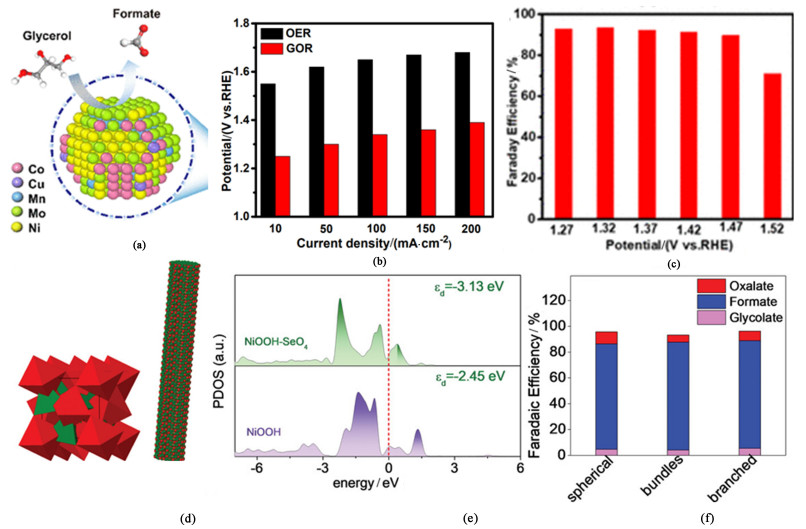
|
| 图 7 (a) HEA-CoNiCuMnMo NPs的元素构成模型示意图[31];(b) 在1.0 mol ·L-1 KOH中添加和无添加0.1 mol ·L-1甘油的电解液中,达到不同电流密度CoNiCuMnMo-NPs/CC所需的不同阳极电压[31];(c) HEA-CoNiCuMnMo NPs在不同电位下生成甲酸盐的法拉第效率[31];(d) NiSe2的晶体模型和束状NiSe2的3D原子超级胞模型示意图[32];(e) NiOOH和NiOOH-SeO4中关于Ni 3d的部分态密度分析[32];(f) 不同形态NiSe基催化剂作用下乙二醇主要产物的法拉第效率[32] Fig.7 (a) Schematic diagram of the elemental composition model of HEA-CoNiCuMnMo NPs[31]; (b) Different anode voltages required to achieve different current densities CoNiCuMnMo-NPs/CC in an electrolyte with and without 0.1 mol·L-1 glycerol in 1.0 mol ·L-1 KOH[31]; (c) FEs of HEA-CoNiCuMnMo NPs at different potentials for formate generation[31]; (d) Schematic diagram of the crystal model of NiSe2 and the 3D atomic supercell model of bundled NiSe2[32]; (e) PDOS analysis of Ni 3d in NiOOH and NiOOH-SeO4[32]; (f) Faradaic efficiency of the main products of ethylene glycol under different forms of NiSe-based catalysts[32] |
| |
总体来说,廉价过渡金属因其可调的价态变化以及相对丰富的资源储备而成为醇类小分子电解催化偶联制氢阳极催化材料中广受青睐的选择,研究者们对其在醇类氧化中作用机理的研究逐渐深入,目前已经取得了一定的进展,表 1总结了近期报道的非贵金属基催化剂在AOR中的性能。为了实现过渡金属基催化剂大规模的商业化应用,提升3 d金属的活性、降低过电位同时简化合成步骤将仍然是未来的研究重点。
2 总结与展望醇类小分子选择性电催化氧化制备高附加值化学联产制氢技术路线,能有效解决电解水制氢过程中的高能耗问题;并且阳极端高附加值化学品的绿色合成,更能有效提升技术经济性,从而降低绿氢生产成本,为氢能的商业化推广提供了可行的路径。本综述围绕直链一元醇和直链多元醇类小分子电催化氧化反应体系,介绍了醇类小分子电催化氧化反应机制,包括亲核氧化反应机理、表面吸附机理和晶格氧参与机理。系统性地归纳总结了适用于醇类小分子电解制氢体系的贵金属基和非贵金属基阳极催化剂研究进展。虽然在适用于醇类小分子电催化氧化催化材料的设计与开发方面,相关研究人员已经付出了巨大的努力并取得了大量的研究成果,但是,在高性能催化材料的理性设计与可控合成方面,仍然面临着诸多挑战。
(1) 阳极催化剂在反应过程中,普遍会发生界面重构现象。而重构后的催化剂界面特征结构才与其本征催化活性直接关联。这一特性大大提高了醇类小分子选择性电催化氧化催化剂活性中心的解析难度。虽然,有研究表明,在非贵金属催化材料体系中,界面重构得到的羟基氧化物组分是醇类小分子选择性氧化反应的活性中心,但仍然需要进一步的利用不同类型原位表征分析手段,以深入解析界面重构后的材料原子构型与其醇类小分子氧化反应本征催化性能之间的构效关系。
(2) 醇类小分子电催化反应机制及其反应动力学过程仍有待深入研究。目前,对于醇类小分子电催化氧化反应机制的研究工作虽然已取得了一定的进展,已提出了包括亲核氧化反应机理、表面吸附机理和晶格氧参与机理在内的不同反应机制,但是现有实验角度的反应机制解析手段仍然主要聚焦于非时间分辨的反应中间体原位表征技术,对具有多电子传输步骤的醇类小分子氧化反应全流程动态过程的完整解析,包括不同类型醇类小分子的吸附形式、C—H键解离过程和C—O键耦合等动态过程依旧缺乏有效的实验观测和解析手段,因而难以全方位揭示该反应的动力学演化机制。
(3) 现有醇类小分子催化剂的器件性能(如在质子交换膜电解槽或者阴离子交换膜电解槽中的性能)仍不理想,绝大部分材料性能仍低于0.5 A ·cm-2,无法满足商业化安培级电流密度的要求。需要进一步提升相关反应的器件性能,例如进一步优化膜电极制备工艺,以降低系统内阻,或者通过流道结构的设计与优化,以提升醇类小分子传质效率等。同时,产物中的高附加值化学品的分离提纯,同样需要深入考虑与优化,以进一步明确相关技术路线的技术经济性,从而为上述反应体系的商业化推广提供理论指导。
| [1] |
武晓彤, 谭磊, 郑越源, 等. 氢经济展望与电解水制氢技术经济性分析[J]. 化学工业与工程, 2024, 41(2): 131-140. WU Xiaotong, TAN Lei, ZHENG Yueyuan, et al. Outlook on hydrogen economy and techno-economic assessment of water electrolysis-based hydrogen production[J]. Chemical Industry and Engineering, 2024, 41(2): 131-140. (in Chinese) |
| [2] |
DOTAN H, LANDMAN A, SHEEHAN S W, et al. Decoupled hydrogen and oxygen evolution by a two-step electrochemical-chemical cycle for efficient overall water splitting[J]. Nature Energy, 2019, 4: 786-795. DOI:10.1038/s41560-019-0462-7 |
| [3] |
CHEN Z, WEI W, SONG L, et al. Hybrid water electrolysis: A new sustainable avenue for energy-saving hydrogen production[J]. Sustainable Horizons, 2022, 1: 100002. DOI:10.1016/j.horiz.2021.100002 |
| [4] |
VEERAMANI K, JANANI G, KIM J, et al. Hydrogen and value-added products yield from hybrid water electrolysis: A critical review on recent developments[J]. Renewable and Sustainable Energy Reviews, 2023, 177: 113227. DOI:10.1016/j.rser.2023.113227 |
| [5] |
CHEN Z, DONG J, WU J, et al. Acidic enol electrooxidation-coupled hydrogen production with ampere-level current density[J]. Nature Communications, 2023, 14: 4210. DOI:10.1038/s41467-023-39848-w |
| [6] |
QIAN Q, HE X, LI Z, et al. Electrochemical biomass upgrading coupled with hydrogen production under industrial-level current density[J]. Advanced Materials, 2023, 35(25): e2300935. DOI:10.1002/adma.202300935 |
| [7] |
ZHU Y, ZHOU H, DONG J, et al. Identification of active sites formed on cobalt oxyhydroxide in glucose electrooxidation[J]. Angewandte Chemie (International Ed in English), 2023, 62(15): e202219048. DOI:10.1002/anie.202219048 |
| [8] |
SHI J, MA J, MA E, et al. Electrochemical alcohol oxidation reaction on Precious-Metal-Free catalysts: Mechanism, activity, and selectivity[J]. Carbon Neutralization, 2024, 3(2): 285-312. DOI:10.1002/cnl2.116 |
| [9] |
CHEN W, XIE C, WANG Y, et al. Activity origins and design principles of nickel-based catalysts for nucleophile electrooxidation[J]. Chem, 2020, 6(11): 2974-2993. DOI:10.1016/j.chempr.2020.07.022 |
| [10] |
ZHU B, DONG B, WANG F, et al. Unraveling a bifunctional mechanism for methanol-to-formate electro-oxidation on nickel-based hydroxides[J]. Nature Communications, 2023, 14: 1686. DOI:10.1038/s41467-023-37441-9 |
| [11] |
MENG F, WU Q, ELOUARZAKI K, et al. Essential role of lattice oxygen in methanol electrochemical refinery toward formate[J]. Science Advances, 2023, 9(34): eadh9487. DOI:10.1126/sciadv.adh9487 |
| [12] |
CHEN W, SHI J, WU Y, et al. Vacancy-induced catalytic mechanism for alcohol electrooxidation on nickel-based electrocatalyst[J]. Angewandte Chemie (International Ed in English), 2024, 63(4): e202316449. DOI:10.1002/anie.202316449 |
| [13] |
LI C, BAEK J. Recent advances in noble metal (Pt, Ru, and Ir)-based electrocatalysts for efficient hydrogen evolution reaction[J]. ACS Omega, 2020, 5(1): 31-40. DOI:10.1021/acsomega.9b03550 |
| [14] |
GREELEY J. Theoretical heterogeneous catalysis: Scaling relationships and computational catalyst design[J]. Annual Review of Chemical and Biomolecular Engineering, 2016, 7: 605-635. DOI:10.1146/annurev-chembioeng-080615-034413 |
| [15] |
FU X, WAN C, HUANG Y, et al. Noble metal based electrocatalysts for alcohol oxidation reactions in alkaline media[J]. Advanced Functional Materials, 2022, 32(11): 2106401. DOI:10.1002/adfm.202106401 |
| [16] |
TRAN L T, NGUYEN Q M, NGUYEN M D, et al. Preparation and electrocatalytic characteristics of the Pt-based anode catalysts for ethanol oxidation in acid and alkaline media[J]. International Journal of Hydrogen Energy, 2018, 43(45): 20563-20572. DOI:10.1016/j.ijhydene.2018.09.049 |
| [17] |
CHEN W, LUO S, SUN M, et al. Hexagonal PtBi intermetallic inlaid with sub-monolayer Pb oxyhydroxide boosts methanol oxidation[J]. Small, 2022, 18(14): e2107803. DOI:10.1002/smll.202107803 |
| [18] |
TRITSARIS G A, ROSSMEISL J. Methanol oxidation on model elemental and bimetallic transition metal surfaces[J]. The Journal of Physical Chemistry C, 2012, 116(22): 11980-11986. DOI:10.1021/jp209506d |
| [19] |
FENG F, MA C, HAN S, et al. Breaking highly ordered PtPbBi intermetallic with disordered amorphous phase for boosting electrocatalytic hydrogen evolution and alcohol oxidation[J]. Angewandte Chemie International Edition, 2024, 63(25): 2405173. |
| [20] |
FU H, ZHANG N, LAI F, et al. Surface-regulated platinum-copper nanoframes in electrochemical reforming of ethanol for efficient hydrogen production[J]. ACS Catalysis, 2022, 12(18): 11402-11411. DOI:10.1021/acscatal.2c03022 |
| [21] |
LIN C, LI J, YANG S, et al. Acid-stable Ru atom array for converting methanol to methyl formate at commercially viable current densities[J]. ACS Catalysis, 2023, 13(17): 11675-11686. DOI:10.1021/acscatal.3c02644 |
| [22] |
KISHI R, OGIHARA H, YOSHIDA-HIRAHARA M, et al. Green synthesis of methyl formate via electrolysis of pure methanol[J]. ACS Sustainable Chemistry & Engineering, 2020, 8(31): 11532-11540. |
| [23] |
SI D, XIONG B, CHEN L, et al. Highly selective and efficient electrocatalytic synthesis of glycolic acid in coupling with hydrogen evolution[J]. Chem Catalysis, 2021, 1(4): 941-955. DOI:10.1016/j.checat.2021.08.001 |
| [24] |
YE C, LIU J, ZHANG Q, et al. Activating metal oxides nanocatalysts for electrocatalytic water oxidation by quenching-induced near-surface metal atom functionality[J]. Journal of the American Chemical Society, 2021, 143(35): 14169-14177. DOI:10.1021/jacs.1c04737 |
| [25] |
DENG K, LIU P, LIU X, et al. Synergism of CoO-Ni(OH)2 nanosheets and MOF-derived CNTs array for methanol electrolysis[J]. Green Chemistry, 2023, 25(23): 9837-9846. DOI:10.1039/D3GC03179A |
| [26] |
WANG W, ZHU Y, WEN Q, et al. Modulation of molecular spatial distribution and chemisorption with perforated nanosheets for ethanol electro-oxidation[J]. Advanced Materials, 2019, 31(28): e1900528. DOI:10.1002/adma.201900528 |
| [27] |
HAO Y, YU D, ZHU S, et al. Methanol upgrading coupled with hydrogen product at large current density promoted by strong interfacial interactions[J]. Energy & Environmental Science, 2023, 16(3): 1100-1110. |
| [28] |
JIANG S, XIAO T, XU C, et al. Passivating oxygen evolution activity of NiFe-LDH through heterostructure engineering to realize high-efficiency electrocatalytic formate and hydrogen co-production[J]. Small, 2023, 19(27): 2208027. DOI:10.1002/smll.202208027 |
| [29] |
CHEN Z, ZHENG R, BAO T, et al. Dual-doped nickel sulfide for electro-upgrading polyethylene terephthalate into valuable chemicals and hydrogen fuel[J]. Nano-Micro Letters, 2023, 15(1): 210. DOI:10.1007/s40820-023-01181-8 |
| [30] |
ZHU Y, QIAN Q, CHEN Y, et al. Biphasic transition metal nitride electrode promotes nucleophile oxidation reaction for practicable hybrid water electrocatalysis[J]. Advanced Functional Materials, 2023, 33(25): 2300547. DOI:10.1002/adfm.202300547 |
| [31] |
FAN L, JI Y, WANG G, et al. High entropy alloy electrocatalytic electrode toward alkaline glycerol valorization coupling with acidic hydrogen production[J]. Journal of the American Chemical Society, 2022, 144(16): 7224-7235. DOI:10.1021/jacs.1c13740 |
| [32] |
LI J, LI L, MA X, et al. Selective ethylene glycol oxidation to formate on nickel selenide with simultaneous evolution of hydrogen[J]. Advanced Science, 2023, 10(15): 202300841. |
| [33] |
KUANG Y, QIAO W, WANG S, et al. Doping and interfacial engineering of MoSe2 nanosheets by NH3 plasma promoted Pt for methanol electrolysis[J]. ACS Materials Letters, 2024, 6(5): 1722-1731. DOI:10.1021/acsmaterialslett.4c00244 |
| [34] |
MIAO J, ZHAO X, HU H, et al. Trimetallic RhNiFe phosphide nanosheets for electrochemical reforming of ethanol[J]. ACS Applied Nano Materials, 2022, 5(4): 4948-4957. DOI:10.1021/acsanm.1c04547 |
| [35] |
LI T, WANG Q, WU J, et al. Strain and shell thickness engineering in Pd3Pb@Pt bifunctional electrocatalyst for ethanol upgrading coupled with hydrogen production[J]. Small, 2024, 20(7): 2306178. DOI:10.1002/smll.202306178 |
| [36] |
ZHOU C, WANG S, MA K, et al. Membrane-free pure H2 production over single dispersed Ru-anchored Pt3Ni alloys via coupling ethanol selective electrooxidation[J]. Applied Catalysis B: Environmental, 2023, 321: 122065. DOI:10.1016/j.apcatb.2022.122065 |
| [37] |
ZHAO B, LIU J, XU C, et al. Hollow NiSe nanocrystals heterogenized with carbon nanotubes for efficient electrocatalytic methanol upgrading to boost hydrogen co-production[J]. Advanced Functional Materials, 2021, 31(8): 2008812. DOI:10.1002/adfm.202008812 |
| [38] |
YANG H, VIJAYKUMAR G, CHEN Z, et al. In situ reconstruction of helical iron borophosphate precatalyst toward durable industrial alkaline water electrolysis and selective oxidation of alcohols[J]. Advanced Functional Materials, 2023, 33(41): 2303702. DOI:10.1002/adfm.202303702 |
| [39] |
CAO C, MA D, JIA J, et al. Divergent paths, same goal: A pair-electrosynthesis tactic for cost-efficient and exclusive formate production by metal-organic-framework-derived 2D electrocatalysts[J]. Advanced Materials, 2021, 33(25): e2008631. DOI:10.1002/adma.202008631 |
| [40] |
SHAO J, FANG Y, WU X, et al. Unraveling the role of NiSnPH@OOH/CC perovskite hydroxide for efficient electrocatalytic oxidation of methanol to formate[J]. Nano Research, 2024, 17(4): 2388-2399. DOI:10.1007/s12274-023-6078-z |
| [41] |
LIU Z, CHANG P, XI M, et al. Synthesis of Ni3B/Ni via vacuum-induced for ultrahigh stable and efficient methanol oxidation[J]. Small, 2023, 19(52): 2303855. DOI:10.1002/smll.202303855 |
| [42] |
XU Y, ZHOU Q, REN T, et al. Enhanced electron penetration triggering interfacial charge redistribution in N-doped graphene-wrapped NiGd nanoparticles for coupling methanol electroreforming to H2 production[J]. Journal of Materials Chemistry A, 2023, 11(37): 20112-20119. DOI:10.1039/D3TA03991A |
| [43] |
ZHANG J, HUA Y, LI H, et al. Phase reconstruction of Co3O4 with enriched oxygen vacancies induced by cold plasma for boosting methanol-to-formate electro-oxidation[J]. Chemical Engineering Journal, 2023, 478: 147288. DOI:10.1016/j.cej.2023.147288 |
| [44] |
ANANTHARAJ S, LI M, ARULRAJ R, et al. A tri-functional self-supported electrocatalyst featuring mostly NiTeO3 perovskite for H2 production via methanol-water co-electrolysis[J]. Chemical Communications, 2023, 59(85): 12755-12758. DOI:10.1039/D3CC02568C |
| [45] |
JIANG S, WU M, XIAO T, et al. Tailoring the activity of electrocatalytic methanol oxidation on cobalt hydroxide by the incorporation of catalytically inactive zinc ions[J]. ACS Applied Materials & Interfaces, 2023, 15(48): 55870-55876. |
| [46] |
BOTT-NETO J L, MARTINS T S, MACHADO S A S, et al. Electrocatalytic oxidation of methanol, ethanol, and glycerol on Ni(OH)2 nanoparticles encapsulated with poly[Ni(salen)] film[J]. ACS Applied Materials & Interfaces, 2019, 11(34): 30810-30818. |
| [47] |
DUBALE A A, ZHENG Y, WANG H, et al. High-performance bismuth-doped nickel aerogel electrocatalyst for the methanol oxidation reaction[J]. Angewandte Chemie (International Ed in English), 2020, 59(33): 13891-13899. DOI:10.1002/anie.202004314 |
| [48] |
LI S, MA R, HU J, et al. Coordination environment tuning of nickel sites by oxyanions to optimize methanol electro-oxidation activity[J]. Nature Communications, 2022, 13: 2916. DOI:10.1038/s41467-022-30670-4 |
| [49] |
YANG W, YANG X, JIA J, et al. Oxygen vacancies confined in ultrathin nickel oxide nanosheets for enhanced electrocatalytic methanol oxidation[J]. Applied Catalysis B: Environmental, 2019, 244: 1096-1102. DOI:10.1016/j.apcatb.2018.12.038 |
| [50] |
SUN H, LI L, CHEN Y, et al. Boosting ethanol oxidation by NiOOH-CuO nano-heterostructure for energy-saving hydrogen production and biomass upgrading[J]. Applied Catalysis B: Environmental, 2023, 325: 122388. DOI:10.1016/j.apcatb.2023.122388 |
| [51] |
LIU F, GAO X, SHI R, et al. Concerted and selective electrooxidation of polyethylene-terephthalate-derived alcohol to glycolic acid at an industry-level current density over a Pd-Ni(OH)2 catalyst[J]. Angewandte Chemie International Edition, 2023, 62(11): e202300094. DOI:10.1002/anie.202300094 |
 2024, Vol. 41
2024, Vol. 41





