氢气因其清洁无污染、热量高等优点,被誉为21世纪最具发展前景的清洁能源[1]。在目前的各种制氢技术中,利用可再生能源所产生的电能作为动力来电解水制氢是最有潜力的技术,被视为通向氢经济的一个最佳途径[2]。其中,碱性电解水制氢技术路线最为成熟,具有技术安全可靠、制造成本低、操作简单和运行寿命长等优点,在工业制氢领域占有主导地位[3]。近年来,在所报道的碱性电解水阴极催化剂中,电镀Ni-Mo合金因其析氢反应活性高、不需要昂贵制备设备、易放大生产,得到广泛研究及工业应用[4-12]。
然而,Ni-Mo镀层易开裂且普遍存在于多种电镀条件下,其内在原因尚未见有详细研究。在探讨这一问题时,研究者们主要提出了两方面的猜测。一方面,开裂可能与电镀过程中的析氢密切相关。例如,Zhang等[4]在低钼浓度镀液中,以泡沫镍为基底,在n(Ni)/n(Mo)为3、电流密度为90 mA ·cm-2的条件下电镀Ni-Mo时,在镀层上可以观察到微裂纹。类似地,Wang等[12]在铜箔基底上,使用镀液n(Ni)/n(Mo)为1.5和电流密度2.4 A ·cm-2的电镀条件,也发现了镀层上的微裂纹。而在高钼浓度镀液中,Jovic等[13]、Krstajic'等[9]以及Sun等[11]分别使用低碳钢、镍网和铜作为基底进行电镀实验,同样观察到了Ni-Mo镀层上存在的大量裂缝。研究者们普遍认为,这些裂缝的形成与合金电沉积过程中产生的大量氢气有关。同时,Sun等[11]的研究进一步指出,高钼浓度镀液下副反应析氢的偏电流密度增加,因此他们推测开裂问题可能是由于析氢副反应的加剧所致,但这一观点目前尚缺乏直接证据支持。
另一方面,研究者们还提出开裂可能与电镀过程中产生的应力有关。Raj等[6]和Bao等[14]分别在低碳钢箔和铝基底上采用镀液n(Ni)/n(Mo)为4.0和3.5~7.0、电流密度10和20~80 mA ·cm-2的电镀条件电镀Ni-Mo合金,观察到了镀层开裂的现象。他们将这一现象归因于镀层内部应力,然而并未详细解释应力的来源和开裂成因。总体来看,尽管研究者们已经报道了多种电镀条件下Ni-Mo镀层的开裂或裂纹问题,但确切的成因仍需进一步的科学探究与证实。作为析氢催化剂,Ni-Mo镀层的开裂问题可能对电解制氢产生不利影响。因为在长时间工业析氢条件下,开裂的Ni-Mo镀层可能会发生脱落,严重时甚至会堵塞电解槽流道。因此,对于Ni-Mo镀层开裂问题的深入研究具有重要的实际意义。
研究者已报道了多种方法来减轻或消除Ni-Mo镀层的裂纹问题,但对于专门针对析氢电极应用中的Ni-Mo合金裂纹解决方案则相对匮乏。Liu等[15]和Suryanto等[16]通过脉冲电沉积制备出无裂纹Ni-Mo镀层。他们认为恒电流沉积制备的镀层会受到高应力而开裂,而脉冲电沉积可以在电镀间歇期间释放一些镀层应力,缓解开裂现象。但是Liu等和Suryanto等的研究并非针对析氢电极。为制备不开裂的Ni-Mo析氢电极,黄波[17]用离子液体镀液电镀Ni-Mo合金,以避免水系镀液电镀过程中的析氢副反应。结果是不但避免了Ni-Mo电极出现裂纹,而且在6 mol ·L-1 NaOH碱液中以100 mA ·cm-2电流密度析氢的过电位比在水系镀液中得到的电极降低了100 mV左右,尽管离子液系镀液的成本更高。
本研究首先基于观察Ni-Mo合金在电镀结束后镀层中的气泡析出、裂纹发展情况和氢剥离响应电流曲线,提出了水系镀液所得Ni-Mo镀层的开裂原因——随Ni、Mo金属离子沉积进入镀层的氢在电镀结束后又从镀层中释放出来,从而导致镀层收缩,最终产生开裂和脱落。进而,本研究提出一种更简单的避免Ni-Mo合金镀层开裂的新方法,无需依赖昂贵的离子液体或复杂的脉冲电源技术。只需适当降低镀液中Ni和Mo金属离子浓度使金属沉积处于扩散控制,同时施加大电流密度电镀即可避免镀层开裂。
1 实验部分 1.1 实验材料和设备实验用到的材料和设备见表 1。
| 试剂材料 | 纯度/规格 | 生产厂家 |
| 硫酸镍(NiSO4·6H2O) | AR | 上海阿拉丁生化科技股份有限公司 |
| 钼酸钠(Na2MoO4) | AR | 天津希恩思生化科技有限公司 |
| 柠檬酸钠(C6H5Na3O7·2H2O) | AR | 上海阿拉丁生化科技股份有限公司 |
| 氢氧化钾(KOH) | GR | 天津科密欧化学试剂有限公司 |
| 乙醇 | AR | 天津科密欧化学试剂有限公司 |
| 氨水(NH3·H2O) | AR | 天津科密欧化学试剂有限公司 |
| 硫酸(H2SO4) | AR | 天津科密欧化学试剂有限公司 |
| 去离子水 | 1 MΩ·cm | 天津永清源蒸馏水经营部 |
| 镍网(Ni mesh) | 200目 | 河北安平县辉瑞丝网制造厂 |
| 饱和甘汞电极(SCE) | R232 | 天津艾达恒晟科技发展有限公司 |
| 石墨板 | 2 cm×3 cm×0.1 cm,w=99.99% | 山东淄博宝越碳材料有限公司 |
| 铂片(Pt sheet) | 2 cm×2 cm×0.03 cm | 天津艾达恒晟科技发展有限公司 |
| 铂片电极夹 | J110 | 天津艾达恒晟科技发展有限公司 |
实验用到的水系镀液有3种,分别为Ni-Mo镀液、Ni镀液和低浓度Ni-Mo镀液。镀液制备方法如下:参照文献[18]的配方制备Ni-Mo镀液,其中包含了52 g ·L-1 NiSO4 ·6H2O、62 g ·L-1 Na2MoO4以及88 g ·L-1 Na3C6H5O7 ·2H2O,然后用氨水调节溶液至pH=10.5。Ni镀液按照52 g ·L-1 NiSO4 ·6H2O和88 g ·L-1 Na3C6H5O7 ·2H2O的配方进行配制。低浓度Ni-Mo镀液按照7.95 g ·L-1 NiSO4 ·6H2O、9.3 g ·L-1 Na2MoO4、13.2 g ·L-1 Na3C6H5O7 ·2H2O的配方进行配制,并进一步通过添加氨水调节溶液至pH=10.5。
电沉积前,将镍网裁剪成工作面积为1 cm×1 cm并带有极耳的电极基底。极耳是为了便于后面电镀和测试过程中导线连接电极。将裁剪好的镍网依次在乙醇、0.5 mol ·L-1 H2SO4和去离子水中超声15 min进行预处理,除去基底表面的油污和氧化物层,使镀层与基底结合牢固。
电镀时,用石墨板作电镀阳极,清洗过的镍网基底作电镀阴极,直流电源作电镀电源。在Ni-Mo镀液和Ni镀液中以恒电流密度20 mA ·cm-2、25 ℃下电镀20 min得到的电极分别记为NiMo/Ni mesh和Ni/Ni mesh。在低浓度Ni-Mo镀液中以恒电流密度500 mA ·cm-2和25 ℃下电镀20 min获得与NiMo/Ni mesh电极相同载量和镍钼比的电极,记为NiMo-L/Ni mesh。电极制备完成后,均用去离子水和乙醇清洗,干燥后将电极放置在密封袋中备用。
1.3 Ni-Mo合金电极的气泡现象和偏振光学显微镜观察将NiMo/Ni mesh电极经去离子水冲洗后立即置于预先超声除气的去离子水中,观察和记录气泡生成情况。为了监测镀层裂纹变化,电镀结束后将NiMo/Ni mesh电极快速取出,用去离子水冲洗并吸干水分,然后放置在卡尔蔡司偏振光学显微镜(Polarizing optical microscopy)下放大700倍进行观察。
1.4 样品表征和电化学测试用配置能量色散X射线能谱仪(Energy dispersive X-ray speictrometer, EDS)的日本日立8100型扫描电子显微镜(Scanning Electron Microscope, SEM)对制备的Ni-Mo合金电极进行形貌观测和元素分析。
电化学测试采用连接CHI760E工作站的三电极体系。以制备的样品作工作电极,铂片作对电极,饱和甘汞电极作参比电极。本研究所报道的电位均转化为相对于可逆氢电极(Reversible hydrogen electrode, RHE)的电位,转换公式为:ERHE=ESCE+0.241+0.059 pH。循环伏安法(Cyclic Voltammetry,CV)在0~0.6 V区间检测氢剥离电流,扫描速度为5 mV ·s-1。电极析氢极化曲线测试前需进行5圈-0.8~0 V的CV活化,扫描速度为50 mV ·s-1。活化后,使用线性扫描伏安法(Linear sweep voltammetry, LSV)在-0.8~0 V区间测试电极析氢性能,扫描速度为5 mV ·s-1。利用循环伏安法在-0.5~-0.2 V (vs. SCE)区间内扫描,扫描速率分别为20、40、60、80和100 mV ·s-1,测定电化学双层电容(Double-layer capacitance,Cdl)以估算电化学活性表面积(Electrochemical active surface area,ECSA)。
2 结果与讨论 2.1 电沉积Ni-Mo合金开裂机理图 1为Ni-Mo镀液在20 mA ·cm-2电流密度下,不同电镀时间所得电极的SEM图像。

|
| 图 1 不同电镀时间Ni-Mo电极电镜图 Fig.1 SEM of Ni-Mo electrode at different electroplating time |
| |
图 1显示,在电镀时间为20~120 min的范围内所得到的Ni-Mo合金镀层均开裂,并且随着电镀时间的增长,开裂程度呈现出加剧的趋势。
2.1.1 电极气泡冒出观察将电沉积法制得的NiMo/Ni mesh电极、Ni/Ni mesh电极以及原始镍网基底进行去离子水冲洗处理后,分别将其浸没在预先除气的去离子水中进行了观察,结果见图 2。实验发现,在Ni/Ni mesh电极和原始镍网基底上均未观测到气泡生成,而仅在NiMo/Ni mesh电极表面观察到了明显的气泡冒出。这显示有气体随金属离子的沉积进入Ni-Mo镀层中,并且气体会随后释放出来。而镀层未出现开裂的Ni/Ni mesh电极上没有观察到气泡出现。这说明Ni-Mo镀层的开裂或与其中的气体释放有关。

|
| 图 2 对浸泡在除气去离子水中不同电极上气泡的观察 Fig.2 observation of bubbles on different electrodes immersed in degassed deionized water |
| |
对电沉积NiMo/Ni mesh电极的镀层表面的光学显微镜连续观测结果见图 3。图 3显示了NiMo/Ni mesh电极同一个观察区域在7 min内的变化。实验结果显示镀层表面的裂纹在不断地变化和发展。例如在图 3中红色箭头所指处,原先无裂纹区域观察到了新生裂纹的形成,而已存在的裂纹呈现出扩展与延伸的趋势。类似的现象也有研究者在其他合金镀层上观察到,如Haché等[19]就通过视频拍摄捕捉的方法监测到了电镀结束后NiFeCr镀层的裂纹发展。结果显示镀层上单个裂纹形成时间小于0.4 s,并且随着时间推移,裂纹会逐渐加宽。他们认为是镀层内部氢氧化铬和铬氢化物的逐渐分解导致镀层体积收缩和内应力的积累,进而引发开裂。
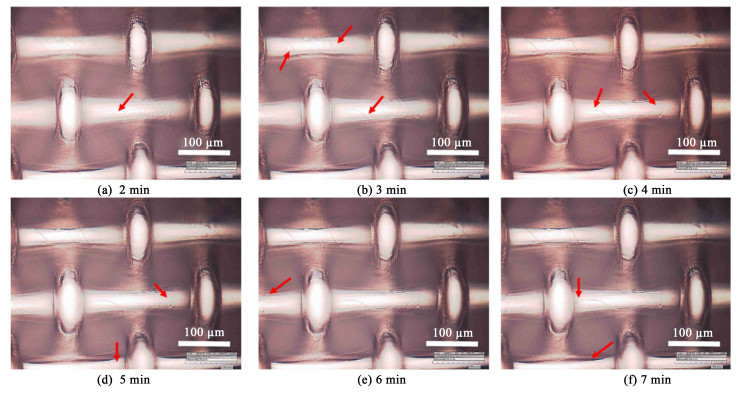
|
| 图 3 NiMo/Ni mesh电极随时间裂纹变化图 Fig.3 crack change of NiMo/Ni mesh electrode over time |
| |
根据上述观察,NiMo/Ni mesh电极在完成电镀后表现出显著的开裂现象和气体释放,而且两者发生的时间尺度相近。因此,本研究推断开裂原因是由于在水溶液电镀过程中产生的气体会嵌入到正在形成的金属镀层内部,并且在电镀结束后会从镀层内部释放出来,导致镀层表面收缩产生了拉应力,最终造成开裂。
2.1.3 电化学测试因为Ni-Mo镀层是在水系电解质中阴极电沉积过程的产物,并且过程中伴随有析氢反应,所以从镀层中释放的气体应该是氢气。本研究通过循环伏安测试对Ni-Mo镀层中气体成分进行验证,结果如图 4所示。在图 4 (a)中,展示了NiMo/Ni mesh电极、Ni/Ni mesh电极以及基底镍网在循环伏安(CV)第1圈扫描时的电流-电压特性。NiMo/Ni mesh电极在0.1~0.4 V之间有明显的电流峰,在此电位区间的电流为氢剥离电流(H2 stripping current)[20, 21]。表明镀层中含有大量氢。在氢剥离电流较高时,还能观察到电极上有气泡释放出来。而在第2圈扫描时,氢剥离电流显著减小(约至0.000 5 mA ·cm-2),证明镀层内氢已大幅逸出[图 4 (b)]。相比之下,在第1圈和第2圈CV扫描过程中,Ni/Ni mesh电极和基底镍网的氢剥离电流始终为0。说明Ni-Mo镀层中大量含氢是由于钼的加入。
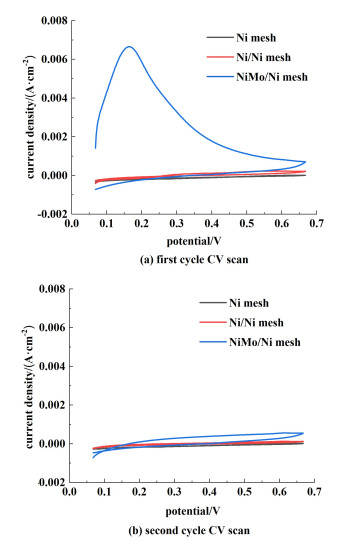
|
| 图 4 不同电极的CV图 Fig.4 CV diagram of different electrodes |
| |
基于上述实验结果,本研究提出Ni-Mo合金镀层容易开裂的根本原因是:氢在电沉积过程中伴随Ni和Mo金属离子一同进入镀层内部,在电镀结束后又持续从镀层内部逸出,导致镀层体积收缩。由于镍网基底与Ni-Mo镀层的结合限制镀层的自由变形,由此产生的收缩应力在达到临界值时引发开裂。前人在金属,特别是Ni-Mo合金电沉积研究中的若干发现也为上述见解提供了佐证和支持。Chassaing[22, 23]、Suryanto[16]和Crousier等[24]都曾报道在Ni-Mo镀层中检测到了氢元素,这表明氢确实会随金属离子沉积而被嵌入到镀层内部。此外,文献[14, 25]指出镀层中钼含量的增加与Ni-Mo镀层开裂加剧相关,Chassaing等[22]将此归因于Mo含量的提高使镀层内部捕获的氢含量增大。他们还发现在电镀完成1周后,镀层氢体积分数由250×10-6降至140×10-6,揭示了氢逸出的动态过程。还有研究者从金属结构变化来证实以电化学方法加入金属内部的氢可以自行溢出。例如,通过电化学方法给材料加氢时,X射线衍射(XRD)谱图会显示出与氢化物相关的新的衍射峰,然而随着后续的氢化物分解和氢逸出,相应的X射线衍射峰也会随之减弱直至消失[26-28]。这一系列的衍射峰变化动态地反映了氢在材料内部的注入、氢化物形成、分解以及最终逸出的完整过程,为氢逸出行为提供了直接的金属结构演化证据。张昕[29]和袁诗璞[30]等的氢相关应力理论指出在电沉积过程中渗入镀层内的氢气在后续释放后会导致镀层收缩并产生拉应力。当这种应力超出镀层的承受极限时,就会引发开裂等脆性破坏。这些前人研究明确了镀层内氢的累积及其后续释放是导致镀层开裂的核心因素。
2.2 新型电极制备与表征为解决Ni-Mo镀层开裂问题,本研究提出了一种采用低浓度镀液并配合大电流密度的电镀方法。所得NiMo-L/Ni mesh电极不仅避免了镀层开裂问题,而且显著提升了电极的析氢性能。为便于无开裂的NiMo-L/Ni mesh电极与有开裂NiMo/Ni mesh电极比较,实验调整了电沉积工艺条件使二电极中NiMo镀层质量接近,分别是2.74和2.87 mg。另外, EDS表征结果显示,二电极中Ni-Mo镀层中的镍钼原子比均约为5 ∶1[图 5(a)和图 5 (b)]。由SEM图像可见,NiMo/Ni mesh电极上的镀层有严重开裂,镀层厚度约为1.54 μm,而其表面相对平整光滑[图 5 (c)]。而NiMo-L/Ni mesh电极上的镀层未见有开裂,镀层表面呈现明显的凹凸粗糙结构[图 5 (d)],这归因于非均匀沉积过程。因为在低浓度镀液、高电流密度条件下进行电镀时,促进了局部优先沉积,形成了多孔隙和通道丰富的疏松结构,这不仅有利于沉积过程中氢的快速逸出,还有效分散了由氢释放引起的收缩应力,避免了镀层开裂。与文献报道的脉冲电沉积法[15, 16, 31]异曲同工,均通过促进氢的适时释放来减轻内部应力。
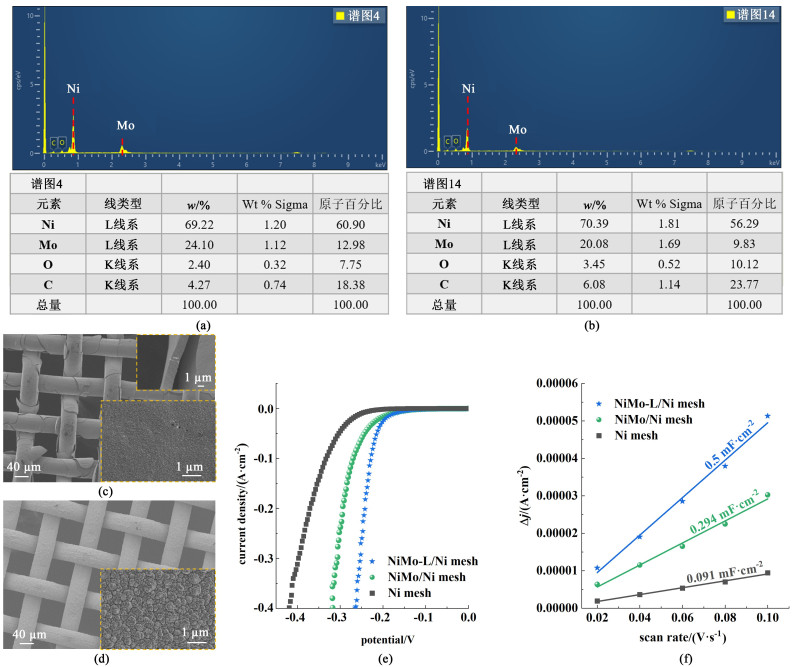
|
| 图 5 (a) NiMo/Ni mesh电极能谱图; (b) NiMo-L/Ni mesh电极能谱图; (c) NiMo/Ni mesh电极电镜图; (d) NiMo-L/Ni mesh电极电镜图; (e) 各电极极化曲线图; (f) 各电极ECSA Fig.5 EDS of (a) NiMo/Ni mesh electrode; (b) NiMo/L/Ni mesh electrode; SEM of (c) NiMo/Ni mesh electrode; (d) NiMo/L/Ni mesh electrode; (e) polarization curves of each electrode; (f) ECSA of each electrode |
| |
凹凸粗糙的镀层形貌还使NiMo-L/Ni mesh电极表现出更高的HER活性[图 5 (e)]。当析氢电流密度为400 mA ·cm-2时,NiMo-L/Ni mesh电极的过电位相较于NiMo/Ni mesh电极和基底镍网分别降低了55和157 mV。NiMo-L/Ni mesh电极与NiMo/Ni mesh电极表面的镍钼原子比相近[图 5(a)和图 5 (b)],但前者的电化学活性面积约为后者的1.7倍[图 5 (f)]。所以,NiMo-L/Ni mesh电极的HER活性提高的主因是其电化学活性面积的增加,即镀层形貌的凹凸起伏增加了电极表面积,使更多的活性位点得到暴露。
3 结论本研究揭示了NiMo合金电镀层开裂的机理,即电镀期间氢随镍、钼金属离子共同沉积并积聚在合金镀层内部。当电镀过程结束,积聚的氢会快速释放。这一过程会造成镀层体积收缩,从而形成收缩应力。当该应力超过材料本身的抗拉强度时,就会导致镀层开裂。针对这一问题,本研究提出通过降低镀液浓度与增大电流密度的策略,诱导非均匀金属沉积,形成的凹凸起伏形貌有利于嵌入氢的快速逸出并有效分散应力,从而减少开裂的可能性。实验结果表明,该方法不仅达到了避免镀层开裂的目的,同时还提高了Ni-Mo合金的电化学析氢性能。400 mA ·cm-2时,无镀层开裂的NiMo-L/Ni mesh电极过电位仅260 mV,相较于传统NiMo/Ni mesh电极及基底镍网分别降低了55和157 mV。
本研究不仅揭示了Ni-Mo合金电极镀层开裂的原因,还提出了有效解决方案,为今后防止类似问题提供了理论基础和实践指导。抑制镀层裂纹对于提升Ni-Mo电极的结构稳定性至关重要,也有助于推动Ni-Mo合金电极在碱性水电解制氢等大规模应用领域的商业化进程。
| [1] |
赵永志, 蒙波, 陈霖新, 等. 氢能源的利用现状分析[J]. 化工进展, 2015, 34(9): 3248-3255. ZHAO Yongzhi, MENG Bo, CHEN Linxin, et al. Utilization status of hydrogen energy[J]. Chemical Industry and Engineering Progress, 2015, 34(9): 3248-3255. (in Chinese) |
| [2] |
倪萌, LEUNG M K H, SUMATHY K. 电解水制氢技术进展[J]. 能源环境保护, 2004(5): 5-9. NI Meng, LEUNG M K H, SUMATHY K. Progress of hydrogen production by electrolytic water[J]. Energy and Environmental Protection, 2004(5): 5-9. DOI:10.3969/j.issn.1006-8759.2004.05.002 (in Chinese) |
| [3] |
郭博文, 罗聃, 周红军. 可再生能源电解制氢技术及催化剂的研究进展[J]. 化工进展, 2021, 40(6): 2933-2951. GUO Bowen, LUO Dan, ZHOU Hongjun. Recent advances in renewable energy electrolysis hydrogen production technology and related electrocatalysts[J]. Chemical Industry and Engineering Progress, 2021, 40(6): 2933-2951. (in Chinese) |
| [4] |
ZHANG J, ZHANG S, LI S, et al. Electrocatalytic properties of nickel foam-based Ni-Mo, Ni+Mo and Ni+Mo/Ni-Mo electrodes for hydrogen evolution reaction[J]. Materials Science Forum, 2018, 921: 134-140. DOI:10.4028/www.scientific.net/MSF.921.134 |
| [5] |
LI C, WANG J, WANG Y, et al. Enhancing hydrogen evolution reaction by synergistically coupling NiMo alloy with Ni(OH)2 nanosheet on carbon cloth[J]. ChemistrySelect, 2020, 5(22): 6774-6779. DOI:10.1002/slct.202000955 |
| [6] |
RAJ I A. Nickel-based, binary-composite electrocatalysts for the cathodes in the energy-efficient industrial production of hydrogen from alkaline-water electrolytic cells[J]. Journal of Materials Science, 1993, 28(16): 4375-4382. DOI:10.1007/BF01154945 |
| [7] |
SANTOS H L S, CORRADINI P G, MEDINA M, et al. NiMo-NiCu inexpensive composite with high activity for hydrogen evolution reaction[J]. ACS Applied Materials & Interfaces, 2020, 12(15): 17492-17501. |
| [8] |
MCKONE J R, WARREN E L, BIERMAN M J, et al. Evaluation of Pt, Ni, and Ni-Mo electrocatalysts for hydrogen evolution on crystalline Si electrodes[J]. Energy & Environmental Science, 2011, 4(9): 3573-3583. |
| [9] |
KRSTAJIC N, JOVIC V, GAJICKRSTAJIC L, et al. Electrodeposition of Ni-Mo alloy coatings and their characterization as cathodes for hydrogen evolution in sodium hydroxide solution[J]. International Journal of Hydrogen Energy, 2008, 33(14): 3676-3687. DOI:10.1016/j.ijhydene.2008.04.039 |
| [10] |
LI N, HUANG J, CHEN W, et al. Electrochemical characteristics of the amorphous-nanocrystal Ni-Mo cathodes in sodium hydroxide solution[J]. Key Engineering Materials, 2015, 667: 280-285. DOI:10.4028/www.scientific.net/KEM.667.280 |
| [11] |
SUN S, PODLAHA E J. Electrodeposition of Mo-rich, MoNi alloys from an aqueous electrolyte[J]. Journal of the Electrochemical Society, 2011, 159(2): D97-D102. DOI:10.1149/2.091202jes |
| [12] |
WANG M, WANG Z, YU X, et al. Facile one-step electrodeposition preparation of porous NiMo film as electrocatalyst for hydrogen evolution reaction[J]. International Journal of Hydrogen Energy, 2015, 40(5): 2173-2181. DOI:10.1016/j.ijhydene.2014.12.022 |
| [13] |
JOVIC V, JOVIC B, GERY S. Composition and morphology changes and their influence on hydrogen evolution on Ni-Mo and Fe-Mo alloys electrodeposited by DC and pulsed current[C]//American Electroplaters and Surface Finishers Society, 2002
|
| [14] |
BAO Q, ZHENG W, CHEN L, et al. Optimization of plating process and corrosion behavior of nanocrystalline Ni-Mo coatings on pure aluminum[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2022, 636: 128128. DOI:10.1016/j.colsurfa.2021.128128 |
| [15] |
LIU C, HUANG X, XU R, et al. Microstructure and properties of nanocrystalline Ni-Mo coatings prepared by ultrasound-assisted pulse electrodeposition[J]. Journal of Materials Engineering and Performance, 2021, 30(4): 2514-2525. DOI:10.1007/s11665-021-05570-1 |
| [16] |
Eagleton, Earwaker, Fa rr, et al. Pulse electrodeposited nickel molybdenum[J]. Transactions of the IMF, 2007, 85(1): 34-39. DOI:10.1179/174591907X162468 |
| [17] |
黄波. 离子液体中电沉积镍钼合金及其催化析氢性能[D]. 天津: 天津大学, 2014 HUANG Bo. The preparation of Ni-Mo alloy in ionic liquid and its catalytic properties for hydrogen evolution[D]. Tianjin: Tianjin University, 2014 (in Chinese) |
| [18] |
NAVARRO-FLORES E, CHONG Z, OMANOVIC S. Characterization of Ni, NiMo, NiW and NiFe electroactive coatings as electrocatalysts for hydrogen evolution in an acidic medium[J]. Journal of Molecular Catalysis A: Chemical, 2005, 226(2): 179-197. DOI:10.1016/j.molcata.2004.10.029 |
| [19] |
HACHÉ M J R, ZOU Y, ERB U. Post-deposition crack evolution in Cr(Ⅲ) alloy electrodeposits: Phenomenology[J]. Surface and Coatings Technology, 2021, 406: 126648. DOI:10.1016/j.surfcoat.2020.126648 |
| [20] |
张慧, 周芬, 潘牧. Pt合金催化剂电化学活性面积表征方法综述[J]. 科学通报, 2023, 68(5): 448-456. ZHANG Hui, ZHOU Fen, PAN Mu. Review on electrochemical active surface area characterization methods of Pt alloy catalysts[J]. Chinese Science Bulletin, 2023, 68(5): 448-456. (in Chinese) |
| [21] |
张颖, 段莉蕾. 加氢反应器不锈钢单层堆焊氢剥离试验研究[J]. 一重技术, 2015(2): 41-46. ZHANG Ying, DUAN Lilei. Hydrogen-induced disbonding test on single stainless steel clad layer of hydrogenation reactors[J]. CFHI Technology, 2015(2): 41-46. DOI:10.3969/j.issn.1673-3355.2015.02.010 (in Chinese) |
| [22] |
CHASSAING E, VU QUANG K, BAUMGÄRTNER M E, et al. Properties of electrodeposited Ni-Mo alloy coatings[J]. Surface and Coatings Technology, 1992, 53(3): 257-265. DOI:10.1016/0257-8972(92)90384-M |
| [23] |
CHASSAING E, CORNET M, KINH V Q. Influence of codeposited impurities on hydrogen permeation and properties of Ni-Mo and Co-Mo electrodeposited alloys[J]. Surface Technology, 1978, 7(2): 145-150. DOI:10.1016/0376-4583(78)90007-9 |
| [24] |
CROUSIER J, EYRAUD M, CROUSIER J P, et al. Influence of substrate on the electrodeposition of nickel-molybdenum alloys[J]. Journal of Applied Electrochemistry, 1992, 22(8): 749-755. DOI:10.1007/BF01027505 |
| [25] |
HALIM J, ABDEL-KARIM R, EL-RAGHY S, et al. Electrodeposition and characterization of nanocrystalline Ni-Mo catalysts for hydrogen production[J]. Journal of Nanomaterials, 2012, 2012: 845673. DOI:10.1155/2012/845673 |
| [26] |
YAO Y, PANG X, GAO K. Investigation on hydrogen induced cracking behaviors of Ni-base alloy[J]. International Journal of Hydrogen Energy, 2011, 36(9): 5729-5738. DOI:10.1016/j.ijhydene.2011.01.123 |
| [27] |
KAMACHI K. An X-ray study of hydrides formed in austenitic stainless steels[J]. Transactions of the Iron and Steel Institute of Japan, 1978, 18(8): 485-491. DOI:10.2355/isijinternational1966.18.485 |
| [28] |
WANG Q, LIU X, ZHU T, et al. Mechanism of hydrogen-induced defects and cracking in Ti and Ti-Mo alloy[J]. International Journal of Hydrogen Energy, 2023, 48(15): 5801-5809. DOI:10.1016/j.ijhydene.2022.11.119 |
| [29] |
张昕. 对电镀层内应力形成机理的研究[J]. 中小企业管理与科技(上旬刊), 2014(9): 308. ZHANG Xin. Study on the formation mechanism of internal stress in electroplating layer[J]. Management & Technology of SME, 2014(9): 308. (in Chinese) |
| [30] |
袁诗璞. 第十四讲: 镀层的内应力与脆性[J]. 电镀与涂饰, 2009, 28(10): 40-44. YUAN Shipu. Lecture 14——Internal stress and brittleness of coating[J]. Electroplating & Finishing, 2009, 28(10): 40-44. (in Chinese) |
| [31] |
AHMADI K, BRANKOVIC S R, YARALI M, et al. Crack formation during electrodeposition and post-deposition aging of thin film coatings[R]. 2020, https://www.researchgate.net/publication/341849797
|
 2024, Vol. 41
2024, Vol. 41





