为了积极应对全球气候变化、减少温室气体排放、实现可持续发展,我国提出了“碳达峰和碳中和”的“双碳”目标。通过实现“双碳”目标,推动能源结构从依赖化石燃料向更多采用清洁能源转变,提高能源使用效率,降低环境污染。氢能具有能量密度高、储量丰富、绿色低碳、应用范围广等优点,正在成为未来能源转型的关键组成部分。与此同时,电解水制氢、燃料电池等利用氢能的可再生能源转换技术引起了人们的广泛关注。离子交换膜(Ion exchange membrane, IEM)在以上电化学能源装置上的应用非常广泛,具有传递离子、分隔气体、为电极反应提供单一可控的环境等功能,在电化学反应中扮演着关键角色,IEM的发展在提高能源转换效率,实现可持续能源转型方面具有重要意义。
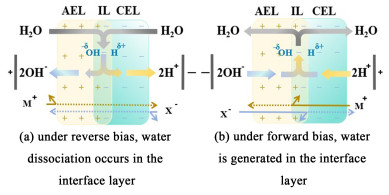
双极膜(Bipolar membrane,BPM)是一类具有特殊结构的离子交换膜,由带负电的阳离子交换膜层(Cation-exchange layer,CEL)和带正电的阴离子交换膜层(Anion-exchange layer,AEL)复合而成。CEL和AEL之间的界面称为“界面层”(Interfacial layer,IL),界面层的存在使BPM具有不同于CEL和AEL的离子传导特性,其电流-电压特性类似于半导体中的PN结[1](图 1):反向偏压下,膜内正负离子在电场的作用下向主体溶液迁移,BPM电阻增大,界面层内形成约108 V ·m-1的电势梯度,水分子解离为H+与OH-;正向偏压下,主体溶液中的正负离子向膜内迁移,在界面层结合生成水分子,使膜内电阻降低。
根据BPM反向偏压下水解离与正向偏压下水生成的特性,可将其用于多种电化学应用如燃料电池、电解水制氢、二氧化碳还原和液流电池等。其中,在双极膜燃料电池(Bipolar membrane fuel cell,BPMFC)中,由于水在界面层生成,此独特的自增湿机制解决了电池的水管理问题;双极膜电解水制氢(Bipolar membrane water electrolyzer,BPMWE)的酸碱双极界面结构可维持膜两侧pH值梯度恒定,提高HER和OER效率;独特的优势使得BPM区别于传统的离子交换膜在电化学能源转换装置方面的应用,在降低能耗方面具有重要前景。
本论文从BPM水解离机理出发,详细介绍BPM组成、界面层结构及BPM制备工艺,主要着眼于BPM在氢能领域的2大应用:双极膜燃料电池和双极膜电解水制氢的国内外研究进展,提出关键问题和发展方向,总结绿色制氢发展的机遇和挑战,并对BPM在其他领域的相关应用进行了梳理。
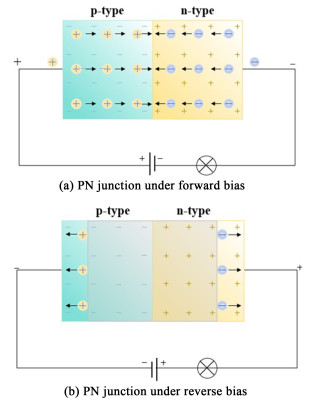
1 双极膜的水解离理论双极膜是一类特殊的离子交换膜,由阳离子和阴离子交换层结合而成,可通过水离解机制产生H+和OH-,而非在电极处产生气体。由于阴、阳离子膜的复合,双极膜具有独特的电化学特性,通常用同样具有电流-电压行为的PN结半导体来描述BPM[1](图 2):在正向偏压下,来自P型材料的空穴和来自N型材料的电子会向PN结的中央扩散,从而减小电势垒的高度。当电势垒的高度降低到一定程度,空穴与电子即可穿过PN结形成电流。在反向偏压下,空穴和电子将被电势差吸引而拉离PN结,并产生耗尽层,导致电流停止。
将水与半导体进行比较,则水解离产生质子和氢氧根离子的化学平衡与半导体中载流子的化学平衡类似[3],故BPM是与无机态半导体PN结类似的高分子膜:在正向偏压下,离子向双极界面处迁移并在界面积累,以至于穿过膜层在双极膜的另一侧进入溶液中,此时膜具有较低的电阻,电流随外加电压快速增加。在反向偏压下,由于固定带电基团的静电排斥,同离子无法从溶液中渗透进离子交换层,反离子却被高效地抽提,导致2离子交换层中间存在一个狭窄的离子耗尽层,该区域由于电荷分离故存在极高的电场(E≈108 V ·m-1)。由于BPM水解离产物的存在,可以观察到膜两侧的溶液存在明显的pH值梯度。
普通的水解离反应为可逆反应,正反应生成H+和OH-,逆反应生成水,在无外加电场时,若将BPM水解离看作为普通的水解离,则产生的H+和OH-通量可按式(1)计算且不会超过式(1)的最大值[4]。
| $ J_{\mathrm{H}^{+}, \mathrm{OH}^{-}}=k_{\mathrm{d}, \mathrm{W}}^0 c_{\mathrm{W}, \mathrm{J}} \lambda $ | (1) |
式(1)中:kd, W0=2.5×10-5 s-1,为无外加电场时的水解离速率常数;cW, J≈10 mol ·L-1,为双极界面处的水分子浓度;λ≈10-8 m,为BPM界面层的最大厚度。式(1)计算出H+和OH-通量约为2×10-9 mol ·m-2 ·s-1,然而实际BPM内H+和OH-通量为10-2 mol ·m-2 ·s-1[5],远高于理论值107倍。理论值与实际值的不一致发展了多种有关水解离的理论。
1.1 第二维恩效应(The Second Wien Effect,SWE)第二维恩效应指的是,对于弱电解质,当外界施加的电场足够高时,电导会随电场强度迅速增加,即欧姆定律失效[6]。由Onsager等[7]开发的动力学模型同时考虑了外部电场与荷电粒子之间的库仑相互作用,对于水解离机理如式(2)所示。
| $\begin{array}{l} &2 \mathrm{H}_2 \mathrm{O} \underset{k_{\mathrm{ba}}}{\stackrel{k_{\mathrm{ab}}} {\rightleftharpoons}} \mathrm{H}_3 \mathrm{O}^{+} &\cdots \mathrm{OH}^{-} \underset{k_{\mathrm{cb}}}{\stackrel{k_{\mathrm{bc}}}{\rightleftharpoons}} \mathrm{H}_3 \mathrm{O}^{+}&+\mathrm{OH}^{-}\\ &\rm{(a)}&\rm{(b)}&\rm{(c)} \end{array} $ | (2) |
式(2)中,(a)和(b)之间发生化学构型转换,(b)和(c)之间因静电相互作用发生复合或解离。此模型假定kcb步骤与化学构型转换步骤与外加电场场强无关,仅有kbc与场强有关,则随着场强增大,解离速率增加,复合速率保持不变[8]。此时水的解离速率与电场强度的关系为[9]:
| $ k_{\mathrm{d}, \mathrm{SWE}}=\frac{I_1(\sqrt{-b})}{\sqrt{2 b}} k_{\mathrm{d}, \mathrm{W}}^0 $ | (3) |
| $ b=\frac{0.096 E}{\varepsilon_{\mathrm{r}} T^2} $ | (4) |
式(3)和式(4)中:kd, W0为外加电场为0时的水解离常数;I1为一阶Bessel函数;εr为介电常数;E为外加电场强度;T为温度;当E>6×107 V ·m-1时,式(4)可转换为:
| $ k_{\mathrm{d}, \mathrm{SWE}} \approx\left(\frac{2}{{\rm{\mathsf{π}}}}\right)^{\frac{1}{2}}(8 b)^{-\frac{3}{4}} \exp \left[(8 b)^{\frac{1}{2}}\right] k_{\mathrm{d}, \mathrm{W}}^0 $ | (5) |
此处假设双极界面层的是突变结合的,具有薄的空间电荷区域,当移动离子完全耗尽时,水分子的解离类似于弱电解质的解离。将实际BPM界面层水解离的场强代入式(5) (E≈108 V ·m-1),有kd, SWE/kd, W0≈107,这是BPM水解离速率随着场强增大的原因。尽管Onsager提出的SWE模型与实验测得的结果一致[10],但将此理论运用到双极界面还是存在一定的局限性[9]。该模型忽略的结构特征在实际运用中恰恰对水溶液有重要影响,且水分子在双极界面处(尤其靠近固定荷电基团时)的高电场下会发生局部扭曲。SWE模型仅在107~108 V ·m-1的电场范围内适用,但实际BPM界面层的电场高达108~109 V ·m-1,且该模型无法解释阴阳离子交换层水解离速率不一致的原因[5]。由此可见,在讨论BPM的水解离速率时,不仅需要考虑界面层的高电场,离子交换层上固定基团的化学属性也同样重要。
1.2 化学反应理论(Chemical Reaction Theory,CHR)SWE模型假设2膜层水解离效应完全一致,但实际过程中阴离子交换膜的水解离效应大于阳离子交换膜[11]。为了解释这一现象,Simons[8]提出了化学反应理论来解释BPM水解离机理,通过研究—NH4+、COO-、—SO3-等膜层上固定离子基团的特性,CHR理论认为水的解离主要是由于膜层上固定基团与水分子之间发生质子化和去质子化反应引起的,机理如下。
对于阴离子交换层:
| $ \mathrm{B}+\mathrm{H}_2 \mathrm{O} \rightleftharpoons \mathrm{BH}^{+}+\mathrm{OH}^{-} $ | (6a) |
| $ \mathrm{BH}^{+}+\mathrm{H}_2 \mathrm{O} \rightleftharpoons \mathrm{B}+\mathrm{H}_3 \mathrm{O}^{+} $ | (6b) |
对于阳离子交换层:
| $ \mathrm{A}^{-}+\mathrm{H}_2 \mathrm{O} \rightleftharpoons \mathrm{AH}+\mathrm{OH}^{-} $ | (7a) |
| $ \mathrm{AH}+\mathrm{H}_2 \mathrm{O} \rightleftharpoons \mathrm{A}^{-}+\mathrm{H}_3 \mathrm{O}^{+} $ | (7b) |
式(6a)~式(7b)中:B与A-为膜层固定荷电基团,BH+与A-为质子转移反应的催化活性位点。由于BPM同时具有阴离子交换层与阳离子交换层,上述水解离反应也同样适用。由于阴离子交换基团的催化作用比阳离子交换基团明显,AEL对水解离作用更大,BPM水解离主要发生在界面层中更靠近AEL区域[12],H+与OH-由膜上固定荷电基团与水分子之间发生质子化和去质子化反应。Simons[5, 8]的研究表明,高电场会导致质子化和去质子化反应中的水解离速率增加,Timashev与Kirganova由此提出了经验方程[13]:
| $ k_{\mathrm{d}, \mathrm{CHR}}=k_{\mathrm{d}, \mathrm{CHR}}^0 \exp \left(\frac{\alpha F}{R T} E\right) $ | (8) |
式(8)中:kd, CHR0为无电场时水的解离常数;α为反应的长度因子,约为10-10 m。将α值与E值(10-8 V ·m-1) 代入式(8),可得kd, CHR/kd, CHR0≈20,这对BPM中异常高的水解离速率做出了解释。
1.3 中和层理论(Neutral Layer,NL)中和层理论模型认为在2膜层界面处存在着1层中和区域导致了双极界面处较大的电压消耗,与前两者不同的是,该模型认为水解离不发生在双极膜内的中和层,而是发生在离子交换层的电荷区与电荷和中和层区域的界面处。在反向偏压下,此区域产生的H+和OH-到达中和层时会重新结合。由于此区域的电场强度非常小,水的解离速率远远小于H+与OH-重新结合的速率,到达稳态时二者达到平衡[14]。该理论无法适用于不存在中和层的双极膜体系,例如在基膜两侧引入不同固定荷电基团的双极膜。
2 双极膜的组成双极膜主要由阴离子交换膜层(AEL)、阳离子交换膜层(CEL)和2层之间的界面层(IL)组成。其中,AEL与CEL必须有高度选择透过性以保证水解离产生的H+、OH-及时迁移出界面层及膜外水分子及时补充到IL;且2膜层还需具有同离子选择性,防止同离子进入界面层并从另一膜层迁移。另外,膜还需满足机械强度高、电阻低、水解离电压小等条件。BPM的独特结构使得水解离发生在IL,在设计BPM时,仅考虑具有优良性能的阴、阳离子交换膜层是不够的,也需要巧妙设计在2膜层之间的界面层。工作电压由界面层的厚度、亲水性、静电效应、空间效应等共同决定。
2.1 离子交换膜层大多数商业BPM都采用带有季铵盐基团[15]的以聚苯乙烯为高分子主链的AEL。叔胺和仲胺以及不同的二胺[16]也可以作为阴离子官能团。聚偏氟乙烯(PVDF)、聚砜以及其他各种共聚物[17]可代替聚苯乙烯用作AEL的高分子主链(表 1)。化学稳定性是AEL的瓶颈,季铵基团在碱性溶液中会通过霍夫曼反应降解[18]。近年来,多项研究试图提高AEL的化学稳定性。然而迄今为止,阴离子交换层材料的化学稳定性差仍然是一个问题。
用于商业BPM的CEL通常带有磺酸基团,极少数情况下含有膦酸基团或羧基[26]。带有磺酸基团的CEL主要以交联聚苯乙烯为骨架,也有基于聚苯醚[27]、聚氯乙烯[28]和聚醚醚酮[29]的例子(表 2)。磺化可以使用硫酸、三氧化硫、发烟硫酸或其混合物来完成[30]。
膜材料对膜层的迁移性能和化学稳定性,机械稳定性和界面层的强度和形态皆有影响。故研究人员对膜材料从以下角度进行优化以改善BPM的综合性能:选择不同的高分子骨架和功能基团;改变离子交换基团的含量;改变共混膜、共聚膜或异相膜的混料比;改变交联剂的种类和数量等。
2.2 界面层 2.2.1 水解离催化剂Simons在水解离的质子化-去质子化理论式(6)~式(7)中提到水解离过程受到膜上固定离子基团的影响[5],且膜上固定离子基团直接参与水解离反应并可增加解离速率[31]。通过对具有不同CEL离子基团(磺酸基、羧基、膦基)的研究表明,BPM上的电势差由固定基团的解离常数Ka决定,且随着Ka减小而降低。因此CEL中的弱离子基团如酚羟基、膦酸基和羧酸基,以及AEL中的伯、仲、叔胺基、咪唑基和吡啶基等基团均可加速水解离[32, 33]。
为了促进含有强离子基团的BPM中的水解离,通常将额外的催化剂引入界面层。有机水解离催化剂主要是含有吡啶、胺基、磺酸基团、羧基和季铵[34]等催化活性官能团的聚合物和聚电解质如聚乙烯醇(PVA)、吡啶二羧酸(DPA)[35]等。大多数商业和文献报道的BPM使用的pKa在4到10之间的弱酸或弱碱作为常用催化剂,如羧酸和磷酸[36]。
最常用的无机催化剂包括金属氧化物/氢氧化物[37]、金属络合物[38]、金属盐[39]和其他金属化合物。当Ca2+或Mg2+等金属离子作为电解质存在时,电膜系统中的水解离速率急剧增加[40]。单极膜表面在水解离过程中形成了不溶的金属氢氧化物,特别是Mg(OH)2,并随之带来H+ 和OH- 离子通量的增加,Mg(OH)2参与并加速了水解离过程:
| $ \mathrm{Me}(\mathrm{OH})_n \underset{k_{-1}}{\stackrel{k_1}{\rightleftarrows}} \mathrm{Me}(\mathrm{OH})_{n-1}^{+}+\mathrm{OH}^{+} $ | (9) |
| $ \mathrm{Me}(\mathrm{OH})_{n-1}^{+}+\mathrm{H}_2 \mathrm{O} \underset{k_{-2}}{\stackrel{k_2}{\rightleftharpoons}} \mathrm{Me}(\mathrm{OH})_n+\mathrm{OH}^{+} $ | (10) |
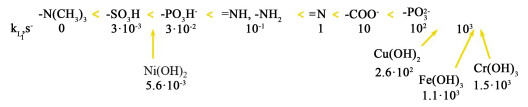
中科大徐铜文等[41]通过调控苯胺分子在中间层界面处原位锚定、聚集、聚合生长并包裹羟基氧化铁颗粒构建稳定水解离催化层,在电流密度100 mA ·cm-2下水解离电压仅为1.1 V。Melnikov等[42]研究的一些过渡金属氢氧化物扩展了水解离反应中已知的离子基团的催化活性顺序(图 3)。
另一类在质子化-去质子化反应中具有催化活性的化合物以金属有机骨架(Metal-organic framework,MOF)为代表,即金属离子与有机配体以配位键组成的化合物。因此,MOF可以受益于2个不同的催化位点,分别为中心的无机催化基团(金属基团)和配体中的有机催化基团[43], 且MOF的配位结构通过金属离子与有机配体的强相互作用,形成稳定的三维网络,这种结构有利于增强稳定性,延缓金属离子的损失,延长催化剂寿命。
最近石墨烯/碳基材料作为催化材料也受到了广泛关注[44, 45]。McDonald等[46]将氧化石墨烯引入BPM界面层,相比于对照膜,BPM过电位降低了75%,氧化石墨烯最大的优点在于它的加入不会引起中间层厚度的增加,而是通过改变膜结构来提高膜的水解离效率,且他们发现氧化石墨烯薄膜的催化活性受到薄膜的沉积条件影响,就此可进一步调节得到的BPM性能。Manohar等[47]用膦基和季铵基对氧化石墨烯进行功能化,获得了具有高选择性和低工作电压的双极膜。Liu等[48]使用碳纳米管将铁离子固定在BPM界面处,对碳纳米管功能化使铁离子与管表面的离子基团结合,从而减少铁离子泄漏。最后,还有一些其他有前途的化合物,例如离子液体[49]和氧化石墨烯-聚苯胺复合物[50]的催化活性被报道。
2.2.2 界面层结构2膜层之间的IL是高性能BPM最关键的组成部分。界面结构、组成和形貌决定了反向偏压下水解离和离子分离的动力学[31]。
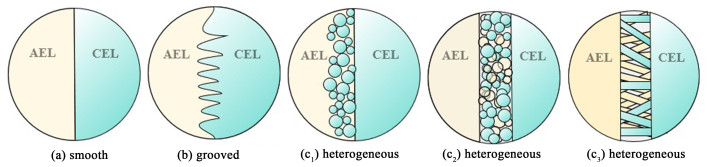
IL可以根据水解离催化剂的特性以及膜层与催化剂之间的连接方式设计成不同的结构,且两者之间的连接方式根据膜层的不同类型和形态而变化(图 4)。在突变结模型中,界面层的厚度(δ)被假定为无穷小,2膜层互不渗透形成光滑界面,突变结模型的缺点是未考虑水或催化剂层的存在,也排除了界面层和离聚物中官能团强度和离子通道结构对BPM界面和外层的异质性和形态的影响[51]。简单地层压具有光滑表面的CEL和AEL层可形成平滑界面,平滑界面的形成主要与膜层的物理化学性质差异导致的形态不均匀和接触不良有关。在某些情况下,BPM的某一膜层可被粗糙化或微图案化[52],便于另一膜层融合,形成粗糙界面。粗糙界面可通过在预制的、粗糙的一膜层上浇铸另一膜层来形成,以溶液的形式浇铸第2层(而不是用预先形成的膜)会使2膜层之间的接触增强,从而形成稳定的双极膜,这种情况在第1膜层中使用增强材料时更为突出。一定的粗糙度使界面处的接触面积增加,从而降低驱动水解离和离子分离所需的过电势。Arges等[52]最近报道了通过在CEL上以圆孔的形式形成图案来制备具有粗糙(微图案化)界面的BPM,与没有微图案的相应BPM界面相比,这种方法可将界面接触面积增加约2倍,相当于起始电位降低约250 mV。BPM界面层一般或多或少具有异相性,在界面引入催化剂时,会形成异相界面,填充单独的催化剂与填充单极或双极离聚物和催化剂时具有不同的水解离动力学。使用静电纺丝技术制备的BPM也会形成异相界面,界面层随机分布着大量由阴阳离聚物组成的纳米纤维,交织的纤维网络使2膜层的连接更紧密,离聚物层具有高表面积[53],可提高水解离反应的效率,使水和离子在界面中的传输更高效,在高电流密度下运行更稳定。在调控界面层组成和结构时,在2膜层的物理化学和电化学性质中保持适当的平衡对于确保界面层的良好接触是非常重要的,膨胀率和机械性能等2膜层性能的差异可能会导致界面层在操作过程中分层。由于具有异相界面的膜表面会部分不导电,故与具有均相界面的膜相比,具有异相界面的膜通常表现出更高的膜电位,具有均相界面的BPM在电化学能源系统中应用较广。一般均相BPM的界面层宽度不超过1 nm[54],对于具有高水解离速率的BPM,界面层厚度(2λ)应小于空间电荷区的Debye长度,当2膜层相互渗透时,“模糊”的界面层电场减小,水解离速率下降。
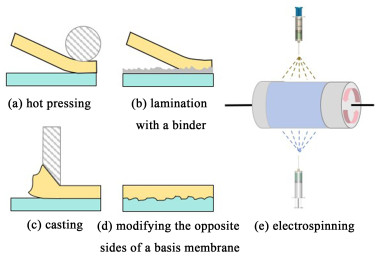
在制备BPM时,不仅涉及最佳膜材料的选择与设计,还需使用合适的制备工艺。制备工艺对BPM的厚度、机械强度、界面结构、离子交换容量等有很大的影响,相同的膜材料通过不同的膜层复合工艺可制得性能不同的BPM。材料特性、内部结构和复合工艺等多方面共同决定BPM的水解离性能,制备BPM的主要方法有热压法、黏合法、流延法、基膜改性法和静电纺丝法等(图 5)。
热压法指将阴、阳离子交换膜层贴合紧密叠放在一起,再通过热压机加热加压制得BPM,制得注意的是,加压前需排出2膜层结合处的气泡。该工艺制备的BPM存在2膜层互相渗透的问题,由于固定基团之间存在静电相互作用,故BPM界面层电阻升高,导致BPM工作电压增大,能耗变高。
黏合法即在阴、阳离子交换膜层之间添加黏合剂,将2膜层紧密黏合在一起。黏合剂要有足够的黏合力和较好的离子渗透能力,在黏合过程中要排除膜层与黏合剂中的气泡,也可利用加热加压的方法使2膜层黏合的更紧密。黏合剂的引入使界面层厚度增加,导致界面层电阻变大,BPM水解离电压升高,故在制备过程中要选择高离子渗透能力的黏合剂,合理控制黏合剂的用量,以2膜层有足够黏合强度为宜。
流延法指将配置好的离子交换铸膜液流延到带有相反电荷的已成型的离子交换层(基膜)上,再经干燥即得BPM。为了使2膜层结合得更紧密,可在流延前先通过砂纸打磨,压花纹或等离子体刻蚀等方法将膜表面粗糙化,增大2膜层之间接触面积。此工艺制备步骤简单,成本低,工业应用性强,如由Tokuyama公司生产的商业Neosepta BP-1即用流延法制备,用商业Neosepta CM-1阳离子交换膜作为基膜,Fe3+作水解离催化剂,用砂纸打磨表面,再用季铵化聚砜铸膜液流延形成阴离子交换层,所得的BPM性能稳定,水解离效率高。但此工艺在制备过程中存在基膜易被溶剂溶解,导致2膜层相互渗透,水解离电压升高的问题。可通过直接将离子交换树脂颗粒均匀撒在基膜上或将含有树脂颗粒的聚合物溶液涂覆在基膜上的办法[55],在2膜层之间形成保护的中间层来避免膜层互渗,提高双极膜性能。
基膜改性法是指将阴、阳离子交换基团通过化学反应的方式引入到无功能基团的基膜两侧,制得的是单片型BPM,比如在基膜一侧通过氯磺化,水解反应制备阳膜层,另一侧通过氯甲基化、季铵化反应制备阴膜层。该法制备的BPM最突出的优点是2膜层不会分离脱落,但实现该工艺的关键因素在于化学反应的程度,控制基膜两侧阴、阳膜层的厚度,确保2膜层不相互渗透且膜层之间有清晰的界面结构,且单片型BPM难以引入催化剂,只能通过吸附或扩散的方式引入BPM中。
静电纺丝法是一种新型的膜制备方法,在强静电场作用下,铸膜液从纺丝头喷出,当电场力高于液滴的表面张力时,带电液滴变成纳米级的高速细射流喷到接收板上,跟随纺丝头的运动而交织形成了三维的膜。利用该法可分别将阴、阳离子交换膜液、催化剂溶液逐层喷出制备形成双极膜,通过调节溶液浓度和纺丝时间来精确调控膜层和催化层的厚度,操作简便,精度高但成本较高昂。
传统的BPM制备工艺存在大量问题,规模化制备难以实现,除了以上提到的几种方式,研究人员还开发了电沉积法、超声喷涂法等其他方法制备BPM。电沉积法是在电解槽中放置离子交换膜,在外加反向电场的作用下,电解液中带相反电荷的离子交换树脂分散沉积在离子交换膜的表面形成BPM,膜表面沉积的树脂颗粒可稳定存在。超声喷涂法是在加热条件下,将膜液超声雾化为细小液滴喷到基体上,溶剂能够速干,此法减少了2膜层的互渗,提高了膜层之间的结合力。
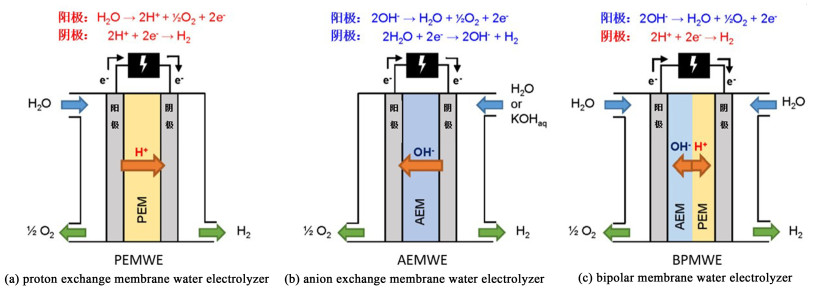
4 氢能方向应用 4.1 燃料电池应用展望离子交换膜是聚合物电解质燃料电池(Polyelectrolyte fuel cell,PEFC)的核心部分,不仅承载离子(H+或OH-)在内电路的传输,还起到隔绝燃料和氧化剂在电池内部渗透的作用。反应过程包括阴极的氧气还原反应(Oxygen reduction reaction,ORR)和阳极的氢气氧化反应(Hydrogen oxidation reaction,HOR)。根据离子交换膜传递的离子类型,聚合物电解质燃料电池可分为质子交换膜燃料电池(Proton exchange membrane fuel cell,PEMFC)、阴离子交换膜燃料电池(Anion exchange membrane fuel cell,AEMFC)和双极膜燃料电池(BPMFC)。其中,PEMFC研究时间最长,应用较成熟,以H2或CH3OH等为燃料,O2或空气为氧化剂。目前最有代表性的质子交换膜是由杜邦公司(今科慕公司)开发的全氟磺酸膜—Nafion®[56],Nafion膜以聚四氟乙烯作为主链,磺酸根离子通过醚支链固定在全氟主链上,由于C—F键键能高于C—H键,使膜具有较好的化学稳定性和热稳定性,且氟的强吸电子作用使膜的酸性增加,提高了膜的离子电导率;疏水的全氟主链和亲水的磺酸基团之间存在着明显的亲疏水差异,进一步提高了Nafion的离子电导率[57]。尽管PEMFC发展时间最长,但仍存在着许多问题:质子交换膜成本高昂;依赖于铂基贵金属催化剂;酸性环境下ORR动力学速率低;水热管理复杂,需要配备相应的增湿系统,成本增加[58]。在AEMFC中,O2在阴极还原生成的OH-经阴离子交换膜到达阳极与H2反应生成水,阴离子交换膜由高分子骨架、阳离子基团以及自由移动的OH-组成。相比于PEMFC,它的突出优势为在碱性环境下具有较高的反应动力学,因此可采用非贵金属催化剂或降低催化剂载量以降低成本[59],但由于AEM离子电导率较低,为了改善往往采用增加离子交换容量的方式,又会使膜的机械性能降低[60]。
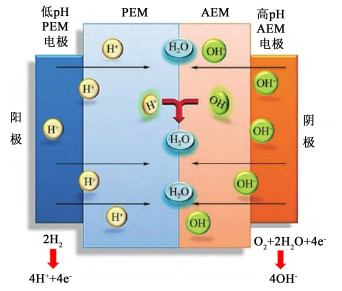
BPMFC整体的研究还处于起步阶段,是结合PEMFC和AEMFC二者优点的新型燃料电池[61, 62]。在H2/O2 BPMFC中,H2在阳极氧化成H+和电子;阴极通入的O2与从外电路到达的电子结合,还原生成OH-;H+和OH-分别向界面层汇聚反应生成水(图 6)。虽然阴极氧还原电势较低,但界面层的存在补偿了阴极损失的电位,BPMFC的理论开路电压与同类型PEMFC和AEMFC相同。BPMFC不仅结合了两者的优点,还具有独特的优势:阴、阳极反应在不同的化学环境下进行,提高电极反应的效率且阴极可使用非贵金属催化剂降低成本;在界面层反应生成的水使BPMFC具有自增湿机制[63],使离子迁移能力提高进而增大电池功率密度,且在运行过程中不再需要对气体进行外部加湿,简化燃料电池的水管理;H+和OH-在界面层的消耗,推动了阴极ORR和阳极HOR的正向进行,进一步提高BPMFC性能。
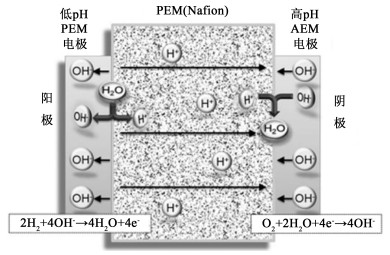
2003年,为解决PEMFC中氧气氧化反应迟滞、贵金属催化剂造价高以及复杂的水管理等问题,东京工业大学Ayato课题组提出双极膜燃料电池的概念[64]。在初步的探索中,该课题组利用商业化的Neosepta阴离子交换膜和Nafion117阳离子交换膜制备双极膜。此双极膜电导率比较低,仅为Nafion117的1/10,在单电池测试中开路电压0.882 V,最高功率密度仅26 mW ·cm-2(70 ℃)。2006年,赫尔辛基理工大学Kallio研究组[65]将Nafion膜与商业化阴离子交换膜(FuMA-Tech)热压制成双极膜,对双极膜的电导率、含水率、质子迁移数等基本物理性质进行研究,并将该双极膜用于制备H2O2的燃料电池,但由于燃料电池结构和测试条件未曾进行优化,其开路电压仅为0.7 V,最大电流密度约5.7 mA ·cm-2。随后佐治亚理工大学Kohl课题组将Nafion 212(~50 μm)与亚芳基醚砜膜(~150 μm)二者结合制成BPM,开始了H2/O2 BPMFC的研究,经过对膜电极的制备工艺[66]、阴极碳纸中阴离子交换树脂含量、气体流速[67]等方面的探索,于2010年提出了“离子聚合物浸渍法”制备疏水型阴离子高pH值电极以代替AEL[68],再将Nafion 212与电极在135 ℃、2 MPa热压3 min制成膜电极,成功使得燃料电池的性能达到375 mW ·cm-2(70 ℃),实现了性能的飞跃,也使得BPMFC拥有了较高的实际应用可能性, 这种不使用阴离子交换膜的双极膜构型也被称为杂化阴阳膜燃料电池(Hybrid anion-cation membrane fuel cell),其运行机制如图 7所示。
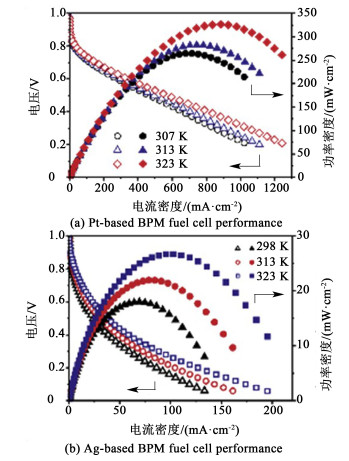
北京航空航天大学相艳课题组[69]采用热压法,将Nafion膜与季铵化聚砜膜在60 ℃、4 MPa下热压10 min制得双极膜,并使用Pt基酸性阳极、Pt基碱性阴极和Ag基碱性阴极在135 ℃、4 MPa下分别通过90 s热压组装成为Pt基膜电极(Membrane electrode assembly,MEA)和Ag基膜电极;其中采用Pt基MEA的BPMFC在干气状态下峰值功率密度为327 mW ·cm-2(50 ℃);采用Ag基MEA的BPMFC在干气状态下峰值功率密度为27 mW ·cm-2(50 ℃)并连续运行250 h(图 8),虽然峰值功率密度相对较小,但首次验证了BPM具有自增湿功能和BPMFC可采用非贵催化剂的可行性。后徐鑫等接着优化BPM膜电极构型和碱性阴极催化层结构,提出界面层和碱性催化层界面的传输和反应性能为影响电池输出功率的主要原因[70],且在理论模拟和实验验证的基础上,提出双极膜自增湿与AEL的厚度有关,当AEL过厚时,自增湿效果不再显现。
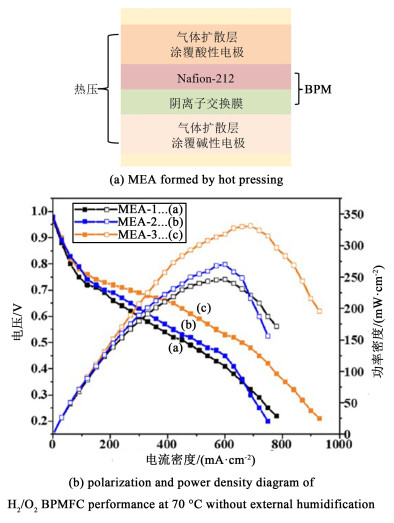
2024年,Suhag等[71]将表面改性处理过的蒙脱土(SM-MMT)与聚砜基膜复合得到阴离子交换膜,Nafion 212作为阳膜,由此制得的BPM与各自的气体扩散层夹在酸性电极和碱性电极之间,构成MEA(图 9)。在没有外部加湿的情况下进行燃料电池测试,以6 %(质量分数) SM-MMT复合AEM作为阴膜的BPM(MEA-3)峰值功率密度为331.2 mW ·cm-2,而以原始聚砜基膜(AEL)作为阴膜的BPM(MEA-1)峰值功率密度为246 mW ·cm-2,证实了复合阴离子交换膜在自增湿BPMFC中具有优良性能。
4.2 电解水制氢应用展望电解水是一种高效、大规模、清洁的制氢技术,由阴极上生成H2的析氢反应(Hydrogen evolution reaction,HER)和阳极上生成O2的析氧反应(Oxygen evolution reaction,OER)组成。目前所存在的3种常温电解水制氢技术,主要包括碱性水溶液电解(Alkaline water electrolysis,AWE)、质子交换膜水电解(Proton exchange membrane water electrolysis,PEMWE)和阴离子交换膜水电解(Anion exchange membrane water electrolysis AEMWE)。其中,基于全氟磺酸膜如Nafion的PEMWE可实现高电流密度(在商业系统中通常为1.5~2.5 A ·cm-2)[72],并快速响应负载变化,并且适用于高压水电解。然而,PEMWE的关键缺点是成本较高,原因是在酸性介质中,其无法避免贵金属催化剂(Pt和IrO2等)的使用及需用钛基双极板来维持较高的阳极电位[73],高制氢成本限制了PEMWE的大规模利用。AEMWE的优势在于成本较低,该技术能使用非贵金属催化剂、无钛部件,并与PEMWE一样能在压差下运行。但目前AEM存在化学、机械稳定性的问题;因为AEM中OH-的传导速度比PEM中H+质子慢3倍,导致OH-电导率低,催化动力学慢,只能通过增加离子交换基团或通过添加碱性电解质[74](如KOH、NaHCO3)来提升性能,但又使AEM耐久性降低[75]。对比PEMWE与AEMWE,BPMWE可在膜两侧同时引入酸性和碱性的电解质,且在水电解过程中,H+和OH-不断地由界面层向膜外迁移,使BPM两侧pH值梯度保持恒定[76],同时保证HER和OER效率的最大化(图 10)[77, 78],这使BPMWE同时具有两者的优势:HER催化剂在低pH值的阴极中表现出更佳的活性,析氢速率快且可使用非贵金属催化剂或低载量贵金属催化剂;高pH值阳极可使用非贵金属催化剂、经济高效的镍、铁集流体和双极板使成本降低。近年来,将BPM应用于电解水制氢方向引起了越来越多的关注。
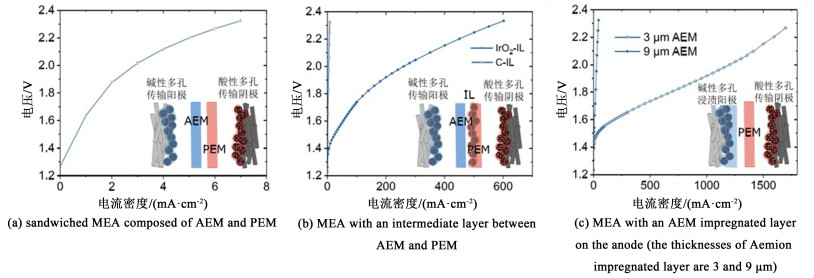
Thiele等[79]开发了以液态水为原料的BPMWE,同时具有高pH值的OER环境和低PH值的HER环境。碱性阳极是双极膜系统不可或缺的一部分,作者使用这种配置来研究双极界面逐渐向阳极移动时的电池性能。首先使用36 μm Aemion与51 μm Nafion 212通过复合组成三明治结构的BPM,在未添加水解离催化剂时该电解槽在2.2 V下仅产生了5 mA ·cm-2的电流密度,添加水解离催化剂IrO2作为界面层后电流密度增大到450 mA ·cm-2。在酸性膜和高pH值阳极之间直接移动双极界面后,在2.2 V的电池电压下实现了9 000 mA ·cm-2的电流密度(图 11),充分证实了这种水电解结构的潜力,在进一步研究的基础上,可能成为未来的商业水电解系统。
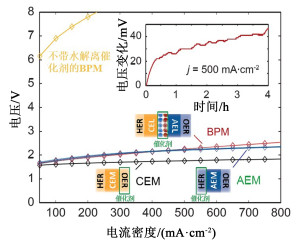
Oener等[80]利用BPMWE中膜两侧存在的pH值梯度来定量测量水解离动力学。通过研究发现,对于金属纳米颗粒,水解离活性与碱性HER活性相关。通过在AEL表面上修饰表面包覆10层TiO2原子层的NiO或IrO2、在CEL表面修饰RuO2或IrO2,该BPMWE在20 mA ·cm-2下,驱动电解槽的过电位低于10 mV,且在纯水BPMWE中,在500 mA ·cm-2下电解总电压为2.2 V(图 12)。添加双层水解离催化剂后,BPM水电解槽性能显著提高传统的电解槽通过电解纯水制氢,但制备纯水增加了设备的复杂性,提高了制氢成本,而直接电解海水具有原料易得、绿色环保等优势,但海水存在的大量Cl-易在阳极发生氧化反应,生成Cl2、HOCl和OCl-等对电解槽有腐蚀作用。Jaramillo等[81]利用BPM的性质设计和开发了一种耐海水的BPMWE,其中海水从阴极进料,由于CEL的选择性限制了Cl-向阳极侧扩散,且阳极的碱性环境不利于Cl-氧化反应的发生且能使OER催化剂的选择性提高。使用该装置电解真实海水产氢时,电流密度为250 mA ·cm-2,BPMWE将Cl-在阳极处氧化为腐蚀性OCl-的法拉第效率限制在0.005%,而PEMWE在类似的操作条件下对Cl-的氧化的法拉第效率高达10%;得益于Cl-氧化问题的有效缓解,在电解海水时,BPMWE的使用寿命比PEMWE高140倍,表明BPMWE电解海水制氢具有特殊的优势。
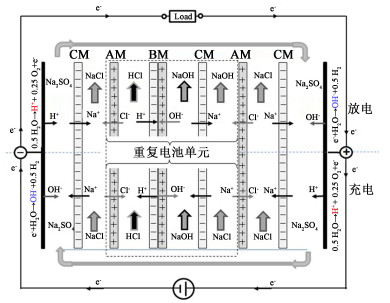
5 其他应用 5.1 资源生产和回收目前BPM应用最主要的工艺是双极膜电渗析(Bipolar membrane electrodialysis,BMED),是一种绿色环保的电渗析技术,它的出现改变了传统工业分离和制备过程,为解决环境、化工、生物和海洋化工等领域中的技术难题注入新的生机和活力。BMED膜堆是由双极膜(BPM)、阳离子交换膜(CEM)、阴离子交换膜(AEM)交替排列堆叠而成(图 13)。电渗析过程中所产生的H+和OH-分别通过BPM的相应膜层向外部溶液迁移,H+与从AEM迁移的阴离子结合产生酸,OH-与从CEM迁移的阳离子结合产生碱,由此BMED技术被广泛应用于酸碱生产。其中,利用NaCl、Na2SO4、NaNO3和Na3PO4等盐溶液来生产无机酸和碱占据了极大的市场份额[82],有机酸生产工业化的应用规模较小[83]。膜的成本较高、电解质浓度高、产品的纯度低,导致BMED在酸碱生产中的经济性仍然不如传统工业技术。
BMED的另一个相关应用是从废水或发酵混合物[85]中回收氨。以硝酸铵解离为例的过程为:含有NH4NO3的盐溶液被送入BMED装置中,在电场作用下,NO3-离子透过AEM迁移到酸室,在酸室中与BPM产生的H+结合成HNO3,而NH4+离子在碱室中与OH-结合生成氨和水,后通过加热或减压的方式提取NH3。该过程中存在的主要问题是BPM的质子泄漏和氨扩散,H+的泄漏几率随着HNO3浓度的提高而增大;NH3跨膜扩散的几率与NH3浓度正相关。Ali等[85]研究发现,运行BMED回收氨的过程中,在500 A ·m-2电流密度下由于氨的扩散可造成12%~17%的电流效率损失(分别对应2和3 mol NH3),可适当提高电流密度来减少氨的扩散。此外,氨转化率受到碱室pH值的影响,当碱室pH>10时,氨转化率>90%。
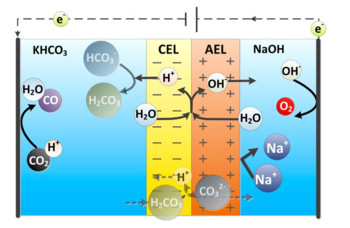
5.2 CO2还原(CO2RR)化石燃料的燃烧排放出大量的CO2,导致全球变暖,严重影响了人类的生存环境,在“双碳”目标背景下,CO2的回收与利用受到了广泛的关注。传统的CO2电解槽为单一膜组件体系,pH值环境单一,酸性条件下阴极发生的CO2RR与HER存在竞争关系,但CO2在碱性条件下溶解度较低[86]。为了解决这些问题,Vermaas等[75]将BPM引入CO2电解槽(图 14),使阴、阳极可在不同的pH值下工作,提高CO2RR效率;而且BPM界面层水解离产生的H+与OH-可及时补充阴、阳极室消耗的H+与OH-,维持pH值梯度。但是,该反应过程中存在CO2在溶液中溶解度较低的问题,影响反应速率,降低电流密度;此外,阴极生成CO的同时也伴随有H2的析出,竞争反应的存在使反应的法拉第效率和产物纯度降低[87],后续还需进一步优化。
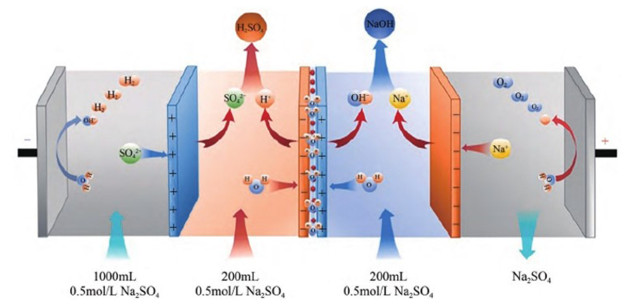
5.3 液流电池液流电池是利用正负极电解质间的氧化还原反应将化学能和电能互相转化的储能设备。BPM在正向偏压下生成水、反向偏压下水解离,两者的交替进行也可应用于液流电池的放电和充电过程:充电时,外部电流流过电池,BPM界面层发生水解离产生H+与OH-形成pH值梯度;放电时,两者在界面处结合生成水,由离子迁移产生的电流由外部负载收集[88]。由于BPM独有的pH值梯度,使该酸碱液流电池(Acid-base flow battery,ABFB)的能量密度比传统的由浓度梯度形成的液流电池高3倍以上[89]。与全钒液流电池相比,ABFB可使用廉价的NaCl溶液作为电解质向HCl和NaOH充电,具有经济优势(图 15)[90]。ABFB库伦效率在13%~27%,其能量损失主要是由于BPM对H+和OH-选择性较低而导致的同离子泄漏,占总能量损失的39%~65%[91],后续可通过改善膜层选择性和BPM复合工艺等提高电池性能并延长使用寿命。
本论文通过介绍双极膜的水解离理论、组成结构和制备工艺,详细概述目前的BPM技术。虽然目前关于BPM的制备和应用取得了巨大的进展,但绝大多数仍停留在实验室阶段,达到工业化生产目标的相对较少。现有难点一为高性能、长寿命的BPM仍有待开发,二为工业化生产中2膜层如何与催化剂相互紧密复合的问题。双极膜的出现为传统工业分离和制备过程提供了新的技术方向,不仅可用于制备酸与碱,在资源回收、食品加工、废水处理等领域也具有显著优势。在“双碳”背景下,双极膜在CO2捕集、储能、氢能储存和转化等领域的应用逐步引起了人们的关注。由于BPM独特的组成和结构,使之在燃料电池和电解水制氢领域具有其他离子交换膜难以企及的优势,故需要开发高导电性的2膜层、快速重组动力学的界面层、具有低离子交叉、高透水性、长寿命特点的BPM。可通过材料增强或调整操作条件来改进BPM的任一特性,但某一特性的增强往往以牺牲另一特性为代价。如BPM燃料电池在正向偏置运行时,界面层中产生的水约为燃料电池反应产物的3倍,这种自增湿机制一方面简化了燃料电池的水管理,另一方面可能导致水淹和BPM分层的问题,故除了提高BPM本身性能之外,膜电极的制备工艺等细节也需探索和研究,以进一步提高双极膜燃料电池性能。对于BPM应用于电解水领域,现有商业化的BPM还不能提供足够的水解离动力学来实现高效节能的水分解,开发薄且高度不对称的BPM将是一个研究方向。正如Mayerhofer等[79]的研究工作,带有不对称BPM电极组件的电池在2.2 V时实现了高达8 A ·cm-2的电流密度,表明进一步探索高度不对称的BPM是合理的研究方向。随着技术的不断进步和成本的降低,预计双极膜在氢能领域的应用将更加广泛。
| [1] |
HONG E, YANG Z, ZENG H, et al. Recent development and challenges of bipolar membranes for high performance water electrolysis[J]. ACS Materials Letters, 2024, 6(5): 1623-1648. DOI:10.1021/acsmaterialslett.3c01227 |
| [2] |
PÄRNAMÄE R, MAREEV S, NIKONENKO V, et al. Bipolar membranes: A review on principles, latest developments, and applications[J]. Journal of Membrane Science, 2021, 617: 118538. DOI:10.1016/j.memsci.2020.118538 |
| [3] |
TUFA R A, BLOMMAERT M A, CHANDA D, et al. Bipolar membrane and interface materials for electrochemical energy systems[J]. ACS Applied Energy Materials, 2021, 4(8): 7419-7439. DOI:10.1021/acsaem.1c01140 |
| [4] |
MAREEV S A, EVDOCHENKO E, WESSLING M, et al. A comprehensive mathematical model of water splitting in bipolar membranes: Impact of the spatial distribution of fixed charges and catalyst at bipolar junction[J]. Journal of Membrane Science, 2020, 603: 118010. DOI:10.1016/j.memsci.2020.118010 |
| [5] |
SIMONS R. Electric field effects on proton transfer between ionizable groups and water in ion exchange membranes[J]. Electrochimica Acta, 1984, 29(2): 151-158. DOI:10.1016/0013-4686(84)87040-1 |
| [6] |
WIEN M. On the validity of Ohm's laws for electrolytes in very high field forces[J]. Annalen Der Physik, 1924, 73(3-4): 161-181. |
| [7] |
GROSSMAN G. Water dissociation effects in ion transport through composite membrane[J]. The Journal of Physical Chemistry, 1976, 80(14): 1616-1625. DOI:10.1021/j100555a020 |
| [8] |
SIMONS R. Strong electric field effects on proton transfer between membrane-bound amines and water[J]. Nature, 1979, 280: 824-826. DOI:10.1038/280824a0 |
| [9] |
ONSAGER L. Deviations from Ohm's law in weak electrolytes[J]. The Journal of Chemical Physics, 1934, 2(9): 599-615. DOI:10.1063/1.1749541 |
| [10] |
TANIOKA A, SHIMIZU K, MIYASAKA K, et al. Effect of polymer materials on membrane potential, rectification and water splitting in bipolar membranes[J]. Polymer, 1996, 37(10): 1883-1889. DOI:10.1016/0032-3861(96)87305-8 |
| [11] |
KAISER V, BRAMWELL S T, HOLDSWORTH P C W, et al. Onsager's Wien effect on a lattice[J]. Nature Materials, 2013, 12: 1033-1037. DOI:10.1038/nmat3729 |
| [12] |
GIESBRECHT P K, FREUND M S. Recent advances in bipolar membrane design and applications[J]. Chemistry of Materials, 2020, 32(19): 8060-8090. DOI:10.1021/acs.chemmater.0c02829 |
| [13] |
Kirganova E V, Timashev S F, Popkov Y M. Electrolytic dissociation of water-molecules in bipolar ion-exchange membranes[J]. Soviet Electrochemistry, 1983, 19(7): 876-878. |
| [14] |
CHEN L, XU Q, OENER S Z, et al. Design principles for water dissociation catalysts in high-performance bipolar membranes[J]. Nature Communications, 2022, 13: 3846. DOI:10.1038/s41467-022-31429-7 |
| [15] |
KEMPERMAN A J B. Handbook bipolar membrane technology[M]. Netherlands: Twente University Press (TUP), 2000.
|
| [16] |
BLOMMAERT M A, AILI D, TUFA R A, et al. Insights and challenges for applying bipolar membranes in advanced electrochemical energy systems[J]. ACS Energy Letters, 2021, 6(7): 2539-2548. DOI:10.1021/acsenergylett.1c00618 |
| [17] |
PARK E J, JANNASCH P, MIYATAKE K, et al. Aryl ether-free polymer electrolytes for electrochemical and energy devices[J]. Chemical Society Reviews, 2024, 53(11): 5704-5780. DOI:10.1039/D3CS00186E |
| [18] |
ZENG M, HE X, WEN J, et al. N-methylquinuclidinium-based anion exchange membrane with ultrahigh alkaline stability[J]. Advanced Materials, 2023, 35(51): 2306675. DOI:10.1002/adma.202306675 |
| [19] |
金延超, 陈日耀, 陈晓, 等. 一种主链碳氟-酞菁催化层耐碱双极膜及其制备方法: CN114471179B[P]. 2023-09-22
|
| [20] |
白晓倩. 半含浸法制备阴离子扩散渗析膜及应用研究[D]. 杭州: 浙江大学, 2016 BAI Xiaoqian. Preparation and application of anion diffusion dialysis membrane by semi-impregnation method [D]. Hangzhou: Zhejiang University, 2016 (in Chinese) |
| [21] |
林埔, 陈燕红, 黄雪红. SSBS-g-AA/SBS-g-DMAEMA双极膜在电氧化制备乳糖酸中的用途: CN112030190A[P]. 2020-12-04
|
| [22] |
BHOWMICK S, QURESHI M. Vanadium oxide nanosheet-infused functionalized polysulfone bipolar membrane for an efficient water dissociation reaction[J]. ACS Applied Materials & Interfaces, 2023, 15(4): 5466-5477. |
| [23] |
徐铜文, 吴亮, 罗芬, 等. 一种反应-分离双功能双极膜及其制备方法: CN115888417A[P]. 2023-04-04
|
| [24] |
郭宇星. 侧链磺化聚醚醚酮质子交换膜的制备及其在双极膜中的性能研究[D]. 武汉: 武汉理工大学, 2020 GUO Yuxing. Preparation of side-chain sulfonated polyether ether ketone proton exchange membrane and its performance in bipolar membrane[D]. Wuhan: Wuhan University of Technology, 2020 (in Chinese) |
| [25] |
刘训道, 贾文静, 李加杰. 全氟双极膜及其制备方法: CN116036889A[P]. 2023-05-02
|
| [26] |
SHI S, PAN Y, LU B, et al. Preparation and characterization of a bipolar membrane modified by copper phthalocyanine 16-carboxylic acid and acetyl ferrocene[J]. Journal of Macromolecular Science, Part B, 2014, 53(8): 1431-1441. DOI:10.1080/00222348.2014.910047 |
| [27] |
PU Y, ZHU S, WANG P, et al. Novel branched sulfonated polyimide/molybdenum disulfide nanosheets composite membrane for vanadium redox flow battery application[J]. Applied Surface Science, 2018, 448: 186-202. DOI:10.1016/j.apsusc.2018.04.090 |
| [28] |
KISHINO M, YUZUKI K, FUKUTA K. Bipolar membrane: US20190118144[P]. 2019-04-25
|
| [29] |
LEE L, KIM D. Poly(arylene ether ketone)-based bipolar membranes for acid-alkaline water electrolysis applications[J]. Journal of Materials Chemistry A, 2021, 9(9): 5485-5496. DOI:10.1039/D0TA09398J |
| [30] |
AL-DHUBHANI E, SWART H, BORNEMAN Z, et al. Entanglement-enhanced water dissociation in bipolar membranes with 3D electrospun junction and polymeric catalyst[J]. ACS Applied Energy Materials, 2021, 4(4): 3724-3736. DOI:10.1021/acsaem.1c00151 |
| [31] |
RODELLAR C G, GISBERT-GONZALEZ J M, SARABIA F, et al. Ion solvation kinetics in bipolar membranes and at electrolyte-metal interfaces[J]. Nature Energy, 2024, 9: 548-558. DOI:10.1038/s41560-024-01484-z |
| [32] |
罗芬, 杨晓琪, 段方麟, 等. 双极膜研究进展及应用展望[J]. 化工进展, 2024, 43(1): 145-163. LUO Fen, YANG Xiaoqi, DUAN Fanglin, et al. Recent advances in the bipolar membrane and its applications[J]. Chemical Industry and Engineering Progress, 2024, 43(1): 145-163. (in Chinese) |
| [33] |
FLIEG R, STORR M, KRAUSE B, et al. Doped membranes: US20140326669[P]. 2014-11-06
|
| [34] |
ABDU S, SRICHAROEN K, WONG J E, et al. Catalytic polyelectrolyte multilayers at the bipolar membrane interface[J]. ACS Applied Materials & Interfaces, 2013, 5(21): 10445-10455. |
| [35] |
ESWARASWAMY B, MANDAL P, GOEL P, et al. Potential of dipicolinic acid as a water-dissociating catalyst in a bipolar membrane[J]. ACS Applied Polymer Materials, 2021, 3(12): 6218-6229. DOI:10.1021/acsapm.1c01045 |
| [36] |
CHEN Y, WRUBEL J A, KLEIN W E, et al. High-performance bipolar membrane development for improved water dissociation[J]. ACS Applied Polymer Materials, 2020, 2(11): 4559-4569. DOI:10.1021/acsapm.0c00653 |
| [37] |
HUANG Y, FAN H, YIP N Y. Influence of electrolyte on concentration-induced conductivity-permselectivity tradeoff of ion-exchange membranes[J]. Journal of Membrane Science, 2023, 668: 121184. DOI:10.1016/j.memsci.2022.121184 |
| [38] |
CHENG G, ZHAO Y, LI W, et al. Performance enhancement of bipolar membranes modified by Fe complex catalyst[J]. Journal of Membrane Science, 2019, 589: 117243. DOI:10.1016/j.memsci.2019.117243 |
| [39] |
CELIK A, HASAR H. Fabrication and implementation of extensively dense bipolar membrane using FeCl3 as a junction catalyst[J]. Polymer Bulletin, 2022, 79(8): 6815-6825. DOI:10.1007/s00289-021-04034-9 |
| [40] |
RYBALKINA O A, TSYGURINA K A, MELNIKOVA E D, et al. Catalytic effect of ammonia-containing species on water splitting during electrodialysis with ion-exchange membranes[J]. Electrochimica Acta, 2019, 299: 946-962. DOI:10.1016/j.electacta.2019.01.068 |
| [41] |
SHEHZAD M A, YASMIN A, GE X, et al. Shielded goethite catalyst that enables fast water dissociation in bipolar membranes[J]. Nature Communications, 2021, 12: 9. DOI:10.1038/s41467-020-20131-1 |
| [42] |
MEL'NIKOV S S, SHAPOVALOVA O V, SHEL'DESHOV N V, et al. Effect of d-metal hydroxides on water dissociation in bipolar membranes[J]. Petroleum Chemistry, 2011, 51(7): 577-584. DOI:10.1134/S0965544111070097 |
| [43] |
RATHOD N H, MISHRA S, MISHRA S, et al. Fabrication of efficient bipolar membranes with functionalized MOF interfacial layer for generation of various carboxylic acids via electrodialysis[J]. Chemical Engineering Journal, 2023, 477: 146765. DOI:10.1016/j.cej.2023.146765 |
| [44] |
MCDONALD M B, FREUND M S, HAMMOND P T. Catalytic, conductive bipolar membrane interfaces through layer-by-layer deposition for the design of membrane-integrated artificial photosynthesis systems[J]. ChemSusChem, 2017, 10(22): 4599-4609. DOI:10.1002/cssc.201701397 |
| [45] |
WANG H, DING F, JIN G, et al. Ultra-thin graphene oxide intermediate layer for bipolar membranes using atomizing spray assembly[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2017, 520: 114-120. |
| [46] |
MCDONALD M B, FREUND M S. Graphene oxide as a water dissociation catalyst in the bipolar membrane interfacial layer[J]. ACS Applied Materials & Interfaces, 2014, 6(16): 13790-13797. |
| [47] |
MANOHAR M, DAS A K, SHAHI V K. Efficient bipolar membrane with functionalized graphene oxide interfacial layer for water splitting and converting salt into acid/base by electrodialysis[J]. Industrial & Engineering Chemistry Research, 2018, 57(4): 1129-1136. |
| [48] |
LIU Y, CHEN J, CHEN R, et al. Effects of multi-walled carbon nanotubes on bipolar membrane properties[J]. Materials Chemistry and Physics, 2018, 203: 259-265. DOI:10.1016/j.matchemphys.2017.09.068 |
| [49] |
AHLFIELD J M, LIU L S, KOHL P A. PEM/AEM junction design for bipolar membrane fuel cells[J]. Journal of the Electrochemical Society, 2017, 164(12): F1165-F1171. DOI:10.1149/2.1041712jes |
| [50] |
MANOHAR M, SHAHI V K. Graphene oxide-polyaniline as a water dissociation catalyst in the interfacial layer of bipolar membrane for energy-saving production of carboxylic acids from carboxylates by electrodialysis[J]. ACS Sustainable Chemistry & Engineering, 2018, 6(3): 3463-3471. |
| [51] |
MENG L, SHI W, LI Y, et al. Janus membranes at the water-energy nexus: A critical review[J]. Advances in Colloid and Interface Science, 2023, 318: 102937. DOI:10.1016/j.cis.2023.102937 |
| [52] |
KOLE S, VENUGOPALAN G, BHATTACHARYA D, et al. Bipolar membrane polarization behavior with systematically varied interfacial areas in the junction region[J]. Journal of Materials Chemistry A, 2021, 9(4): 2223-2238. DOI:10.1039/D0TA10602J |
| [53] |
CHABI S, WRIGHT A G, HOLDCROFT S, et al. Transparent bipolar membrane for water splitting applications[J]. ACS Applied Materials & Interfaces, 2017, 9(32): 26749-26755. |
| [54] |
ZABOLOTSKⅡ V, SHELDESHOV N, MELNIKOV S. Heterogeneous bipolar membranes and their application in electrodialysis[J]. Desalination, 2014, 342: 183-203. DOI:10.1016/j.desal.2013.11.043 |
| [55] |
KUHL K P, CAVE E R, LEONARD G, et al. Membrane electrode assembly for cox reduction: US20210395908[P]. 2021-12-23
|
| [56] |
AGARWAL T, PRASAD A K, ADVANI S G, et al. Infrared spectroscopy for understanding the structure of Nafion and its associated properties[J]. Journal of Materials Chemistry A, 2024, 12(24): 14229-14244. DOI:10.1039/D3TA05653H |
| [57] |
KATZENBERG A, CHOWDHURY A, FANG M, et al. Highly permeable perfluorinated sulfonic acid ionomers for improved electrochemical devices: Insights into structure-property relationships[J]. Journal of the American Chemical Society, 2020, 142(8): 3742-3752. DOI:10.1021/jacs.9b09170 |
| [58] |
TANG M, YAN H, ZHANG X, et al. Materials strategies tackling interfacial issues in catalyst layers of proton exchange membrane fuel cells[J]. Advanced Materials, 2023, e2306387. DOI:10.1002/adma.202306387 |
| [59] |
WU X, CHEN N, HU C, et al. Fluorinated poly(aryl piperidinium) membranes for anion exchange membrane fuel cells[J]. Advanced Materials, 2023, 35(26): e2210432. DOI:10.1002/adma.202210432 |
| [60] |
FAVERO S, STEPHENS I E L, TITIRCI M M. Anion exchange ionomers: Design considerations and recent advances: An electrochemical perspective[J]. Advanced Materials, 2024, 36(8): 2308238. DOI:10.1002/adma.202308238 |
| [61] |
PENG S, LU S, ZHANG J, et al. Evaluating the interfacial reaction kinetics of the bipolar membrane interface in the bipolar membrane fuel cell[J]. Physical Chemistry Chemical Physics, 2013, 15(27): 11217-11220. DOI:10.1039/c3cp52150h |
| [62] |
ÜNLÜ M, ZHOU J, KOHL P A. Hybrid anion and proton exchange membrane fuel cells[J]. The Journal of Physical Chemistry C, 2009, 113(26): 11416-11423. DOI:10.1021/jp903252u |
| [63] |
彭思侃, 徐鑫, 张劲, 等. 双极界面聚合物膜燃料电池Ⅰ: 膜电极构型[J]. 化学学报, 2015, 73(2): 137-142. PENG Sikan, XU Xin, ZHANG Jin, et al. Bipolar interfacial polyelectrolyte membrane fuel cell Ⅰ: Structure of membrane electrode assembly[J]. Acta Chimica Sinica, 2015, 73(2): 137-142. (in Chinese) |
| [64] |
AYATO Y, OKADA T, YAMAZAKI Y. Characterization of bipolar ion exchange membrane for polymer electrolyte fuel cells[J]. Electrochemistry, 2003, 71(5): 313-317. DOI:10.5796/electrochemistry.71.313 |
| [65] |
LOBYNTSEVA E, KALLIO T, KONTTURI K. Bipolar membranes in forward bias region for fuel cell reactors[J]. Electrochimica Acta, 2006, 51(7): 1165-1171. DOI:10.1016/j.electacta.2005.06.004 |
| [66] |
ÜNLÜ M, ZHOU J F, ANESTIS-RICHARD I, et al. Improved gas diffusion electrodes for hybrid polymer electrolyte fuel cells[J]. Electrochimica Acta, 2011, 56(12): 4439-4444. DOI:10.1016/j.electacta.2011.02.017 |
| [67] |
ÜNLÜ D M, ZHOU D, ANESTIS-RICHARD I, et al. Characterization of anion exchange ionomers in hybrid polymer electrolyte fuel cells[J]. ChemSusChem, 2010, 3(12): 1398-1402. DOI:10.1002/cssc.201000239 |
| [68] |
ÜNLÜ M, ZHOU J, KOHL P. Hybrid polymer electrolyte fuel cells: Alkaline electrodes with proton conducting membrane[J]. Angewandte Chemie International Edition, 2010, 49(7): 1299-1301. DOI:10.1002/anie.200906021 |
| [69] |
PENG S, XU X, LU S, et al. A self-humidifying acidic-alkaline bipolar membrane fuel cell[J]. Journal of Power Sources, 2015, 299: 273-279. DOI:10.1016/j.jpowsour.2015.08.104 |
| [70] |
徐鑫, 彭思侃, 张劲, 等. 双极界面聚合物膜燃料电池Ⅱ: 阴极催化层结构优化[J]. 化学学报, 2016, 74(3): 271-276. XU Xin, PENG Sikan, ZHANG Jin, et al. Bipolar interfacial polyelectrolyte membrane fuel cell Ⅱ: Optimization of cathode catalyst layer[J]. Acta Chimica Sinica, 2016, 74(3): 271-276. (in Chinese) |
| [71] |
SUHAG A, GOEL P, ESWARASWAMY B, et al. Surface-modified nanoclay incorporated anion exchange membrane facilitating performance in self-humidifying bipolar membrane fuel cell[J]. International Journal of Hydrogen Energy, 2024, 55: 704-717. DOI:10.1016/j.ijhydene.2023.11.188 |
| [72] |
CHATENET M, POLLET B G, DEKEL D R, et al. Water electrolysis: From textbook knowledge to the latest scientific strategies and industrial developments[J]. Chemical Society Reviews, 2022, 51(11): 4583-4762. DOI:10.1039/D0CS01079K |
| [73] |
LI A, KONG S, ADACHI K, et al. Atomically dispersed hexavalent iridium oxide from MnO2 reduction for oxygen evolution catalysis[J]. Science, 2024, 384(6696): 666-670. DOI:10.1126/science.adg5193 |
| [74] |
YASSIN K, RASIN I G, BRANDON S, et al. How can we design anion-exchange membranes to achieve longer fuel cell lifetime?[J]. Journal of Membrane Science, 2024, 690: 122164. DOI:10.1016/j.memsci.2023.122164 |
| [75] |
YIN L, REN R, HE L, et al. Stable anion exchange membrane bearing quinuclidinium for high-performance water electrolysis[J]. Angewandte Chemie International Edition, 2024, 136(19): e202400764. |
| [76] |
KIM B S, PARK S C, KIM D H, et al. Bipolar membranes to promote formation of tight ice-like water for efficient and sustainable water splitting[J]. Small, 2020, 16(41): e2002641. DOI:10.1002/smll.202002641 |
| [77] |
GRIMAUD A. Acidic or basic oxides? Better together[J]. Joule, 2020, 4(11): 2251-2253. DOI:10.1016/j.joule.2020.10.016 |
| [78] |
PARK E J, ARGES C G, XU H, et al. Membrane strategies for water electrolysis[J]. ACS Energy Letters, 2022, 7(10): 3447-3457. DOI:10.1021/acsenergylett.2c01609 |
| [79] |
MAYERHÖFER B, MCLAUGHLIN D, BÖHM T, et al. Bipolar membrane electrode assemblies for water electrolysis[J]. ACS Applied Energy Materials, 2020, 3(10): 9635-9644. DOI:10.1021/acsaem.0c01127 |
| [80] |
OENER S Z, FOSTER M J, BOETTCHER S W. Accelerating water dissociation in bipolar membranes and for electrocatalysis[J]. Science, 2020, 369(6507): 1099-1103. DOI:10.1126/science.aaz1487 |
| [81] |
MARIN D, PERRYMAN J T, STEVENS M B, et al. Hydrogen production with seawater-resilient bipolar-membrane electrolyzers[J]. ECS Meeting Abstracts, 2023, 2023(39): 1908. |
| [82] |
YAN J, YU W, WANG Z, et al. Review on high-performance polymeric bipolar membrane design and novel electrochemical applications[J]. Aggregate, 2024, e527. |
| [83] |
KABIR M M, SABUR G M, AKTER M M, et al. Electrodialysis desalination, resource and energy recovery from water industries for a circular economy[J]. Desalination, 2024, 569: 117041. DOI:10.1016/j.desal.2023.117041 |
| [84] |
GE Z, SHEHZAD M A, YANG X, et al. High-performance bipolar membrane for electrochemical water electrolysis[J]. Journal of Membrane Science, 2022, 656: 120660. DOI:10.1016/j.memsci.2022.120660 |
| [85] |
NARAYEN D, VAN BERLO E, VAN LIER J B, et al. Recovery of sulfuric acid and ammonia from scrubber effluents using bipolar membrane electrodialysis: Effect of pH and temperature[J]. Separation and Purification Technology, 2024, 338: 126605. DOI:10.1016/j.seppur.2024.126605 |
| [86] |
SIRITANARATKUL B, FORSTER M, GREENWELL F, et al. Zero-gap bipolar membrane electrolyzer for carbon dioxide reduction using acid-tolerant molecular electrocatalysts[J]. Journal of the American Chemical Society, 2022, 144(17): 7551-7556. DOI:10.1021/jacs.1c13024 |
| [87] |
VERMAAS D A, SMITH W A. Synergistic electrochemical CO2 reduction and water oxidation with a bipolar membrane[J]. ACS Energy Letters, 2016, 1(6): 1143-1148. DOI:10.1021/acsenergylett.6b00557 |
| [88] |
XI D, ALFARAIDI A M, GAO J, et al. Mild pH-decoupling aqueous flow battery with practical pH recovery[J]. Nature Energy, 2024, 9: 479-490. DOI:10.1038/s41560-024-01474-1 |
| [89] |
BUI J C, LEES E W, MARIN D H, et al. Multi-scale physics of bipolar membranes in electrochemical processes[J]. Nature Chemical Engineering, 2024, 1: 45-60. DOI:10.1038/s44286-023-00009-x |
| [90] |
XIA J, EIGENBERGER G, STRATHMANN H, et al. Flow battery based on reverse electrodialysis with bipolar membranes: Single cell experiments[J]. Journal of Membrane Science, 2018, 565: 157-168. DOI:10.1016/j.memsci.2018.07.073 |
| [91] |
SHARIFIAN R, WAGTERVELD R M, DIGDAYA I A, et al. Electrochemical carbon dioxide capture to close the carbon cycle[J]. Energy & Environmental Science, 2021, 14(2): 781-814. |
 2024, Vol. 41
2024, Vol. 41