脂肪醇及其衍生物是重要的化学品,是溶剂、润滑剂、香料、增塑剂、洗涤剂、表面活性剂等的中间体[1]。脂肪醇的生产方法主要包括以石油资源为原料的齐格勒法、羰基合成法和正构烷烃氧化法,以及以棕榈油等生物质为原料的钠还原法、脂肪酸加氢法和脂肪酸酯加氢法等[2, 3]。
由于石油资源的不可再生性,从生物质中生产天然脂肪醇成为一种理想的替代途径。与以石油为原料的合成方法相比,源于生物质的脂肪酸酯(FAME)加氢制备相应的脂肪醇是一个简单、环保的绿色化工过程。
酯加氢反应根据反应物沸点和气化难易程度可分为气相反应和液相反应。气相加氢常用于低碳链酯类的加氢[4]。此时原料与氢气为气相,可以很好地混合,反应压力(3~5 MPa)远低于液体酯加氢压力。但脂肪酸酯碳链长、沸点高、气相法工艺所需的氢酯比过高,大幅度提高了生产成本。在液相脂肪酸酯加氢体系中,Ru基催化剂被广泛报道。Takanori Miyake[5]等研究了负载在不同载体上的Ru-Sn催化剂和Rh-Sn催化剂对脂肪酸甲酯加氢反应的催化性能。他们发现在300 ℃和6 MPa条件下,n(Ru)/n(Sn)=1的催化剂对醇的选择性最好(18.3%)。Sanchez等[3]研究发现,SiO2负载的Ru-Sn-B催化剂具有良好的活性,C C双键和C O基团都被氢化,但催化剂易于失活。Ru (1%)-Sn (2%)-B/Al2O3对油醇选择性高达45%,且活性最高。油酸甲酯加氢反应在290 ℃下经过6 h,转化率达到100%。而负载在二氧化钛上的Ru催化剂更有利于C C双键选择性加氢。
相对于贵金属催化剂,因铜基催化剂更容易实现对C O的选择性加氢而在酯加氢领域得到了广泛的研究。工业上采用Cu-Cr催化剂进行酯加氢反应,在200~300 ℃、20~35 MPa[6]条件下具有很好的催化活性。但铬的毒性和所需反应条件较高,不符合绿色化学发展的理念。高效的无铬铜基催化剂受到了广泛的关注。本研究团队[7]通过热解Cu-BTC制备了MOF衍生的具有核壳结构的Cu@C催化剂。核壳结构增加了金属催化剂的分散性,抑制了铜的团聚,使其比浸渍法制备的Cu/AC具有更高的加氢活性[8]。以丁酸丁酯加氢制丁醇反应为模型反应,Cu@C催化剂在230 ℃和5 MPa条件下,转化率为96.7%,醇选择性为100%;并且提出铜基催化剂在酯液相加氢反应中存在活性位点为Cu+和Cu0的平衡协同作用,二者分别促进羰基的解离活化和氢的活化。此外,掺入ZnO的Cu@C催化剂加氢性能有明显改善。发现与Cu-O-Zn作用的Cu+是液相丁酸丁酯加氢的关键活性位点,且与Cu-O-Zn位点作用的Cu+活性高于与Cu-O-C位点作用的Cu+活性[9]。在此基础上,本研究团队[5]设计制备了一系列碳笼包覆的Cu-SiO2@C催化剂。由于碳纳米笼的限制和层状硅酸盐铜的形成[10],得到了一种高度分散的铜基催化剂并在脂肪酸酯加氢反应中表现出优异的催化性能。
铜锌铝(CZA)催化剂作为一种工业催化剂,广泛应用于甲醇重整反应、合成气合成二甲醚、甲醇合成和CO2加氢等各种催化反应过程[11, 12]。何丽敏等[13]研究发现,通过改变共沉淀过程中沉淀剂的初始浓度,可以优化CuO/ZnO/Al2O3催化剂的结构和活性。在高碱浓度下形成的前驱体具有独特的水滑石结构,有利于形成较小的CuO颗粒。该催化剂催化硬脂酸乙酯加氢制硬脂醇反应中,硬脂醇的收率高于98%。黄辉等[14]研究发现,水对Cu/Zn催化剂催化月桂酸甲酯加氢反应的活性和选择性有负面影响。认为水促进Cu0的团聚导致性能下降。袁鹏等[15]认为Cu-Zn/Al2O3催化剂中的ZnO的作用是使表面和亚表面铜物种高度分散。
Cu-Zn-Al催化剂催化脂肪酸酯加氢反应的研究多集中在催化剂的制备上,关于活性位点归属和催化作用机理的研究较少。
本研究采用传统共沉淀法通过固定n(Zn)/n(Al)以及调节n(Cu)/n(Zn)制备Cu-Zn-Al催化剂,用于月桂酸甲酯液相加氢反应。重点探索一种在温和反应条件下铜催化剂催化脂肪酸酯加氢的方法及其活性位点作用机制。研制的催化剂转化率和选择性分别达到99.7%和99.4%。表明Cu-Zn-Al催化剂在脂肪酸甲酯加氢过程中具有良好的催化活性和应用前景。
1 实验部分 1.1 催化剂制备本论文采用传统的共沉淀法制备铜锌铝催化剂。具体制备方法如下:将6.0 g六水合硝酸锌及9.4 g九水合硝酸铝和一定量三水合硝酸铜置于100 mL烧杯中,加入50 mL去离子水,搅拌至溶解形成溶液A待用。配制250 mL碳酸铵水溶液(0.4 mol·L-1)于小烧杯形成溶液B待用。将四口圆底烧瓶置于水浴中,调节溶液A和B的滴加速度使得烧瓶内溶液pH值保持在7左右,沉淀结束之后继续老化2 h,期间水浴温度保持在70 ℃。老化结束后,进行过滤和洗涤,得到的滤饼放入100 ℃烘箱干燥过夜。调控硝酸锌和硝酸铜比例可以得到不同负载量催化剂,命名为xCu(x为Cu理论负载量)。
1.2 催化剂表征采用美国Micromeritics公司的TriStar3000型物理吸附仪进行氮气物理吸脱附测试来表征催化剂的比表面积和孔径分布(BET)。取约0.1 g催化剂样品于球形样品管中,300 ℃脱气3 h后进行测试。催化剂的介孔比表面积采用Brunauer-Emmet-Teller(BET)方法测定,孔径分布采用Barrett-Joyner-Halenda(BJH)方法测定。
催化剂中金属Cu真实负载量通过Vista-MPX电感耦合等离子体发射光谱仪测定(ICP-OES)。测试前,样品采用适量硝酸、盐酸和硫酸进行溶解和容量瓶定容,最终得到待测样品进行金属含量测试。
采用配备Cu_Kα辐射源(γ=1.5406 Å)的Smartlab型X射线衍射仪对还原前后的催化剂样品进行物相分析(XRD)。扫描速度为8 (°)·min-1,范围为10°~90°。通过Jade软件对样品物相进行解析,并以Cu(111)晶面为基准,通过谢乐(Scherrer)公式计算Cu物种晶粒尺寸。
采用N2O化学吸附法测定铜分散度,公式如式(1)。
| $ D=\frac{2 n_1}{n_2} \times 100 \% $ | (1) |
式(1)中:n1为氢气消耗量,mol;n2为催化剂中铜的物质的量,mol。
采用美国Perkin-Elmer公司的PHI-1600型电子能谱仪对催化剂表面的铜元素和锌元素的价态分布进行表征。以Al_Kα(hν=1486.6 eV) 为激发光源,功率300 W。采用C 1s(284.6 eV)为内标校正样品的核电效应。测试前样品置于样品管中并通入Ar气密封保存以防止被氧化。Cu+的比表面积可通过XAES分峰结果以及Cu0的比表面积计算。
采用美国FEI公司的Tecnai G2 F20型场发射透射电镜对催化剂进行了TEM和HRTEM表征,电子源为Schottkg型场发射枪。样品制备过程如下:将样品研磨成粉末,取少量于样品管中,用乙醇稀释,超声分散,滴在附有碳膜的载网上晾干。
1.3 催化剂评价向反应釜中加入0.8 g月桂酸甲酯,0.1 g催化剂以及23.2 g正己烷。置换釜内空气后采用氢气充压至5 MPa。打开冷凝水, 打开机械搅拌开关,调节转速至800 r·min-1。反应结束后,待反应温度降至室温,关闭搅拌。取少量反应产物用含有FID检测器的气相色谱进行分析。
月桂酸甲酯的转化率(X)、月桂醇的选择性(S)和反应的TOF按式(2)~式(4)计算。
| $ X=\left(1-\frac{n_{\mathrm{t}, \mathrm{ML}}}{n_{0, \mathrm{ML}}}\right) \times 100 \% $ | (2) |
| $ S=\frac{\Delta n_{\mathrm{LA}}}{\Delta n_{\mathrm{ML}}} \times 100 \% $ | (3) |
| $ \mathrm{TOF}=\frac{X \cdot S \cdot n_{0, \mathrm{ML}} \times 6.02 \times 10^{23}}{t \cdot m_{\mathrm{cat}} \cdot S_{\mathrm{Cu}(0)} \times 1.46 \times 10^{19}} $ | (4) |
式(2)~式(4)中:nt, ML为反应后月桂酸甲酯的剩余量;n0, ML为初始月桂酸甲酯的量;ΔnLA为反应中转化为月桂醇的量;ΔnML为反应中月桂酸甲酯的转化量;t为反应时间;mcat为催化剂质量。
2 结果与讨论 2.1 铜基催化剂的表征结果 2.1.1 铜基催化剂的物理结构不同铜负载量、n(锌)/n(铝)为4∶5的催化剂的物理化学性质如表 1所示。
| Samples | SBET/(m2·g-1)a | Vpore/(cm3·g-1)a | Dpore/nma | dCu/nmb | DCu/%c | SCu0/(m2·g-1)c | Metal loadingd/% | TOFCu0/h-1 |
| 26Cu | 137 | 0.28 | 9.5 | 9.3 | 6.3 | 15.2 | 31 | 27.1 |
| 35Cu | 97 | 0.23 | 17.7 | 9.8 | 6.2 | 15.2 | 38 | 32.7 |
| 47Cu | 92 | 0.34 | 16.9 | 11.9 | 5.8 | 19.1 | 51 | 27.5 |
| 55Cu | 65 | 0.27 | 15.8 | 12.9 | 5.1 | 19.0 | 58 | 18.7 |
| 60Cu | 64 | 0.28 | 16.4 | 13.3 | 4.9 | 19.1 | 62 | 17.3 |
| CuZn | 19 | 0.09 | 38.8 | 25.7 | 3.4 | 8.2 | 47 | N.D. |
| CuAl | 81 | 0.22 | 15.7 | 8.2 | 10.5 | 8.8 | 46 | N.D. |
| a Determined by N2 isotherm adsorption-desorption. b Calculated from the XRD data by Scherrer equation. c Surface area and dispersion of metallic Cu were determined by N2O titration. d Measured by ICP-OES. | ||||||||
随着Cu负载量的增加,比表面积有减小的趋势。26Cu的比表面积最大,为137 m2·g-1。N2吸脱附曲线以及孔径分布曲线如图 1所示。
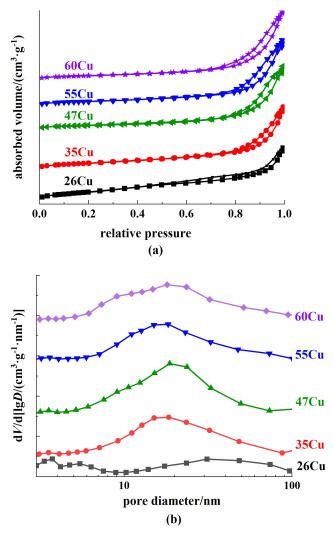
|
| 图 1 (a) 氮气物理吸脱附曲线;(b)孔径分布曲线 Fig.1 (a)N2 adsorption-desorption isotherms of the xCu; (b) the BJH pore size distribution of the xCu |
| |
所有催化剂均呈现IV型回滞曲线,证实了催化剂中介孔结构的存在[图 1(a)]。催化剂的孔径分布如图 1(b)所示。26Cu在2和4 nm处出现较小的介孔分布,而35Cu、47Cu、55Cu和60Cu催化剂在该处没有明显的孔分布,说明较高的铜负载量会破坏催化剂中较小的介孔结构,这在一定程度上导致催化剂比表面积降低。
N2O化学吸附法测定的铜分散度如表 1所示。结果表明,随着铜含量的增加,催化剂的分散度降低,这可能与催化剂的比表面积降低和铜的团聚有关。
2.1.2 铜基催化剂的物理结构煅烧还原后催化剂的XRD谱图如图 2所示。
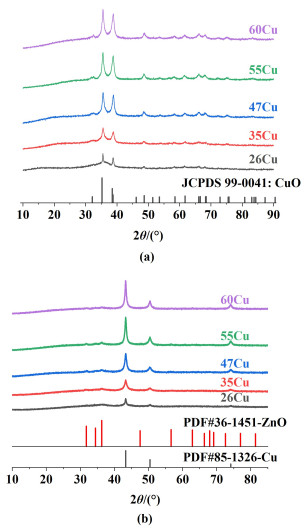
|
| 图 2 xCu (a)煅烧后和(b)还原后的XRD谱图 Fig.2 XRD patterns of the xCu upon (a)calcination; (b)reduction |
| |
2θ为35.6°和38.85° (JCPDS 45-0937)归属于CuO的特征衍射峰[16]。所有催化剂均能观察到明显的氧化铜形态,且没有ZnO和Al2O3的衍射峰特征,说明ZnO和Al2O3物种处于良好的分散状态。此外,也没有出现CuAl2O4的衍射峰。在280 ℃还原后,铜负载量高的催化剂上的金属铜对应的衍射峰强度更高。采用基于Cu(111)衍射峰半峰宽的Scherrer公式计算了铜晶体的晶体尺寸,26Cu、35Cu、47Cu、55Cu和60Cu的铜晶粒粒径分别为9.3、9.8、11.9、12.9、13.3 nm。这说明随着铜负载的增加,铜晶粒粒径逐渐增加。
不同铜负载量的催化剂还原后的TEM图像如图 3所示。
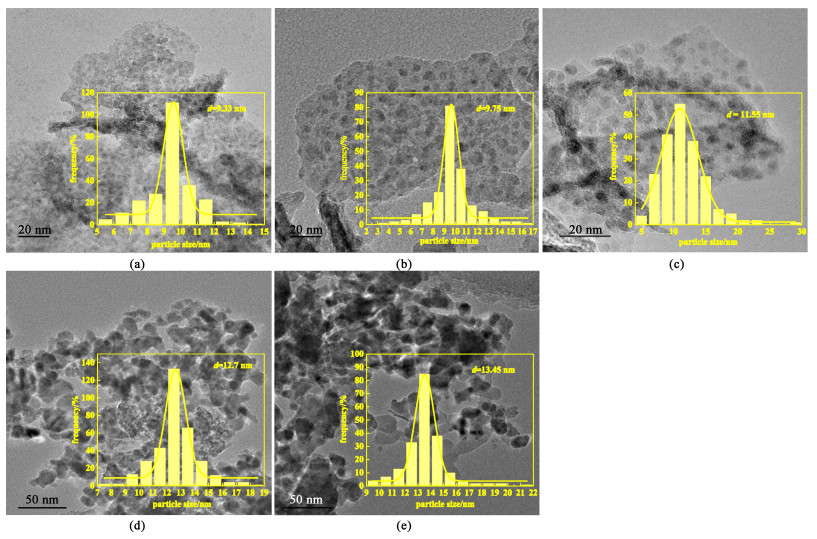
|
| 图 3 xCu的TEM图以及铜晶粒粒径分布图:(a)26Cu (b)35Cu (c)47Cu (d)55Cu (e)60Cu Fig.3 TEM pattern and Particle size distribution of xCu: (a)26Cu (b)35Cu (c)47Cu (d)55Cu (e)60Cu |
| |
26Cu、35Cu和47Cu的形貌基本相同,铜颗粒均匀分布。而在55Cu和60Cu中可以观察到明显的铜聚集,且粒径变化规律与XRD测定的结果基本一致。这说明较高的铜含量会导致催化剂上金属铜颗粒的团聚。
2.1.3 铜的化学价态及其还原行为采用氢气程序升温还原(H2-TPR)方法进一步研究了催化剂的可还原性,结果如图 4所示[17]。
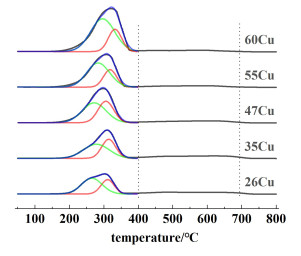
|
| 图 4 xCu的H2-TPR谱图 Fig.4 H2-TPR profiles of xCu |
| |
所有催化剂都有1个宽的不对称峰,这意味着存在2种铜种类。对所有曲线均采用分峰拟合处理,结果见表 2。较低的还原峰归属于与氧化锌相互作用较弱的铜物种,较高的温度峰(约583 K)是与氧化锌相互作用较强的铜物种的还原。结果表明: 随着铜负载的增加,与载体强相互作用的铜物种先增加后减少,其中35Cu和47Cu强相互作用的铜物种所占比例最高(42%)。随着Cu负载量的增加,这2个还原峰都向更高的温度移动,说明氧化锌含量降低和铜负载量的提高导致铜颗粒团聚,从而使还原难度增加。
| Catalyst | Peak area contribution/% | |
| Peak1 | Peak2 | |
| 26Cu | 63 | 37 |
| 35Cu | 58 | 42 |
| 47Cu | 58 | 42 |
| 55Cu | 71 | 29 |
| 60Cu | 73 | 27 |
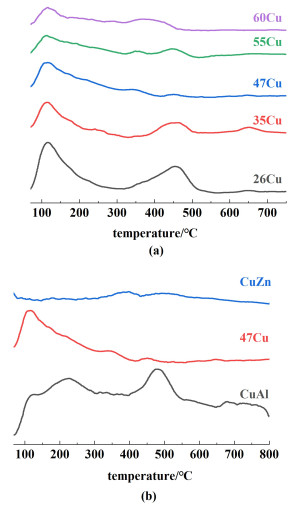
为了研究催化剂的表面酸性。本研究采用同样方法制备了CuZn和CuAl催化剂,并对该系列催化剂进行了NH3-TPD表征,结果如图 5所示。
|
| 图 5 催化剂的NH3-TPD谱图 Fig.5 NH3-TPD profiles of catalysts |
| |
图 5(a)中的NH3-TPD结果说明,随着Al含量的降低,催化剂表面总酸量逐渐降低。图 5(b)结果表明,CuAl催化剂上存在丰富的酸位点,而CuZnAl催化剂在350~550 ℃范围内酸位减少。结果说明Al2O3的减少和Zn组分的存在减少了催化剂的表面酸位点[17]。
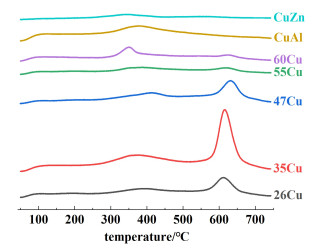
为了考察铜锌之间的相互作用,对催化剂进行了CO2-TPD表征。由图 6可知,催化剂的CO2脱附曲线中出现了3个脱附峰,分别为弱碱性位(α峰)和中强碱性位(β峰)以及强碱性位(γ峰)。根据文献[18-22],弱碱性位归属于载体表面羟基,中强碱性位归属于金属氧对(Zn-O、Al-O以及Cu-O)。而强碱性位归属于低配位的氧,是催化剂还原过程中ZnOx物种与Cu作用形成的未配位的氧离子,即来源于催化剂中的Cu-O-Zn位点。同时,在CuAl催化剂上没有发现强碱性位,进一步证明该位点的出现和Zn有关。随着金属铜负载量的增加,具有强碱性的铜氧锌位点数量先增加后降低,其顺序为35Cu>47Cu>26Cu>55Cu>60Cu,其中,35Cu具有最多的铜氧锌位(Cu-O-Zn)数量。
|
| 图 6 xCu和CuAl的CO2-TPD谱图 Fig.6 CO2-TPD pattern of xCu and CuAl |
| |
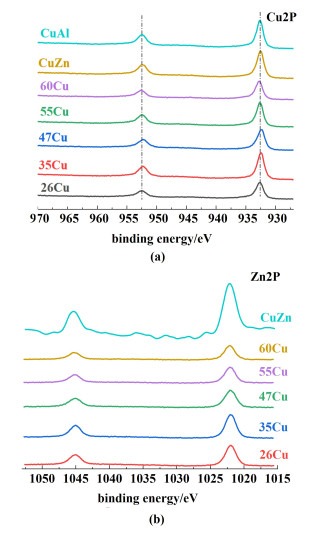
采用XPS和XAES对催化剂表面铜组分的电子状态进行了定量和定性分析。结果如表 3和图 7所示。
| Cat. | binding energy/eV | n(Cu0)/[n(Cu0)+n(Cu+)] | SCu0/(m2·g-1) | SCu+/(m2·g-1) | TOFCu0/h-1 | |||
| Cu 2p1/2 | Cu 2p3/2 | Cu+ | Cu0 | |||||
| 26Cu | 952.58 | 932.58 | 572.7 | 570.51 | 0.38 | 15.1 | 25.1 | 27.1 |
| 35Cu | 952.28 | 932.48 | 572.7 | 570.47 | 0.41 | 15.2 | 21.6 | 32.7 |
| 47Cu | 952.28 | 932.28 | 572.8 | 570.36 | 0.50 | 19.1 | 19.1 | 27.5 |
| 55Cu | 952.48 | 932.58 | 572.8 | 570.59 | 0.43 | 19 | 24.9 | 18.7 |
| 60Cu | 952.58 | 932.78 | 572.9 | 570.71 | 0.45 | 19.1 | 23.8 | 17.4 |
| CuAl | 952.48 | 932.58 | 573.4 | 569.95 | 0.28 | N.D. | N.D. | N.D. |
|
| 图 7 xCu催化剂的XPS谱 Fig.7 XPS spectra of xCu |
| |
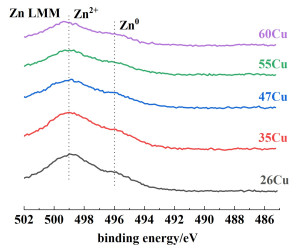
如图 7所示,Cu 2p谱中932.2和952.3 eV处的峰分别归属于Cu 2p3/2和Cu 2p1/2[23-25]。942~944 eV[26]处没有卫星峰,说明表面不存在Cu2+物种,这与XRD结果一致。值得注意的是xCu的Cu 2p3/2和Cu 2p1/2相比于CuAl发生偏移。这说明铜物种和锌物种之间存在电子转移,进一步证明了铜物种和锌物种之间存在相互作用。Zn 2p XPS谱中的B.E.值分别为1 021.8和1 044.9 eV,归属于ZnO的Zn 2p3/2和Zn 2p1/2。由Zn LMM谱结果可以观察到归属于Zn0的结合能(图 8)[27],证实了Cu与Zn之间存在电子转移现象。由于Cu和Zn相互作用会产生ZnOx位点,而ZnOx位点部分融入铜颗粒会导致产生CuZn合金[18, 28]。
|
| 图 8 xCu催化剂中Zn的LMM谱 Fig.8 Zn LMM spectra of xCu |
| |
由于Cu0和Cu+的结合能接近,无法通过XPS能谱进行区分,因此采用Cu LMM能谱进行区分,结果如图 9所示。570 eV处的特征峰归属于Cu+,568 eV处的特征峰归属于Cu0。根据分峰拟合结果计算得到的n(Cu0)/ [n(Cu0)+n(Cu+)]值见表 3。0价铜的比例随着铜负载量的增加而呈现先增加后降低的趋势,在47Cu处0价铜的比例和含量最高这与H2-TPR的峰面积比结果相对应。
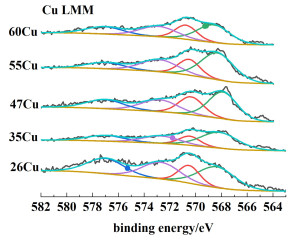
|
| 图 9 xCu催化剂上Cu LMM谱 Fig.9 Cu LMM XPS spectra of xCu catalysts |
| |
在釜式反应器中研究了xCu催化剂催化月桂酸甲酯液相加氢反应性能。月桂酸甲酯加氢反应的产物为月桂醇,副产物为月桂酸月桂醇酯。得到的催化活性数据如图 10所示。
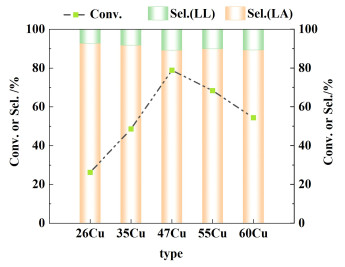
|
| 图 10 xCu催化剂对月桂酸甲酯液相加氢反应的活性结果 Fig.10 Catalytic activity of xCu catalysts for the hydrogenation of methyl laurate |
| |
月桂酸甲酯的转化率随铜负载量的增加先增加后降低。47Cu在这一系列xCu催化剂中催化活性最高,月桂酸甲酯的转化率为78.9%,月桂醇的选择性为89.2%。xCu催化剂对月桂醇的选择性基本保持在90%左右。优化反应温度至210 ℃时,催化加氢反应的月桂酸甲酯的转化率达到99.7%,选择性达到99.4%。
以往的研究表明,铜物种是酯加氢的主要活性位点[7, 9, 15, 29-31]。在本研究体系中,与Cu-O-Zn位点相互作用的Cu0被认为是关键的活性位点。TOF值变化规律呈现与Cu-O-Zn位点数量一致的趋势,说明与Cu-O-Zn位点相互作用会提升Cu0位点催化活性。研究表明,催化性能最好的47Cu催化剂具有较多的Cu-O-Zn位点数和最大的Cu0比面积(19.1 m2·g-1),与锌物种发生强相互作用的铜物种也最多。26Cu的活性较差可能是由于铜负载量较低和SCu0较小(15.0 m2·g-1)。35Cu虽然具有最多的Cu-O-Zn位点数量,但SCu0较小(15.2 m2·g-1),因此与Cu-O-Zn位点作用的Cu0也较少,这可能是其催化活性低于47Cu的原因。过高的铜负载量使催化剂的比表面减小和铜物种的团聚程度增大;同时,铜负载量的增大伴随着n(Cu)/n(Zn)减小、Cu-O-Zn位点减少,导致与其发生协同作用的Cu0位点的催化活性降低,因此催化剂的表观催化活性降低。
为了进步一步探讨锌的作用,进一步对CuZn、CuAl和CuZnAl催化剂进行了对比研究,结果见图 11。
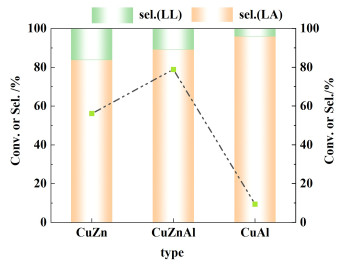
|
| 图 11 CuZn以及CuAl催化剂的催化活性 Fig.11 Catalytic performance of the CuZn and CuAl catalyst |
| |
如图 11所示,3种催化剂中CuZnAl催化剂表现出最佳的催化活性(78.87%),其次为CuZn催化剂(56.22%),CuAl催化剂催化活性最低(9.42%)。这进一步证明Zn的引入大幅度提升了铜物种的催化活性;而氧化铝具有较大的比表面,有利于活性物种的分散并提高其机械强度,该处对比2种催化剂,CuAl催化剂比表面积(81 m2·g-1)远高于CuZn催化剂的比表面积(19 m2·g-1)。
稳定性是工业催化剂极为重要的考核指标。本工作研究了47Cu在190 ℃、5 MPa H2条件下加氢4 h的可重复套用性能,结果如图 12所示。在4次循环套用实验中,该催化剂的月桂酸甲酯转化率(~76.5%)和月桂醇选择性(~90%)几乎没有变化,说明该催化剂具有良好的稳定性。
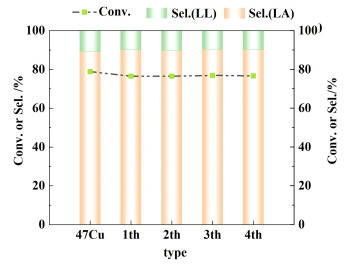
|
| 图 12 47Cu的催化稳定性评价结果 Fig.12 Catalytic stability of the 47Cu |
| |
(1) 制备了Cu-Zn-Al催化剂系列,研究了该催化剂用于温和条件下催化液相月桂酸甲酯加氢制备月桂醇的催化性能。铜负载量为47%的催化剂表现出最佳的催化性能。在5 MPa、210 ℃。空速为2 h-1时,脂肪酸酯转化率达到99.7%的,脂肪醇选择性为99.4%。
(2) 较多的Cu-O-Zn和Cu0位点是高活性的重要原因。TOF值变化规律呈现与Cu-O-Zn位点数量一致的趋势,说明与Cu-O-Zn位点相互作用会提升Cu0位点催化活性。
| [1] |
SÁNCHEZ M A, TORRES G C, MAZZIERI V A, et al. Selective hydrogenation of fatty acids and methyl esters of fatty acids to obtain fatty alcohols-A review[J]. Journal of Chemical Technology & Biotechnology, 2017, 92(1): 27-42. |
| [2] |
BEHR A, WESTFECHTEL A, PÉREZ GOMES J. Catalytic processes for the technical use of natural fats and oils[J]. Chemical Engineering & Technology, 2008, 31(5): 700-714. |
| [3] |
SÁNCHEZ M A, MAZZIERI V A, VICERICH M A, et al. Influence of the support material on the activity and selectivity of Ru-Sn-B catalysts for the selective hydrogenation of methyl oleate[J]. Industrial & Engineering Chemistry Research, 2015, 54(27): 6845-6854. |
| [4] |
耿尧辰, 赵玉军, 王胜平, 等. 热稳定性增强的铈改性Cu/SiO2催化剂及在草酸酯加氢制乙二醇反应中的应用[J]. 化学工业与工程, 2015, 32(6): 1-612, 12. GENG Yaochen, ZHAO Yujun, WANG Shengping, et al. Ceria-modified Cu/SiO2 catalyst with enhanced thermal stability and its application in hydrogenation of dimethyl oxalate to ethylene glycol[J]. Chemical Industry and Engineering, 2015, 32(6): 1-612, 12. DOI:10.3969/j.issn.1006-7906.2015.06.001 (in Chinese) |
| [5] |
YAO Y, WU X, CHEN B, et al. Copper-based catalysts confined in carbon nanocage reactors for condensed ester hydrogenation: Tuning copper species by confined SiO2 and methanol resistance[J]. ACS Sustainable Chemistry & Engineering, 2021, 9(48): 16270-16280. |
| [6] |
CHURCH J M, ABDEL-GELIL M A. Catalytic hydrogenation of methyl laurate to lauryl alcohol[J]. Industrial & Engineering Chemistry, 1957, 49(5): 813-817. |
| [7] |
ZHAO Y, WU X, ZHOU J, et al. MOF-derived Cu@C catalyst for the liquid-phase hydrogenation of esters[J]. Chemistry Letters, 2018, 47(7): 883-886. DOI:10.1246/cl.180277 |
| [8] |
WANG Y, ZHAO Y, LV J, et al. Facile synthesis of Cu@CeO2 and its catalytic behavior for the hydrogenation of methyl acetate to ethanol[J]. ChemCatChem, 2017, 9(12): 2085-2090. DOI:10.1002/cctc.201700111 |
| [9] |
YAO Y, WU X, GUTIÉRREZ O Y, et al. Roles of Cu+ and Cu0 sites in liquid-phase hydrogenation of esters on core-shell CuZnx@C catalysts[J]. Applied Catalysis B: Environmental, 2020, 267: 118698. DOI:10.1016/j.apcatb.2020.118698 |
| [10] |
杨文龙, 赵玉军, 王胜平, 等. 铜硅催化剂中层状硅酸铜的形成过程[J]. 化学工业与工程, 2016, 33(1): 1-5. YANG Wenlong, ZHAO Yujun, WANG Shengping, et al. Formation of copper phyllosilicate in silica supported copper catalyst[J]. Chemical Industry and Engineering, 2016, 33(1): 1-5. DOI:10.3969/j.issn.1006-7906.2016.01.001 (in Chinese) |
| [11] |
WEN C, LI F, CUI Y, et al. Investigation of the structural evolution and catalytic performance of the CuZnAl catalysts in the hydrogenation of dimethyl oxalate to ethylene glycol[J]. Catalysis Today, 2014, 233: 117-126. DOI:10.1016/j.cattod.2013.10.075 |
| [12] |
廖俊宇, 赵玉军, 王胜平, 等. 载体极化率对乙酸甲酯加氢Cu/ZnO催化剂的作用机制研究[J]. 化学工业与工程, 2017, 34(6): 11-17. LIAO Junyu, ZHAO Yujun, WANG Shengping, et al. Roles of the support polarity ratio on Cu/ZnO catalysts for methyl acetate hydrogenation[J]. Chemical Industry and Engineering, 2017, 34(6): 11-17. DOI:10.3969/j.issn.1006-7906.2017.06.004 (in Chinese) |
| [13] |
HE L, CHENG H, LIANG G, et al. Effect of structure of CuO/ZnO/Al2O3 composites on catalytic performance for hydrogenation of fatty acid ester[J]. Applied Catalysis A: General, 2013, 452: 88-93. DOI:10.1016/j.apcata.2012.11.039 |
| [14] |
HUANG H, CAO G, FAN C, et al. Effect of water on Cu/Zn catalyst for hydrogenation of fatty methyl ester to fatty alcohol[J]. Korean Journal of Chemical Engineering, 2009, 26(6): 1574-1579. DOI:10.1007/s11814-009-0267-7 |
| [15] |
YUAN P, LIU Z, ZHANG W, et al. Cu-Zn/Al2O3 catalyst for the hydrogenation of esters to alcohols[J]. Chinese Journal of Catalysis, 2010, 31(7): 769-775. DOI:10.1016/S1872-2067(09)60087-5 |
| [16] |
SHAO Y, SUN K, LI Q, et al. Copper-based catalysts with tunable acidic and basic sites for the selective conversion of levulinic acid/ester to γ-valerolactone or 1, 4-pentanediol[J]. Green Chemistry, 2019, 21(16): 4499-4511. DOI:10.1039/C9GC01706B |
| [17] |
SINGH R, TRIPATHI K, PANT K K, et al. Unravelling synergetic interaction over tandem Cu-ZnO-ZrO2/hierarchical ZSM5 catalyst for CO2 hydrogenation to methanol and DME[J]. Fuel, 2022, 318: 123641. DOI:10.1016/j.fuel.2022.123641 |
| [18] |
LIU Q, ZHAO Z, ARAI M, et al. Transformation of γ-valerolactone into 1, 4-pentanediol and 2-methyltetrahydrofuran over Zn-promoted Cu/Al2O3 catalysts[J]. Catal Sci Technol, 2020, 10(13): 4412-4423. DOI:10.1039/D0CY00801J |
| [19] |
TISSERAUD C, COMMINGES C, BELIN T, et al. The Cu-ZnO synergy in methanol synthesis from CO2, Part 2: Origin of the methanol and CO selectivities explained by experimental studies and a sphere contact quantification model in randomly packed binary mixtures on Cu-ZnO coprecipitate catalysts[J]. Journal of Catalysis, 2015, 330: 533-544. DOI:10.1016/j.jcat.2015.04.035 |
| [20] |
NGUYEN HOANG T T, TSAI D H. Low-temperature methanol synthesis via (CO2+CO) combined hydrogenation using Cu-ZnO/Al2O3 hybrid nanoparticle cluster[J]. Applied Catalysis A: General, 2022, 645: 118844. DOI:10.1016/j.apcata.2022.118844 |
| [21] |
HAN C, ZHANG H, LI C, et al. The regulation of Cu-ZnO interface by Cu-Zn bimetallic metal organic framework-templated strategy for enhanced CO2 hydrogenation to methanol[J]. Applied Catalysis A: General, 2022, 643: 118805. DOI:10.1016/j.apcata.2022.118805 |
| [22] |
YU J, CHEN G, GUO Q, et al. Ultrasmall bimetallic Cu/ZnOx nanoparticles encapsulated in UiO-66 by deposition-precipitation method for CO2 hydrogenation to methanol[J]. Fuel, 2022, 324: 124694. DOI:10.1016/j.fuel.2022.124694 |
| [23] |
YAO D, WANG Y, LI Y, et al. A high-performance nanoreactor for carbon-oxygen bond hydrogenation reactions achieved by the morphology of nanotube-assembled hollow spheres[J]. ACS Catalysis, 2018, 8(2): 1218-1226. DOI:10.1021/acscatal.7b03026 |
| [24] |
CHEN L, GUO P, QIAO M, et al. Cu/SiO2 catalysts prepared by the ammonia-evaporation method: Texture, structure, and catalytic performance in hydrogenation of dimethyl oxalate to ethylene glycol[J]. Journal of Catalysis, 2008, 257(1): 172-180. DOI:10.1016/j.jcat.2008.04.021 |
| [25] |
ZHAO Y, GUO Z, ZHANG H, et al. Hydrogenation of diesters on copper catalyst anchored on ordered hierarchical porous silica: Pore size effect[J]. Journal of Catalysis, 2018, 357: 223-237. DOI:10.1016/j.jcat.2017.11.006 |
| [26] |
CHARY K V R, SAGAR G V, SRIKANTH C S, et al. Characterization and catalytic functionalities of copper oxide catalysts supported on zirconia[J]. The Journal of Physical Chemistry B, 2007, 111(3): 543-550. DOI:10.1021/jp063335x |
| [27] |
JIA P, LIU Y, YANG R, et al. Insight into the structural sensitivity of CuZnAl catalysts for CO hydrogenation to alcohols[J]. Fuel, 2022, 323: 124265. DOI:10.1016/j.fuel.2022.124265 |
| [28] |
KANAI Y, WATANABE T, FUJITANI T, et al. Evidence for the migration of ZnOx in a Cu/ZnO methanol synthesis catalyst[J]. Catalysis Letters, 1994, 27(1): 67-78. |
| [29] |
WU L, LI L, LI B, et al. Selective conversion of coconut oil to fatty alcohols in methanol over a hydrothermally prepared Cu/SiO2 catalyst without extraneous hydrogen[J]. Chemical Communications, 2017, 53(45): 6152-6155. DOI:10.1039/C7CC01126A |
| [30] |
HUANG H, WANG S, WANG S, et al. Deactivation mechanism of Cu/Zn catalyst poisoned by organic chlorides in hydrogenation of fatty methyl ester to fatty alcohol[J]. Catalysis Letters, 2010, 134(3): 351-357. |
| [31] |
REN D, WAN X, JIN F, et al. Selective hydrogenation of levulinate esters to 1, 4-pentanediol using a ternary skeletal CuAlZn catalyst[J]. Green Chemistry, 2016, 18(22): 5999-6003. DOI:10.1039/C6GC02285E |
 2024, Vol. 41
2024, Vol. 41





