随着社会的发展,人类正面临着能源危机、石油枯竭和环境恶化等挑战。高效利用现有资源的同时,寻求可持续能源与资源是我们应对上述挑战的重要途径和目标。核能、太阳能、风能和生物质能等是一系列可再生能源,其中,生物质是指通过光合作用形成的生物有机物质,包括农业和林业废弃物等。生物质的转化和利用为材料、液体燃料和化学品生产提供了可能的来源[1, 2],这需要人类开发新的生物、化学与化工等技术,同时,生物质的高效利用和清洁化学品与燃料的开发也是实现双碳目标的重要途径[3]。选择性催化转化是将生物质转变为高价平台化合物的重要方法,为后续转化为具有工业价值的化学品和燃料添加剂等打下基础[4]。生物质基化学品转化为高价值的油品和燃料所面临的挑战是去除生物质平台分子中的氧元素,同时提高氢元素含量,以提高生物质燃料的热值和燃烧过程的稳定性。目前,常用的方法是使用金属催化剂将平台分子选择性加氢与脱氧转化为高附加值的烷烃等[5, 6]。因此,如何设计具有高活性、高选择性或高稳定性的催化剂是重要的研究方向。
在生物质基平台分子中,苯酚是生产尼龙、燃料、增塑剂、表面活性剂等产品的原料之一,在经济和社会发展中发挥着关键作用,因此,苯酚常作为模型反应物来研究新型催化剂的选择性催化加氢性能,如Pd、Pt、Ru、Ni、Cu和Co等[7, 8]。在苯酚加氢反应中,由于羟基和苯环的存在,加氢产物中常见的有环己醇、环己酮、苯酚等有机物,如何控制选择性是研究目标之一。另一种生物质基平台分子糠醛,它是一种来源于木质纤维素的可再生平台分子,可以转化为用于精细化学、生物燃料和制药工业的各种有价值的化学品[9, 10]。糠醛分子上同时含有C=O键和C=C键,后者在热力学上更容易加氢[11, 12],这导致在糠醛加氢制备糠醇反应过程中容易发生副反应[13],除了来自C=O键和呋喃环氢化的产物外,还有许多副反应(C=O结合的氢解、脱羰、氢化和开环、缩合反应等)衍生的化合物[14, 15]。因此,糠醛选择性加氢反应也是生物质平台化合物高值化的研究热点。
在上述反应中的负载型金属催化剂体系中,除金属活性位以外,催化剂助剂、载体材料与表面性质对调控催化剂的性能也很关键。例如,在Gao等[16]研究发现在以异丙醇为溶剂,在2 MPa H2和100 ℃反应条件下,催化剂Pt3Fe/CeO2在糠醛的选择性加氢反应中对糠醇的选择性接近100%,且初始反应速率达1 495 h-1。表征结果证明Fe助剂可以调节Pt活性位的周边空间和电子结构,从而促进了H2分子的活化而提高其催化效率。Zheng等[17]在研究气相糠醛选择性加氢反应中发现,使用Sn(CH3)4改性得到的双金属催化剂PtSn/NaY与Pt/NaY相比,在约70%转化率下获得的对不饱和醇的选择性明显增加,由41%提高到67%。Li等[18]研究发现疏水改性的分子筛作Ru催化剂载体,在水相苯酚加氢反应中可以获得完全的转化率和>99%的环己醇选择性,原因是催化剂疏水/亲油的性质有利于在油/水界面的微环境中促进界面的反应速率。
本研究针对催化剂在选择性加氢反应过程中容易失活和金属纳米颗粒容易团聚等问题,设计了水热炭改性的催化剂载体,可以达到提高催化选择性的目标。常见的改性方法有原子层沉积法(ALD)和金属载体相互作用法(SMSI)等[19, 20],引入新的物系对催化活性位点进行封装、修饰电子结构或构筑界面活性位点,进而调控催化性能。但是,这些方法存在一些局限,如ALD法对设备要求高、SMSI法需要高温条件等。本研究以Ti3AlC2为载体的前驱体,以氯铂酸和葡萄糖为水热炭前驱体,直接用水热一锅法合成负载型Pt催化剂[21]。研究表明,碳涂层改性可调控催化活性和耐烧结性,在循环测试中保持良好稳定性,例如,碳涂层催化剂(Ni/TiO2)@C-11%增加了表面疏水性,防止了水与镍催化物质接触,起到了一定的隔离作用[22, 23]。水热炭改性的优势在于不需要较高温度煅烧,同时还能保持水热炭表面的功能性含氧基团,以调控其吸附性和酸性等。
在苯酚和糠醛的选择性加氢反应测试中,改性的催化剂表现出了很好的催化活性和目标产物环己醇或糠醇的选择性。特别地,在提高反应体系温度、延长反应时间和催化剂循环使用的研究中,水热炭改性的催化剂活性和稳定性能得到较好的保持,而没改性的催化剂,催化性能不稳且容易失活。同时,我们进一步研究了水热炭含量对催化性能的影响,结合催化性能评价结果和同行研究报道,证实这类改性催化剂性能的提高是由于水热炭较好的吸附性能有利于收集反应体系中的反应物,而稳定性提高则是由于水热炭在Pt纳米颗粒(NPs)周边形成半包围结构,有效减少了Pt NPs的烧结团聚而失活。我们的研究结果将对同行设计新型催化剂用于生物质高值化催化转化有启发作用[4, 24]。
1 试剂与仪器 1.1 试剂MAX相材料Ti3AlC2(>98%),吉林省一一科技有限公司;氢氧化钠(>96.0%),糠醇(AR),异丙醇(AR),国药集团化学试剂有限公司;六水合氯铂酸(99%),葡萄糖(一水),阿拉丁工业有限公司;乙醇(≥98%),苯酚(≥99.0%),环己烷(99.9%),环己醇(≥99.0%),正十二烷(99.0%),环己酮(≥99.5%),糠醛(99%),上海泰坦科技股份有限公司。
1.2 仪器JA503分析电子天平,常州市幸运电子设备有限公司;MS-M-S10 10通道标准型磁力搅拌器,大龙兴创实验仪器(北京)股份公司;SHB-Ⅲ循环水式多用真空泵,郑州长城科工贸有限公司;T-50.1 L溶剂过滤器,津腾;50 mL和100 mL-PTFE水热反应釜,合肥科幂;9 cm定性滤纸,抚顺市民政滤纸厂;Master-Q30纯水机,上海和泰仪器有限公司;X射线衍射仪(XRD Rigaku Smartlab),日本理学Rigaku Ultima IV;场发射扫描电子显微镜(JSM-7600F),德国ZEISS GeminiSEM 300;透射电子显微镜(JEOL JEM-2100),日本JEOL JEM-F200;等离子体电感耦合(NeXion 300X),Agilent 5110;X射线光电子能谱(Thermo Scientific K-Alpha+),VGP/VGD(使用Avantage软件,赛默飞设备)。
2 实验方法 2.1 催化剂的制备载体Ti3AlxC2Ty(T为—OH/Na或O,0 < x < 1, 1 < y < 2)制备是根据之前研究报道的优化程序[25]。通常,将1 g Ti3AlC2粉末加入到15 mL的10 mol·L-1 NaOH溶液中,在室温下搅拌1 h使其混合均匀。然后将悬浮液转移到100 mL的水热反应釜中,内置聚四氟乙烯内胆。静止放置在烘箱中,在180 ℃下加热48 h。冷却至室温后,取出固体产物用去离子水洗涤至pH=7~9,然后在80 ℃的烘箱中干燥过夜(超过16 h)。在使用前,将干燥的固体产物在研钵中研磨成粉末。
水热炭改性催化剂1%Pt/Ti3AlxC2Ty-glucose制备是将1 g Ti3AlC2粉末加入到15 mL的10 mol·L-1 NaOH溶液,室温下搅拌1 h使物料混合均匀。将理论计算的Pt负载量(1%,质量分数,下同)对应的六水合氯铂酸溶液加入上述悬浮液中,室温继续搅拌1 h。接着加入不同质量的葡萄糖粉末(0.25,0.50,1.00,2.00 g)作为水热炭原料,继续搅拌1 h。然后,将上述悬浮液转移到50 mL的水热反应釜,拧紧后静止放置在烘箱中,在180 ℃反应48 h。自然冷却后,物料通过抽滤分离出固体,用去离子水洗涤至pH=7~9,再用乙醇润洗一次。最后,将样品在80 ℃烘箱内干燥,得到目标催化剂[21, 26]。催化剂样品命名为1%Pt/Ti3AlxC2Ty-glucose(M),括弧中的数据表示在制备过程中加入的葡萄糖质量。
2.2 催化剂性能测试苯酚加氢反应中,将催化剂(0.1 g)分散在苯酚-环己烷溶液(1%苯酚,10 mL环己烷)。将不锈钢高压釜密封并用1 MPa N2置换釜内空气3次(将反应釜充入1 MPa N2密封1 min后释放出N2,重复3次),紧接着利用1 MPa H2再次进行置换3次,第4次充入H2并将压力维持1 MPa。温度从室温升至80 ℃开始计时,升温时间约15 min,反应在80 ℃和100 r·min-1下进行1 h。然后,反应釜自然冷却至室温,释放反应釜内压力,用5 mL注射器抽取2 mL反应液,用尼龙滤头(0.22 μm)过滤掉固体催化剂颗粒,先舍弃约1 mL反应液后排除滤头吸附效应,再用GC玻璃样品瓶收集约1 mL反应液用于GC检测[7, 27]。
糠醛加氢反应操作类似。向高压反应釜内胆中依次加入异丙醇为溶剂(10 mL),糠醛反应物(0.24 g),正十二烷内标物(1%),催化剂(0.10 g)。气体置换过程与上述苯酚加氢反应过程相同,最后将压力调至1 MPa。反应在80 ℃和800 r·min-1下进行3 h。取样过程也与上述相同。
上述反应体系涉及到的反应物和产物标准样,以及收集到的反应液,均使用气相色谱仪检测分析。色谱柱为HP-5,直径0.320 mm,长度为30 m。进样器温度为230 ℃,柱箱温度:120 ℃,检测器温度:250 ℃。从120 ℃以10 ℃·min-1的速率升到180 ℃,并保持1 min。测试单个样品的时间为10 min。反应物、产物和内标物等配置成一定浓度梯度,测得标准曲线。反应液中组分含量根据标曲来确定浓度,每个标样进样3次,确保重现性。
反应物的转化率Y、产物的选择性S及反应速率R具体计算如式(1)~(3)(ti表示某个反应时间)。
| $ Y=\frac{n_{t=0}-n_{t=i}}{n_{t=0}} \times 100 \% $ | (1) |
| $ S=\frac{n_{t=i}^{\prime}}{n_{t=0}-n_{t=i}} \times 100 \% $ | (2) |
| $ R=\frac{n_{t=0}-n_{t=i}}{m t} $ | (3) |
式(1)~式(3)中:n为反应物的物质的量; n′为生成物的物质的量; t为反应时间; m为实际负载的金属量。
2.3 催化剂的表征晶相检测使用X-射线衍射(XRD),仪器为Rigaku Smartlab,测试条件是5°~80°(2θ)、电压40 kV下,Cu_Kα辐射(λ=0.1542 nm)和5(°)·min-1的扫描速率。催化剂的形貌用场发射扫描电镜(SEM)测试,仪器型号是JSM-7600F(JEOL Ltd., Japan),工作电压为30 kV。Pt NPs和形貌等用投射电镜(TEM)表征,仪器型号是JEOL JEM-2100、工作电压为200 kV。用等离子体电感耦合(ICP)测得Pt的实际负载量,仪器型号是NeXion 300X;样品先在王水中超声4 h进行消解。X-射线光电子能谱(XPS)仪是美国Thermo Scientific K-Alpha+,配备了电荷中和器和磁聚焦透镜,采用Al_Kα单色辐射(1 486.7 eV)。光谱拟合分析采用CasaXPS版本2.3.16,将结合能校正到284.8 eV时的C1s峰。
3 结果与讨论 3.1 催化剂的XRD表征和SEM形貌表征图 1中XRD图谱显示了催化剂的晶相结构。
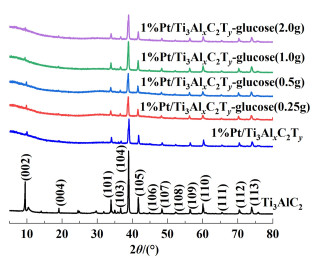
|
| 图 1 载体前驱体Ti3AlC2和系列催化剂的XRD谱图 Fig.1 XRD patterns of Ti3AlC2 precursors and catalyst series |
| |
由图 1可以看出1%Pt/Ti3AlxC2Ty保留了与原始的Ti3AlC2相同的晶体结构,但是由于载体部分脱铝,催化剂的结晶度有所下降,这与我们之前的研究结果一致[21]。对于1%Pt/Ti3AlxC2Ty-glucose系列催化剂的XRD谱图,不同水热炭加入量对催化剂晶体结构的影响没有发现改变。其他研究表明,对Pt NPs而言,衍射峰位置一般在39.9°、46.2°和67.6°(2θ),它们分别对应于Pt面心立方结构的(111)、(200)和(220)晶面[28, 29]。而在催化剂Pt/Ti3AlxC2Ty和水热炭改性的系列催化剂1%Pt/Ti3AlxC2Ty-glucose上,XRD图谱都没有观察到Pt NPs的特征峰。可能是由于Pt NPs太小,它们的峰与高强度的载体峰相比没能显示出来(后面TEM图片分析可见Pt纳米颗粒的尺寸为3~5 nm),也有可能是周边葡萄糖水热炭无定型物的宽峰影响或掩盖等造成的。
图 2中给出了载体前驱体Ti3AlC2和系列催化剂1%Pt/Ti3AlxC2Ty、1%Pt/Ti3AlxC2Ty-glucose(0.25 g)、1%Pt/Ti3AlxC2Ty-glucose(0.50 g)、1%Pt/Ti3AlxC2Ty- glucose(1.00 g)、1%Pt/Ti3AlxC2Ty-glucose(2.00 g)的SEM图片。图 2中显示Ti3AlC2的形状是块状紧密片层结构,而催化剂的形貌与之有所不同,其表面形成了明显的纳米纤维、纳米片或纳米带。这表明水热条件下碱蚀刻反应不仅脱去了部分的铝元素,同时还转变了形貌。

|
| 图 2 SEM图片(催化剂名称后括弧中的数据表示在制备过程中加入的葡萄糖质量) Fig.2 SEM images of catalysts(The numbers in in the parentheses after the catalyst name meant the glucose mass added in preparation) |
| |
我们可以从图 2上看出Pt NPs成功地负载到了载体上。随着葡萄糖加入量的增加,载体的形貌没有发生明显变化。Pt NPs尺寸大小和粒径分布如图 2所示,没有观察到明显的团聚现象。在同一个催化剂上,Pt NPs尺寸存在一些差异,尺寸从2~8 nm不等,主要集中在(4±1) nm。未改性催化剂1%Pt/Ti3AlxC2Ty的TEM图像显示,该催化剂形貌与改性的催化剂整体形貌相似。在一些放大倍数较高的TEM图片上,可以清楚地看到晶格条纹,根据文献报道,这些晶格条纹对应的有Pt的(111)、(200)和(220)晶面[30]。
3.2 Pt纳米颗粒形貌与粒径分布图 3显示了水热炭改性系列催化剂的高分辨率的TEM图片。
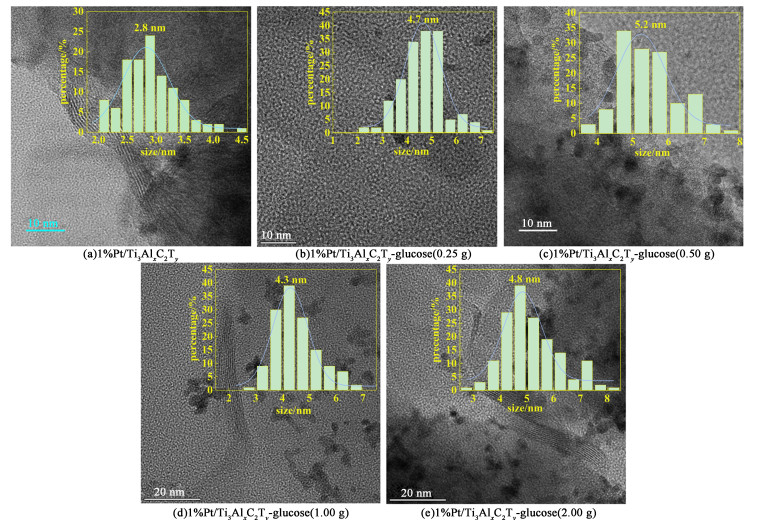
|
| 图 3 未改性催化剂1%Pt/Ti3AlxC2Ty和水热炭改性系列催化剂1%Pt/Ti3AlxC2Ty-glucose的TEM图片及其对应的Pt NPs分布图 Fig.3 TEM image and Pt particle distribution |
| |
图 4给出了催化剂的XPS表征结果,检测了主要元素C、Pt、Ti和O元素的价态和其对应的表面物种情况。这些催化剂的C 1s谱图显示出的峰位置(结合能)情况相似,主要有3种物系组成,分别对应的是C—C键(284.8 eV),C—O键(286.5 eV)和—COO键(288.7 eV)。Pt 4f的XPS谱图都有2个信号较强的峰,对应的是Pt 4f7/2和Pt 4f5/2,这表明Pt被成功负载在了载体Ti3AlxC2Ty上。并且,根据上述2个峰的位置在71.0和74.4 eV,我们可以知道Pt主要以0价态Pt0,即金属态存在。进一步分析显示存在少量氧化态Ptδ+物种,它们对应的结合能为72.6和76.2 eV。根据峰的面积,计算得到Pt物种各种状态的组成,结果列于表 1中。可以发现催化剂的Pt0含量大致相当。相较于未改性催化剂,水热炭改性催化剂中Pt0比例略高,可能是由于电子从载体转移到Pt金属导致[29]。Ti 2p的XPS谱图显示Ti元素主要以Ti4+状态存在,对应的结合能为458.5 (Ti 2p3/2)和464.3 eV(Ti 2p1/2)。也有及其少量的Ti2+能被检测到,大致位置在454.3 eV(Ti 2p3/2)。O1s的XPS谱图显示主要有晶格氧Ti—O(530.1 eV),表面氧元素如羟基—OH(531.8 eV)和吸附的少量结晶水(533.0 eV)。表 1也给出了由ICP测得的Pt元素含量。在实验中目标铂负载量是1%,而5种催化剂的真实Pt负载量在0.82%~0.93%之间,说明该方法负载效果很好。
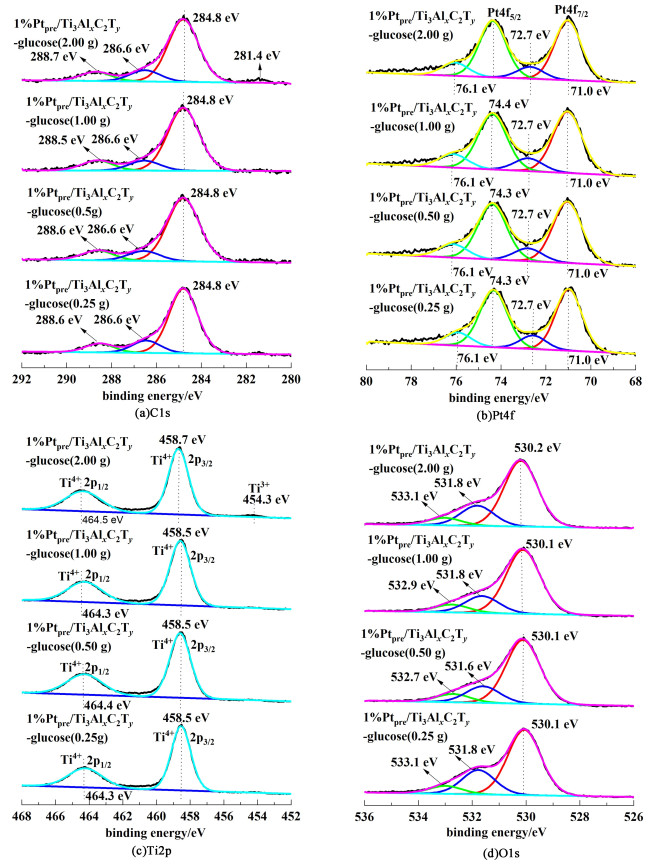
|
| 图 4 1%Pt/Ti3AlxC2Ty-glucose催化剂上主要元素C,Pt, Ti和O的高分辨XPS谱图 Fig.4 High resolution XPS spectra of Ti 2p, Pt 4f, C 1s and O 1s on 1%Pt/Ti3AlxC2Ty-glucose catalysts |
| |
| 催化剂名称 | w(ICP)/% | 金属态Pt比例/% | 氧化态Pt比例/% |
| 1%Pt/Ti3AlxC2Ty | 0.82 | 78.0 | 22.0 |
| 1%Pt/Ti3AlxC2Ty-glucose(0.25 g) | 0.80 | 81.9 | 18.1 |
| 1%Pt/Ti3AlxC2Ty-glucose(0.50 g) | 0.88 | 81.6 | 18.5 |
| 1%Pt/Ti3AlxC2Ty-glucose(1.00 g) | 0.93 | 81.7 | 18.3 |
| 1%Pt/Ti3AlxC2Ty-glucose(2.00 g) | 0.83 | 82.2 | 17.8 |
根据文献报道,苯酚的非开环加氢反应途径通常是2种:(1)苯酚直接加氢为环己醇;(2)苯酚先选择地生成环己酮,再由环己酮进一步加氢成为环己醇。在第(2)种途径中,中间产物环己酮的生成在一定程度上会对环己醇的选择性造成影响。苯酚加氢反应体系通常是在液相溶剂中,也可以是气相体系,这种情况通常是催化剂在高温条件下进行,但其存在一些显而易见的缺点,如苛刻的反应条件和不可避免的焦炭沉积导致催化剂失活。由于液相苯酚加氢的条件相对温和、低能耗、易于操作,可以节省成本和能源,因此,我们选择在液相中苯酚加氢反应作为研究对象。本研究中水热炭改性的系列催化剂的加氢反应性能如表 2所示。催化剂评价结果表明,水热炭的改性在上述反应条件下,既有可能改变催化活性,也有可能提高环己醇的选择性。就转化率而言,与1%Pt/Ti3AlxC2Ty相比,1%Pt/Ti3AlxC2Ty-glucose(1.00 g)和1%Pt/Ti3AlxC2Ty-glucose(2.00 g)提高了9.4%~14.4%;而在选择性方面,最高的环己醇选择性可达到98.7%。
| 催化剂 | 苯酚转化率/% | 选择性/% | 反应速率/(mol·g-1·h-1) | |
| 环己醇 | 环己酮 | |||
| 1%Pt/Ti3AlxC2Ty | 60.7 | 84.1 | N.A. | 592.2 |
| 1%Pt/Ti3AlxC2Ty-glucose(0.25 g) | 61.2 | 93.3 | N.A. | 612.0 |
| 1%Pt/Ti3AlxC2Ty-glucose(0.50 g) | 60.8 | 89.8 | N.A. | 552.7 |
| 1%Pt/Ti3AlxC2Ty-glucose(1.00 g) | 75.1 | 87.7 | N.A. | 646.0 |
| 1%Pt/Ti3AlxC2Ty-glucose(2.00 g) | 70.1 | 98.7 | N.A. | 675.7 |
| Ti3AlxC2Ty | N.A. | N.A. | N.A. | N.A. |
| No catalysts | N.A. | N.A. | N.A. | N.A. |
| 反应条件:催化剂(0.1 g),反应物苯酚(0.076 g),溶剂环己烷(10 mL),内标物正十二烷(0.007 6 g),反应温度: 80 ℃,1 MPa H2,1 h,100 r·min-1。N.A. 表示因浓度太低等原因而检测不到或无法定量。 | ||||
有研究报道,焦炭负载的Rh催化剂在80 ℃、10 MPa H2和12 MPa CO2的苛刻反应条件下,在这种超临界CO2体系中,反应实现了苯酚向环己醇的完全转化[31]。碳纳米纤维负载Rh催化剂可以在0.5 h内达到100%的苯酚转化率,但在超临界CO2介质中对环己醇的选择性较差,为57%[32]。载体的类型也能对催化性能产生显著影响。在聚合物衍生的硅碳氮化合物(SiCN)中稳定负载的Rh NPs(1.6~2.8 nm)在25 ℃和0.6 MPa H2下显示出99%的苯酚转化率[33],而在Al2O3和碳载体负载的催化剂上分别得到49%和36%的转化率;在上述3种催化剂体系中,环己醇选择性为22%~23%。相较而言本研究所制备的催化剂,在80 ℃,1 h的反应条件下就能达到最高75.1%的苯酚转化率。这在一定程度上充分体现了Pt催化剂应用于苯酚加氢反应性能的优越性。并且,水热炭的引入之所以能够提高转化率和选择性,主要原因是水热炭表面丰富的羟基—OH和羧基—COOH等基团,有利于吸附环己烷溶剂中的苯酚分子,富集的反应物分子增强了反应动力,提高了与活性中心Pt NPs的接近机会,从而提高了反应转化率。而选择性的提高,则可能是由于水热炭屏蔽了载体的其他活性位,减少了副反应的发生[34]。
4.2 系列催化剂在糠醛加氢反应中的性能比较在1 MPa H2、80 ℃条件下,水热炭改性的1%Pt/Ti3AlxC2Ty-glucose系列催化剂在异丙醇溶剂中对糠醛选择性加氢反应结果如表 3所示。未改性1%Pt/Ti3AlxC2Ty催化剂上糠醛的转化率高达94.3%,而且产物中只有糠醇生成。引入水热炭改性后,催化剂的转化率可以继续提高,达到完全转化,但是催化剂上水热炭量达到一定程度,糠醇选择性呈现了略微的下降。当然,根据表 1的ICP结果,催化剂1%Pt/Ti3AlxC2Ty-glucose(1.00 g)和1%Pt/Ti3AlxC2Ty-glucose(0.50 g)也可能是因为Pt的负载量相对较高而提高了活性或选择性。研究表明,糠醛转化过程中,糠醇选择性降低可能是由于脱碳和进一步氢解导致[35-37]。可能生成的产物有呋喃、2-甲基呋喃、四氢呋喃、2-甲基四氢呋喃,以及开环加氢产物如正丁醇和1, 5-戊二醇等[38]。另一方面,也有研究人员已经报道了选择性提高的相关原因,包括载体效应和溶剂效应等。例如,Fu等[39]报道称,使用水作为溶剂会导致糠醛缩合和聚合形成焦炭,导致糠醛加氢的催化活性较差。此外,Wang等[40]报道,较高的溶剂极性导致糠醛加氢反应中较高的催化活性。由于在表 3给的典型反应条件下,水热炭改性的效果难以阐明,我们接下来进一步研究了在其他反应温度和延长反应时间等条件下,为改性催化剂和改性催化剂的表现,进一步证实水热炭改性所起到的作用。
| 催化剂 | 糠醛转化率/% | 糠醇选择性/% | 反应速率/(mol·g-1·h-1) |
| 1%Pt/Ti3AlxC2Ty | 94.3 | >99.0 | 958.3 |
| 1%Pt/Ti3AlxC2Ty-glucose(0.25 g) | >99.0 | 92.4 | 1031.3 |
| 1%Pt/Ti3AlxC2Ty-glucose(0.50 g) | >99.0 | >99.0 | 937.5 |
| 1%Pt/Ti3AlxC2Ty-glucose(1.00 g) | >99.0 | >99.0 | 887.1 |
| 1%Pt/Ti3AlxC2Ty-glucose(2.00 g) | >99.0 | 95.0 | 994.0 |
| Ti3AlxC2Ty | N.A. | N.A. | N.A. |
| No catalysts | N.A. | N.A. | N.A. |
| 反应条件:催化剂(0.1 g),糠醛(0.24 g),异丙醇(10 mL),C12 (0.002 4 g),1 MPa H2,80 ℃,800 r·min-1, 3 h。N.A. 表示因浓度太低等原因而检测不到或无法定量。 | |||
图 5(a)和图 5(b)分别给出了在2种典型催化剂1%Pt/Ti3AlxC2Ty和1%Pt/Ti3AlxC2Ty-glucose(2.00 g)上,苯酚加氢反应转化率和产物选择性随反应时间变化。从转化率上看,随着时间的延长,未改性催化剂上的转化率维持在30%~50%,而水热炭改性催化剂上转化率维持在50%~60%。目标产物环己醇的选择性差别不大,2种催化剂上副产物环己酮的生成量都很低。图 5(c)和图 5 (d)分别给出了在1%Pt/Ti3AlxC2Ty和1%Pt/Ti3AlxC2Ty-glucose(2.00 g)上,苯酚加氢反应转化率和产物选择性随反应温度由室温升到80 ℃的变化情况。结果显示,就苯酚转化率而言,未改性催化剂1%Pt/Ti3AlxC2Ty上苯酚的转化率约22%~58%;而在水热炭改性催化剂1%Pt/Ti3AlxC2Ty-glucose(2.00 g)上苯酚的转化率约22%~70%;就环己醇选择性而言,催化剂1%Pt/Ti3AlxC2Ty上苯酚的转化率约20%~85%;而在催化剂1%Pt/Ti3AlxC2Ty-glucose(2.00 g)上,苯酚的转化率约30%~100%,且副产物环己酮的含量也非常低。上述结果都显示了水热炭改性后的催化剂表现出了优越性。
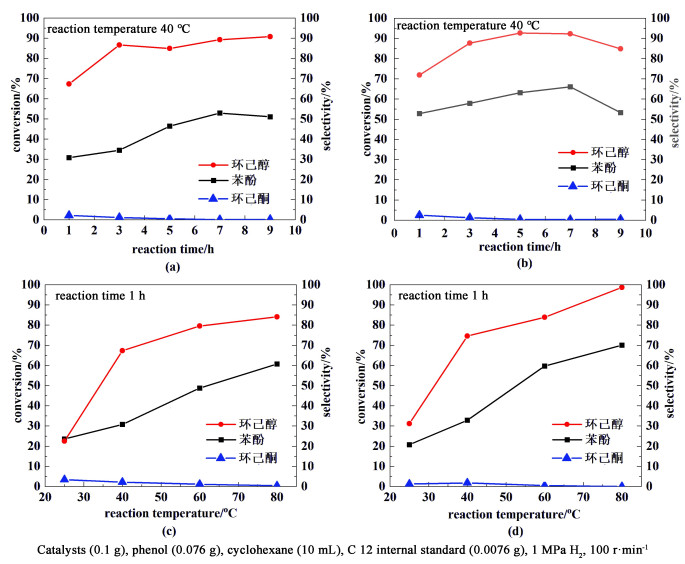
|
| 图 5 随着反应时间的延长,(a) 催化剂1%Pt/Ti3AlxC2Ty和(b) 催化剂1%Pt/Ti3AlxC2Ty-glucose(2.00 g)上,苯酚加氢反应转化率和选择性的变化,反应温度40 ℃;随着反应温度的提高(c) 催化剂1%Pt/Ti3AlxC2Ty和(d)催化剂1%Pt/Ti3AlxC2Ty-glucose(2.00 g)上,苯酚加氢反应转化率和选择性的变化,反应时间1 h Fig.5 Conversion and selectivity of phenol hydrogenation reaction as the function of time over the catalyst of (a)1%Pt/Ti3AlxC2Ty and (b)1%Pt/Ti3AlxC2Ty-glucose(2.00 g) at 40 ℃; Conversion and selectivity of phenol hydrogenation reaction as the function of temperature over the catalyst of (c) 1%Ti3AlxC2Ty and (d)1%Pt/Ti3AlxC2Ty-glucose(2.00 g), reaction time 1 h |
| |
以异丙醇为溶剂,在1 MPa H2反应条件下,我们研究了反应时间(1~3 h)对糠醛加氢的影响,结果如图 6所示。图 6(a)和图 6 (b)分别为未改性和水热炭改性的1%Pt/Ti3AlxC2Ty-glucose催化剂应用于糠醛加氢反应的转化率和选择性随反应时间的变化曲线。可以看出,就转化率而言,所有催化剂的糠醛转化率都随反应时间的延长而增加,且在3 h时达到100%的完全转化, 改性后的催化剂上糠醛转化率没有显示出优势,但是,糠醇的选择性可以维持在80%~90%,高于未改性的催化剂上糠醇的选择性75%~85%。图 6(c)和图 6(d)给出了未改性和水热炭改性的催化剂1%Pt/Ti3AlxC2Ty-glucose上,糠醛加氢反应的转化率和选择性随反应温度的变化曲线。可以观察到改性催化剂在糠醇选择性方面有明显的优势。随着温度的升高,未改性的催化剂上糠醇的选择性下降明显,而水热炭改性的催化剂上糠醇的选择性则稳步上升。两者的对比表明水热炭的改性有利于催化剂在温度较高时保持稳定。
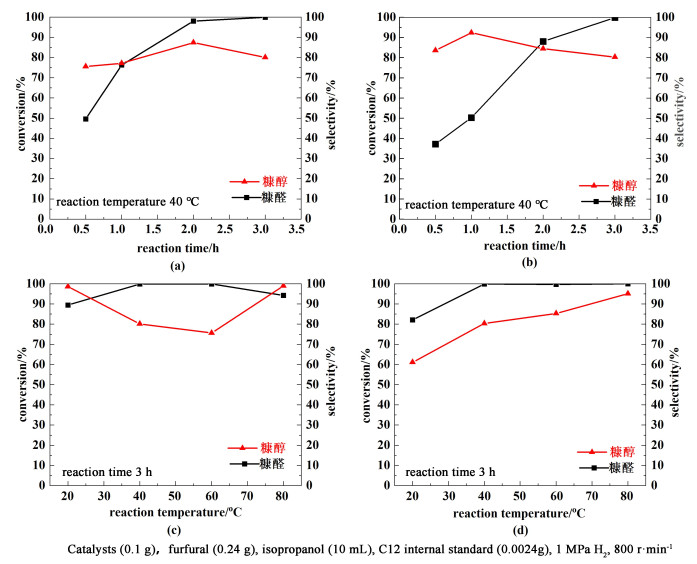
|
| 图 6 随着反应时间的延长(a) 催化剂1%Pt/Ti3AlxC2Ty和(b) 催化剂1%Pt/Ti3AlxC2Ty-glucose(2.00 g)上,糠醛加氢反应转化率和选择性的变化,反应温度40 ℃;随着反应温度的提高,(c) 催化剂1%Pt/Ti3AlxC2Ty和(d)催化剂1%Pt/Ti3AlxC2Ty-glucose(2.00 g)上,糠醛加氢反应转化率和选择性的变化,反应时间3 h Fig.6 Conversion and selectivity of furfural hydrogenation reaction as the function of time over the catalyst of (a)1%Pt/Ti3AlxC2Ty and (b)1%Ti3AlxC2Ty-glucose(2.00 g) at 40 ℃; Conversion and selectivity of furfural hydrogenation reaction as the function of temperature over the catalyst of (c)1%Pt/Ti3AlxC2Ty and (d) 1%Pt/Ti3AlxC2Ty-glucose(2.00 g), reaction time 3 h |
| |
比较2种反应物的时间和温度曲线,我们发现,相较于苯酚加氢,改性后催化剂对于糠醛加氢的优势更加明显。根据同行文献报道,我们推测可能原因是不同类型的活性位点对反应物的吸附性能不同或催化反应活性不同,造成目标产物的选择性不同[8]。
4.5 苯酚加氢反应中催化剂循环稳定性评价催化剂的重复使用性是判断催化剂稳定性的重要参考,特别是在开发直接面向工业化应用过程的催化剂。催化剂的重复实用性测试中,由于每次回收催化剂的过程中会有一点损失,常用的应对方法有同比例缩小反应液用量,补充新鲜催化剂,或同批次反应做多组然后将回收的催化剂整合起来。在操作过程中发现,催化剂损失量小于10%,本研究用添加新鲜催化剂的方式,在每批次反应用反应溶液的用量保持相同。如图 7所示,未改性的催化剂1%Pt/Ti3AlxC2Ty在5次重复使用中,苯酚的转化率略有下降,而且糠醛的选择性出现波动性。相比之下,水热炭改性的催化剂1%Pt/Ti3AlxC2Ty-glucose(2.00 g)不管是转化率还是稳定性都保持较为稳定的状态。这说明水热炭的改性有助于稳定催化剂的性能。
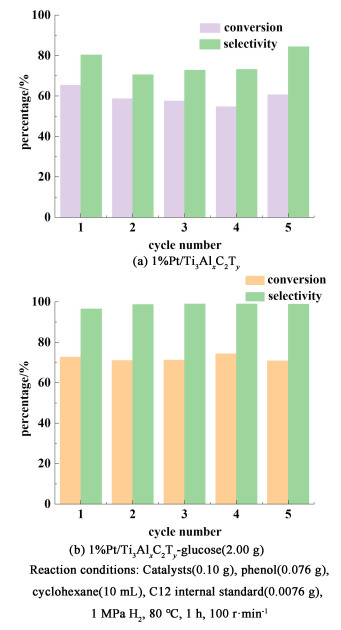
|
| 图 7 苯酚加氢反应中催化剂循环稳定性测试 Fig.7 Recyclability test of catalysts |
| |
负载型金属催化剂对生物衍生化学品进行选择性加氢提高氢含量是一种很有前途的增值化学合成方法,也是绿色和可持续化学发展的基础。本研究选取典型的MAX相材料Ti3AlC2为原料,以其衍生物纳米纤维或片层新材料作为载体,以葡萄糖作为水热炭源,通过一锅水热法合成的Pt催化剂,在苯酚和糠醛加氢反应性能测试中表现出较高的转化率或选择性。同时,水热炭的存在,可以减少Pt NPs的团聚以提高Pt NPs的热稳定性,从而克服贵金属纳米粒子易烧结、团聚、回收困难的缺陷。特别是在提高反应温度、延长反应时间,或循环使用过程中,上述性能特点提升更为显著。
| [1] |
MOHANTY A K, VIVEKANANDHAN S, PIN J M, et al. Composites from renewable and sustainable resources: Challenges and innovations[J]. Science, 2018, 362(6414): 536-542. DOI:10.1126/science.aat9072 |
| [2] |
ZHANG X, WILSON K, LEE A F. Heterogeneously catalyzed hydrothermal processing of C5-C6 sugars[J]. Chemical Reviews, 2016, 116(19): 12328-12368. DOI:10.1021/acs.chemrev.6b00311 |
| [3] |
王肖祎, 张波, 赵龙生. "双碳" 目标下燃煤耦合农林生物质发电技术及应用[J]. 能源研究与利用, 2023(6): 14-18. WANG Xiaoyi, ZHANG Bo, ZHAO Longsheng. Technology and application of coal-fired coupling agriculture and forestry biomass power generation under the goal of "double carbon"[J]. Energy Research & Utilization, 2023(6): 14-18. (in Chinese) |
| [4] |
LIN L, HAN X, HAN B, et al. Emerging heterogeneous catalysts for biomass conversion: Studies of the reaction mechanism[J]. Chemical Society Reviews, 2021, 50(20): 11270-11292. DOI:10.1039/D1CS00039J |
| [5] |
ZHAO M, HU J, WU S, et al. Hydrodeoxygenation of lignin-derived phenolics over facile prepared bimetallic RuCoNx/NC[J]. Fuel, 2022, 308: 121979. DOI:10.1016/j.fuel.2021.121979 |
| [6] |
LIU X, XU L, XU G, et al. Selective hydrodeoxygenation of lignin-derived phenols to cyclohexanols or cyclohexanes over magnetic CoNx@NC catalysts under mild conditions[J]. ACS Catalysis, 2016, 6(11): 7611-7620. DOI:10.1021/acscatal.6b01785 |
| [7] |
QU Z, MAO C, ZHU X, et al. Pd-decorated hierarchically porous carbon nanofibers for enhanced selective hydrogenation of phenol[J]. Industrial & Engineering Chemistry Research, 2022, 61(36): 13416-13430. |
| [8] |
ZHANG H, HAN A, OKUMURA K, et al. Selective hydrogenation of phenol to cyclohexanone by SiO2-supported rhodium nanoparticles under mild conditions[J]. Journal of Catalysis, 2018, 364: 354-365. DOI:10.1016/j.jcat.2018.06.002 |
| [9] |
MATSAGAR B M, HOSSAIN S A, ISLAM T, et al. Direct production of furfural in one-pot fashion from raw biomass using Brønsted acidic ionic liquids[J]. Scientific Reports, 2017, 7: 13508. DOI:10.1038/s41598-017-13946-4 |
| [10] |
LEE C B T L, WU T, TING C, et al. One-pot furfural production using choline chloride-dicarboxylic acid based deep eutectic solvents under mild conditions[J]. Bioresource Technology, 2019, 278: 486-489. DOI:10.1016/j.biortech.2018.12.034 |
| [11] |
IDE M S, HAO B, NEUROCK M, et al. Mechanistic insights on the hydrogenation of α, β-unsaturated ketones and aldehydes to unsaturated alcohols over metal catalysts[J]. ACS Catalysis, 2012, 2(4): 671-683. DOI:10.1021/cs200567z |
| [12] |
BAI S, BU L, SHAO Q, et al. Multicomponent Pt-based zigzag nanowires as selectivity controllers for selective hydrogenation reactions[J]. Journal of the American Chemical Society, 2018, 140(27): 8384-8387. DOI:10.1021/jacs.8b03862 |
| [13] |
MENG X, YANG Y, CHEN L, et al. A control over hydrogenation selectivity of furfural via tuning exposed facet of Ni catalysts[J]. ACS Catalysis, 2019, 9(5): 4226-4235. DOI:10.1021/acscatal.9b00238 |
| [14] |
KIJEŃSKI J, WINIAREK P, PARYJCZAK T, et al. Platinum deposited on monolayer supports in selective hydrogenation of furfural to furfuryl alcohol[J]. Applied Catalysis A: General, 2002, 233(1/2): 171-182. |
| [15] |
ZHENG H, ZHU Y, TENG B, et al. Towards understanding the reaction pathway in vapour phase hydrogenation of furfural to 2-methylfuran[J]. Journal of Molecular Catalysis A: Chemical, 2006, 246(1/2): 18-23. |
| [16] |
GAO X, TIAN S, JIN Y, et al. Bimetallic PtFe-catalyzed selective hydrogenation of furfural to furfuryl alcohol: Solvent effect of isopropanol and hydrogen activation[J]. ACS Sustainable Chemistry & Engineering, 2020, 8(33): 12722-12730. |
| [17] |
ZHENG Y, WANG X, FU X, et al. Preparation and catalytic properties of a bimetallic Sn Pt complex in the supercages of NaY zeolite by use of surface organometallic chemistry[J]. Applied Organometallic Chemistry, 2007, 21(10): 836-840. DOI:10.1002/aoc.1280 |
| [18] |
LI D, WU Z, ZHOU D, et al. One-step synthesis of hybrid zeolite with exceptional hydrophobicity to accelerate the interfacial reaction at low temperature[J]. Microporous and Mesoporous Materials, 2019, 280: 195-202. DOI:10.1016/j.micromeso.2019.02.002 |
| [19] |
LU J, ELAM J W, STAIR P C. Synthesis and stabilization of supported metal catalysts by atomic layer deposition[J]. Accounts of Chemical Research, 2013, 46(8): 1806-1815. DOI:10.1021/ar300229c |
| [20] |
VAN DEELEN T W, HERNÁNDEZ M C, DE JONG K P. Control of metal-support interactions in heterogeneous catalysts to enhance activity and selectivity[J]. Nature Catalysis, 2019, 2: 955-970. DOI:10.1038/s41929-019-0364-x |
| [21] |
SHI L, LU K, KONG X, et al. A new reduction method based on simultaneous Ti3AlC2 support etching and metal deposition to prepare Pt catalysts for aqueous-phase selective hydrogenation of furfural to furfuryl alcohol[J]. New Journal of Chemistry, 2022, 46(31): 14958-14966. DOI:10.1039/D2NJ02245A |
| [22] |
ZHAN W, SHU Y, SHENG Y, et al. Surfactant-assisted stabilization of Au colloids on solids for heterogeneous catalysis[J]. Angewandte Chemie (International Ed in English), 2017, 56(16): 4494-4498. DOI:10.1002/anie.201701191 |
| [23] |
LIN W, CHENG H, MING J, et al. Deactivation of Ni/TiO2 catalyst in the hydrogenation of nitrobenzene in water and improvement in its stability by coating a layer of hydrophobic carbon[J]. Journal of Catalysis, 2012, 291: 149-154. DOI:10.1016/j.jcat.2012.04.020 |
| [24] |
LUO Z, LIU C, RADU A, et al. Carbon-carbon bond cleavage for a lignin refinery[J]. Nature Chemical Engineering, 2024, 1: 61-72. DOI:10.1038/s44286-023-00006-0 |
| [25] |
DONG X, WANG Y, JIA M, et al. Sustainable and scalable in situ synthesis of hydrochar-wrapped Ti3AlC2-derived nanofibers as adsorbents to remove heavy metals[J]. Bioresource Technology, 2019, 282: 222-227. DOI:10.1016/j.biortech.2019.03.010 |
| [26] |
JIANG H, CHEN X, CUI D, et al. Systematic investigation on supported gold catalysts prepared by fluorine-free basic etching Ti3AlC2 in selective oxidation of aromatic alcohols to aldehydes[J]. Materials, 2023, 16(8): 3139. DOI:10.3390/ma16083139 |
| [27] |
尹德福. Pd基核壳型催化剂催化苯酚加氢定向制备环己酮反应的研究[D]. 山东青岛: 青岛科技大学, 2022 YIN Defu. Study on the hydrogenation of phenol to cyclohexanone catalyzed by Pd-based core-shell catalyst[D]. Shandong Qingdao: Qingdao University of Science & Technology, 2022 (in Chinese) |
| [28] |
ZHOU Y, YANG G, PAN H, et al. Ultrasonic-assisted synthesis of carbon nanotube supported bimetallic Pt-Ru nanoparticles for effective methanol oxidation[J]. Journal of Materials Chemistry A, 2015, 3(16): 8459-8465. DOI:10.1039/C5TA00695C |
| [29] |
PENG R, LI S, SUN X, et al. Size effect of Pt nanoparticles on the catalytic oxidation of toluene over Pt/CeO2 catalysts[J]. Applied Catalysis B: Environmental, 2018, 220: 462-470. DOI:10.1016/j.apcatb.2017.07.048 |
| [30] |
BHOGESWARARAO S, SRINIVAS D. Catalytic conversion of furfural to industrial chemicals over supported Pt and Pd catalysts[J]. Journal of Catalysis, 2015, 327: 65-77. DOI:10.1016/j.jcat.2015.04.018 |
| [31] |
RODE C V, JOSHI U D, SATO O, et al. Catalytic ring hydrogenation of phenol under supercritical carbon dioxide[J]. Chemical Communications, 2003(15): 1960-1961. DOI:10.1039/b304344d |
| [32] |
WANG H, ZHAO F, FUJITA S I, et al. Hydrogenation of phenol in scCO2 over carbon nanofiber supported Rh catalyst[J]. Catalysis Communications, 2008, 9(3): 362-368. DOI:10.1016/j.catcom.2007.07.002 |
| [33] |
FEHN S, ZAHEER M, DENNER C E, et al. Robustly supported rhodium nanoclusters: Synthesis and application in selective hydrogenation of lignin derived phenolic compounds[J]. New Journal of Chemistry, 2016, 40(11): 9252-9256. |
| [34] |
CHEN X, JIANG H, CUI D, et al. Selectivity regulation of Au/titanate by biochar modification for selective oxidation of benzyl alcohol[J]. Catalysts, 2023, 13(5): 864. |
| [35] |
YI Z, XU H, HU D, et al. Facile synthesis of supported Pd catalysts by chemical fluid deposition method for selective hydrogenation of biomass-derived furfural[J]. Journal of Alloys and Compounds, 2019, 799: 59-65. |
| [36] |
YAN K, WU G, LAFLEUR T, et al. Production, properties and catalytic hydrogenation of furfural to fuel additives and value-added chemicals[J]. Renewable and Sustainable Energy Reviews, 2014, 38: 663-676. |
| [37] |
SEEMALA B, KUMAR R, CAI C M, et al. Single-step catalytic conversion of furfural to 2-pentanol over bimetallic Co-Cu catalysts[J]. Reaction Chemistry & Engineering, 2019, 4(2): 261-267. |
| [38] |
DIMAS-RIVERA G L, RIVERA DE LA ROSA J, LUCIO-ORTIZ C J, et al. Bimetallic Pd-Fe supported on γ-Al2O3 catalyst used in the ring opening of 2-methylfuran to selective formation of alcohols[J]. Applied Catalysis A: General, 2017, 543: 133-140. |
| [39] |
FU Z, WANG Z, LIN W, et al. High efficient conversion of furfural to 2-methylfuran over Ni-Cu/Al2O3 catalyst with formic acid as a hydrogen donor[J]. Applied Catalysis A: General, 2017, 547: 248-255. |
| [40] |
WANG G, YAO R, XIN H, et al. At room temperature in water: Efficient hydrogenation of furfural to furfuryl alcohol with a Pt/SiC-C catalyst[J]. RSC Advances, 2018, 8(65): 37243-37253. |
 2024, Vol. 41
2024, Vol. 41





