2. 天津大学化工学院, 天津 300072;
3. 天津大学浙江研究院, 浙江 绍兴 312300
2. School of Chemical Engineering and Technology, Tianjin University, Tianjin 300072, China;
3. Zhejiang Institute of Tianjin University, Zhejiang, Shaoxing 312300, China
利用加氢技术将二氧化碳转化为甲醇是服务“双碳”目标的一条绿色可持续发展路线[1, 2],相关催化剂的开发是其中的研究热点。目前,关于二氧化碳加氢制甲醇的催化剂主要包括铜基金属催化剂[3, 4]、贵金属催化剂[5, 6]和金属氧化物催化剂[7, 8]等。其中,Cu/ZnO/Al2O3催化剂[9, 10]已经实现工业化应用,关于铜基催化剂在CO加氢制甲醇的研究占比达70%左右,是众多催化剂中研究得最为成熟和深入的材料,但在其应用过程中仍面临着逆水煤气反应(RWSG)的竞争[11, 12],从而导致其甲醇选择性降低。因此,亟需开发具备高选择性、高活性和高性价比的催化剂。
In2O3作为一种金属氧化物,在二氧化碳加氢制甲醇反应中表现出良好的活性和优异的甲醇选择性,其表面氧空位由于能有效地调节电子和产生吸附位点,在CO2活化和加氢过程中发挥重要作用。但在加氢反应过程中,In2O3通常会被过度还原而生成单质铟(In0),不利于其催化反应的稳定性以及反应位点的可及性。元素掺杂可以有效抑制In2O3的过度还原,稳定催化材料结构和表面氧空位。Yang等[13]采用等离子体强化氮掺杂技术制备了氮掺杂氧化铟(N-In2O3)催化剂,增强了表面电荷局域化,抑制了氧化铟表面的过度还原。Liu等[14]研究了Al对In2O3的促进作用,采用火焰热解法制备了一系列的In2O3-Al2O3样品形成更多的氧空位,促进了二氧化碳吸附,提高了甲醇选择性。此外,Jia等[15]采用湿化学还原法制备了In2O3负载型镍催化剂(Ni/In2O3),构建Ni位点与In2O3载体之间的相互协同作用,极大提升了材料的催化活性。然而,关于金属元素在In2O3晶体中的存在形式对其表面氧空位的作用机制研究有待进一步完善。
综上所述,通过采用共沉淀法制备不同含量Ni掺杂的In2O3催化剂,旨在通过控制Ni的负载量,精确调控Ni元素在In2O3晶体结构中的存在状态,探索其二氧化碳加氢催化性能。对比引入不同Ni含量的In2O3催化剂在相同反应条件下的催化性能,当Ni引入量为2.5%时,其实现了较优的催化活性,即5.5%的CO2转化率,36.5%的甲醇选择性。结合微观结构分析手段深入分析不同镍含量催化剂中镍在氧化铟晶体中的形态结构和电子结构,结果表明通过控制Ni的引入量使其在In2O3晶格结构中以Ni2+形态存在,形成In-O-Ni结构,能够稳定In2O3表面氧空位,抑制H2对In2O3晶体的过度还原,显著增强了CO2的吸附和脱附能力,进而提高了CO2的转化率。
1 实验部分 1.1 原料实验所用试剂如下:硝酸镍六水合物[Ni(NO3)2·6H2O,AR,沪试]、硝酸铟水合物[In(NO3)3·xH2O,AR,阿拉丁试剂有限公司],氨水(NH3·H2O,质量分数为25%)和无水乙醇(C2H5OH)(上海麦克林生化科技股份有限公司)。
1.2 催化剂制备过程将适量的Ni(NO3)2·6H2O和2.4 g的In(NO3)3·xH2O溶解于50 mL去离子水中,加热至80 ℃,搅拌30 min直至完全溶解。逐滴加入适量的0.2 mol·L-1 NH3·H2O至混合液中,缓慢调节混合溶液pH值至9。在80 ℃恒温水浴中搅拌3 h,静置1 h直至完全形成沉淀。待沉淀结束后,用高速离心机设置10 000 r·min-1、10 min的离心参数,分别采用乙醇和去离子水洗涤上述沉淀物3次。然后将得到的沉淀物放入60 ℃的真空干燥箱中过夜,以去除水分和杂质,最后在马弗炉中以3 ℃·min-1的升温速率加热至600 ℃,保持4 h。需要指出的是,为了获得不同含量的Ni掺杂的In2O3催化剂,Ni(NO3)2·6H2O的加入量分别为0(此时为纯In2O3催化剂)、0.15和0.64 g,从而得到理论的质量比分别为0、2.5%和10.0%的Ni掺杂的催化剂,命名为In2O3、2.5% Ni@In2O3和10.0% Ni@In2O3。
1.3 催化剂表征采用Ultima IV,Rigaku进行XRD测定,并使用Jade.6软件分析晶型结构,与粉末衍射标准联合委员会的衍射图谱(JCPDSs)进行物相鉴别;采用美国FEI公司的Nova Nano SEM 450场发射扫描电子显微镜(SEM)对样品形貌进行分析;采用ICAP-6300型号仪器对催化剂中金属Ni含量进行测定;通过Quantachrome Autosorb iQ物理吸附仪分析样品的孔结构性质和比表面积;采用Thermo Fisher Nexsa光电子能谱仪(XPS)分析样品,检测样品中金属元素的化学价态;利用AMI-300全自动程序控温化学吸附仪对样品进行氢气程序升温还原(H2-TPR)、二氧化碳程序升温脱附(CO2-TPD)和氢气程序升温脱附(H2-TPD)测试;采用METTLER TOLEDO热分析仪(TG-DTG)测试反应后的材料积碳行为;用装有原位漫反射池的FTIR光谱仪记录原位漫反射红外傅里叶变换光谱(DRIFTS)在280 ℃下进行原位红外研究,记录1 h相关光谱数据,判别催化剂在二氧化碳加氢体系中的反应路径。
1.4 催化剂活性评价通过连续流高压固定床反应装置评估了催化剂在二氧化碳加氢反应体系中的催化活性。将0.3 g催化剂样品放置在不锈钢管反应器(直径20 mm,长度460 mm)的中心,反应前先将催化剂原位还原(V=40 mL·min-1,纯H2,350 ℃,1 h)。之后,在(3 ∶1)H2/CO2的混合物、3 MPa压力、240~340 ℃反应温度以及GHSV(气时空速)为8 000 h-1下进行催化剂性能评估。最后,采用配备TCD检测器和FID检测器气相色谱仪对体系中涉及的反应物和产物进行定性和定量分析, 通过计算,反应中的碳平衡达到98%以上。二氧化碳转化率、产物选择性、产物时空收率和催化剂失活速率的计算公式如式(1)~式(5)。
1.4.1 二氧化碳转化率| $ X_{\mathrm{CO}_2}=\left(1-\frac{A_{\mathrm{CO}_2, \text { out }} / A_{\mathrm{N}_2 \text {, out }}}{A_{\mathrm{CO}_2, \text { in }} / A_{\mathrm{N}_2, \text { in }}}\right) \times 100 \% $ | (1) |
式(1)中:ACO2, out、ACO2, in、AN2, out和AN2, in分别为出口气体中CO2和进口气体中N2气相色谱检测到的峰面积。
1.4.2 一氧化碳和甲醇的选择性| $ S_{\text {co }}=\frac{[\mathrm{CO}]_{\text {out }}}{\left[\mathrm{CO}_2\right]_{\text {in }}-\left[\mathrm{CO}_2\right]_{\text {out }}} \times 100 \% $ | (2) |
| $ S_{\mathrm{CH}_3 \mathrm { OH }}=\frac{\left[\mathrm{CH}_3 \mathrm{OH}\right]_{\text {out }}}{\left[\mathrm{CO}_2\right]_{\text {in }}-\left[\mathrm{CO}_2\right]_{\text {out }}} \times 100 \% $ | (3) |
式(2)和式(3)中:[CO2]in和[CO2]out是反应入口和出口处的CO2的浓度;[CO]out是在反应出口处的CO的浓度;[CH3OH]out是在反应出口处的CH3OH的浓度。
1.4.3 甲醇时空产率| $ \mathrm{STY}_{\mathrm{CH}_3 \mathrm{OH}}=\frac{F_{\mathrm{CO}_2, \text { in }} X_{\mathrm{CO}_2} S_{\mathrm{CH}_3 \mathrm{OH}} M_{\mathrm{WCH}_3 \mathrm{OH}}}{W_{\text {cat }} V_{\mathrm{m}}} $ | (4) |
式(4)中STY为时空产率,mg·g-1·h-1;FCO2, in是进入反应器的二氧化碳的体积流量;MWCH3OH是甲醇的相对分子质量;Wcat为装载到反应器中的催化剂式的质量;Vm是标准状态下气体的物质的量体积。
1.4.4 催化剂失活率| $ R_{\mathrm{d}}=\frac{X_0-X_{\mathrm{t}}}{X_0} \times 100 \% $ | (5) |
式(5)中:X0和Xt分别表示20 min和t min时的CO2转化率。
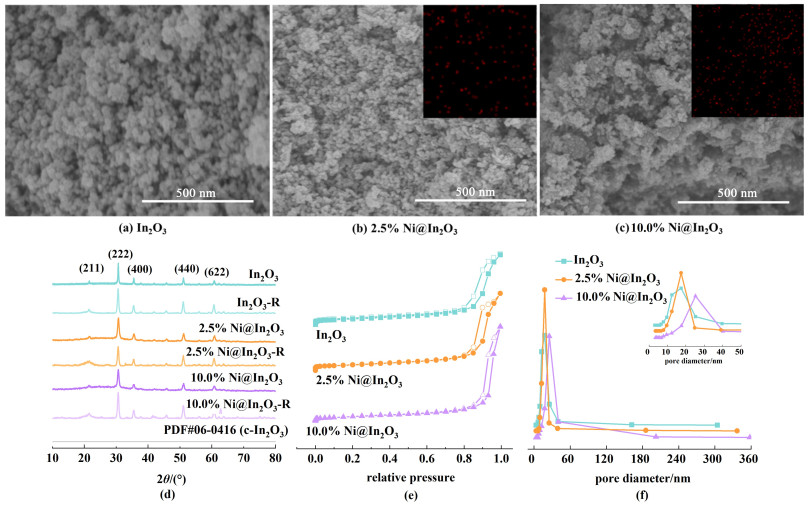
2 结果与讨论 2.1 催化剂的形貌结构分析如图 1(a)~图 1(c),SEM图像可观察到Ni@In2O3和In2O3样品外观形貌并无明显差异,都呈现出小颗粒状。仔细对比10.0% Ni@In2O3与2.5% Ni@In2O3的样品,结合EDS-Mapping发现10.0%Ni@In2O3样品颗粒团聚严重,该结果可能是Ni的引入量过高导致的。此外,通过ICP-AES测试(表 1),所制备催化材料的金属负载量与理论值基本保持一致。
|
| 图 1 (a) In2O3、(b)2.5% Ni@In2O3和(c)10.0% Ni@In2O3的SEM以及对应的Ni元素分布EDS-Mapping结果;(d)3种对比样品的XRD谱图;(e)77 K下的N2吸附-解吸等温线图;(f)样品孔径分布图 Fig.1 SEM images of In2O3 (a), 2.5% Ni@In2O3 (b) and 10.0% Ni@In2O3 (c) with EDS-Mapping results; (d) XRD patterns of different samples; (e) N2 adsorption-desorption isotherms of samples at 77 K; (f) the pore size distributions of the samples |
| |
| Catalyst | w(In)/% | w(Ni)/% |
| In2O3 | 81.68 | |
| 2.5% Ni@In2O3 | 80.52 | 2.48 |
| 10.0% Ni@In2O3 | 75.88 | 10.01 |
将H2/Ar还原后的材料命名为In2O3-R、2.5% Ni@In2O3-R和10.0% Ni@In2O3-R。如图 1(d)所示,对还原前后的材料进行XRD物相结构分析,Ni@In2O3和In2O3表现出相同的衍射峰,对应于c-In2O3晶相(PDF#06-0416),表明在相同的制备条件下,所有样品都以最稳定的立方相(c-In2O3)形式存在。值得注意的是,还原后的材料(In2O3-R、2.5% Ni@In2O3-R和10.0% Ni@In2O3-R)均表现出相同的晶型,说明催化剂的晶体结构在还原过程中没有发生明显的变化,即使是在10.0% Ni@In2O3催化剂中还原前后也都没有检测出明显的Ni或Ni相关化合物的衍射峰,表明Ni的引入对In2O3的晶相结构无明显影响。通过Scherrer公式[16]计算3种样品在2θ=30.6°的最强衍射峰,In2O3、2.5% Ni@In2O3和10.0% Ni@In2O3中In2O3的平均粒径分别为13.83、13.89和13.09 nm,说明Ni的掺杂对In2O3的平均粒径无影响。
通过分析N2吸附-解吸等温线的检测结果,获得了3种样品的孔结构和比表面积情况[图 1(e)和图 1 (f)],检测结果显示所有催化剂呈现出IV型等温线特征并且都存在H3回滞环,与此同时,发现3种催化剂的孔径分布都集中在约10~30 nm之间,孔体积的大小与平均孔径大小趋势一致,表明3种样品都具有介孔结构[17]。
进一步分析3种样品的比表面积,如表 2所示,2.5% Ni@In2O3和In2O3比表面积相对较大,分别为50.34和48.98 m2·g-1,而10.0% Ni@In2O3的比表面积最小,仅为42.46 m2·g-1。这可能是由于引入Ni含量较高,引起颗粒团聚从而极大影响其比表面积,该结果与SEM结果一致。因此,控制Ni金属的掺杂量有助于催化材料比表面积的提高,减少颗粒团聚,充分暴露材料活性位点。
| Catalyst | SBETa/(m2·g-1) | Vtotalb/(m3·g-1) | Dmeanb/nm |
| In2O3 | 48.98 | 0.26 | 20.48 |
| 2.5% Ni@In2O3 | 50.34 | 0.29 | 23.61 |
| 10.0% Ni@In2O3 | 42.46 | 0.36 | 33.54 |
| a由多点Brunauer-Emmet-Teller (BET)等温方程计算;b采用Barrett-Joyner-Halenda (BJH)法测定总孔容和平均孔径。 | |||
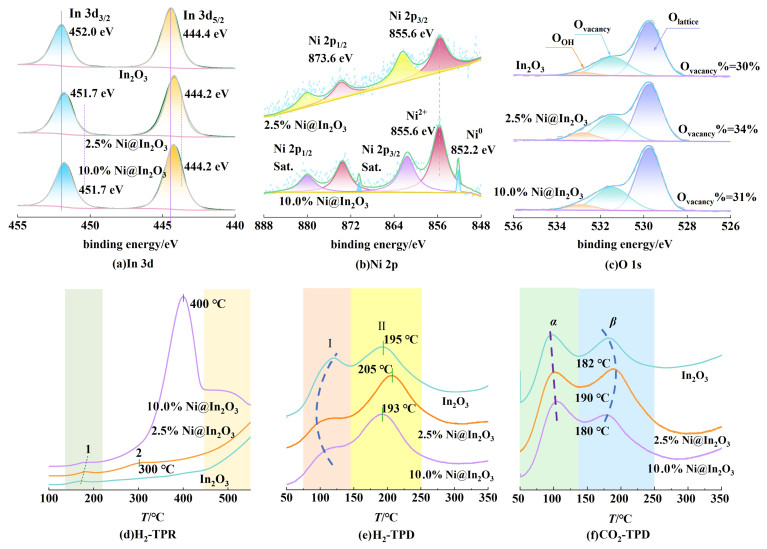
XPS表征了3种样品中In元素的价态结构变化[图 2(a)]。空白对照样In2O3的In 3d结合能在3d5/2和3d3/2自旋轨道中分别对应于444.4和452.0 eV[14],引入Ni金属之后,不同含量Ni@In2O3样品中In 3d轨道分裂峰的结合能分别降低至444.2和451.7 eV,相比于空白In2O3样品中In 3d的结合能,In3+结合能向低结合能方向移动,说明In3+吸引了Ni周围的电子,导致In周围的电子云密度增大,从而导致Ni金属以离子价态形式存在,最终形成In-O-Ni界面结构[18]。进一步通过图 2(b),分析了2.5% Ni@In2O3和10.0% Ni@In2O3中Ni元素结合能的变化,2.5% Ni@In2O3的Ni 2p的结合能在855.6和873.6 eV处有2个强烈的峰,对应于2p3/2和2p1/2自旋轨道[15],这些峰表明镍元素主要以Ni2+的形式存在,从而证实上述In-O-Ni界面结构的形成。需要指出的是,随着Ni引入量的增加,在10.0% Ni@In2O3表面Ni元素除了以Ni2+形式存在外,在852.2和870.5 eV处也观察到Ni0的峰,表明通过控制Ni金属的引入量可以调控Ni元素在In2O3晶体中的存在形式。
|
| 图 2 In2O3、2.5% Ni@In2O3和10.0% Ni@In2O3的(a)In 3d、(b)Ni 2p和(c)O 1s的XPS光谱图;样品的(d)H2-TPR、(e)H2-TPD和(f)CO2-TPD谱图 Fig.2 XPS spectra of (a)In 3d, and (b)Ni 2p, (c)O 1s for different samples; (d)H2-TPR, (e)H2-TPD and (f) CO2-TPD profiles of various samples |
| |
为了确定Ni掺杂对催化剂氧空位浓度的影响,如图 2(c)所示,O 1s在529.7、531.4和532.8 eV处的峰分别对应晶格氧(Olattice)、氧空位(Ovacancy)和吸附的氧物种(OOH)[14]。通过计算各样品的氧空位占比,2.5% Ni@In2O3的表面氧空位浓度为34%,高于10.0% Ni@In2O3(31%)和In2O3(30%)的氧空位浓度,表明金属元素的引入可以实现In2O3中大量氧空位的构建,适量Ni元素的引入可以优化氧空位浓度。结合上述XRD、SEM、N2吸附-脱附分析,2.5% Ni@In2O3具备良好的Ni分散性、更高的比表面积,以及In-O-Ni结构有利于构建氧空位,增强其在二氧化碳加氢体系中的催化活性。
通过H2-TPR深入分析样品在还原行为上的差异。如图 2(d)所示,在低温段(140~220 ℃)3种样品均有1个明显的还原峰,这与表面氧空位的生成有关。此外,低温还原峰随着Ni含量的增加逐渐向高温偏移,表明Ni的存在会在一定程度上抑制In2O3的过度还原,可能是由Ni与In2O3的强相互作用导致的[19]。随着温度升至250 ℃以上,2.5% Ni@In2O3在300 ℃还存在1个特有的还原峰,促进了氧空位的生成。在高温段往往展现的是催化剂的体相还原过程,10.0% Ni@In2O3中由于Ni的引入量过高,相较于In2O3和2.5% Ni@In2O3,在较低的温度(400 ℃)便出现还原峰,主要是10.0%Ni@In2O3中存在的Ni0导致的。
采用H2-TPD研究了不同样品对H2的吸脱附行为。由图 2(e)可见,随着温度的增加,所有样品均呈现出2个主要的解吸峰,分别位于低温范围的Ⅰ峰(75~150 ℃)和中温范围Ⅱ峰(150~250 ℃)[20]。对于Ⅰ峰,2.5% Ni@In2O3表现出明显更低的H2解吸温度。对于Ⅱ峰,2.5% Ni@In2O3的H2解吸温度发生了明显的偏移,即从195 ℃(In2O3)提高到205 ℃,而10.0% Ni@In2O3(193 ℃)与In2O3相对接近,由此可见,H2解吸峰温度的增加和Ni的负载量并未保持同向相关性,这表明控制Ni的引入量对调控材料的H2吸附能力至关重要,2.5% Ni@In2O3更利于拓宽解吸峰的范围。
随后,通过CO2-TPD测试[图 2(f)]分析样品对CO2的吸附和解吸行为。所有样品的CO2解吸峰α和β均出现在250 ℃以内,在低温段α区域对应样品表面羟基的弱碱性位点上CO2的吸附,随着Ni的引入量增加,解吸峰温度向着高的温度方向移动。而在中温段β区域主要是基于金属-氧电子对(In-O,Ni-O)的中等强度的碱性位点和氧缺陷对CO2的吸附[21],相比In2O3(182 ℃)和10.0% Ni@In2O3(180 ℃),2.5% Ni@In2O3的解吸峰温度最高,为190 ℃,这表明低温下随着Ni含量的增加,Ni与In2O3之间的相互作用越来越明显,而中温下2.5% Ni@In2O3展现出最佳的CO2吸脱附能力。
进一步对1、2、Ⅰ+Ⅱ和α+β峰进行定量分析发现(表 3),2.5% Ni@In2O3的H2解离量最高,达到55.08 μmol·g-1,而In2O3和10.0% Ni@In2O3分别为13.97和7.32 μmol·g-1,表明低负载量的Ni更利于Ni@In2O3催化剂对H2的解离。而In2O3的H2解吸量最高,达到25.30 μmol·g-1,2.5% Ni@In2O3和10.0% Ni@In2O3较为接近。以上2点分析表明Ni的负载量严重影响着Ni@In2O3催化剂对H2的吸附量和解吸温度。此外,通过对比3种样品对CO2的解吸量,2.5% Ni@In2O3的CO2解吸量最高,达到了62.78 μmol·g-1,这主要归因于2.5% Ni@In2O3中更多的In-O、Ni-O电子对和表面氧空位,与前述XPS结果一致。
| Catalyst | H2 dissociated 1 (μmol·g-1)a | H2 desorbed (Ⅰ+Ⅱ) (μmol·g-1)b | CO2 desorbed (α+β) (μmol·g-1)c |
| In2O3 | 13.97 | 25.30 | 25.91 |
| 2.5% Ni@In2O3 | 55.08(1+2) | 17.63 | 62.78 |
| 10.0% Ni@In2O3 | 7.32 | 19.02 | 48.42 |
| a通过H2-TPR测试计算;b通过H2-TPD测试计算;c通过CO2-TPD测试计算。 | |||
在此对比了3种样品在240~340 ℃、GHSV为8 000 h-1、压力3 MPa条件下的CO2加氢催化性能。如图 3(a)所示,随着温度从240 ℃升高至340 ℃,CO2转化率有明显的提高,特别是在300 ℃时,2.5% Ni@In2O3的CO2转化率从基础水平的7%显著增加到接近20%,而10.0% Ni@In2O3的转化率却只有15.58%。这表明,Ni的催化活性对温度有很强的依赖性,并且镍的引入确实有利于提高CO2的转化率,但是控制Ni的引入量十分关键,过度引入镍反而会导致一定程度的抑制效果,这可能归因于较高镍含量形成Ni0单质,引起颗粒团聚,从而降低了活性位点的暴露。如图 3(b)所示,尽管Ni的引入有利于大幅度提高催化剂的CO2转化率,但其产物并不局限于只生成甲醇,反而产生了更多的CO副产物,可能由逆水煤气反应竞争引起,最终导致了甲醇选择性的下降。对比催化剂在各个温度下的时空收率发现,2.5% Ni@In2O3在260 ℃下表现出最佳的甲醇收率59 mg·g-1·h-1[图 3(c)]。综合考虑催化体系的转化率、选择性以及时空收率,2.5% Ni@In2O3表现出了优异的催化性能,这一优势与其具有最低的表观活化能(Ea=75.97 kJ·mol-1)一致[图 3(d)]。此外,该体系在XPS分析中显示出最高的氧空位含量,在H2-TPR测试中表现出最佳的H2解离量,而在CO2-TPD实验中则展现出最佳的CO2脱附量。这些结果相互印证,进一步验证了其优越的催化特性。

|
| 图 3 In2O3、2.5% Ni@In2O3和10.0% Ni@In2O3的(a)CO2转化率;(b)甲醇选择性;(c)时空产率和(d)表观活化能 Fig.3 (a)CO2 conversion; (b)methanol selectivity; (c)space time yield (STY) and (d)apparent activation energy of In2O3, 2.5% Ni@In2O3 and 10.0% Ni@In2O3 |
| |
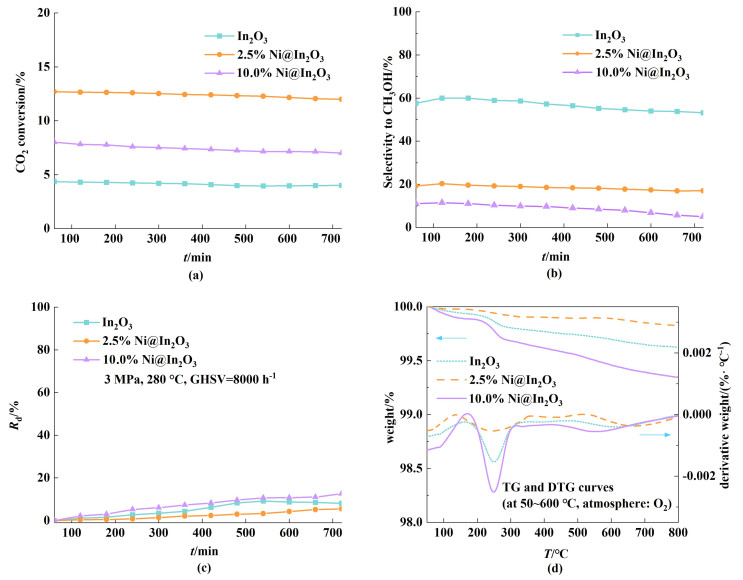
除以上分析之外,进一步分析了催化剂的稳定性。如图 4(a)所示,在280 ℃下,2.5% Ni@In2O3在700 min后仍有12%的转化率,而In2O3仅有2.5% Ni@In2O3的1/3,10.0% Ni@In2O3的催化剂CO2转化率下降十分明显。与此同时,随着时间的推移,尽管In2O3的选择性偏高,但其表现出明显的失活特性[图(4b)],而2.5% Ni@In2O3的甲醇选择性仅降低了2%,且综合表观失活率仅为5%[图 4(c)],稳定性明显优于其他样品。综上所述,优化镍的加入量可以有效提高体系活性和稳定性。
|
| 图 4 稳定性测试:催化剂的CO2转化率(a)、甲醇选择性(b)和失活速率(c)(测试条件:3 MPa,280 ℃,GHSV=8000 h-1);(d)反应后的催化剂分析:TG和DTG曲线(在50~600 ℃、气氛:O2) Fig.4 Stability test: CO2 conversion (a), methanol selectivity (b) and deactivation rate (c) of catalysts (test conditions: 3 MPa, 280 ℃, GHSV=8000 h-1); (d) Analysis of catalysts after reaction: TG and DTG curves (at 50~600 ℃, atmosphere: O2) |
| |
随后,进一步推测催化剂在反应之后的积碳现象,积碳存在可能会导致活性位点被遮蔽,进而降低其活性和选择性。为了验证这一假设,我们利用热重技术对反应后的催化剂进行了深入研究[图 4(d)]。在温度区间50~300 ℃内,可以看到1个明显台阶,说明此范围内发生了水的脱附过程,而在400~800 ℃范围内,可能由于产生焦炭物种表现出缓慢的失质量过程[22]。对比3种样品结果,2.5% Ni@In2O3的失量最少,而10.0% Ni@In2O3的失质量比例约为2.5% Ni@In2O3的2倍,与失活率的差异一致。由于2.5% Ni@In2O3的失质量率不足0.5%,表明少量的Ni引入量在反应过程中具有抗积碳作用。这也解释了即使经过700 min的稳定性评估,催化剂仍然表现出优异的稳定性。
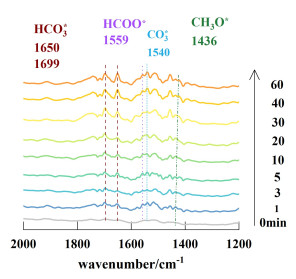
2.3 CO2加氢反应中间体的测定及其反应机理采用原位红外漫反射模式深入研究2.5% Ni@In2O3催化剂在模拟CO2加氢反应条件下的中间体类别以及反应路径。如图 5所示的红外谱图,在反应初始阶段就检测到了碳酸盐CO3*(1 540 cm-1)[23],这归因于CO2分子与催化剂表面的活性位点结合。随后,CO3*经过逐步加氢依次获得中间体HCO3* (1 699[24]与1 650 cm-1[25])、HCOO*(1 559 cm-1)[25]和表面甲氧基物种CH3O*(1 436 cm-1)[25](图 6)。有研究证实HCOO*逐步加氢生成H2COO*→CH2O*→CH3O*[26],然而,在该红外谱图中并未发现H2COO*和CH2O*信号峰,可以推测,H2COO*→CH2O*→CH3O*是2.5% Ni@In2O3在整个过程中的速率控制步骤。
|
| 图 5 2.5% Ni@In2O3催化剂不同时间间隔的原位红外光谱 Fig.5 In situ DRIFT spectra of 2.5% Ni@In2O3 at different time interval |
| |
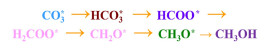
|
| 图 6 2.5% Ni@In2O3催化剂反应路径分析 Fig.6 2.5% Ni@In2O3 catalyst reaction path analysis |
| |
通过共沉淀法制备了不同含量Ni掺杂的In2O3催化剂,利用XRD、SEM、BET、H2-TPR、H2-TPD、CO2-TPR、TG等表征技术对其进行了详细分析。研究了Ni在In2O3晶体结构中的存在形式以及Ni与In2O3的相互作用对CO2加氢体系的影响。主要结论如下。
(1) 优化Ni在In2O3晶体中的引入量保持In2O3的晶型不变,有利于形成In-O-Ni结构,促进氧空位的生成,进而提高CO2加氢催化活性。
(2) 较高镍含量掺入In2O3晶体中,Ni元素不仅以Ni2+形式存在,部分还以Ni0单质存在,易引起颗粒团聚,不利于活性位点的暴露。
(3) 适量的Ni引入量可以增强Ni@In2O3催化剂在二氧化碳加氢过程中的抗积碳能力。
(4) 2.5% Ni@In2O3催化剂二氧化碳加氢反应过程中遵循甲酸盐途径:HCOO*→H2COO*→CH2O*→CH3O*→CH3OH。
| [1] |
REN M, ZHANG Y, WANG X, et al. Catalytic hydrogenation of CO2 to methanol: A review[J]. Catalysts, 2022, 12(4): 403. DOI:10.3390/catal12040403 |
| [2] |
WANG W, HIMEDA Y, MUCKERMAN J T, et al. CO2 hydrogenation to formate and methanol as an alternative to photo- and electrochemical CO2 reduction[J]. Chemical Reviews, 2015, 115(23): 12936-12973. DOI:10.1021/acs.chemrev.5b00197 |
| [3] |
TADA S, KAYAMORI S, HONMA T, et al. Design of interfacial sites between Cu and amorphous ZrO2 dedicated to CO2-to-methanol hydrogenation[J]. ACS Catalysis, 2018, 8(9): 7809-7819. DOI:10.1021/acscatal.8b01396 |
| [4] |
YU J, YANG M, ZHANG J, et al. Stabilizing Cu+ in Cu/SiO2 catalysts with a shattuckite-like structure boosts CO2 hydrogenation into methanol[J]. ACS Catalysis, 2020, 10(24): 14694-14706. DOI:10.1021/acscatal.0c04371 |
| [5] |
ZHANG M, WU Y, DOU M, et al. A DFT study of methanol synthesis from CO2 hydrogenation on the Pd(111) surface[J]. Catalysis Letters, 2018, 148(9): 2935-2944. DOI:10.1007/s10562-018-2497-y |
| [6] |
DÍEZ-RAMÍREZ J, VALVERDE J L, SÁNCHEZ P, et al. CO2 hydrogenation to methanol at atmospheric pressure: Influence of the preparation method of Pd/ZnO catalysts[J]. Catalysis Letters, 2016, 146(2): 373-382. DOI:10.1007/s10562-015-1627-z |
| [7] |
KATTEL S, RAMÍREZ P J, CHEN J G, et al. Active sites for CO2 hydrogenation to methanol on Cu/ZnO catalysts[J]. Science, 2017, 355(6331): 1296-1299. DOI:10.1126/science.aal3573 |
| [8] |
SUN Y, CHEN L, BAO Y, et al. Roles of nitrogen species on nitrogen-doped CNTs supported Cu-ZrO2 system for carbon dioxide hydrogenation to methanol[J]. Catalysis Today, 2018, 307: 212-223. DOI:10.1016/j.cattod.2017.04.017 |
| [9] |
DIN I U, SHAHARUN M S, ALOTAIBI M A, et al. Recent developments on heterogeneous catalytic CO2 reduction to methanol[J]. Journal of CO2 Utilization, 2019, 34: 20-33. DOI:10.1016/j.jcou.2019.05.036 |
| [10] |
BECK A, NEWTON M A, VAN DE WATER L G A, et al. The enigma of methanol synthesis by Cu/ZnO/Al2O3-based catalysts[J]. Chemical Reviews, 2024, 124(8): 4543-4678. DOI:10.1021/acs.chemrev.3c00148 |
| [11] |
LI M, MY PHAM T H, KO Y, et al. Support-dependent Cu-In bimetallic catalysts for tailoring the activity of reverse water gas shift reaction[J]. ACS Sustainable Chemistry & Engineering, 2022, 10(4): 1524-1535. |
| [12] |
JUDITH G A, MIRIAM G C, ELENA S M, et al. Valorization of biomass-derived CO2 residues with Cu-MnOx catalysts for RWGS reaction[J]. Renewable Energy, 2022, 182: 443-451. DOI:10.1016/j.renene.2021.10.029 |
| [13] |
YANG Y, SHEN C, SUN K, et al. Enhanced surface charge localization over nitrogen-doped In2O3 for CO2 hydrogenation to methanol with improved stability[J]. ACS Catalysis, 2023, 13(9): 6154-6168. DOI:10.1021/acscatal.2c06299 |
| [14] |
LIU L, MEZARI B, KOSINOV N, et al. Al promotion of In2O3 for CO2 hydrogenation to methanol[J]. ACS Catalysis, 2023, 13(24): 15730-15745. DOI:10.1021/acscatal.3c04620 |
| [15] |
JIA X, SUN K, WANG J, et al. Selective hydrogenation of CO2 to methanol over Ni/In2O3 catalyst[J]. Journal of Energy Chemistry, 2020, 50: 409-415. DOI:10.1016/j.jechem.2020.03.083 |
| [16] |
BOKUNIAEVA A O, VOROKH A S. Estimation of particle size using the Debye equation and the Scherrer formula for polyphasic TiO2 powder[J]. Journal of Physics: Conference Series, 2019, 1410(1): 012057. DOI:10.1088/1742-6596/1410/1/012057 |
| [17] |
LIN D, ZHANG Z, CHEN Y, et al. The Co-In2O3 interaction concerning the effect of amorphous Co metal on CO2 hydrogenation to methanol[J]. Journal of CO2 Utilization, 2022, 65: 102209. DOI:10.1016/j.jcou.2022.102209 |
| [18] |
杨菲菲, 赵世熙, 周维, 等. Sn掺杂的In2O3催化CO2选择性加氢制甲醇[J]. 化工学报, 2023, 74(8): 3366-3374. YANG Feifei, ZHAO Shixi, ZHOU Wei, et al. Sn doped In2O3 catalyst for selective hydrogenation of CO2 to methanol[J]. CIESC Journal, 2023, 74(8): 3366-3374. (in Chinese) |
| [19] |
XIE F, XU S, DENG L, et al. CO2 hydrogenation on Co/CeO2-δ catalyst: morphology effect from CeO2 support[J]. International Journal of Hydrogen Energy, 2020, 45(51): 26938-26952. DOI:10.1016/j.ijhydene.2020.05.260 |
| [20] |
GAO P, LI F, ZHAO N, et al. Influence of modifier (Mn, La, Ce, Zr and Y) on the performance of Cu/Zn/Al catalysts via hydrotalcite-like precursors for CO2 hydrogenation to methanol[J]. Applied Catalysis A: General, 2013, 468: 442-452. DOI:10.1016/j.apcata.2013.09.026 |
| [21] |
WANG S, YANG J, WANG S, et al. Effect of Cu and Zn on the performance of Cu-Mn-Zn/ZrO2 catalysts for CO2 hydrogenation to methanol[J]. Fuel Processing Technology, 2023, 247: 107789. DOI:10.1016/j.fuproc.2023.107789 |
| [22] |
GUAN L, HUANG C, HAN D, et al. HZSM-5 zeolite cross-linked with ultrathin siliceous layer for intensifying catalytic cracking and diffusion of n-butane[J]. Fuel, 2022, 315: 123252. DOI:10.1016/j.fuel.2022.123252 |
| [23] |
ZHANG G, LIU M, FAN G, et al. Efficient role of nanosheet-like Pr2O3 induced surface-interface synergistic structures over Cu-based catalysts for enhanced methanol production from CO2 hydrogenation[J]. ACS Applied Materials & Interfaces, 2022, 14(2): 2768-2781. |
| [24] |
ZHAO H, YU R, MA S, et al. The role of Cu1-O3 species in single-atom Cu/ZrO2 catalyst for CO2 hydrogenation[J]. Nature Catalysis, 2022, 5: 818-831. DOI:10.1038/s41929-022-00840-0 |
| [25] |
WU Y, XU K, TIAN J, et al. Construction of Ni/In2O3 integrated nanocatalysts based on MIL-68(In) precursors for efficient CO2 hydrogenation to methanol[J]. ACS Applied Materials & Interfaces, 2024, 16(13): 16186-16202. |
| [26] |
LEE K, YAN H, SUN Q, et al. Mechanism-guided catalyst design for CO2 hydrogenation to formate and methanol[J]. Accounts of Materials Research, 2023, 4(9): 746-757. DOI:10.1021/accountsmr.3c00075 |
 2024, Vol. 41
2024, Vol. 41





