2. 中国辐射防护研究所,太原 030006
2. China Institute for Radiation Protection, Taiyuan 030006, China
自2000年以来,基于硫酸根自由基(SO4·-)的高级氧化法(SR-AOPs)已成为废水处理领域的一个新的研究热点[1-3],一般采用激活过硫酸盐(PS)的方法来产生SO4·-。激活PS的工艺有很多,如过渡金属催化、碱活化以及苯酚活化[1-5]等。与基于羟基自由基(OH·)的传统AOPs(如Fenton体系)相比,SR-AOPs具有高选择氧化性以及适用范围广等优点[6, 7]。然而,PS的成本相对较高,且由于稳定性较强而具有毒性,所以PS的环保替代品一直备受关注[8],亚硫酸盐[S(Ⅳ)]来源丰富、成本低廉、生态毒性低,已成为PS的一种有前途的替代品。
过渡金属,如铁、铜、钴以及锰等激活亚硫酸盐生成SO4·-的氧化体系被广泛用来降解水体污染物。Chen等[9]研究了S(Ⅳ)-Fe(Ⅱ)体系降解氯霉素的效果和机理,研究表明,S(Ⅳ)-Fe(Ⅱ)体系相对于单一Fe(Ⅱ)和单一S(Ⅳ)体系明显提升了降解速率。通过对比有氧和无氧条件下S(Ⅳ)-Fe(Ⅱ)体系降解氯霉素的反应速率,发现体系中溶解氧(DO)的存在显著促进了氯霉素降解。此外,淬灭剂实验表明,SO4·-是降解过程的氧化物种。Jia等[10]研究酸性条件下S(Ⅳ)-Mn(Ⅱ)体系降解双酚A,研究表明,S(Ⅳ)-Mn(Ⅱ)体系在40 min内能够降解46.3%的双酚A,加上电极后,能够在40 min内降解94.2%的双酚A。碱性条件下Mn(Ⅱ)活化S(Ⅳ)会经历以下过程[11, 12]:
| $ \mathrm{Mn}(\mathrm{Ⅱ})+\mathrm{SO}_3^{2-} \rightarrow \mathrm{MnSO}_3 $ | (1) |
| $ \mathrm{MnSO}_3+\frac{1}{4} \mathrm{O}_2+\frac{1}{2} \mathrm{H}_2 \mathrm{O} \rightarrow \mathrm{MnSO}_3^{+}+\mathrm{OH}^{-} $ | (2) |
| $ \mathrm{MnSO}_3^{+} \rightarrow \mathrm{Mn}(\mathrm{Ⅱ})+\mathrm{SO}_3^{·-} $ | (3) |
| $ \mathrm{SO}_3^{·-}+\mathrm{O}_2 \rightarrow \mathrm{SO}_5^{·-} $ | (4) |
| $ \mathrm{SO}_5^{·-}+\mathrm{Mn}(\mathrm{Ⅱ}) \rightarrow \mathrm{HSO}_5^{-}+\mathrm{Mn}(\mathrm{Ⅲ}) $ | (5) |
| $ \mathrm{HSO}_5^{-}+\mathrm{Mn}(\mathrm{Ⅱ}) \rightarrow \mathrm{Mn}(\mathrm{Ⅲ})+\mathrm{OH}^{-}+\mathrm{SO}_4^{·-} $ | (6) |
| $ \mathrm{SO}_4^{·-}+\mathrm{Mn}(\mathrm{Ⅱ}) \rightarrow \mathrm{Mn}(\mathrm{Ⅲ})+\mathrm{SO}_4^{2-} $ | (7) |
砷(As)是水体污染物之一,且危害性较大,人体如果砷摄入量过多,会出现呕吐、休克等中毒症状[13]。通常地下水中砷含量不超过10 μg·L-1,但近年来有报道指出全球有众多地区的地下水中砷含量超过50 μg·L-1[14]。我国也存在高砷地下水区域,新疆部分地区自流水中砷含量超过800 μg·L-1,呼和浩特部分地下水砷含量超过1 000 μg·L-1,湖北仙桃部分地下水砷含量甚至超过2 000 μg·L-1等[15]。因此对高砷地下水的治理研究得到越来越多的关注。
无机亚砷酸盐[As(Ⅲ)]的毒性高于砷酸盐[As(Ⅴ)],因此高砷地下水处理工艺中通常考虑将As(Ⅲ)氧化为As(Ⅴ)来降低As毒性[16, 17]。一些催化氧化系统如Fenton反应、金属活化PS和TiO2光催化系统已应用于As(Ⅲ)的氧化中[18-20]。SR-AOPs体系由于其环境友好性以及能够产生强氧化性SO4·-等优点,在As(Ⅲ)的处理方面有很高的应用价值。吉冰冰等[21]用过渡金属Fe(Ⅲ)激活S(Ⅳ)生成SO4·-的方法来处理As(Ⅲ),结果表明,反应体系产生的SO4·-可以有效氧化As(Ⅲ);此外,通过调控pH值,体系生成氢氧化铁将As(Ⅴ)进行沉淀,达到高效去除As的目的。Xu等[22]去除As(Ⅲ)的亚硫酸盐反应体系有很大不同,他们借助发光二极管辅助Fe(Ⅲ)来激活S(Ⅳ),结果表明,在中性pH值条件下,30 min内可去除93%的As(Ⅲ),该过程中有SO4·-的参与。
由此可见,使用过渡金属激活亚硫酸盐体系来处理高砷地下水有很大的环境意义和研究价值。有文献[14]报道,高砷地下水中含有较高浓度的Fe和Mn(本文中浓度如不特殊说明,均指物质的量浓度),且阴离子中HCO3-的浓度最高,然而,HCO3-催化的S(Ⅳ)-Mn(Ⅱ)体系对高砷地下水中As(Ⅲ)的处理没有被研究过,因此本工作主要研究S(Ⅳ)-HCO3--Mn(Ⅱ)体系氧化As(Ⅲ)的性能以及氧化机理。
1 实验部分 1.1 实验试剂与仪器实验试剂见表 1,实验药品都是分析纯纯度。实验仪器见表 2。
| 名称 | 生产厂家 |
| 亚硫酸氢钾(KHSO3) | 上海阿拉丁有限公司 |
| 碳酸氢钠(NaHCO3) | 上海阿拉丁有限公司 |
| 氯化锰(MnCl2) | 上海阿拉丁有限公司 |
| 草酸钠(Na2C2O4) | 上海阿拉丁有限公司 |
| 过硫酸钾(K2S2O8) | 上海阿拉丁有限公司 |
| 甲醇(CH3OH) | 上海阿拉丁有限公司 |
| 叔丁醇(C4H9OH) | 上海阿拉丁有限公司 |
| 焦磷酸钠(Na4P2O7,PP) | 上海阿拉丁有限公司 |
| 氢氧化钠(NaOH) | 上海阿拉丁有限公司 |
| 盐酸(HCl) | 上海阿拉丁有限公司 |
| 亚砷酸钠(NaAsO2) | 默克化工技术有限公司 |
| 去离子水 | 天津市永清源蒸馏水 |
| 名称 | 型号 | 生产厂家 |
| pH计 | PHS-3C | 上海市精密科学仪器有限公司 |
| 电子天平 | BP121S | 上海市精密科学仪器有限公司 |
| 紫外可见分光光度计 | UV-1800 | 上海市美谱达仪器有限公司 |
| 恒温水浴振荡器 | THZ-82 | 天津市欧诺仪器仪表有限公司 |
| 超声波清洗器 | KQ5200DB | 昆山市超声仪器有限公司 |
| 磁力搅拌器 | EMS-13 | 天津市欧诺仪器仪表有限公司 |
实验反应体系为200 mL,NaHCO3、MnCl2、As(Ⅲ)和KHSO3的初始浓度分别为100、0.1、10和3 mmol·L-1,用0.1 mol·L-1 NaOH和0.1 mol·L-1 HCl调节反应体系的pH值(一般为9.0),反应进行30 min,在一定时间取反应样品来检测生成的As(Ⅴ)浓度。所有实验在(25±1) ℃下重复进行,并给出平均值和的标准偏差。
1.3 实验分析方法用比色法测定As(Ⅴ)的浓度[23]。用Visual Minteq软件对不同体系中各组分的存在形态及浓度进行了模拟[24]。
2 实验结果和讨论 2.1 S(Ⅳ)-HCO3--Mn(Ⅱ)体系的氧化性能As(Ⅲ)的氧化实验在不同条件下开展。
由图 1可知,S(Ⅳ)-HCO3-和HCO3--Mn(Ⅱ)体系在30 min内几乎没有As(Ⅴ)生成,表明S(Ⅳ)-HCO3-和HCO3--Mn(Ⅱ)体系没有氧化As(Ⅱ)的能力。此外,S(Ⅳ)-HCO3--Mn(Ⅱ)体系氧化As(Ⅱ)的能力明显高于S(Ⅳ)-Mn(Ⅱ)体系,S(Ⅳ)-HCO3--Mn(Ⅱ)体系30 min内可以氧化95.5%的As(Ⅲ),而S(Ⅳ)-Mn(Ⅱ)体系只能氧化56.4%的As(Ⅲ),表观反应速率常数kobs分别为(1.8±0.2)×10-1和(2.5±0.3)×10-2 min-1。这表明HCO3-的存在明显促进As(Ⅲ)的氧化过程。
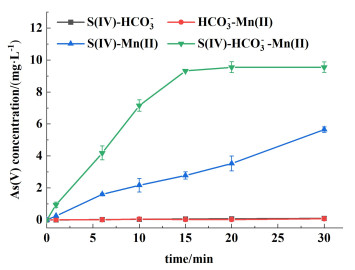
|
| 图 1 不同反应体系对As(Ⅲ)的氧化 Fig.1 Oxidation of As(Ⅲ) in different reaction systems |
| |
图 2显示的是当HCO3-浓度为100 mmol·L-1、Mn(Ⅱ)浓度为0.1 mmol·L-1时S(Ⅳ)浓度对As(Ⅲ)氧化的影响,结果表明As(Ⅲ)在S(Ⅳ)-HCO3--Mn(Ⅱ)体系中的氧化速率随着S(Ⅳ)浓度从1 mmol·L-1增加到5 mmol·L-1呈提高趋势,其中S(Ⅳ)浓度为1、2、3和5 mmol·L-1时kobs分别为(5.5±0.2)×10-2、(8.0±0.2)×10-2、(1.8±0.2)×10-1和(2.0±0.3)×10-1 min-1。随着S(Ⅳ)的浓度增加到10 mmol·L-1,As(Ⅲ)的氧化速率有所下降,kobs为(9.5±0.1)×10-2 min-1,这是因为过量的S(Ⅳ)可能会消除体系中存在的活性自由基,比如SO4·-和OH·,进而抑制As(Ⅲ)的氧化[25, 26]。
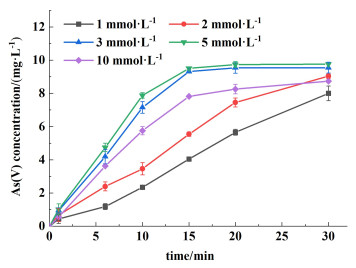
|
| 图 2 不同S(Ⅳ)浓度对As(Ⅲ)氧化的影响 Fig.2 The effect of S(Ⅳ) concentration on the As(Ⅲ) oxidation in the S(Ⅳ)-HCO3--Mn(Ⅱ) system |
| |
如图 3所示,随着Mn(Ⅱ)浓度从0.05 mmol·L-1增加到0.2 mmol·L-1,As(Ⅲ)氧化的kobs从(5.7±0.1)×10-2 min-1持续增加到(2.0±0.3)×10-1 min-1。过量的Mn(Ⅱ)会与SO4·-和SO5·-反应[27],所以在实验中观察到当Mn(Ⅱ)增大到0.5 mmol·L-1时,kobs降低到(1.2±0.2)×10-1 min-1。
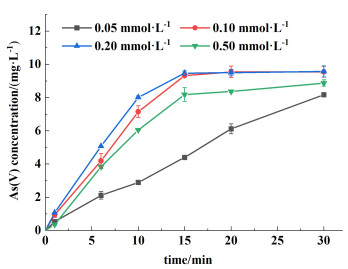
|
| 图 3 不同Mn(Ⅱ)浓度对As(Ⅲ)氧化的影响 Fig.3 The effect of Mn(Ⅱ) concentration on the As(Ⅲ) oxidation in the S(Ⅳ)-HCO3--Mn(Ⅱ) system |
| |
图 4显示的是S(Ⅳ)-HCO3--Mn(Ⅱ)体系在不同pH值条件下As(Ⅴ)的生成情况。在pH值为7.0~9.0范围内,pH值升高促进了As(Ⅴ)的生成。表 3列举了不同pH值时氧化反应的kobs,再次证实了这一结论。而pH值为10.0时的kobs和pH值为9.0的相同(表 3),表明当pH值高于9.0时,pH值不再是影响As(Ⅲ)氧化的因素。
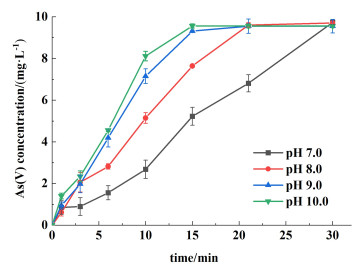
|
| 图 4 不同pH值对As(Ⅲ)氧化的影响 Fig.4 The effect of initial pH on the As(Ⅲ) oxidation in the S(Ⅳ)-HCO3--Mn(Ⅱ) system |
| |
| pH值 | kobs/min-1 |
| 7.0 | (1.1±0.2)×10-1 |
| 8.0 | (1.4±0.2)×10-1 |
| 9.0 | (1.8±0.2)×10-1 |
| 10.0 | (1.8±0.2)×10-1 |
考虑到pH值变化会影响HCO3-在溶液中的种类以及锰碳酸氢根配合物[MnⅡ-(HCO3-)n]的组分情况[28],为此,用Visual Minteq软件模拟出含有100 mmol·L-1 NaHCO3、0.1 mmol·L-1 Mn(Ⅱ)的溶液在pH值为7.0~9.0范围内HCO3-的浓度情况。
表 4可以看出,HCO3-浓度在该pH值范围内先升高后下降,不同于As(Ⅲ)氧化过程kobs随pH值的变化,表明pH值变化对S(Ⅳ)-HCO3--Mn(Ⅱ)体系氧化性能的影响不是由溶液中HCO3-浓度变化导致的。
| pH值 | HCO3-浓度/(mol·L-1) |
| 7.0 | 8.43×10-2 |
| 8.0 | 9.68×10-2 |
| 8.2 | 9.74×10-2 |
| 8.5 | 9.76×10-2 |
| 8.8 | 9.45×10-2 |
| 9.0 | 9.17×10-2 |
有文献[29]报道,pH值还会影响溶液中S(Ⅳ)的种类:在pH值为7.0~9.0范围内,S(Ⅳ)以SO32-形态存在,并且SO32-的浓度随着pH值增大而增大,这与S(Ⅳ)-HCO3--Mn(Ⅱ)体系氧化性能随pH值变化一致,表明在pH值7.0~9.0范围内SO32-浓度越多越有利于As(Ⅲ)的氧化。从式(1)~式(7)可以看出,SO32-参与Mn(Ⅱ)激活S(Ⅳ)的第一步,表明SO32-浓度增大有利于后续的一系列反应,进而有利于活性自由基的生成[如SO4·-,式(6)],这证明SO32-浓度是pH值变化导致S(Ⅳ)-HCO3--Mn(Ⅱ)体系氧化性能发生差异的因素。
另一方面,pH值7.0~9.0范围内Mn(Ⅱ)在溶液中的存在形态也发生改变:随着pH值增大,Mn2+浓度逐渐降低,Mn(Ⅱ)的氢氧化物(MnOH+)浓度逐渐增加[12],而MnOH+会降低Mn(Ⅱ)的氧化能垒[30],有利于Mn(Ⅱ)转化为Mn(Ⅲ)进而生成具有较强氧化性的活性物种[如SO4·-,式(6)],因此,pH值变化引起的MnOH+浓度变化也是影响S(Ⅳ)-HCO3--Mn(Ⅱ)体系氧化性能的因素。
2.4 HCO3-浓度对As(Ⅲ)氧化的影响为进一步考察HCO3-对体系氧化性能的影响,开展了HCO3-浓度为60、80、100和500 mmol·L-1时S(Ⅳ)-HCO3--Mn(Ⅱ)体系的氧化动力学实验。
由图 5可知,当HCO3-浓度为60~100 mmol·L-1时,HCO3-浓度增加会提高S(Ⅳ)-HCO3--Mn(Ⅱ)体系的氧化性能。

|
| 图 5 不同HCO3-浓度对As(Ⅲ)氧化的影响 Fig.5 The effect of HCO3- concentration on the As(Ⅲ) oxidation in the S(Ⅳ)-HCO3--Mn(Ⅱ) system |
| |
此外,图 6表明HCO3-浓度在60~100 mmol·L-1范围内时,S(Ⅳ)-HCO3--Mn(Ⅱ)体系氧化As(Ⅲ)的过程分为2个阶段:阶段1反应速率较慢,kobs在3.8×10-2 min-1左右;阶段2反应速率较快,kobs大致为(1.0~1.8)×10-1 min-1;并且当HCO3-浓度从60增大到100 mmol·L-1时,第1阶段的时长从15缩短到0 min(图 6)。因此,我们提出HCO3-浓度越高越有利于HCO3-、Mn(Ⅱ)和S(Ⅳ) 3者之间的结合,进而促进了As(Ⅲ)的氧化过程。

|
| 图 6 不同HCO3-浓度不同时间段的氧化反应的kobs值 Fig.6 kobs values in the oxidation of As(Ⅲ) at different time periods under different HCO3- concentrations in the S(Ⅳ)-HCO3--Mn(Ⅱ) system |
| |
然而,当HCO3-浓度为500 mmol·L-1时,As(Ⅲ)的氧化反而受到了抑制(图 5), kobs为(8.7±0.04)×10-2 min-1。Dasgupta等[31]指出,在Mn(Ⅱ)浓度为0.5 mmol·L-1,HCO3-浓度为100 mmol·L-1时,随着反应的进行会出现白色的MnCO3沉淀。为此,Visual Minteq软件模拟了在3 mmol·L-1 S(Ⅳ)和0.1 mmol·L-1 Mn(Ⅱ)条件下,HCO3-浓度分别为100和500 mmol·L-1时MnCO3沉淀生成情况以及溶液中MnSO3的浓度(表 5)。结果表明即使在HCO3-浓度为100和500 mmol·L-1条件下30 min的反应过程中都没有观察到白色沉淀生成,但是饱和指数都大于0意味着都有形成MnCO3沉淀的可能性,且HCO3-浓度为500 mmol·L-1生成沉淀的可能性要大于100 mmol·L-1;另一方面,随着HCO3-浓度增加MnSO3(aq)浓度反而降低(表 5),表明当HCO3-浓度大于100 mmol·L-1时,增大HCO3-浓度会生成MnCO3沉淀,进而降低S(Ⅳ)与Mn(Ⅱ)结合的可能,从而降低了S(Ⅳ)-HCO3--Mn(Ⅱ)体系氧化性能。
| c(HCO3-)/(mmol·L-1) | lg IAP | 饱和指数 | c[MnSO3(aq)]/(mmol·L-1) |
| 100 | -8.707 | 1.793 | 9.87×10-2 |
| 500 | -8.674 | 1.826 | 9.38×10-2 |
| IAP: 离子活度积;Ks: MnCO3的溶解度常数,lgKs=-10.5;饱和指数=lg IAP-lgKs。 | |||
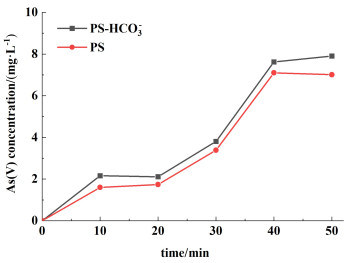
为了进一步探究HCO3-在氧化As(Ⅲ)过程中起到的作用,考虑到能生成SO4·-的体系在HCO3-存在下会进一步生成碳酸根自由基(CO3·-)[32, 33],为此,需要验证体系中是否存在CO3·-。超声PS可以产生SO4·-[32],因此我们对比了有和没有HCO3-的条件下超声激活的PS体系生成As(Ⅴ)的情况(图 7)。50 min内,PS-HCO3-体系和单一PS体系生成的As(Ⅴ)浓度变化曲线几近重合,说明CO3·-对氧化As(Ⅲ)的影响较小。因此,排除了CO3·-对As(Ⅲ)氧化的贡献。
|
| 图 7 PS-HCO3-和单一PS体系在超声条件下氧化As(Ⅲ)的对比 Fig.7 Comparison of As(Ⅲ) Oxidation by PS-HCO3- and PS alone systems under ultrasonic conditions |
| |
另一方面,我们借鉴HCO3-在光合系统Ⅱ(PS Ⅱ) 中的作用来进一步探索HCO3-对S(Ⅳ)-HCO3--Mn(Ⅱ)体系氧化As(Ⅲ)的贡献。目前为止,HCO3-在PS Ⅱ供体侧有两方面作用:一是HCO3-和Mn(Ⅱ)形成弱配位,二是促进电子的转移[34]。为此,考虑到C2O42-与HCO3-和Mn(Ⅱ)的配位常数LgK分别为3.1和1.3[30, 35],我们使用C2O42-替代HCO3-来研究HCO3-和Mn(Ⅱ)的弱配位作用在氧化As(Ⅲ)过程中的贡献。
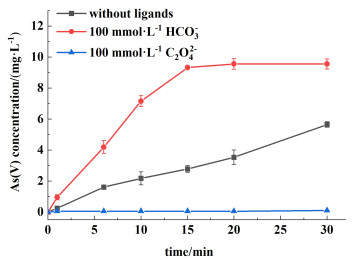
图 8为相同浓度的HCO3-和C2O42-对S(Ⅳ)-Mn(Ⅱ)体系生成As(Ⅴ)的影响,明显看出100 mmol·L-1 HCO3-显著促进了S(Ⅳ)-Mn(Ⅱ)体系的氧化性能,而100 mmol·L-1 C2O42-完全抑制了As(Ⅲ)的氧化,这表明能与Mn(Ⅱ)弱配位结合的配体有利于As(Ⅲ)的氧化,而强配位作用的配体会抑制As(Ⅲ)的氧化过程。此外,由Visual Minteq软件模拟可知,在0.1 mmol·L-1 Mn(Ⅱ)的溶液中加入等量的C2O42-和HCO3-时,有接近90%的Mn(Ⅱ)会和C2O42-结合,进一步证明了C2O42-与Mn(Ⅱ)有高于HCO3-与Mn(Ⅱ)的强配位作用。Limburg等[36, 37]用一硫酸氢盐氧化Mn(Ⅲ)/Mn(Ⅳ)二聚体来模拟PS Ⅱ体系中的水氧化过程,提出Mn二聚体的配体配位强度越小,越有利于Mn的氧化。因此,我们推断HCO3-和Mn(Ⅱ)的弱配位作用有利于S(Ⅳ)和Mn(Ⅱ)结合,进而促进Mn(Ⅱ)的氧化,由式(6)可知,Mn(Ⅱ)氧化为Mn(Ⅲ)会生成SO4·-,从而有利于As(Ⅲ)的氧化[22]。
|
| 图 8 不同配体对S(Ⅳ)-Mn(Ⅱ)体系As(Ⅴ)生成的影响 Fig.8 Effect of different ligands on the formation of As(Ⅴ) in the S(Ⅳ)-Mn(Ⅱ) system |
| |
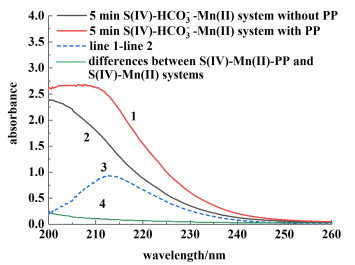
为了验证HCO3-促进Mn(Ⅱ)氧化为Mn(Ⅲ)的作用,首先采用Mn(Ⅲ)-PP法[38]检测S(Ⅳ)-HCO3--Mn(Ⅱ)体系是否存在Mn(Ⅲ)中间体。研究对比了S(Ⅳ)-HCO3--Mn(Ⅱ)体系反应5 min后加和不加PP的UV全扫图(图 9),可以看出,在200~260 nm的UV全扫谱图中,加入PP的曲线(曲线1)完全不同于未加PP的曲线(曲线2)。为了便于观察,用代表S(Ⅳ)-HCO3--Mn(Ⅱ)-PP体系的1号曲线减去代表S(Ⅳ)-HCO3--Mn(Ⅱ)体系的2号曲线得到3号曲线,该曲线在214 nm处有吸收峰,此吸收峰符合Mn(Ⅲ)-PP在214 nm处特征峰的特点[39],这表明S(Ⅳ)-HCO3--Mn(Ⅱ)体系的确生成了Mn(Ⅲ)中间体。另一方面,4号曲线代表同一时刻S(Ⅳ)-Mn(Ⅱ)-PP体系和S(Ⅳ)-Mn(Ⅱ)体系的UV全扫曲线差别,可以看出同一时刻S(Ⅳ)-Mn(Ⅱ)体系没有生成Mn(Ⅲ)中间体。因此,我们提出HCO3-促进S(Ⅳ)-HCO3--Mn(Ⅱ)体系中Mn(Ⅲ)的生成。
|
| 图 9 HCO3-促进S(Ⅳ)-HCO3--Mn(Ⅱ)体系生成Mn(Ⅲ) Fig.9 HCO3- promotes the formation of Mn(Ⅲ) in the S(Ⅳ)-HCO3--Mn(Ⅱ) system |
| |
Tikhonov等[40]用伏安法计算Mn(Ⅱ)还原为Mn(0)的峰值电位与HCO3-浓度的相关性,并用式(8)进行分析,计算不同HCO3-浓度范围内MnⅡ-(HCO3-)n的配位个数。
| $ \Delta E_{1 / 2}=-q \frac{0.059}{n} \Delta \lg c_X $ | (8) |
式(8)中:ΔE1/2是Mn(Ⅱ)配合物还原的中点电位; cX是溶液中HCO3-的浓度; q是Mn(Ⅱ)的配体个数; n是参与氧化还原反应的电子数。
由于可逆的双电子过程Ep和E1/2之差等于14 mV[41],因此用伏安法测定的还原电位峰值Ep代替E1/2来探究式(8)中峰值电位与HCO3-浓度的相关性。结果表明在0.5 mmol·L-1 Mn(Ⅱ)条件下,没有HCO3-时,溶液中Mn(Ⅱ)主要以Mn2+形式存在;在HCO3-浓度为10~100 mmol·L-1时,Mn(Ⅱ)和HCO3-以1 ∶1的形式配位,即[Mn2+(HCO3-)]+;在HCO3-浓度大于100 mmol·L-1时Mn(Ⅱ)和HCO3-以1 ∶2的形式配位,即[Mn2+(HCO3-)2]0[40]。Kozlov等[28]提出Mn(Ⅱ)络合的HCO3-越多,Mn(Ⅱ)越容易氧化为Mn(Ⅲ),因此,HCO3-促进了S(Ⅳ)-HCO3--Mn(Ⅱ)体系中Mn(Ⅱ)到Mn(Ⅲ)的氧化过程,进而生成有利于As(Ⅲ)氧化的SO4·-[式(6)][22]。
综上,HCO3-对S(Ⅳ)-HCO3--Mn(Ⅱ)氧化性能的影响体现在两方面:一是和Mn(Ⅱ)形成弱配位,有助于S(Ⅳ)和Mn(Ⅱ)结合;二是促进Mn(Ⅱ)到Mn(Ⅲ)的氧化过程,生成有利于As(Ⅲ)氧化的SO4·-。
2.5 S(Ⅳ)-HCO3--Mn(Ⅱ)体系的活性氧化物种从式(1)~式(7)可知,Mn(Ⅱ)激活S(Ⅳ)的过程中会产生SO4·-和SO5·-自由基,为了探究As(Ⅲ)氧化过程中是否有自由基参与,用0.1 mol·L-1的甲醇和0.1 mol·L-1的叔丁醇进行了自由基淬灭实验(图 10)。

|
| 图 10 自由基淬灭实验 Fig.10 Quenching experiments with methanol and tert-butanol as the scavengers |
| |
图 10显示,相比于叔丁醇对氧化As(Ⅲ)的抑制作用,甲醇的抑制效果更明显。考虑到甲醇是SO4·-和OH·的淬灭剂(k甲醇, SO4·-=3.2×106 L·moL-1·s-1; k甲醇, OH·=9.7×108 L·moL-1·s-1,而叔丁醇只对OH· 有淬灭作用(k叔丁醇, OH·=6.0×108 L·moL-1·s-1)[42, 43],表明SO4·-是As(Ⅲ)氧化的主要活性氧化物种。另一方面,甲醇对SO5·-都没有较强的淬灭效果(k<103 L·moL-1·s-1)[43],所以在甲醇存在情况下剩余39%是SO5·-的作用。
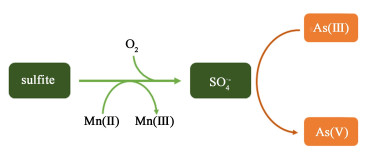
3 结论HCO3-明显促进了S(Ⅳ)-Mn(Ⅱ)体系氧化As(Ⅲ)的过程,主要是促进Mn(Ⅱ)激活S(Ⅳ)的过程:HCO3-与Mn(Ⅱ)形成弱配位,有助于S(Ⅳ)和Mn(Ⅱ)结合发生反应;另一方面促进该过程中Mn(Ⅱ)氧化为Mn(Ⅲ),生成有利于As(Ⅲ)氧化的SO4·-(图 11)。自由基淬灭实验证明Mn(Ⅱ)向Mn(Ⅲ)转化过程中生成的SO4·-是氧化As(Ⅲ)的主要氧化物种。
|
| 图 11 S(Ⅳ)-HCO3--Mn(Ⅱ)体系氧化As(Ⅲ)的机理图 Fig.11 Proposed mechanisms for As(Ⅲ) oxidation in the S(Ⅳ)-HCO3--Mn(Ⅱ) system |
| |
| [1] |
ANIPSITAKIS G P, DIONYSIOU D D. Degradation of organic contaminants in water with sulfate radicals generated by the conjunction of peroxymonosulfate with cobalt[J]. Environmental Science & Technology, 2003, 37(20): 4790-4797. |
| [2] |
ANIPSITAKIS G P, DIONYSIOU D D. Radical generation by the interaction of transition metals with common oxidants[J]. Environmental Science & Technology, 2004, 38(13): 3705-3712. |
| [3] |
ANIPSITAKIS G P, DIONYSIOU D D, GONZALEZ M A. Cobalt-mediated activation of peroxymonosulfate and sulfate radical attack on phenolic compounds. implications of chloride ions[J]. Environmental Science & Technology, 2006, 40(3): 1000-1007. |
| [4] |
FURMAN O S, TEEL A L, WATTS R J. Mechanism of base activation of persulfate[J]. Environmental Science and Technology, 2010, 44(16): 6423-6428. DOI:10.1021/es1013714 |
| [5] |
AHMAD M, TEEL A L, WATTS R J. Mechanism of persulfate activation by phenols[J]. Environmental Science & Technology, 2013, 47(11): 5864-5871. |
| [6] |
DEWIL R, MANTZAVINOS D, POULIOS I, et al. New perspectives for Advanced Oxidation Processes[J]. Journal of Environmental Management, 2017, 195(2): 93-99. |
| [7] |
HU P, LONG M. Cobalt-catalyzed sulfate radical-based advanced oxidation: A review on heterogeneous catalysts and applications[J]. Applied Catalysis B: Environmental, 2016, 181: 103-117. DOI:10.1016/j.apcatb.2015.07.024 |
| [8] |
HUANG Y, HAN C, LIU Y, et al. Degradation of atrazine by ZnxCu1-xFe2O4 nanomaterial-catalyzed sulfite under UV-vis light irradiation: Green strategy to generate SO4-[J]. Applied Catalysis B: Environmental, 2018, 221: 380-392. DOI:10.1016/j.apcatb.2017.09.001 |
| [9] |
CHEN X, MIAO W, YANG Y, et al. Aeration-assisted sulfite activation with ferrous for enhanced chloramphenicol degradation[J]. Chemosphere, 2020, 238: 124599. DOI:10.1016/j.chemosphere.2019.124599 |
| [10] |
JIA L, PEI X, YANG F. Electrolysis-assisted Mn(Ⅱ)/sulfite process for organic contaminant degradation at near-neutral pH[J]. Water, 2019, 11(8): 1608. DOI:10.3390/w11081608 |
| [11] |
ZHOU D, CHEN L, LI J, et al. Transition metal catalyzed sulfite auto-oxidation systems for oxidative decontamination in waters: A state-of-the-art minireview[J]. Chemical Engineering Journal, 2018, 346: 726-738. DOI:10.1016/j.cej.2018.04.016 |
| [12] |
RAO D, SUN Y, SHAO B, et al. Activation of oxygen with sulfite for enhanced Removal of Mn(Ⅱ): The involvement of SO4·[J]. Water Research, 2019, 157: 435-444. DOI:10.1016/j.watres.2019.03.095 |
| [13] |
唐志华. 微量元素砷与人体健康[J]. 广东微量元素科学, 2003, 10(3): 10-13. TANG Zhihua. Trace element arsenic and health[J]. Trace Elements Science, 2003, 10(3): 10-13. (in Chinese) |
| [14] |
SMEDLEY P L, KINNIBURGH D G. A review of the source, behaviour and distribution of arsenic in natural waters[J]. Applied Geochemistry, 2002, 17(5): 517-568. DOI:10.1016/S0883-2927(02)00018-5 |
| [15] |
赵凯, 郭华明, 高存荣. 北方典型内陆盆地高砷地下水的水化学特征及处理技术[J]. 现代地质, 2015, 29(2): 351-360. ZHAO Kai, GUO Huaming, GAO Cunrong. Chemical characteristics and remediation of high arsenic groundwater in typical inland basins of North China[J]. Geoscience, 2015, 29(2): 351-360. DOI:10.3969/j.issn.1000-8527.2015.02.019 (in Chinese) |
| [16] |
WANG Z, BUSH R T, SULLⅣAN L A, et al. Selective oxidation of arsenite by peroxymonosulfate with high utilization efficiency of oxidant[J]. Environmental Science & Technology, 2014, 48(7): 3978-3985. |
| [17] |
WANG Z, BUSH R T, SULLⅣAN L A, et al. Simultaneous redox conversion of chromium(Ⅵ) and arsenic(Ⅲ) under acidic conditions[J]. Environmental Science & Technology, 2013, 47(12): 6486-6492. |
| [18] |
WANG Z, BUSH R T, LIU J. Arsenic(Ⅲ) and iron(Ⅱ) co-oxidation by oxygen and hydrogen peroxide: Divergent reactions in the presence of organic ligands[J]. Chemosphere, 2013, 93(9): 1936-1941. DOI:10.1016/j.chemosphere.2013.06.076 |
| [19] |
ZHOU L, ZHENG W, JI Y, et al. Ferrous-activated persulfate oxidation of arsenic(Ⅲ) and diuron in aquatic system[J]. Journal of Hazardous Materials, 2013, 263 Pt 2: 422-430. |
| [20] |
YOON S H, LEE J H. Oxidation mechanism of As(Ⅲ) in the UV/TiO2 system: Evidence for a direct hole oxidation mechanism[J]. Environmental Science & Technology, 2005, 39(24): 9695-9701. |
| [21] |
吉冰冰, 肖玫, 张琳, 等. 铁-亚硫酸盐配合物体系氧化处理硫酸厂的含砷废水[J]. 水处理技术, 2014, 40(9): 52-56. JI Bingbing, XIAO Mei, ZHANG Lin, et al. Oxidation and removal of arsenic-containing wastewater from sulfuric acid factory by iron-sulfite complex system[J]. Technology of Water Treatment, 2014, 40(9): 52-56. (in Chinese) |
| [22] |
XU J, DING W, WU F, et al. Rapid catalytic oxidation of arsenite to arsenate in an iron(Ⅲ)/sulfite system under visible light[J]. Applied Catalysis B: Environmental, 2016, 186: 56-61. DOI:10.1016/j.apcatb.2015.12.033 |
| [23] |
季朝阳. 含砷铁(羟基)氧化物光致溶解与转化中砷迁移的研究[D]. 天津: 天津大学, 2018 JI Zhaoyang. Mobilization of arsenic during light-induced dissolution and transformation of arsenic contained iron (hydr) oxides[D]. Tianjin: Tianjin University, 2018 (in Chinese) |
| [24] |
顾雪元, 艾弗逊, 张云燕. Visual MINTEQ软件在环境化学教学中的应用[J]. 实验室研究与探索, 2018, 37(11): 165-167, 176. GU Xueyuan, AI Fusun, ZHANG Yunyan. Application of visual MINTEQ in the teaching of environmental chemistry[J]. Research and Exploration in Laboratory, 2018, 37(11): 165-167, 176. (in Chinese) |
| [25] |
XIE P, GUO Y, CHEN Y, et al. Application of a novel advanced oxidation process using sulfite and zero-valent iron in treatment of organic pollutants[J]. Chemical Engineering Journal, 2017, 314: 240-248. |
| [26] |
ZHANG L, CHEN L, XIAO M, et al. Enhanced decolorization of orange Ⅱ solutions by the Fe(Ⅱ)-sulfite system under xenon lamp irradiation[J]. Industrial & Engineering Chemistry Research, 2013, 52(30): 10089-10094. |
| [27] |
BRANDT C, VAN ELDIK R. Transition metal-catalyzed oxidation of sulfur(Ⅳ) oxides. atmospheric-relevant processes and mechanisms[J]. Chemical Reviews, 1995, 95(1): 119-190. |
| [28] |
KOZLOV Y N, TIKHONOV K G, ZASTRIZHNAYA O M, et al. pH dependence of the composition and stability of Mn(Ⅲ)-bicarbonate complexes and its implication for redox interaction of MnⅡ with photosystemⅡ[J]. Journal of Photochemistry and Photobiology B: Biology, 2010, 101(3): 362-366. |
| [29] |
熊龙. Fe(Ⅱ)/亚硫酸盐氧化体系的构建及其转化As(Ⅲ)机理研究[D]. 山东东营: 中国石油大学(华东), 2016 XIONG Long. Construction of Fe(Ⅱ)/sulfite oxidation system and investigation of the transformation mechanisms of As(Ⅲ)[D]. Shandong Dongying: China University of Petroleum (Huadong), 2016 (in Chinese) |
| [30] |
MORGAN J J. Kinetics of reaction between O2 and Mn(Ⅱ) species in aqueous solutions[J]. Geochimica et Cosmochimica Acta, 2005, 69(1): 35-48. |
| [31] |
DASGUPTA J, TYRYSHKIN A M, KOZLOV Y N, et al. Carbonate complexation of Mn2+ in the aqueous phase: Redox behavior and ligand binding modes by electrochemistry and EPR spectroscopy[J]. The Journal of Physical Chemistry B, 2006, 110(10): 5099-5111. |
| [32] |
WANG J, WANG S. Activation of persulfate (PS) and peroxymonosulfate(PMS) and application for the degradation of emerging contaminants[J]. Chemical Engineering Journal, 2018, 334: 1502-1517. |
| [33] |
HUIE R E, CLIFTON C L. Temperature dependence of the rate constants for reactions of the sulfate radical, SO4-, with anions[J]. The Journal of Physical Chemistry, 1990, 94(23): 8561-8567. |
| [34] |
SHEVELA D, EATON-RYE J J, SHEN J R, et al. Photosystem Ⅱ and the unique role of bicarbonate: A historical perspective[J]. Biochimica et Biophysica Acta, 2012, 1817(8): 1134-1151. |
| [35] |
NICO P S, ZASOSKI R J. Mn(Ⅲ) center availability as a rate controlling factor in the oxidation of phenol and sulfide on δ-MnO2[J]. Environmental Science & Technology, 2001, 35(16): 3338-3343. |
| [36] |
LIMBURG J, BRUDVIG G W, CRABTREE R H. O2 evolution and permanganate formation from high-valent manganese complexes[J]. Journal of the American Chemical Society, 1997, 119(11): 2761-2762. |
| [37] |
LIMBURG J, VRETTOS J S, LIABLE-SANDS L M, et al. A functional model for O—O bond formation by the O2-evolving complex in photosystem Ⅱ[J]. Science, 1999, 283(5407): 1524-1527. |
| [38] |
SUN B, GUAN X, FANG J, et al. Activation of manganese oxidants with bisulfite for enhanced oxidation of organic contaminants: The involvement of Mn(Ⅲ)[J]. Environmental Science & Technology, 2015, 49(20): 12414-12421. |
| [39] |
MIZRAHI A, ZILBERMANN I, MAIMON E, et al. Different oxidation mechanisms of MnⅡ(polyphosphate)n by the radicals NO2·- and CO3·-[J]. Journal of Coordination Chemistry, 2016, 69(11/12/13): 1709-1721. |
| [40] |
TIKHONOV K G, ZASTRIZHNAYA O M, KOZLOV Y N, et al. Composition and catalase-like activity of Mn(Ⅱ)-bicarbonate complexes[J]. Biochemistry Biokhimiia, 2006, 71(11): 1270-1277. |
| [41] |
DISMUKES G C, KLIMOV V V, BARANOV S V, et al. The origin of atmospheric oxygen on Earth: The innovation of oxygenic photosynthesis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(5): 2170-2175. |
| [42] |
BUXTON G V, WOOD N D, DYSTER S. Ionisation constants of OH · and HO2· in aqueous solution up to 200 ℃. A pulse radiolysis study[J]. Journal of the Chemical Society, Faraday Transactions 1: Physical Chemistry in Condensed Phases, 1988, 84(4): 1113. |
| [43] |
NETA P, HUIE R E, ROSS A B. Rate constants for reactions of inorganic radicals in aqueous solution[J]. Journal of Physical and Chemical Reference Data, 1988, 17(3): 1027-1284. |
 2024, Vol. 41
2024, Vol. 41





