2. 攀钢集团研究院有限公司 钒钛资源综合利用国家重点实验室,四川 攀枝花 617000;
3. 重庆大学化学化工学院,重庆 400030
2. State Key Laboratory of Vanadium and Titanium Resources Comprehensive Utilization, Sichuan, Panzhihua 617000, China;
3. School of Chemistry and Chemical Engineering, Chongqing University, Chongqing 400030, China
钛白粉即二氧化钛(TiO2)常见的有锐钛(A)和金红石(R) 2种晶型,是目前常用于粉末涂料的性能最好的白色颜料之一,也被广泛应用于油漆、塑料、橡胶、陶瓷、纤维制造、制药、化妆品和食品等工业领域[1-3]。鉴于金红石比锐钛更加稳定而致密,并且有着更高的遮盖率、耐久性和着色力,故研究TiO2由锐钛到金红石的不可逆相变对于钛白粉的推广应用极具现实意义[4-6]。遍观国内研究,钛白粉的生产大多采用硫酸法钛白工艺[7]。在该方案中,偏钛酸的煅烧过程是制备金红石TiO2的必经阶段和关键技术之一,历经非晶偏钛酸向锐钛的转变,以及锐钛到更加稳定的金红石的转变,涉及到原子重排和Ti—O键断裂过程[8, 9]。直接对偏钛酸进行煅烧,不仅需要较高的温度、耗费能源,而且会使TiO2粒子烧结、变硬、泛灰黄相、消色力低等[1]。因此,工业上常在煅烧前添加一定的盐处理剂,以克服直接煅烧带来的不良影响。常见的盐处理剂如铝盐[10, 11]、镁盐[12]、钾盐[13]、磷盐[14]和锌盐[15]等。
目前国内外的研究大多集中在各种盐处理剂的掺杂对后续钛白粉性能的影响、工艺条件的最优化,以及各种离子掺杂对TiO2光催化性能的影响等方面。Wu等[15]对比分析了锌盐和铝盐处理对钛白粉的性能差异;Tian等[16]分析了盐处理和煅烧温度对金红石TiO2的消色力的作用,建立了消色力正交相互作用回归模型,并提出最适宜盐处理条件为0.36%ZnO、0.70%K2O和0.20%P2O5,且最高煅烧温度为850 ℃;容尔益等[17]综合分析了P、Mg对TiO2晶粒生长情况及晶型转变的影响,提出Mg显著促进了晶粒生长和晶型转变,而P会显著抑制TiO2晶粒生长。Wang等[18]、Yu等[19]、Yang等[20]和Zhao等[21]通过溶胶-凝胶法分别制备并分析了不同温度下退火的Zr4+、Zn2+、Fe3+和B3+掺杂的TiO2的光催化性能。
以上研究多是基于TiO2产品的颜料性能和光催化性能的影响,然而,在硫酸法钛白工艺中,关于离子在晶型转变过程的作用机制和存在形式却少有报道。Zn2+在TiO2晶型转变方面表现出较好的促进作用,为了探究Zn2+在煅烧生产过程中的内在作用机制,本研究采用物理混合方式对偏钛酸进行锌盐处理,制备了一系列不同煅烧温度、不同浓度Zn2+掺杂的TiO2,系统分析了Zn2+掺杂下TiO2的晶体结构、Zn2+的掺杂方式、掺杂态及掺杂态的转变,探讨了钛白煅烧工艺中Zn2+从锐钛到金红石晶型转变过程中Zn2+对晶型转变的作用机理和掺杂机制。
1 实验方法 1.1 制备方法本实验所用原料为某钛白厂硫酸法钛白工艺的中间物料二洗偏钛酸;盐处理剂采用分析纯级ZnSO4 ·7H2O;实验过程中用水均为去离子水。
将相同质量的偏钛酸分别置于3个坩埚中于800 ℃下煅烧2 h,自然冷却,称量煅烧前后样品质量的变化,计算得到偏钛酸滤饼的固含量为35.38%。依据实际硫酸法钛白工业生产中的偏钛酸的打浆条件,将浆料浓度设为350 g ·L-1,采用物理混合法制备Zn掺杂TiO2粉末。在室温下,将99.49 g偏钛酸加入到100 mL水溶液中,打浆分散2 h,向分散后的偏钛酸浆料中添加不同浓度(以TiO2计)的锌盐(以ZnO计),继续搅拌2 h,混合均匀。将浆料置于刚玉方舟中,以2 ℃ ·min-1的升温速率升温至设定的煅烧终点温度(600~900 ℃)下进行煅烧、自然冷却、研磨过筛,得到不同温度下的纯TiO2粉末以及不同Zn掺杂量的TiO2粉末,分别记为P-T和Z-x-T,其中T表示煅烧温度,x表示锌盐的添加量(0~10%,以ZnO计,质量分数)。
1.2 分析方法采用粉末X射线衍射仪(P-XRD,Rigaku Ultima Ⅳ,日本)对煅烧后的TiO2粉末样品的晶体结构和组成进行分析,测试条件为:Cu靶,管压40 kV,管流40 mA,扫描角度2θ范围为20°~80°,扫描步长为0.02°。采用场发射透射电子显微镜(TEM,HRTEM,STEM mapping,JEOL JEM-F200,日本)对二氧化钛晶格和元素分布进行形貌和晶格分析。采用X射线光电子能谱仪(XPS,Thermo Scientific,英国)对样品结构和成键进行分析。
2 结果与讨论 2.1 晶相组成和晶型转变为研究Zn2+对偏钛酸煅烧过程中TiO2晶型转变的相变温度的影响,采用P-XRD技术对煅烧后的粉末样品进行表征测试。表 1为不同温度下的金红石晶型转变率。由表 1可知,P-800、Z-0.1-800和Z-0.2-800均为锐钛晶型,晶型尚未开始转变,表明相变温度高于800 ℃;随着Zn2+浓度的增加,金红石晶型开始出现,且金红石含量随着Zn2+浓度的增加而增加,如Z-0.5-800、Z-1.0-800、Z-5.0-800和Z-10.0-800,相变温度低于800 ℃,表明Zn2+降低了锐钛向金红石转变的相变温度。
| w(Zn2+)/% | 晶型转变率/% | |||
| 800 ℃ | 850 ℃ | 875 ℃ | 900 ℃ | |
| 0 | 0 | 13.2 | 88.9 | 97.0 |
| 0.1 | 0 | 16.4 | 89.0 | 100 |
| 0.2 | 0 | 19.7 | 96.0 | 100 |
| 0.5 | 2.1 | 38.5 | 100 | 100 |
| 1.0 | 3.2 | 88.6 | 100 | 100 |
| 5.0 | 10.5 | 100 | 100 | 100 |
| 10.0 | 11.3 | 100 | 100 | 100 |
图 1为利用Jade软件对XRD衍射数据定量计算得到的金红石晶型转变率随Zn2+浓度的变化关系图,P-T和Z-x-T的晶型转变率在相同煅烧温度下随Zn2+浓度的增加而升高。其中,850 ℃时,P-850的金红石晶型转变率为13.2%;Zn2+质量分数从0.1%增加到10%时,转变率相应提高了3.2%、6.5%、25.3%、75.4%、86.8%和86.8%,表明Zn2+促进了晶型转变。值得注意的是,相较于P-850,Z-1.0-850的转变率为88.6%,存在明显的跃变,即1%的锌盐显著促进了晶型转变。另外,金红石转变率为100%时的温度称为完全转变温度,可知纯TiO2的完全转变温度高于900 ℃,而Z-0.5-T的样品在875 ℃已经完全转变,温度约降低25 ℃;Z-5.0-T的样品在850 ℃便完全转变,温度至少降低50 ℃。
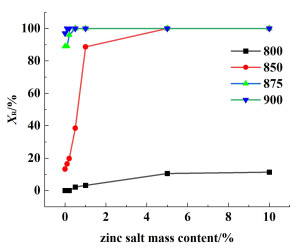
|
| 图 1 金红石转变率与锌盐浓度的关系图 Fig.1 Relation diagram of rutile conversion rate (XR) and zinc salt content |
| |
综上,Zn2+的存在降低了锐钛向金红石晶型转变的相变温度;且在相同温度下,Zn2+的加入显著提高了金红石晶型转变率。
2.2 Zn2+在TiO2中的存在状态和掺杂模式利用XRD技术分析了Zn2+在TiO2中的掺杂行为。图 2(a)为P-850和Z-x-850(x=0, 0.1, 0.2, 0.5, 1, 5, 10)的XRD谱图,发现随着Zn2+浓度的增加,锐钛含量减少,金红石含量增加,表明Zn2+加速了锐钛到金红石的晶型转变过程;当锌盐质量分数为0~1%时,未观察到新峰和ZnO的相关峰;而当锌盐质量分数高达5%时,在32.8°左右有新峰出现,对应于六方相ZnTiO3的(104)晶面。图 2(b)和图 2 (c)为Z-0.5-T和Z-5.0-T(T=600、700、800、850、875和900 ℃)的XRD谱图。图 2(b)的Z-0.5-T除锐钛和金红石相外,无其它新物种和ZnO的相关峰,说明Zn2+以某种方式掺杂到TiO2晶格中。图 2 (c)中,随着煅烧温度的升高,Z-10.0-850、Z-10.0-875、Z-10.0-900均存在ZnTiO3的(104)晶面峰,且峰强随温度的升高而增强,表明越来越多的ZnTiO3生成。
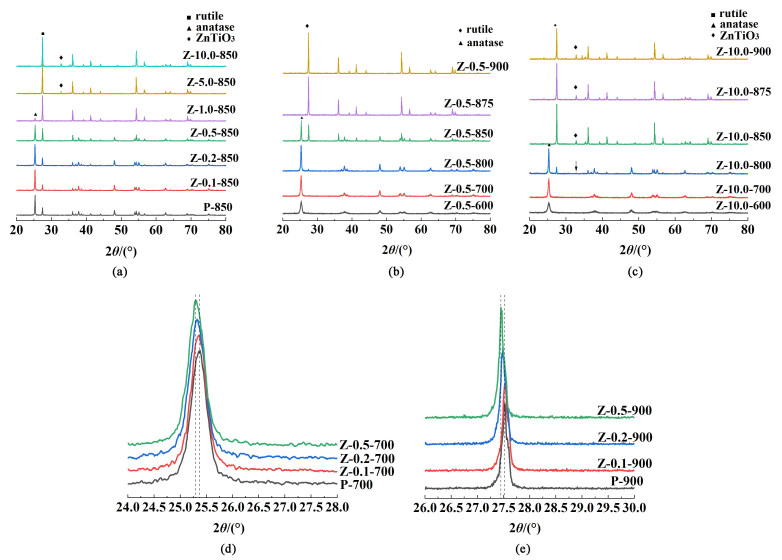
|
| 图 2 (a) Z-x-850 (x=0, 0.1, 0.2, 0.5, 1.0, 5.0, 10.0);(b) Z-0.5-T (T=600, 700, 800, 850, 875, 900);(c) Z-10.0-T (T=600, 700, 800, 850, 875, 900);(d) 锐钛(101)晶面;(e) 金红石(110)晶面的XRD谱图 Fig.2 XRD patterns of catalysts (a) Z-x-850 (x=0, 0.1, 0.2, 0.5, 1.0, 5.0, 10.0); (b) Z-0.5-T (T=600, 700, 800, 850, 875, 900); (c) Z-10.0-T (T=600, 700, 800, 850, 875, 900); (d) (101) face of anatase; (e) (110) face of rutile |
| |
在离子掺杂过程中,实际的掺杂行为受离子的电负性和离子半径共同影响,通常根据离子掺杂位点有间隙掺杂和取代掺杂2种方式。一般来说,间隙掺杂主要发生在掺杂离子的离子半径相对较小的情况下,占据材料晶格的间隙位点;而当掺杂离子与材料的本征离子价态相同、电子排布类似或者离子半径相近时,主要发生取代掺杂。Ti4+的离子半径为0.068 nm,电负性为1.54;O2-的离子半径为0.142 nm;Zn2+的离子半径为0.074 nm,电负性为1.6。由于Ti4+和Zn2+的离子半径和电负性相对接近,故排除间隙掺杂,可能发生取代掺杂。在取代掺杂模式下,掺杂离子Zn2+将取代TiO2晶格中的Ti4+离子,Zn2+的离子半径略大于Ti4+的离子半径,因此会导致晶胞参数和晶胞体积的增大,使XRD峰位置向低角度偏移,如图 2(d)和图 2 (e)所示。相对于P-T样品,掺杂0.1%、0.2%、0.5%时,锐钛(101)晶面和金红石(110)晶面的峰位置均发生左移,与前文猜测一致,表明Zn2+以取代掺杂方式进入TiO2晶格中取代Ti4+。另外,偏钛酸的煅烧过程经历脱水、脱硫和晶型转变等过程,其中晶型转变过程又分为锐钛相生长、晶型转变和金红石相生长[1]。Z-10.0-700晶型尚未开始转变,未出现ZnTiO3的相关峰,Z-10.0-800开始出现ZnTiO3的相关峰,表明ZnTiO3的形成处于A→R晶型转变的阶段。从图 2(a)中可以发现Z-1.0-850无ZnTiO3的相关峰,而Z-5.0-850存在ZnTiO3的相关峰,故在Zn2+浓度居于1%~5%之间存在一个掺杂饱和浓度。根据本实验所选的浓度实验点将整个浓度区间分为低浓度(x≤1%)和高浓度(x≥5%),即高浓度5%或10%的Zn2+部分以掺杂的形式存在于晶格中,达到饱和后其余部分Zn2+以ZnTiO3的形式存在与TiO2表面。利用HRTEM可以进一步验证Zn2+的取代掺杂和表面ZnTiO3的存在方式。
图 3为样品的HRTEM图像,图 3 (a)、图 3 (b)和图 3 (c)均为900 ℃下退火的粉末样品,测量得到晶格条纹间距分别为0.315、0.325和0.330 nm,结合XRD数据和Jade可知这些条纹间距均对应于金红石(110)晶面的条纹间距。发现随着Zn2+浓度的增加,条纹间距逐渐增大,表明Zn2+成功掺杂到TiO2晶格中,从而使晶胞体积变大。此外,图 3(d)Z-10.0-900除了0.340 nm的金红石(110)晶面条纹间距外,还存在d=0.270 nm的条纹间距,该条纹属于ZnTiO3的(104)晶面对应的条纹间距,表明当盐处理过程中Zn2+浓度足够高时,经过高温煅烧,金红石晶面条纹间距变大,同时部分Zn2+还在TiO2表面以新相ZnTiO3的形式存在。

|
| 图 3 (a) P-900;(b) Z-0.2-900;(c) Z-0.5-900;(d) Z-10.0-900的HRTEM图 Fig.3 HRTEM images of catalysts (a) P-900; (b) Z-0.2-900; (c) Z-0.5-900; (d) Z-10.0-900 |
| |
图 4是在透射电子显微镜下观察到的未掺杂和掺杂0.2%锌的二氧化钛的形貌图,图 4 (b)、图 4 (c)、图 4 (e)和图 4 (f)的晶粒平均尺寸分别为27、44、37和84 nm,发现粒子随温度的升高而生长;且锌掺杂后,在同温度下,样品的尺寸增加,表明锌的掺杂促进了晶体的生长过程。

|
| 图 4 (a) 偏钛酸;(b) P-800;(c) P-900;(d) Z-0.2-偏钛酸;(e) Z-0.2-800;(f) Z-0.2-900的晶粒尺寸图 Fig.4 TEM images of (a) H2TiO3; (b) P-800; (c) P-900; (d) Z-0.2-H2TiO3; (e) Z-0.2-800; (f) Z-0.2-900 |
| |
图 5为Z-x-T的元素分布情况,均存在Ti、O和Zn 3种元素,且Ti和O元素分布均匀。图 5(a)为直接干燥的Z-5.0-H2TiO3粉末,Zn元素分布较为均匀,说明煅烧前的盐处理过程混合相对均匀。图 5(c)和图 5(d)分别为Z-1.0-900和Z-0.2-900,说明在较低浓度下Zn元素分布也较为均匀,且1%元素含量较0.2%更加明显,这是受检测限度所限。又因为XRD图未检测到ZnO的相关峰,进一步说明TiO2晶格中存在Zn2+,即Zn2+成功掺杂到了二氧化钛晶格中。图 5(b)中,盐处理浓度较高,发现除了锌元素均匀分布的A区域外,在B区域还存在锌元素相对密集区,结合图 5(a)排除盐处理阶段元素分布不均的情况,推测为部分Zn2+进入晶格使掺杂浓度达到饱和后,其余Zn2+堆积在TiO2表面,以锌的相关化合物ZnTiO3的形式存在。
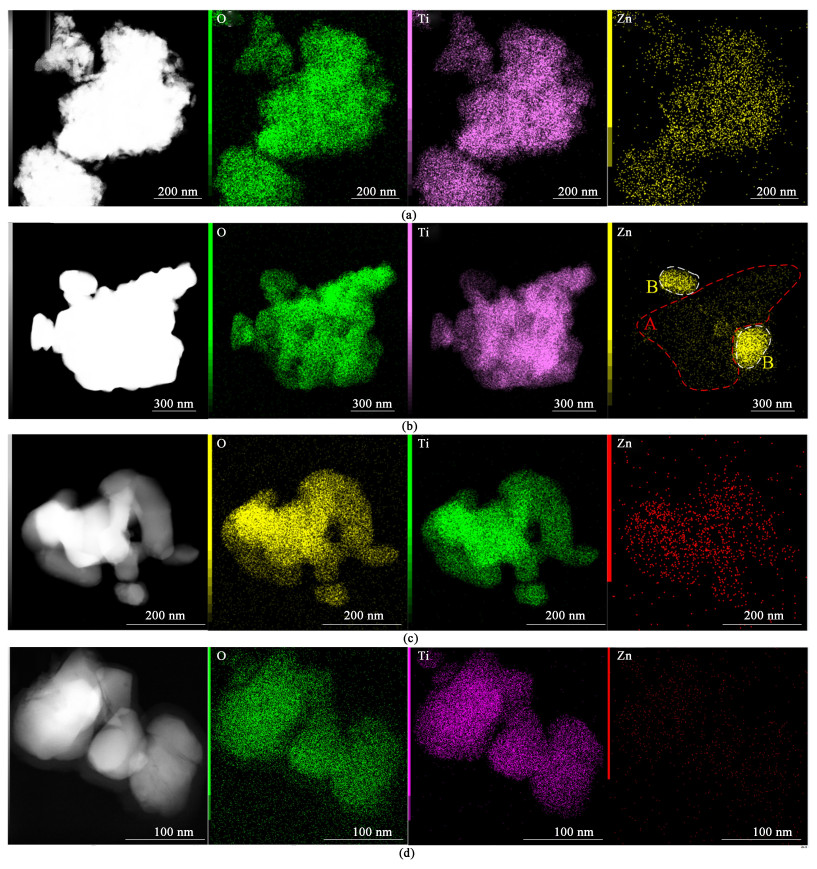
|
| 图 5 (a) Z-5.0-偏钛酸;(b) Z-5.0-900;(c) Z-1.0-900;(d) Z-0.2-900的元素分布图 Fig.5 EDS mapping images of (a) Z-5.0-H2TiO3; (b) Z-5.0-900; (c) Z-1.0-900; (d) Z-0.2-900 |
| |
采用XPS技术进一步对不同锌含量不同煅烧温度的TiO2中Zn2+的存在状态及其关系进行分析。图 6为Z-0.5-T和Z-10.0-T各元素的XPS图。
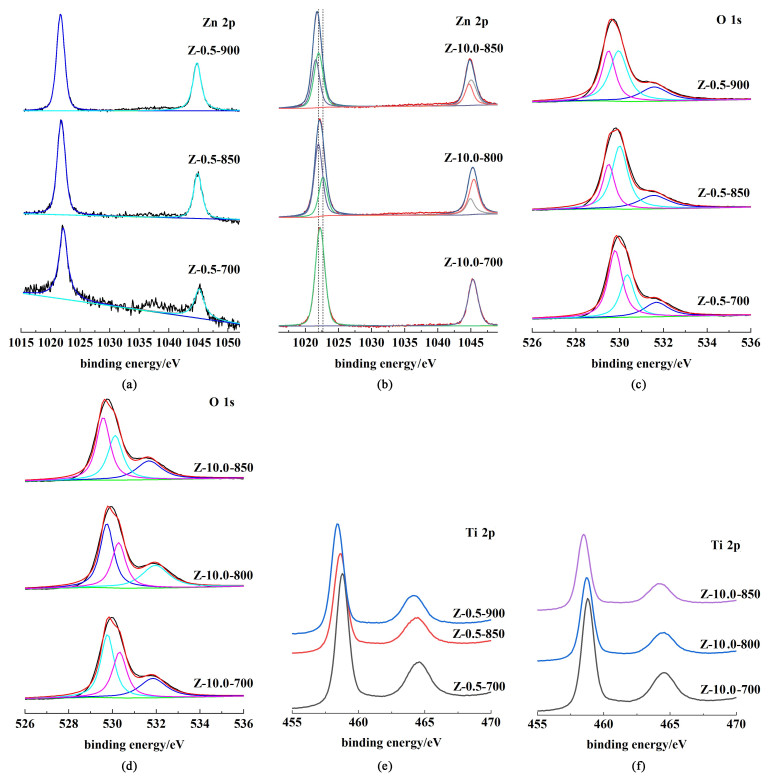
|
| 图 6 (a)~(b) Zn 2p;(c)~(d) O 1s;(e)~(f) Ti 2p的XPS图 Fig.6 XPS narrow san of (a)—(b) Zn 2p; (c)—(d) O 1s; (e)—(f) Ti 2p |
| |
由图 6(a)可知,Z-0.5-700、Z-0.5-850、Z-0.5-900的Zn 2p光谱中的双峰中心分别位于1 022.1和1 045.1 eV、1 021.8和1 044.9 eV、1 021.7和1 044.8 eV处,可归因于取代模式下掺杂2价Zn2+的Zn 2p3/2和Zn 2p1/2,因为掺杂Zn2+的Zn 2p3/2的峰位于ZnO(1 022.3 eV)和金属Zn(1 021.6 eV)之间[19]。并且随着煅烧温度从700升高900 ℃的过程,峰强增强,结合能略有降低,表明Zn离子价态为+2价,且Zn2+正在逐渐以取代模式掺杂到二氧化钛晶格中。同理,图 6(b)中,Z-10.0-700的Zn 2p光谱中的双峰(1 022.2和1 045.3 eV)为取代模式下掺杂Zn2+的Zn 2p3/2和Zn 2p1/2;而随着煅烧温度的升高,在Z-10.0-800和Z-10.0-850中,Zn2+的Zn 2p3/2和Zn 2p1/2分别解卷积出2条峰,即除了取代模式下Zn2+的峰外,还存在约处于1 022.6和1 044.9 eV、1 021.9和1 045.0 eV的双峰位置,可归因于ZnTiO3的Zn 2p3/2和Zn 2p1/2[19]。且Zn 2p光谱表明,随着煅烧温度的升高,ZnTiO3中归属于Zn的Zn 2p3/2峰的峰强度增加,同时,取代掺杂模式下Zn2+的Zn 2p3/2峰的峰强度相对降低;在Z-10.0-800和Z-10.0-850中,取代掺杂模式下的Zn2+与ZnTiO3 2种Zn2+存在方式共存。这些结果表明,煅烧温度的增加使得越来越多的ZnTiO3物相生成;随着锌含量的增加,取代掺杂达到饱和,其余部分Zn2+在TiO2表面与TiO2相结合以生成ZnTiO3的形式存在。由图 6(c)和图 6 (d)的O1s光谱发现Z-0.5-T和Z-10.0-T均存在3条峰,峰位置分别位于529.5、530.0和531.0 eV左右,对应于晶格氧、氧空位吸附氧和表面吸附氧[22-25],表明,在煅烧过程中晶格中的氧部分脱离,使部分晶格氧缺失,从而形成氧空位。图 6(e)和(f)的Ti 2p光谱表明Ti离子仍然以+4价的状态存在[22, 25]。
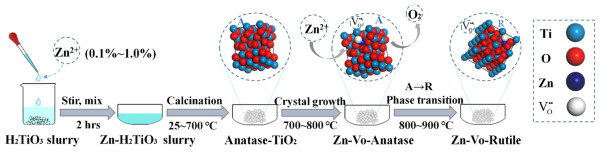
2.3 掺杂机理和晶型转变基于上述的实验结果可知,盐处理时添加的锌盐在高温煅烧过程可以降低相变温度,促进锐钛向金红石的相转变。当Zn2+掺杂量不同时,存在2种不同的作用机理,具体如下:当Zn2+掺杂量位于低浓度区间(x≤1%)时,随着煅烧温度的升高,偏钛酸脱水脱硫,锐钛型TiO2晶粒生长。Zn2+作为掺杂离子进入锐钛型TiO2晶格中,受Zn2+和Ti4+的离子半径、电负性所限,掺杂方式只能为取代掺杂,即Zn2+置换了晶格中的Ti4+,造成杂质缺陷,形成ZnxTiyO2,此类掺杂从锐钛相粒子生长起便开始进入晶格,持续到晶型转变的整个煅烧过程中。根据杂质缺陷反应规律,低价Zn2+占据高价Ti4+位置时,该位置带有负电荷,即Zn″Ti,为保持电中性,会产生负离子空位,即氧空位VO··,XPS数据证明了氧空位的存在。氧空位通过降低晶型转变过程中Ti—O键断裂所需的能量来降低相变温度,同时为原子重排提供了更多的空间,有利于加速转晶过程,提高晶型转变率。低浓度Zn2+掺杂机理如式(1)~式(3)和图 7所示。
| $ \mathrm{H}_2 \mathrm{TiO}_3 \xrightarrow{\text { Calcination }} \mathrm{TiO}_2 \text { (anatase) }+\mathrm{H}_2 \mathrm{O}(\mathrm{g}) \uparrow $ | (1) |
| $ \mathrm{ZnO} \xrightarrow{\mathrm{TiO}_2} \mathrm{Zn}^{\prime \prime}_{\mathrm{Ti}}+\mathrm{O}_0+\mathrm{V}_{\mathrm{o}}^{··}+1 / 2 \mathrm{O}_2 \uparrow $ | (2) |
| $ \mathrm{Zn}_x \mathrm{Ti}_y \mathrm{O}_2 \text { (anatase) } \rightarrow \mathrm{Zn}_x \mathrm{Ti}_y \mathrm{O}_2 \text { (rutile) } $ | (3) |
| $ \mathrm{Zn}^{2+}+\mathrm{TiO}_2+\mathrm{O}^{2-} \rightarrow \mathrm{ZnTiO}_3 $ | (4) |
|
| 图 7 低浓度Zn2+掺杂机理示意图 Fig.7 Schematic diagram of low-content of Zn2+ doping mechanism |
| |
其中:Zn″Ti为Zn2+占据Ti4+位置,带有2个单位的负电荷;
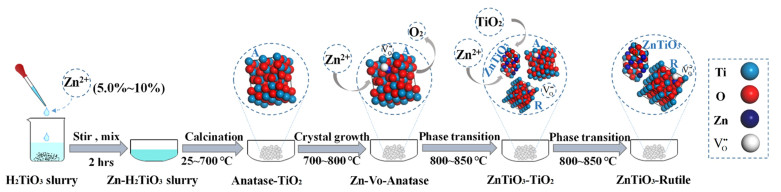
当Zn2+掺杂量位于高浓度区间(5%≤x≤10%)时,随着温度的升高和掺杂过程的进行,锐钛逐渐转变为金红石,越来越多的离子掺入TiO2晶格中,取代掺杂浓度存在一个缺陷浓度饱和值,达到该值后,Zn2+将难以进入TiO2晶格中,而是存在于晶格表面,在高温的作用下,与空气中的O2和H2O反应生成新物质ZnTiO3; 且Zn2+浓度越高,ZnTiO3的含量也越高。
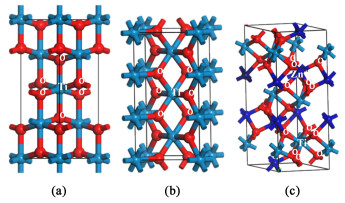
由图 8中锐钛、金红石和ZnTiO3的晶体结构图可知,3种晶体中的Ti原子均与6个O原子相连成键,且ZnTiO3中的Zn—O键也是[ZnO6]结构。利用Materials Studio对3种晶体结构进行优化计算,结果可知锐钛的Ti—O键长为0.192和0.198 nm,金红石的Ti—O键长为0.195和0.198 nm,ZnTiO3中的Ti—O键长为0.187和0.209 nm、Zn—O键长为0.202和0.223 nm,ZnTiO3与金红石型TiO2的成键方式和晶格结构更为接近,而锐钛矿相对更加扭曲。由于与金红石相似的晶体结构单元,在煅烧过程中TiO2表面的ZnTiO3会诱导金红石的形成[19],从而降低相变所需的能量,使相变温度降低。高浓度Zn2+掺杂机理如式(1)~式(4)和图 9所示。
|
| 图 8 (a) 锐钛相;(b) 金红石相;(c) ZnTiO3的晶体结构图 Fig.8 Crystal structure diagrams of (a) anatase; (b) rutile; (c) ZnTiO3 |
| |
|
| 图 9 高浓度Zn2+掺杂机理示意图 Fig.9 Schematic diagram of high-content of Zn2+ doping mechanism |
| |
通过物理混合方法制备不同浓度Zn2+掺杂的TiO2,利用各种表征手段和方法对其进行分析,得到以下结论。
(1) 对比同一煅烧终点温度下的P-T和Z-x-T,发现Z-x-T的相变温度低于P-T,且金红石晶型转变率高于P-T。因此,加入Zn2+可以降低相变温度,促进晶型转变。
(2) Zn在TiO2中的存在状态与Zn2+浓度密切相关,首先在TiO2晶格中以取代态Zn2+存在,后随着Zn2+浓度的增加,除取代位Zn2+外,其余Zn的存在态为表面物相ZnTiO3。
(3) Zn2+对TiO2晶型转变的促进机制根据Zn2+浓度有所不同。低浓度Zn2+掺杂时,Zn2+以取代方式进入TiO2晶格,置换Ti4+,形成氧空位,造成杂质缺陷,为原子重排提供更多空间,从而加速晶型转变;高浓度Zn2+掺杂时,随着Zn2+浓度的增加,Zn2+的取代掺杂达到饱和,更多的Zn2+以TiO2表面形成新物种ZnTiO3来诱导金红石的生成,促进晶型转变。
本研究探讨了Zn2+浓度对偏钛酸煅烧过程中晶型转变的内在作用机制,总结了不同浓度Zn2+的掺杂态和掺杂方式等掺杂机理,对后续钛白产品的调控具有一定的理论指导意义。
致谢: 感谢攀钢集团研究院有限公司对本研究的资金和技术支持。
| [1] |
唐振宁. 钛白粉的生产与环境治理[M]. 北京: 化学工业出版社, 2000. TANG Zhenning. Production and environmental treatment of titanium dioxide[M]. Beijing: Chemical Industry Press, 2000. (in Chinese) |
| [2] |
JOSE S, JOSHY D, NARENDRANATH S B, et al. Recent advances in infrared reflective inorganic pigments[J]. Solar Energy Materials and Solar Cells, 2019, 194: 7-27. DOI:10.1016/j.solmat.2019.01.037 |
| [3] |
VAN DRIEL B A, KOOYMAN P J, VAN DEN BERG K J, et al. A quick assessment of the photocatalytic activity of TiO2 pigments—From lab to conservation studio![J]. Microchemical Journal, 2016, 126: 162-171. DOI:10.1016/j.microc.2015.11.048 |
| [4] |
GIRALDI T R, ALMEIDA D J, BAGGIO C M, et al. Anatase-to-rutile transition in Co-doped TiO2 pigments[J]. Journal of Sol-Gel Science and Technology, 2017, 83(1): 115-123. DOI:10.1007/s10971-017-4379-y |
| [5] |
吴胜财, 罗弦, 龙永富, 等. 二氧化硅掺杂对二氧化钛晶型转变机理的影响[J]. 材料工程, 2020, 48(11): 99-107. WU Shengcai, LUO Xian, LONG Yongfu, et al. Effects of silicon doping on phase transformation mechanism of titanium dioxide[J]. Journal of Materials Engineering, 2020, 48(11): 99-107. (in Chinese) |
| [6] |
姜贵民, 严继康, 杨钢, 等. TiO2晶型转变(A→R)的影响因素[J]. 材料导报, 2016, 30(19): 95-100. JIANG Guimin, YAN Jikang, YANG Gang, et al. Influencing factors of crystal phase transformation(A→R) of TiO2[J]. Materials Review, 2016, 30(19): 95-100. (in Chinese) |
| [7] |
SONG Y, WANG H. Using polyvinyl alcohol to improve the deacidification performance of titanium white waste acid: Pilot tests[J]. Waste Management, 2019, 87: 13-20. DOI:10.1016/j.wasman.2019.01.043 |
| [8] |
SONG M, LU Z, LI D. Phase transformations among TiO2 polymorphs[J]. Nanoscale, 2020, 12(45): 23183-23190. DOI:10.1039/D0NR06226J |
| [9] |
XU J, HUANG J, ZHANG S, et al. Understanding the surface reduction of nano rutile and anatase: Selective breaking of Ti—O bonds[J]. Materials Research Bulletin, 2020, 121: 110617. DOI:10.1016/j.materresbull.2019.110617 |
| [10] |
GESENHUES U, RENTSCHLER T. Crystal growth and defect structure of Al3+-doped rutile[J]. Journal of Solid State Chemistry, 1999, 143(2): 210-218. DOI:10.1006/jssc.1998.8088 |
| [11] |
HO D Q, KIM S. Role of aluminum doping in anatase-to-rutile transformation from thermodynamic view point[J]. Physica Status Solidi Rapid Research Letters, 2018, 12(12): 1800234. DOI:10.1002/pssr.201800234 |
| [12] |
王书亮, 刘洪学, 曾人杰. Mg2+掺杂对TiO2粉末晶型转变的影响与机理[J]. 厦门大学学报(自然科学版), 2005, 44(6): 806-809. WANG Shuliang, LIU Hongxue, ZENG Renjie. Effects of Mg2+ doping on polymorphic transition of TiO2 powders and mechanism[J]. Journal of Xiamen University (Natural Science), 2005, 44(6): 806-809. (in Chinese) |
| [13] |
马维平. 偏钛酸煅烧过程中氢氧化钾作用研究[J]. 钢铁钒钛, 2019, 40(4): 35-38. MA Weiping. Effect of potassium hydroxide on calcination of metatitanic acid[J]. Iron Steel Vanadium Titanium, 2019, 40(4): 35-38. (in Chinese) |
| [14] |
马维平, 王斌, 吴健春. 磷酸对制备金红石型钛白粉的影响[J]. 钢铁钒钛, 2019, 40(3): 30-33. MA Weiping, WANG Bin, WU Jianchun. Effect of phosphoric acid on preparation of rutile titanium dioxide[J]. Iron Steel Vanadium Titanium, 2019, 40(3): 30-33. (in Chinese) |
| [15] |
吴健春, 路瑞芳, 马维平. 锌系与铝系盐处理钛白差异分析[J]. 钢铁钒钛, 2020, 41(2): 29-32. WU Jianchun, LU Ruifang, MA Weiping. Analysis of difference between zinc salt and aluminum salt treated titanium dioxide[J]. Iron Steel Vanadium Titanium, 2020, 41(2): 29-32. (in Chinese) |
| [16] |
TIAN C. Orthogonal interactions and synergistic effects of salt treatment and calcination on rutile titanium dioxide pigment preparation[J]. Materials Chemistry and Physics, 2020, 249: 123125. DOI:10.1016/j.matchemphys.2020.123125 |
| [17] |
容尔益, 朱家文, 陈葵, 等. 煅烧晶种和磷、镁对二氧化钛晶体的影响[J]. 无机盐工业, 2016, 48(7): 21-24. RONG Eryi, ZHU Jiawen, CHEN Kui, et al. Effects of calcining seed, phosphate, and magnesium on titanium dioxide crystal[J]. Inorganic Chemicals Industry, 2016, 48(7): 21-24. (in Chinese) |
| [18] |
WANG J, YU Y, LI S, et al. Doping behavior of Zr4+ ions in Zr4+-doped TiO2 nanoparticles[J]. The Journal of Physical Chemistry C, 2013, 117(51): 27120-27126. DOI:10.1021/jp407662d |
| [19] |
YU Y, WANG J, LI W, et al. Doping mechanism of Zn2+ ions in Zn-doped TiO2 prepared by a sol-gel method[J]. CrystEngComm, 2015, 17(27): 5074-5080. DOI:10.1039/C5CE00933B |
| [20] |
YANG Y, YU Y, WANG J, et al. Doping and transformation mechanisms of Fe3+ ions in Fe-doped TiO2[J]. CrystEngComm, 2017, 19(7): 1100-1105. DOI:10.1039/C6CE02523D |
| [21] |
ZHAO D, YU Y, CAO C, et al. The existing states of doped B3+ ions on the B doped TiO2[J]. Applied Surface Science, 2015, 345: 67-71. DOI:10.1016/j.apsusc.2015.03.140 |
| [22] |
DING Y, ZHANG X, CHEN L, et al. Oxygen vacancies enabled enhancement of catalytic property of Al reduced anatase TiO2 in the decomposition of high concentration ozone[J]. Journal of Solid State Chemistry France, 2017, 250: 121-127. DOI:10.1016/j.jssc.2017.03.022 |
| [23] |
ABDULLAH S A, SAHDAN M Z, NAYAN N, et al. Neutron beam interaction with rutile TiO2 single crystal (111): Raman and XPS study on Ti3+-oxygen vacancy formation[J]. Materials Letters, 2020, 263: 127143. DOI:10.1016/j.matlet.2019.127143 |
| [24] |
ZHU J, MU W, SU L, et al. Al-doped TiO2 mesoporous material supported Pd with enhanced catalytic activity for complete oxidation of ethanol[J]. Journal of Solid State Chemistry, 2017, 248: 142-149. DOI:10.1016/j.jssc.2017.01.028 |
| [25] |
MEHTA M, KODAN N, KUMAR S, et al. Hydrogen treated anatase TiO2: A new experimental approach and further insights from theory[J]. Journal of Materials Chemistry A, 2016, 4(7): 2670-2681. DOI:10.1039/C5TA07133J |
 2024, Vol. 41
2024, Vol. 41





