2. 天津大学化工学院, 天津 300350;
3. 天津大学环境学院, 天津 300350
2. School of Chemical Engineering and Technology, Tianjin University, Tianjin 300350, China;
3. School of Environmental Science and Engineering, Tianjin University, Tianjin 300350, China
水是地球上生命存在的主要资源,随着工业化和城市化进程的加快,地下水质量受到了严重威胁。长期饮用含砷水可导致各种慢性疾病,例如乳头状和皮质坏死、皮肤损伤、肝硬化、黑变病和黑足病[1, 2]。慢性砷暴露会加剧人类致癌风险,例如肺癌、肝癌、肾癌和皮肤癌[1, 3, 4]。因此世界卫生组织将饮用水中的最大允许砷浓度降低到0.01 mg ·L-1[5]。在水中,95%的As以无机形式存在[6, 7],无机形式的As以多种氧化形式存在,例如-3、0、+3和+5(并非所有都存在于自然条件下)。在自然系统中,它们主要以As(Ⅲ)和As(Ⅴ)的形式存在。因此,物种形成取决于溶液pH值和氧化还原电位值[8]。前者对人体健康危害更大,在pH <9时主要以非离子形式H3AsO3存在,难以通过简单的混凝/沉淀去除或吸附[9]。因此,重要的是在后续处理步骤之前将As(Ⅲ)预氧化为As(Ⅴ),以去除水中的总砷。在已报道的将As(Ⅲ)转化为As(Ⅴ)的各种处理方法中,研究者们认为光催化氧化As(Ⅲ)是一种有前景的方法[10-13]。
卤氧化铋BiOX(X=Cl, Br, I)由于其独特的层状结构、高活性和高光腐蚀稳定性,且在紫外或可见光照射下具有优异的光催化活性,被认为是有前途的光催化剂[14]。例如,Hu等[11]报道了使用不同的溶剂通过水热/溶剂热法成功合成了具有从2D层状结构到3D分层结构的可调形态的BiOI光催化剂,发现以甘油为溶剂合成的BiOI具有更好的光催化活性。Ma等[13]报道了ZrO2改性BiOCl0.5I0.5表现出优异的光催化氧化-吸附去除水中As(Ⅲ)的能力。半导体的光催化活性是基于吸附在半导体表面的污染物的氧化还原反应。因此,表面性质、晶体尺寸和晶体结合在一起的方式决定了光活性能的灵敏度。
众所周知,在材料的合成过程中不同的反应时间会影响晶体的生长[15]。对于BiOX这种由[Bi2O2]2+层和卤素离子堆叠而成的典型层状结构,合成过程中随着水热时间的延长,BiOX晶体生长从逐渐完整到结构破坏,为得到结晶度更好且光催化性能最优的BiOX材料,我们控制水热时间(4、8、12 h)以得到具有最高活性的BiOCl,并将其用于水中除As(Ⅲ)。在水热8 h制备的BiOCl-8在较宽的pH值范围内对As(Ⅲ)都有较好的光催化和吸附去除能力。
1 实验部分 1.1 BiOCl纳米花的合成本工作中使用的所有化学品均为分析级试剂,没有进一步纯化。在合成过程中,将0.485 1 g Bi(NO3)3 ·5H2O溶于20 mL去离子水中超声分散15 min,另取0.075 3 g KCl和0.2 g聚乙烯吡咯烷酮(PVP)溶于20 mL去离子水中。在剧烈的搅拌下将2溶液混合均匀,并用1 mol ·L-1 NaOH将混合溶液pH值调节到6,在室温下剧烈搅拌30 min后转移至50 mL的聚四氟乙烯高压反应釜中,在真空干燥烘箱中100 ℃条件下分别保持4、8、12 h。自然冷却至室温后,离心收集所得沉淀物,分别用去离子水和无水乙醇洗涤3次。最后将所得样品置于60 ℃烘箱中干燥8 h。样品分别命名名为BiOCl-4,BiOCl-8,BiOCl-12。
1.2 物理化学表征采用铜靶(Cu_Ka)辐射的X’Pert Pro型X射线衍射仪(XRD)对所制备的各个BiOCl材料进行分析,扫描范围为10°~80°。使用JEM-2100F透射电子显微镜(TEM)和高分辨率透射电子显微镜(HRTEM)分析表征样品的形态和晶体结构,加速电压为200 kV,点分辨率小于0.19 nm,线分辨率小于0.4 nm,倾斜角为25°。X射线光电子能谱(XPS)用于研究组成元素的化学成分和价态。使用美国尼高力公司AVATAR 330型号光谱仪对样品进行傅里叶变换红外光谱(FTIR)对样品中所含官能团进行分析。使用荧光分光光度计(Fluorolog-3,HORIBA Scientific,America)分析样品的稳态荧光(激发波长为320 nm)。电感耦合等离子体发射光谱仪(ICP-OES)用于测量反应溶液中总砷的量。
1.3 电化学表征如下制备工作电极。首先,将FTO导电玻璃在乙醇中超声处理10 min;其次,将5 mg样品分散在450 μL乙醇和50 μL Nafion的混合溶液中,超声处理30 min,直至得到均匀浆液。然后将50 μL浆液分散到FTO导电玻璃的表面上以形成1 cm2的薄膜。
光电流研究在上海华辰工作站上进行。所有电化学测量均使用自制的三电极系统进行,Ag/AgCl和Pt片分别用作参比电极和对电极。电解质为0.1 mol ·L-1 Na2SO4。通过使用模拟太阳光AM 1.5截止滤光片300 W Xe灯照射其样品面来记录光电流研究。
1.4 光催化性能评价在室温条件下,使用装有AM 1.5模拟太阳光滤光片的300 W Xe灯作为光源,评估样品对As(Ⅲ) 光催化活性。在一个典型的实验中,将50 mg的光催化剂粉末加入到含有5 mg ·L-1 As(Ⅲ)的100 mL水溶液中,并在黑暗条件下剧烈搅拌60 min以确保样品对As(Ⅲ)吸附/解吸平衡。之后,在光照射条件下连续搅拌混合物,并以给定的时间间隔收集样品。总As的浓度使用ICP-OES测量,As(Ⅴ)的浓度使用钼酸铵显色法测定,As(Ⅲ)的浓度由总As减去As(Ⅴ)所得。
2 结果和讨论 2.1 物相和形貌分析实验制备的光催化剂样品使用XRD确定其物相结构和晶体结构,如图 1(a)所示,BiOCl-4、BiOCl-8和BiOCl-12 3个样品的衍射峰与四方BiOCl的标准衍射峰(PDF #06-0249)卡片完全对应,且没有其他的杂质峰,表明通过一步水热法成功制备了BiOCl-4、BiOCl-8和BiOCl-12材料。图 1(a)中BiOCl-8分别在25.86°和32.50°出现了2个最强的衍射峰,分别对应于四方BiOCl的(101)和(110)晶面。与BiOCl-8相比,BiOCl-4和BiOCl-12对应的衍射峰强度较低说明其结晶度较低,这可能是因为过长的水热时间使晶体结构出现坍塌,从而表现为结晶度降低。BiOCl-8样品的形态和表面微结构通过TEM表征分析。如图 1(b)所示,BiOCl-8样品表现为,由BiOCl纳米片组成的纳米花状结构。经测量纳米花尺寸在450~600 nm之间,而组成纳米花的纳米片厚度约为30 nm,宽度约为200 nm,这些纳米片自组装交织在一起形成具有大比表面积、多孔的纳米花结构。不仅提高其比表面积暴露了更多的活性位点,同时更有利于光的折射、反射和吸收,从而提高其光吸收能力。为了研究BiOCl-8样品的内部形貌,将BiOCl经行高分辨率TEM(HRTEM)表征。如图 1(c)所示,0.276 nm的晶格条纹间距属于四方BiOCl的(110)晶面,插图中选区电子衍射(SAED),显示出斑点图案则表明所获得的BiOCl-8纳米花的单晶特性[16]。同时在SAED图案中标记的相邻点的角度为45°,这与四方BiOCl的(110)和(200)平面之间的角度的理论值相同,进一步证实了四方BiOCl-8材料的合成。此外,为了再进一步确认BiOCl的形成,利用高角度环形暗场-扫描透射电子显微镜(HAADF-STEM)对BiOCl-8样品经行表征分析,并得到了对应的EDS元素图,结果如图 1(d),显示Bi、O和Cl元素均匀分布。

|
| 图 1 (a) BiOCl-4、BiOCl-8和BiOCl-12的XRD图谱;(b) BiOCl-8的TEM图像;(c) BiOCl-8的HRTEM图像;(d) BiOCl的HAADF-STEM元素图 Fig.1 (a) XRD patterns of BiOCl-4, BiOCl-8 and BiOCl-12; (b) TEM image; (c) HRTEM image; (d) HAADF-STEM element mapping of BiOCl-8 |
| |
半导体光催化剂的能带结构可以通过测量其对光吸收能力计算得到。如图 2(a)所示,BiOCl-4、BiOCl-8和BiOCl-12仅可以吸收 < 370 nm的紫外光,但随着水热时间的延长,BiOCl-4、BiOCl-8和BiOCl-12对紫外光的吸收峰值依次增强,说明延长水热时间可以提高BiOCl对紫外光的吸收,但当水热时间高于8 h后,我们发现其对光吸收量几乎不增加,因此可以确定最佳的水热时间在8 h左右。禁带宽度是指1个带隙宽度,固体中电子的能量是不可以连续取值的,而是一些不连续的能带,要导电就需要有自由电子或者空穴存在,自由电子存在的能带称为导带,自由空穴存在的能带称为价带。被束缚的电子要成为自由电子或者空穴,就必须获得足够能量从价带跃迁到导带,这个能量的最小值就是禁带宽度。禁带宽度是半导体的一个重要特征参量,其大小主要决定于半导体的能带结构。禁带宽度可采用KubelkaMunk方法计算获得。经计算得到BiOCl-4、BiOCl-8和BiOCl-12的禁带宽度分别为3.41、3.39和3.42 eV[与图 2(a)内置图的(ahv1/2-光子能量曲线切线在横轴上截距值相同)]。计算结果表明,随着水热时间的延长BiOCl的带隙仅有略微的变化,即对光波的吸收范围略有影响。

|
| 图 2 BiOCl-4、BiOCl-8和BiOCl-12的(a)紫外-可见漫反射光谱,插图为(ahv)1/2vs. hv曲线;(b) 稳态荧光光谱;(c) 电化学阻抗图谱;(d) 瞬态光电流响应图 Fig.2 (a) UV-visible diffuse reflectance spectra, illustrated with (ahv)1/2 vs. hv curves; (b) steady-state fluorescence spectrum; (c) electrochemical impedance spectroscopy; (d) transient photocurrent response diagram of BiOCl-4, BiOCl-8 and BiOCl-12 |
| |
光生载流子分离的行为可以通过光电化学测试揭示,如图 2(c)和图 2(d)。相对于BiOCl-4和BiOCl-12,BiOCl-8拥有较小的奈奎斯特图弧半径,表明BiOCl-8界面电荷转移势垒最小,从而促进载流子在界面间快速转移,促进光生电子-空穴对的分离。此外,图 2(d)中BiOCl-8表现出了显著增强光电流密度响应,说明在光照的条件下BiOCl-8相比于BiOCl-4和BiOCl-12能够产生更多的光生载流子,表明了BiOCl-8可以有效促进光生载流子的分离,从而强化光催化氧化还原反应。根据荧光光谱,在相同的激发波长(320 nm)下半导体催化剂被光激发,在半导体催化剂体相中产生光生电子和空穴,向催化剂表面迁移,在迁移的过程中会进行光生电子和空穴的复合,复合的过程会产生荧光效应,而荧光光谱的峰强就表明载流子复合的量的大小,峰值越强就说明催化剂产生的光生载流子复合越多,反之则越少。从图 2(b)中可以看出BiOCl-4的荧光强度最高,其次为BiOCl-8,BiOCl-12的荧光强度最低,这表明BiOCl-4中光生电子和空穴最容易复合,载流子寿命最短,与之相比,BiOCl-8能够有效抑制载流子复合。而从光电流结果可以看出,BiOCl-12生成的光生载流子强度最低,所以复合的产生的荧光强度也最低。同时如图 2(b)所示,BiOCl-4、BiOCl-8和BiOCl-12均在400 nm左右有强度不同的荧光发射峰,而发射光波长与半导体的能带结构有关,这进一步验证了水热时间对BiOCl的能带结构稍有影响。
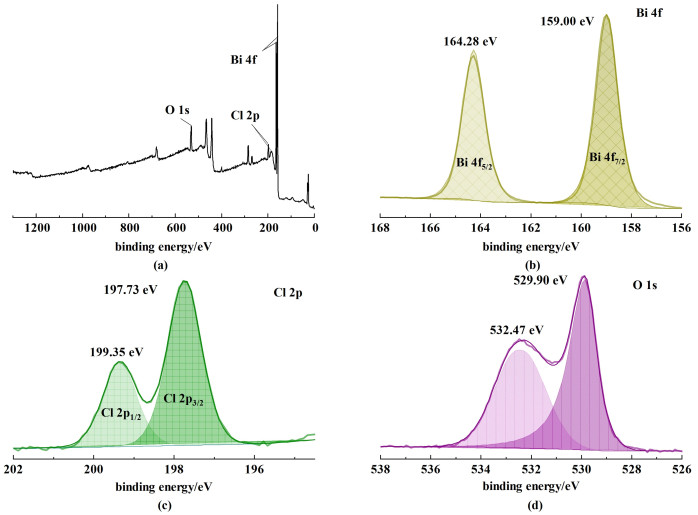
2.3 元素化合态分析为研究样品BiOCl-8表面元素组成,对BiOCl-8样品进行了XPS全谱扫描测试。如图 4(a)所示,图谱中可观察到Bi、O、Cl元素特征峰,表明样品BiOCl-8确实是由Bi、O和Cl组成。利用红外光谱对样品BiOCl-4、BiOCl-8和BiOCl-12表面基团进行了表征,如图 3所示:位于3 545.2 cm-1处的吸收峰对应于BiOCl材料表面结合的H2O或者—OH的O—H伸缩振动,1 666.4、1 426.9和547.7 cm-1处的吸收峰分别对应于BiOCl材料结构中的Cl—Cl伸缩振动、Bi—Cl伸缩振动和Bi—O伸缩振动。从BiOCl-4、BiOCl-8和BiOCl-12的红外光谱图可以看出,在1 666.4 cm-1处的BiOCl-8的Cl—Cl吸收峰明显高于BiOCl-4和BiOCl-12,可能是有较高结晶度的BiOCl-8有更为完整的Cl-Bi-O—O-Bi-Cl结构。而1 284.5以及844.8 cm-1对应的是C—N的弯曲振动,表征BiOCl材料红外光谱图中之所以出现C—N的弯曲振动峰,可能是由于在材料制备过程中,由于表面活性剂聚乙烯吡咯烷酮的高黏性导致在洗涤材料时未能完全洗去。

|
| 图 3 BiOCl-4、BiOCl-8和BiOCl-12的红外光谱图 Fig.3 FTIR patterns of BiOCl-4, BiOCl-8 and BiOCl-12 |
| |
|
| 图 4 BiOCl-8的XPS图谱:(a) XPS元素全谱扫描;(b) Bi 4f;(c) Cl 2p;(d) O 1s Fig.4 The XPS map of BiOCl-8:(a) full spectrum scan of XPS elements; (b) Bi 4f; (c) Cl 2p; (d) O 1s |
| |
图 4(b)为Bi 4f的XPS谱图,对BiOCl-8而言,在164.28和159.00 eV处的峰分别对应于Bi 4f5/2和Bi 4f7/2,代表BiOCl中的Bi3+[17]。在图 4(c)中,199.35和197.73 eV对应的是BiOCl-8中的Cl 2p1/2和Cl 2p3/2,图 4(d)中532.47 eV对应的是BiOCl-8材料表面—OH中的的O,以及529.90 eV对应的是BiOCl-8样品中的晶格O[18, 19]。从XPS谱图中可以准确的确定各元素的化合状态。
2.4 不同pH值条件下BiOCl去除As(Ⅲ)性能测试不同水热时间所得BiOCl材料光催化氧化As(Ⅲ) 的能力有不同。如图 5(a)所示,在初始As(Ⅲ)浓度为5 mg ·L-1,初始pH=8,催化剂投加剂量为0.5 g ·L-1的条件下进行光催化实验。实验结果显示BiOCl-8在黑暗条件下表现出对As(Ⅲ)优异的吸附性,以及之后光催化反应对As(Ⅲ)稳定的去除性能。因此,在之后的实验中选择BiOCl-8作为主要研究对象,研究其在不同pH值条件下对As(Ⅲ)光催化氧化去除的影响。

|
| 图 5 (a) BiOCl-4、BiOCl-8和BiOCl-12光催化氧化As(Ⅲ),pH=8;(b) As(Ⅲ)的去除率;(c) As(Ⅴ)的生成率;(d) 总As的去除率[As(Ⅲ)=5 mg ·L-1,催化剂剂量0.5 g ·L-1] Fig.5 (a) Photocatalytic oxidation of As(Ⅲ) of BiOCl-4, BiOCl-8 and BiOCl-12, pH=8; (b) removal rate of As(Ⅲ); (c) formation rate of As(Ⅴ); (d) removal rate of total As [As(Ⅲ)=5 mg ·L-1, catalyst dose 0.5 g ·L-1] |
| |
为探究不同pH值条件下BiOCl-8对As(Ⅲ)光催化氧化去除的影响,做了不同pH值条件下BiOCl-8对As(Ⅲ)光催化氧化实验,结果如图 5(b)所示,可以发现当pH>3时,随着反应条件pH值的升高,BiOCl-8对As(Ⅲ)的去除率升高,当pH=10时光催化氧化去除As(Ⅲ)的效率达到最高,其原因主要归因于BiOCl-8对As(Ⅲ)的吸附作用,在1 h的黑暗条件下0.5 g ·L-1的催化剂材料就已经通过吸附作用去除了约90%的5 mg ·L-1的As(Ⅲ),而在给予反应体系光照后极短的时间内,BiOCl-8首先对吸附在材料上的As(Ⅲ)进行光催化氧化,将As(Ⅲ)氧化为As(Ⅴ)的同时相当于提高了BiOCl-8对溶液中砷的吸附量,从图 5(d)可得知相比于As(Ⅲ),BiOCl-8对As(Ⅴ)的吸附能力更大,因此在基于反应系统光照之后,BiOCl-8材料表面的As(Ⅲ)被氧化为As(Ⅴ),从而被进一步吸附。表 1为As(Ⅲ)在酸性和碱性下的氧化还原电位,发现,As(Ⅲ)在碱性条件下更利于被氧化。
| 电极反应式 | E/V | |
| H+ | H3AsO4+2H++2e-=HAsO2+2H2O | 0.560 |
| OH- | AsO43-+2H2O+2e-=AsO2-+4OH- | -0.670 |
图 5(c)表示为溶液中As(Ⅴ)含量随时间的变化曲线,发现在黑暗条件下的1 h反应过程中在各个pH值条件下,溶液中并没有As(Ⅴ)的生成,说明在没有光照的条件下BiOCl-8并不能将As(Ⅲ)氧化为As(Ⅴ),而在1 h的暗反应结束后给予反应体系光照,发现在pH值小于等于9以下的反应体系中有As(Ⅴ)的生成,说明在光照条件下BiOCl-8可将溶液中的As(Ⅲ)氧化为As(Ⅴ),随着初始反应pH值的不同,越低pH值条件下,随着光照时间的延长,溶液体系中As(Ⅴ)的量越高,原因在于BiOCl-8随着pH值的降低对As吸附的能力也随之降低。图 5(d)为溶液中总As的去除率,这里的去除率主要为BiOCl-8对As(Ⅲ)以及As(Ⅴ)的吸附所致。
如图 6(a)1 666.4、1 426.9和547.7 cm-1处的吸收峰分别对应于BiOCl材料结构中的Cl—Cl伸缩振动、Bi—Cl伸缩振动和Bi—O伸缩振动。对比反应前后的BiOCl-8样品的红外光谱图,发现位于547.7 cm-1处的Bi—O峰没有明显的位移以及峰强没有明显的改变,说明BiOCl-8晶体结构很稳定。667.4 cm-1为Bi—O的不对称伸缩振动峰,1 427.3和1 666.4 cm-1分别为BiOCl-8样品中Bi—Cl的不对称伸缩振动峰和Cl—Cl伸缩振动峰,从图 6(a)中可明显观察到,在不同pH值条件下反应后的BiOC-8对应的这2个峰强度降低,说明Bi—Cl和Cl—Cl基团含量减少,其可能原因是BiOCl-8层间的Cl-与溶液中砷酸根和亚砷酸根阴离子进行了不同程度的置换。1 284.6 cm-1为C—N的伸缩振动峰,1 375.2 cm-1为C—H,1 392.6 cm-1为NO3-的伸缩振动峰,这些含碳、氮官能团的出现可能是由于材料表面的PVP在碱性,且光照的条件下被分解所致。771.5 cm-1为As—O伸缩振动峰,随着反应条件pH值的增大,BiOCl-8材料中存在的As—O基团越来越多,说明随着pH值的增大BiOCl-8对As的吸附效果增强,吸附了更多的砷的含氧阴离子[20]。图 6(b)为BiOCl-8反应前后的XRD谱图,可明显看出,反应前后BiOCl-8材料的结晶度没有明显改变,说明其结晶度依然良好,样品结构完整,同时发现BiOCl-8的(001)晶面所对应的衍射峰向低角度偏移如图 6(c),可能是As被BiOCl吸附到了层间,因此扩大了其层间距。

|
| 图 6 (a) BiOCl-8以及在不同pH值(2,7,10)条件下反应后的材料的红外光谱图;(b) BiOCl-8反应前后的XRD谱图;(c) XRD部分放大图;(d) 莫特-肖特基曲线;(e) 导、价带位置图 Fig.6 (a) FTIR patterns of BiOCl-8 and the materials after reaction at different pH (2, 7, 10); (b) XRD patterns before and after BiOCl-8 reaction; (c) enlarged XRD patterns; (d) Mott-Schottky curves; (e) positions of conduction and valence bands of BiOCl-4, BiOCl-8 and BiOCl-12 |
| |
为了了解BiOCl-4、BiOCl-8和BiOCl-12样品的平带电位,利用电化学工作战对材料进行了莫特-肖特基(MS)曲线测试。如图 6(d)所示,MS图的正斜率说明所制备的BiOCl材料全部属于n型半导体。通过读取曲线与x=0直线的交点可以得到BiOCl-4、BiOCl-8和BiOCl-12样品的平带电位。一般认为,平带电位约等于费米能级,且对于n型半导体,导带位置比费米能级约负0.2 eV,因此,结合图 2(a)的带隙值,得到了BiOCl-4、BiOCl-8和BiOCl-12样品的导带和价带位置如图 6(e)。由图 6(d)可知,随着水热时间延长到8 h,其导带和价带位置向正移,价带正移意味光催化氧化能力增强。而当水热时间达到12 h后其价带位置几乎无变化。
3 结论以调控水热反应时间为主要手段合成具有不同晶体结构的BiOCl光催化剂,以其对As(Ⅲ)的光催化转化反应研究半导体晶体结构和催化性能之间的构效关系。在碱性反应条件下,BiOCl-8光催化剂对As(Ⅲ)的暗吸附和光催化表现出较高的去除性能。在初始As(Ⅲ)为5 mg ·L-1、初始pH值为10、反应时间为30 min、催化剂用量为0.5 g ·L-1时可达到100%的去除率。性能提高的主要原因有:首先,通过控制合成反应时间得到了结晶度较好的BiOCl-8纳米花光催化剂,更利于光吸收和共生载流子的有效分离;其次,BiOCl-8在碱性条件下实现了对As(Ⅲ)的增强吸附,从而使光催化过程更加高效。
| [1] |
MOHAMMED ABDUL K S, JAYASINGHE S S, CHANDANA E P S, et al. Arsenic and human health effects: A review[J]. Environmental Toxicology and Pharmacology, 2015, 40(3): 828-846. DOI:10.1016/j.etap.2015.09.016 |
| [2] |
JOSEPH L, JUN B, FLORA J R V, et al. Removal of heavy metals from water sources in the developing world using low-cost materials: A review[J]. Chemosphere, 2019, 229: 142-159. DOI:10.1016/j.chemosphere.2019.04.198 |
| [3] |
ANTONIADIS V, SHAHEEN S M, LEVIZOU E, et al. A critical prospective analysis of the potential toxicity of trace element regulation limits in soils worldwide: Are they protective concerning health risk assessment?A review[J]. Environment International, 2019, 127: 819-847. DOI:10.1016/j.envint.2019.03.039 |
| [4] |
SHAKOOR M B, NIAZI N K, BIBI I, et al. Unraveling health risk and speciation of arsenic from groundwater in rural areas of Punjab, Pakistan[J]. International Journal of Environmental Research and Public Health, 2015, 12(10): 12371-12390. DOI:10.3390/ijerph121012371 |
| [5] |
MOHAN D, PITTMAN C U. Arsenic removal from water/wastewater using adsorbents—A critical review[J]. Journal of Hazardous Materials, 2007, 142(1/2): 1-53. |
| [6] |
MAITY S, NASKAR N, LAHIRI S, et al. Polysaccharide-derived hydrogel water filter for the rapid and selective removal of arsenic[J]. Environmental Science: Water Research & Technology, 2019, 5(7): 1318-1327. |
| [7] |
SHINDE R N, PANDEY A K, ACHARYA R, et al. Chitosan-transition metal ions complexes for selective arsenic(V) preconcentration[J]. Water Research, 2013, 47(10): 3497-3506. DOI:10.1016/j.watres.2013.03.059 |
| [8] |
KUMAR R, PATEL M, SINGH P, et al. Emerging technologies for arsenic removal from drinking water in rural and peri-urban areas: Methods, experience from, and options for Latin America[J]. Science of the Total Environment, 2019, 694: 133427. DOI:10.1016/j.scitotenv.2019.07.233 |
| [9] |
GUAN X, DU J, MENG X, et al. Application of titanium dioxide in arsenic removal from water: A review[J]. Journal of Hazardous Materials, 2012, 215/216: 1-16. DOI:10.1016/j.jhazmat.2012.02.069 |
| [10] |
BORDOLOI S, NATH S K, GOGOI S, et al. Arsenic and iron removal from groundwater by oxidation-coagulation at optimized pH: Laboratory and field studies[J]. Journal of Hazardous Materials, 2013, 260: 618-626. DOI:10.1016/j.jhazmat.2013.06.017 |
| [11] |
HU J, WENG S, ZHENG Z, et al. Solvents mediated-synthesis of BiOI photocatalysts with tunable morphologies and their visible-light driven photocatalytic performances in removing of arsenic from water[J]. Journal of Hazardous Materials, 2014, 264: 293-302. DOI:10.1016/j.jhazmat.2013.11.027 |
| [12] |
RAHIMI B, EBRAHIMI A. Photocatalytic process for total arsenic removal using an innovative BiVO4/TiO2/LED system from aqueous solution: Optimization by response surface methodology (RSM)[J]. Journal of the Taiwan Institute of Chemical Engineers, 2019, 101: 64-79. DOI:10.1016/j.jtice.2019.04.036 |
| [13] |
MA Z, ZHANG M, GUO J, et al. Facile synthesis of ZrO2 coated BiOCl0.5I0.5 for photocatalytic oxidation-adsorption of As(Ⅲ) under visible light irradiation[J]. Chemosphere, 2018, 211: 934-942. DOI:10.1016/j.chemosphere.2018.08.003 |
| [14] |
CHANG X, HUANG J, CHENG C, et al. BiOX (X=Cl, Br, I) photocatalysts prepared using NaBiO3 as the Bi source: Characterization and catalytic performance[J]. Catalysis Communications, 2010, 11(5): 460-464. DOI:10.1016/j.catcom.2009.11.023 |
| [15] |
MENG X, ZHANG Z. Synthesis, analysis, and testing of BiOBr-Bi2WO6 photocatalytic heterojunction semiconductors[J]. International Journal of Photoenergy, 2015, 2015: 1-12. |
| [16] |
BISWAS A, DAS R, DEY C, et al. Ligand-free one-step synthesis of{001}faceted semiconducting BiOCl single crystals and their photocatalytic activity[J]. Crystal Growth & Design, 2014, 14(1): 236-239. |
| [17] |
JIANG J, ZHANG L, LI H, et al. Self-doping and surface plasmon modification induced visible light photocatalysis of BiOCl[J]. Nanoscale, 2013, 5(21): 10573-10581. DOI:10.1039/c3nr03597b |
| [18] |
DONG F, SUN Y, FU M, et al. Room temperature synthesis and highly enhanced visible light photocatalytic activity of porous BiOI/BiOCl composites nanoplates microflowers[J]. Journal of Hazardous Materials, 2012, 219/220: 26-34. DOI:10.1016/j.jhazmat.2012.03.015 |
| [19] |
AI Z, HO W, LEE S, et al. Efficient photocatalytic removal of NO in indoor air with hierarchical bismuth oxybromide nanoplate microspheres under visible light[J]. Environmental Science & Technology, 2009, 43(11): 4143-4150. |
| [20] |
JIA L, ZHOU W, HUANG X, et al. Enhanced adsorption of Cr(Ⅵ) on BiOBr under alkaline conditions: Interlayer anion exchange[J]. Environmental Science: Nano, 2019, 6(12): 3601-3610. DOI:10.1039/C9EN00717B |
 2024, Vol. 41
2024, Vol. 41