据统计,全世界有1 800多种杂草, 每年给农业生产造成的损失不可估量[1, 2]。近年来有关异噁唑类除草剂的应用和合成报道较多[3]。最早的产品是由日本组合化学研发的2款苗前土壤处理除草剂砜吡草唑(Pyroxasulfone)和苯磺噁唑草(Fenoxasulfone),巴斯夫公司开发的高选择性除草剂苯唑草酮(Topramezone),韩国化学研究所研发的水稻田异噁唑啉除草剂(Methiozolin),拜耳公司研发的麦类和玉米除草安全剂双苯噁唑酸乙酯(Isoxadifen-ethyl)等。这类除草剂相较于传统除草剂如草甘膦[4-6]、乙草胺[7, 8]、磺酰脲类[9]、三嗪类[10, 11]等,具有更好的生态安全性以及选择性,但因存在合成路线长、收率低、成本高等问题,目前尚未实现大规模应用。
本论文介绍了上述5类新兴异噁唑类除草剂的合成研究进展和作用机理,对其合成与发展作了进一步的展望。
1 砜吡草唑除草剂砜吡草唑,英文名称为Pyroxasulfone,是由日本组合化学公司和庵原化学工业株式会社共同开发的一种新型苗前除草剂。通过抑制超长链脂肪酸延长合成酶(VLCFAs),降低稗草细胞中超长链脂肪酸的含量,增加长链和中长链脂肪酸的含量,阻碍植物质膜鞘脂和角质层蜡层的形成而致效[12, 13]。
砜吡草唑的用药量只有传统除草剂乙草胺的1/10左右[14],同时提升了在土壤中的持效期[15]。且该产品防治谱广,可以安全地用于小麦、玉米、水稻和向日葵等作物[16, 17];也可有效防除狗尾草属、稗属等禾本科杂草以及苋属、曼陀罗属等阔叶杂草。预计未来有望取代氯乙酰胺类除草剂,成为土壤处理剂的新标杆。
如图 1,砜吡草唑的合成通常由3-(5-二氟甲氧基-1-甲基-3-三氟甲基吡唑-4-基)甲硫基-4,5-二氢-5,5-二甲基异噁唑(M1)经一步氧化得到。关键中间体 M1分子由异噁唑环和吡唑环2部分组成,目前报道主要有4条合成路线。
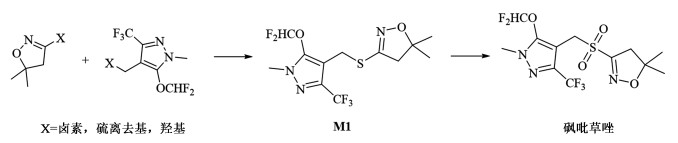
|
| 图 1 砜吡草唑的主要合成路线 Fig.1 Main Synthesis routes of pyroxasulfone |
| |
3-氯-5,5-二甲基-4,5-二氢异噁唑(1)与硫氢化钠或硫脲进行取代反应或者5,5-二甲基异噁唑烷-3-酮(2)与P2S5反应得到巯基异噁唑(3)。3再与吡唑中间体 4在碱性和多聚甲醛条件下脱水取代得到3-(5-羟基-1-甲基-3-三氟甲基吡唑-4-基)甲硫基-4,5-二氢-5,5-二甲基异噁唑(5), 与二氟一氯甲烷发生取代脱去HCl得到 M1 (图 2)。

|
| 图 2 通过巯基异噁唑中间体3合成M1的路线 Fig.2 Synthesis route of M1 through mercaptoisoxazole intermediate 3 |
| |
文献[18]报道以 2为原料合成3的路线,收率57%,需要使用五硫化二磷作为硫化试剂,会产生大量的含磷硫渣和含硫废气,三废多,不适于大规模生产。以氯代二氢异噁唑(1)为原料的路线,反应时间短,条件温和,合成 3的收率94%。3与4的反应收率为93%,2步总收率达到87%[19],易于工业化生产。
1.2 经甲磺酰基异噁唑中间体7的路线氯代二氢异噁唑(1)和甲硫醇钠经甲硫基取代得到甲硫基代异噁唑中间体 6,后经间氯过氧苯甲酸(mCPBA)氧化得到甲磺酰基异噁唑中间体 7,与溴取代的吡唑中间体 8反应得到 M1,据报道3步总收率38%(图 3)[20]。

|
| 图 3 通过甲磺酰基异噁唑中间体7合成M1的路线 Fig.3 Synthesis route of M1 through methanesulfonyl isoxazole intermediate 7 |
| |
该合成路线的甲磺酰基的氧化步骤收率仅有59%。而且mCPBA价格偏高,同时引入甲硫基所用的甲硫醇钠在生产过程中容易产生废水、废盐和废气污染,导致该路线生产成本较高。
1.3 经异噁唑-3基硫脲盐酸盐9的路线氯代二氢异噁唑(1) 和硫脲在酸性条件下生成5,5-二甲基-4,5-二氢异噁唑-3基硫脲盐酸盐 9,其与羟甲基取代的吡唑中间体 10在碱性条件下脱掉一分子尿素后酸化得到 M1,2步总收率82%(图 4)[21]。

|
| 图 4 异噁唑-3基硫脲盐酸盐9的合成M1的路线 Fig.4 Synthesis route of M1 of isoxazole-3-ylthiourea hydrochloride 9 |
| |
该路线总收率较高,条件相对温和,制备硫代甲脒盐酸盐所用硫脲等价格低廉,是相对可行的工业生产路线。
1.4 经乙酰硫甲基吡唑中间体11的路线溴甲基取代的吡唑中间体 10在乙醇溶液中与硫代乙酸钾反应发生乙酰硫基取代得到中间体 11,收率65%。11与氯代二氢异噁唑(1) 在碱性条件下脱去乙酰基得到 M1,收率78%(图 5)[22]。

|
| 图 5 乙酰硫基甲基吡唑中间体10合成M1的路线 Fig.5 Synthesis route of M1 from acetylthiomethylpyrazole intermediate 10 |
| |
该路线引入了乙酰硫甲基作为中间过渡基团,但所用的硫代乙酸钾价格相对昂贵;2步反应的总收率50%,低于上述其他路线。
4条合成路线中,经甲磺酰基异噁唑中间体 7和经乙酰硫甲基吡唑中间体10的路线受收率和成本的限制较大;经巯基异噁唑中间体 2和经硫脲盐酸盐中间体9的路线收率较高,条件相对温和,更有工业化潜力。由 M1一步氧化可制备砜吡草唑,所用氧化剂主要有mCPBA和过氧化氢(图 6)[23, 24]。
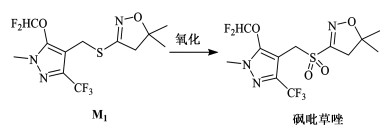
|
| 图 6 中间体M1氧化合成砜吡草唑 Fig.6 Oxidation synthesis of pyroxasulfone from intermediate M1 |
| |
苯磺噁唑草(Fenoxasulfone)是日本组合化学工业株式会社开发的对羟基苯基丙酮酸双氧化酶(HPPD)抑制剂类除草剂,是一种水稻芽前/芽后广谱除草剂,于2014上市。苯磺噁唑草的作用机制与包括砜吡草唑的VLCFAs抑制型除草剂相似,作用于超长链脂肪酸延长酶[25],对超长链脂肪酸生物的合成具有抑制作用[26]。
其创制是在基于砜吡草唑的基础上,保留了5,5-二甲基-4,5-二氢异恶唑和磺酰基的活性结构,引入了一个苯基增强其土壤吸附能力,而后进一步在苯基上进行取代基筛选。与其他取代基相比,苯基上邻位取代基衍生物表现出更强的除草活性。而含有2,5-二氯-4-乙氧基苯环的结构,在具有优良的除草活性的同时兼具优良的作物安全性,且具有更长的持效期和更低的土壤流失率[27, 28]。
苯磺噁唑草的整体分子结构可拆分为异噁唑环 A和取代苯环B 2部分。其中3-(2,5-二氯-1-乙氧基-4-基)甲硫基-4,5-二氢-5,5-二甲基异噁唑 M2是合成苯磺噁唑草的关键中间体,其在一步氧化后得到目标产物苯磺噁唑草[29],如图 7所示。有关苯磺噁唑草的合成报道目前较少,主要是采用不同的原料合成异噁唑中间体A, 异噁唑上的与硫连接的离去基团不同。
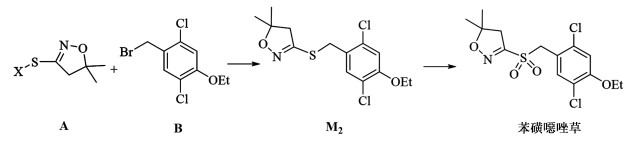
|
| 图 7 通过中间体M2合成苯磺噁唑草 Fig.7 Synthesis of fenoxasulfone through intermediate M2 |
| |
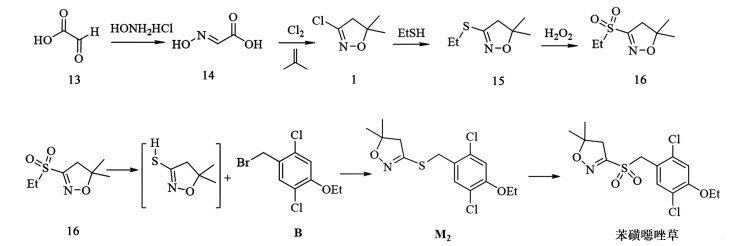
|
| 图 8 苯磺噁唑草的合成路线1 Fig.8 Synthesis route 1 of fenoxasulfone |
| |
以乙醛酸(13)为原料,与羟氨盐酸盐进行醛胺缩合得到羟基亚氨基乙酸(14),经氯化异丁醇环合得到3-氯-4,5二氢异噁唑(1),再经硫醇取代得到硫代异噁唑中间体 15,过氧化氢氧化成乙磺酰异噁唑中间体 16,其在碱性条件转换为硫醇与带有卤取代基的中间体 B进行亲核取代反应得到M2,再经过氧化氢氧化得到苯磺噁唑草,收率68%,反应条件温和。
2.2 硫代肟基为异噁唑上的硫基离去基团2022年Barda等[31]使用N, N-二甲基硫代甲酰胺与3-溴-4,5二氢异噁唑(17)的反应在异噁唑环上引入硫代亚胺基离去基团,得到中间体 18,其与 B反应得到化合物M2,收率79%(图 9)。
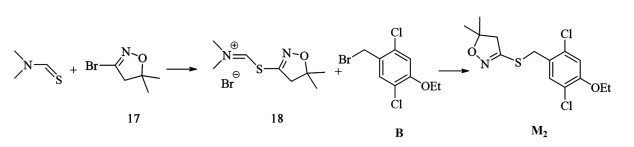
|
| 图 9 苯磺噁唑草的合成路线2 Fig.9 Synthesis route 2 of fenoxasulfone |
| |
该路线单步反应收率较以前的路线更高,但使用的N,N-二甲基硫代甲酰胺较为昂贵,且三氟乙酸工业危险性较高。
3 苯唑草酮除草剂苯唑草酮(Topramezone)又称苯吡唑草酮,是巴斯夫公司开发的一种新型高选择性苯甲酯吡唑酮类除草剂,具有高安全性、优良选择性、广谱杀草活性、时效长和兼容性强等特点,对耐草甘膦、三嗪类的杂草有很好的防除效果[32]。于2006年投入市场,中国推广的产品为33.6%苯唑草酮,商品名为苞卫[33]。
苯唑草酮除草剂的作用机理为,抑制对羟苯基丙酮酸双加氧酶(4-HPPD)的活性,在生物合成途径中阻断4-羟苯丙酮酸(HPP)转化为尿黑酸(HGA),最终阻滞杂草内的细胞膜合成和光合反应过程[34-36]。
苯唑草酮的分子结构可拆分为1-甲基-5羟基吡唑和5-苯基异噁唑中间体 M3。因采用异噁唑关键中间体 M3中X取代基不同,可分别通过CO插羰法和羧基酰氯化成酯后重排法与1-甲基-5羟基吡唑合成苯唑草酮(图 10)。
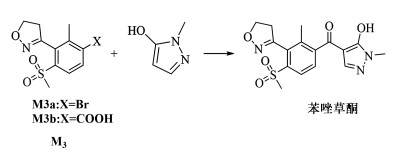
|
| 图 10 通过M3一步合成苯唑草酮 Fig.10 One-step synthesis of topramezone through M3 |
| |
巴斯夫报道,3-(4,5-二氢-3-异噁唑基)-2-甲基-4-(甲基磺酰基)溴苯(M3a)与1-甲基-5-羟基吡唑在三苯基膦、二氯化钯的催化下,与一氧化碳发生羰基化反应,得到苯唑草酮。其反应压力达到2.0 MPa,而温度也需要130 ℃,收率86%(图 11)[37]。
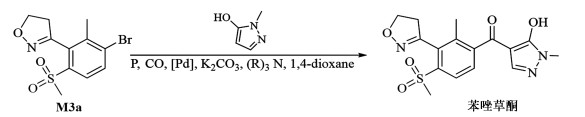
|
| 图 11 CO插羰合成法合成苯唑草酮的路线 Fig.11 Synthesis route of topramezone by CO carbon insertion synthesis |
| |
Deyn等[38]报道以3-(4,5-二氢-3-异噁唑基)-2-甲基-4-(甲基磺酰基)苯甲酸(M3b)进行二氯亚砜酰氯化,再通过羧基与1-甲基-5-羟基吡唑缩合得到苯唑草酮(图 12)。
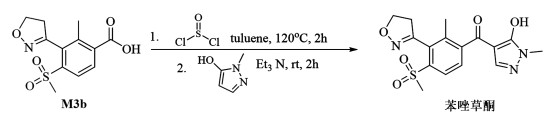
|
| 图 12 羧基酰氯化成酯后重排法合成苯唑草酮 Fig.12 Synthesis of topramezone by rearrangement method after carboxylacyl chlorination into ester |
| |
该方法收率92%左右,同时避免高温高压及贵金属催化下进行长时间非均相反应,成本低,但需要注意二氯亚砜使用中的安全隐患。
3.2 异恶唑中间体M3的合成通过2种合成路线苯唑草酮的关键异恶唑中间体 M3a和 M3b的结构相近,卤素或羧基取代基团的引入路线较多,但部分路线可行性不高,在此叙述几类具有可行性的合成路线和引入顺序。
3.2.1 中间体M3a的合成李林等[39]报道的2-甲基-6-硝基苯甲腈(19)为起始原料,通过甲硫化生成 20,苯环溴化生成 21,格氏试剂羧基化得到 22,氧化制备 23,再由腈基肟化得到24,氨基取代氯化与乙烯在三乙胺条件下环合最终得到 M3a,收率23%(图 13)。此路线的缺点是引入羧基制备中间体 22需要格氏反应,需要较苛刻的反应条件,也存在一定的危险性。此外有以氯基取代为氰基再得到羧基的路线,但使用了剧毒的氰化物[40]。

|
| 图 13 M3a的合成路线 Fig.13 Synthesis route of M3a |
| |
张大永等[41]以2,3二甲基硝基苯(26)为原料,通过亚硝酸酯肟化得到 27,NCS氯化,乙烯环合制备异噁唑环中间体 28,硝基还原为氨基得到 29,再在铜催化下进行甲硫基取代生成 30,苯环邻位溴化得到31、CO2羧基化制备 32,甲硫基过氧化氢氧化最终得到 M3b (图 14)。

|
| 图 14 M3b的合成路线 Fig.14 Synthesis route of M3b |
| |
该路线共7步,总收率37%。其中31到32使用正丁基锂作用后加入干冰引入羧基,提高了插入羰基的反应收率。但此步反应需要在低温条件下反应,且反应有一定危险性。
4 异噁唑啉除草剂异噁唑啉除草剂(Methiozolin)是韩国化学技术研究所开发的除草剂,对移栽水稻有良好的选择性,对水稻芽前至四叶期稗草的除草活性非常明显,可选择性控制草坪中一年生蓝草[42],对哺乳动物的毒性也较低[43]。
异噁唑啉除草剂的作用机理为,在酪氨酸氨基转移酶(TAT)的催化下,在异戊烯醌途径中阻断酪氨酸转化为4-HPP,由此阻断了类胡萝卜素的合成[44-46]。
异噁唑啉除草剂作为新型的除草剂暂未上市,目前的应用较少。Suganuma等[47]研究了一种除草组合物,选择异噁唑啉除草剂作为胡萝卜素生物合成抑制剂和脂生成抑制剂复配,具有更广泛的除草范围。
异噁唑啉除草剂的合成路线如图 15所示。

|
| 图 15 异噁唑啉除草剂的合成路线 Fig.15 Synthesis route of methiozolin |
| |
异噁唑啉除草剂的合成以3-甲基噻吩-2-甲醛(33)为原料与盐酸羟胺在发生醛胺缩合得到3-甲基-2-甲醛肟基噻吩(34),与N-氯代丁二酰亚胺发生氯化取代反应生成N-羟基-3-甲基-2-甲酰氯基噻吩(35),然后在碱性条件下与甲基烯丙醇发生环合反应得到36。最后与2,6-二氟氯苄(37)反应得到异噁唑啉除草剂[48]。
4步反应中前3步反应收率分别为99%、96%和90%,3步反应均可在室温条件下进行,反应时间控制在2 h内。最后一步反应为,在DMF中分别滴加 36、37和氢化钠,在65 ℃下反应1 h,收率60%,路线总收率51%。
2013年Yeong等[49]对上述异噁唑啉除草剂的最后一步合成进行了改进,在碱金属盐和相转移催化剂的条件下,以甲苯和水为混合反应体系,提升最后一步收率至92%,得到的异噁唑啉除草剂纯度达99.5%,总收率79%,但反应时间增加到20 h。
5 双苯噁唑酸乙酯除草剂双苯噁唑酸乙酯,英文名称为Isoxadifen-ethyl,是拜耳公司2002年开发的是第1个可应用于多种作物和多种除草剂的除草安全剂[50]。拜耳公司以吡唑解草酯为基础,将结构中的吡唑环以噁唑环替代优化,由此发现了双苯噁唑酸乙酯。
双苯噁唑酸乙酯的除草安全协同作用机理尚未明确,目前Sun等[51]研究了烟嘧磺隆和双苯噁唑酸乙酯使用中的4个玉米解毒基因的变化过程,推测这类基因可能是增强作物中除草剂代谢的关键基因。
双苯噁唑酸乙酯可在磺酰脲类除草剂烟嘧磺隆和甲酰胺磺隆中添加[52],在麦田和玉米田内降低除草剂对农作物的药害,可以增强除草剂的性能,增强施用后土壤的代谢水平[53]。其在与甲酰胺磺隆的结合实例中,显著地缓解了玉米田的穗畸形现象,减少了作物损伤,提高了玉米产量[54]。
双苯噁唑酸乙酯合成路线如图 16所示。

|
| 图 16 双苯噁唑酸乙酯的合成路线 Fig.16 Synthesis route of ethyl bisoxazolate |
| |
双苯噁唑酸乙酯的合成由1,1-二苯乙烯(41)与腈氧化物(40) 经一步不饱和键[3+2]加成反应得到,腈氧化物的来源目前主要有2条路线,分别是用硝基乙酸乙酯(39) 中的硝基在三乙胺条件下脱水生成腈氧化物。以及2-氯-2-(羟基亚氨基)乙酸乙酯(38) 在碱性条件下进行1,3偶极环加成反应得到双苯噁唑酸乙酯。
合成由1,1-二苯乙烯(41)与腈氧化物(40) 经一步不饱和键[3+2]加成反应得到[55],其中腈氧化物的来源目前主要有2条路线:(1)2-氯-2-(羟基亚氨基)乙酸乙酯(38) 在碱性条件下进行1,3偶极环加成反应得到双苯噁唑酸乙酯;(2)通过硝基乙酸乙酯(39) 中的硝基在三乙胺条件下脱水生成腈氧化物;再经双键加成得到双苯噁唑酸乙酯。
5.1 双苯噁唑酸乙酯的2条合成路线 5.1.1 经2-氯-2-(羟基亚氨基)乙酸乙酯(38)的路线由氯代肟基乙酸乙酯为中间体的合成路线,以甘氨酸为原料合成甘氨酸乙酯盐酸盐,再经肟化、氯化合成氯代肟基乙酸乙酯(38),在三乙胺、二乙基乙醇胺或异丙醇中与1,1-二苯基乙烯(41)环化得到,2步收率78%(图 17)。

|
| 图 17 通过氯代肟基乙酸乙酯合成双苯噁唑酸乙酯 Fig.17 Synthesis of ethyl bisoxazolate by chlorooxime ethyl acetate |
| |
该路线所用化工原料,试剂价廉易得,溶剂异丙醇价格便宜,需求温度最高为70 ℃,反应时间为6 h,后处理操作简单,相对易于工业化生产。王浩等[56]报道通过改进氯代肟基乙酸乙酯的合成方法,1,1-二苯基乙烯(41)与氯代肟基乙酸乙酯(38)在异丙醇中添加碳酸氢钠缓慢升温至60~70 ℃,冷却酸化析出产品的方法,最后一步收率提高至96%,整体路线收率较高,原料成本较低。
5.1.2 经硝基乙酸乙酯39的路线2008年Cremones使用1,1-二苯基乙烯(41)与硝基乙酸乙酯(39)的加成反应。该反应使用三乙烯二胺(Dabco)[57]为催化剂,在80 ℃下进行,反应时间为5 d,收率为75%。该路线反应时间较长,限制了工业化生产(图 18)。
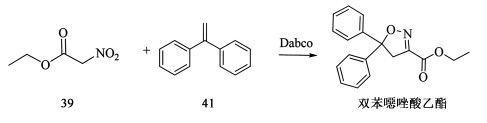
|
| 图 18 通过硝基乙酸乙酯合成双苯噁唑酸乙酯 Fig.18 Synthesis of ethyl bisoxazolate from ethyl nitroacetate ethyl acetate |
| |
1,1-二苯乙烯(41)的合成是以溴苯为原料合成的格氏试剂苯基溴化镁和苯乙酮反应生成1,1-二苯乙醇再经脱水生成,反应产率可达95%(图 19)[58]。
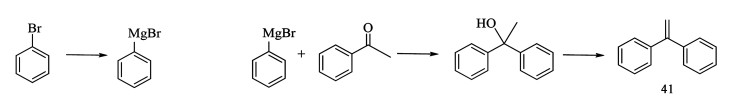
|
| 图 19 1,1-二苯乙烯的合成路线 Fig.19 Synthesis route of 1,1-distyrene |
| |
基于异噁唑杂环结构的除草剂具有的高药效、高选择性、低毒性的特点,与绿色农药的发展要求相适应,其适用面广且在针对不同农作物的适应性方面具有独特的优势,一般使用量极低,因此近年来受到广泛关注,在合成路线及工艺上取得了突破。然而,该类除草剂相对于传统使用量较大的除草剂如草甘膦、莠去津、异丙甲草胺等仍然存在生产工艺复杂,成本较高的问题;而传统除草剂虽然存在环境不友好等缺点,较低的成本使其仍占据很大市场。
基于异噁唑类除草剂在应用性能方面的明显优势,未来需要在合成路线、合成方法以及生产工艺方面不断优化,降低生产成本。根据课题组前期在该类除草剂合成工艺开发的经验基础上,我们认为可在如下几个方面重点开展开发研究:(1)优化合成路线。可以看到文中的异噁唑类除草剂尤其是砜吡草唑、苯唑草酮等采用线性合成方法,合成路线较长、效率较低,未来可以考虑通过收敛性合成设计,提高合成效率以及产物收率。(2)优化绿色连续化工艺设计,重点优化剂型加工、施药技术、残留检测和风险评估等环节。充分考虑各步反应特点,通过溶剂筛选及反应条件优化,一方面提高最终产物收率,提高生产效率;另一方面减少“三废”排放,降低生产成本。未来,通过理论突破、技术创新,实现生产成本降低,有望在异噁唑类除草剂产品的推广应用方面做出贡献。
| [1] |
刘长令. 世界农药大全-除草剂卷[M]. 北京: 化学工业出版社, 2002.
|
| [2] |
潘兴鲁, 董丰收, 刘新刚, 等. 中国农药七十年发展与应用回顾[J]. 现代农药, 2020, 19(1): 1-5, 23. PAN Xinglu, DONG Fengshou, LIU Xingang, et al. Development and application of pesticide in China in past 70 years[J]. Modern Agrochemicals, 2020, 19(1): 1-5, 23. (in Chinese) |
| [3] |
张一宾. 异噁唑类除草剂的研发和发展前景[J]. 世界农药, 2015, 37(1): 4-8. ZHANG Yibin. Research and development of isoxazoline herbicides[J]. World Pesticides, 2015, 37(1): 4-8. (in Chinese) |
| [4] |
CHO H, CHEN M. 李复信摘译. 草甘膦的制备方法[J]. 化学工业与工程, 1987, 4(2): 67-70
|
| [5] |
DUKE S O, POWLES S B. Glyphosate: A once-in-a-century herbicide[J]. Pest Management Science, 2008, 64(4): 319-325. DOI:10.1002/ps.1518 |
| [6] |
周曙光, 陈静, 王硕, 等. 草甘膦合成工艺的改进[J]. 精细化工, 2009, 26(6): 605-608. ZHOU Shuguang, CHEN Jing, WANG Shuo, et al. Improved synthesis of glyphosate[J]. Fine Chemicals, 2009, 26(6): 605-608. (in Chinese) |
| [7] |
LENGYEL Z, FÖLDÉNYI R. Acetochlor as a soil pollutant[J]. Journal of Soils and Sediments, 2002, 2(3): 155. DOI:10.1007/BF02988468 |
| [8] |
XIA X, KONG B, ZHANG Z. Progress of synthetic process of acetochlor[J]. 农药科学与管理, 2006, 27(3): 35-38. |
| [9] |
杨森, 吴勇, 刘洪明. 磺酰脲类除草剂的研究进展[J]. 现代农药, 2022, 21(2): 14-21. YANG Sen, WU Yong, LIU Hongming. Research progress of sulfonylurea herbicides[J]. Modern Agrochemicals, 2022, 21(2): 14-21. (in Chinese) |
| [10] |
顾林玲. 三嗪类除草剂研究与开发新进展[J]. 世界农药, 2021, 43(12): 12-23. GU Linling. New progress of research and development of triazine herbicides[J]. World Pesticides, 2021, 43(12): 12-23. (in Chinese) |
| [11] |
KAUFMAN D D, KEARNEY P C. Microbial degradation of s-triazine herbicides[C]//GUNTHER FA, GUNTHER JD. Single Pesticide Volume: The Triazine Herbicides. New York: Springer, 1970: 235-265
|
| [12] |
TANETANI Y, KAKU K, KAWAI K, et al. Action mechanism of a novel herbicide, pyroxasulfone[J]. Pesticide Biochemistry and Physiology, 2009, 95(1): 47-55. DOI:10.1016/j.pestbp.2009.06.003 |
| [13] |
TANETANI Y, FUJIOKA T, KAKU K, et al. Studies on the inhibition of plant very-long-chain fatty acid elongase by a novel herbicide, pyroxasulfone[J]. Journal of Pesticide Science, 2011, 36(2): 221-228. DOI:10.1584/jpestics.G10-81 |
| [14] |
STEELE G L, PORPIGLIA P J, CHANDLER J M. Efficacy of KIH-485 on texas panicum (panicum texanum) and selected broadleaf weeds in Corn[J]. Weed Technology, 2005, 19(4): 866-869. DOI:10.1614/WT-04-229R1.1 |
| [15] |
TIDEMANN B D, HALL L M, JOHNSON E N, et al. Additive efficacy of soil-applied pyroxasulfone and sulfentrazone combinations[J]. Canadian Journal of Plant Science, 2014, 94(7): 1245-1253. DOI:10.4141/cjps-2014-124 |
| [16] |
SONI J K, NIBHORIA A, PUNIA S S, et al. Herbicide resistant Phalaris minor in India—History of evolution, present status and its management[J]. Phytoparasitica, 2023, 51(2): 353-378. DOI:10.1007/s12600-022-01039-6 |
| [17] |
AVENT T H, NORSWORTHY J K, BUTTS T R, et al. Fenclorim rice safening and weed control with fall-applied acetochlor and pyroxasulfone[J]. Agrosystems, Geosciences & Environment, 2023, 6(1): e20345. |
| [18] |
CHI Z, SONG J, LAN N. Preparation method of 5,5-dimethyl isoxazolidine-3-thioketone: CN114315747A[P]. 2022-04-12
|
| [19] |
HAO S, SONG J, WANG S. Preparation method of pyroxasulfone and intermediate thereof: CN113754648A[P]. 2021-12-07
|
| [20] |
KINI P V, GANDHALE S N, SENGUPTA D, et al. Novel intermediate for preparation of pyroxasulfone: EP4003964A1[P]. 2022-12-01
|
| [21] |
TANI S, SHIKAMA D, TAKIZAWA K. Sulfone derivative production method: WO2022138781A1[P]. 2022-06-30
|
| [22] |
WANG S, HAO S, SONG J. S-(5,5-dimethyl-4,5-dihydroisoxazol-3-yl) ethyl sulfate and its synthesis method and application in intermediate of pyroxasulfone: CN113135867A[P]. 2021-07-20
|
| [23] |
TANI S. Method for producing sulfone derivative as herbicide: WO2022191292A1[P]. 2022-09-15
|
| [24] |
BRISTOW, JAMES T. New crystalline form of pyroxasulfone, process of preparation and use of this France: FR3119622A1[P]. 2022-08-12
|
| [25] |
TANETANI Y, FUJIOKA T, HORITA J, et al. Action mechanism of a novel herbicide, fenoxasulfone[J]. Journal of Pesticide Science, 2011, 36(3): 357-362. DOI:10.1584/jpestics.G10-97 |
| [26] |
TANETANI Y. Action mechanism of isoxazoline-type herbicides[J]. Journal of Pesticide Science, 2012, 37(3): 261-262. DOI:10.1584/jpestics.J12-05 |
| [27] |
WOLFGANG D, JOACHIM G, MICHAEL R, et al. Method and novel intermediate products for producing isoxazolin-3-ylacylbenzenenes: US6469176B[P]. 1999-11-12
|
| [28] |
ITO M, NAKATANI M, FUJINAMI M, et al. 3-sulfonylisoxazoline derivatives as novel herbicides[J]. ACS Symposium Series, 2015, 1204: 261-276. |
| [29] |
Yang J, Guan A WU Q, et al. Design, synthesis and herbicidal evaluation of novel uracil derivatives containing an isoxazoline moiety[J]. Pest Management Science, 2020, 76(10): 3395-3402. DOI:10.1002/ps.5970 |
| [30] |
FUJINAMI M, TAKAHASHI Y, TANETANI Y, et al. Development of a rice herbicide, fenoxasulfone[J]. Journal of Pesticide science, 2019, 44(4): 282-289. DOI:10.1584/jpestics.J19-04 |
| [31] |
BARDA Y, PAPO N, RECSEI C. Preparing pyroxasulfone or fenoxasulfone immediate precursor involves brominating 5-(difluoromethoxy)-1,4-dimethyl-3-(trifluoromethyl)-1H-pyrazole/1,4-dichloro-2-ethoxy-5-methylbenzene, thionating and substituting with 2-isoxazoline moiety: WO2022009044-A[P]. 2022-02-06
|
| [32] |
JHALA A J, SANDELL L D, RANA N, et al. Confirmation and control of triazine and 4-hydroxyphenylpyruvate dioxygenase-inhibiting herbicide-resistant palmer amaranth (Amaranthus palmeri) in Nebraska[J]. Weed Technology, 2014, 28(1): 28-38. DOI:10.1614/WT-D-13-00090.1 |
| [33] |
杨益军. 全球苯唑草酮市场极具潜力中国产业化难题将是市场进入第二峰的最大壁垒[J]. 农药市场信息, 2019(23): 39-42. |
| [34] |
GROSSMANN K, EHRHARDT T. On the mechanism of action and selectivity of the corn herbicide topramezone: A new inhibitor of 4-hydroxyphenylpyruvate dioxygenase[J]. Pest Management Science, 2007, 63(5): 429-439. DOI:10.1002/ps.1341 |
| [35] |
方韬, 夏子涵, 帅佳雪, 等. 向日葵HPPD基因的克隆与表达分析[J]. 分子植物育种, 2022. |
| [36] |
CHEN P, SHI M, NIU M, et al. Effects of HPPD inhibitor herbicides on soybean root exudates: A combination study of multispectral technique and 2D-COS analysis[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2023, 289: 122241. DOI:10.1016/j.saa.2022.122241 |
| [37] |
RHEINHEIMER J, VON DEYN W, GEBHARDT J, et al. Method for producing isoxazoline-3-yl-acyl benzene: US6525204[P]. 2003-02-25
|
| [38] |
DEYN W V, HILL R L, KARDORFF U, et al. 3-Heterocyclylsubstituted benzoyl derivatives: WO, 9831681[P]. 1997-01-17
|
| [39] |
李林, 邢瑞娟, 刘兰, 等. 一种3-取代苯基-4,5-二氢异恶唑衍生物的制备方法及其用途和中间体: CN110183392A[P]. 2019-08-30
|
| [40] |
张璞, 卜龙, 高鹋, 等. 一种苯唑草酮的中间体及苯唑草酮的制备方法: CN110922367A[P]. 2020-03-27 ZHANG Pu, BU Long, GAO Miao, et al. Topramezone intermediate and topramezone preparation method: CN110922367A[P]. 2020-03-27 (in Chinese) |
| [41] |
张大永, 陈志银, 余双双, 等. 一种制备除草剂苯唑草酮的方法: CN103788083[P]. 2014-05-14
|
| [42] |
KOO S J, HWANG K H, JEON M S, et al. Methiozolin[5-(2,6-difluorobenzyl)oxymethyl-5-methyl-3,3(3-methylthiophen-2-yl)-1,2-isoxazoline], a new annual bluegrass (Poa annuaL.) herbicide for turfgrasses[J]. Pest Management Science, 2014, 70(1): 156-162. DOI:10.1002/ps.3541 |
| [43] |
LEE J, SONG J, JEONG E J, et al. Developmental toxicity assessment of the new turf herbicide, methiozolin ([5-(2,6-difluorobenzyl)oxymethyl-5-methyl-3,3(3-methylthiophen-2-yl)-1,2-isoxazoline]), in rabbits[J]. Regulatory Toxicology and Pharmacology, 2015, 72(3): 639-645. DOI:10.1016/j.yrtph.2015.05.007 |
| [44] |
GROSSMANN K, HUTZLER J, TRESCH S, et al. On the mode of action of the herbicides cinmethylin and 5-benzyloxymethyl-1,2-isoxazolines: Putative inhibitors of plant tyrosine aminotransferase[J]. Pest Management Science, 2012, 68(3): 482-492. DOI:10.1002/ps.2319 |
| [45] |
SHI J, CAO H F, WANG C F, et al. Silico approach of novel HPPD/PDS dual target inhibitors by pharmacophore, AILDE and molecular docking[J]. Journal of the Taiwan Institute of Chemical Engineers, 2023, 143: 104711. DOI:10.1016/j.jtice.2023.104711 |
| [46] |
JOHNEN P, ZIMMERMANN S, BETZ M, et al. Inhibition of acyl-ACP thioesterase as site of action of the commercial herbicides cumyluron, oxaziclomefone, bromobutide, methyldymron and tebutam[J]. Pest Management Science, 2022, 78(8): 3620-3629. DOI:10.1002/ps.7004 |
| [47] |
SUGANUMA T, NAITO Y. Herbicidal composition containing carotenoid biosynthesis inhibitor and fat biosynthesis inhibitor: JP2021073168A[P]. 2021-05-13
|
| [48] |
杨桂秋, 焦爽, 李青, 等. 除草剂Methiozolin的合成与生物活性[J]. 农药, 2013, 52(4): 247-248. YANG Guiqiu, JIAO Shuang, LI Qing, et al. Synthesis and herbicidal activity study of methiozolin[J]. Agrochemicals, 2013, 52(4): 247-248. (in Chinese) |
| [49] |
KO Y K, KOO D W, WOO J C, et al. Industrial method for the preparation of high-purity methiozolin: US9303022[P]. 2016-04-05
|
| [50] |
ABU-QARE A W, DUNCAN H J. Herbicide safeners: Uses, limitations, metabolism, and mechanisms of action[J]. Chemosphere, 2002, 48(9): 965-974. DOI:10.1016/S0045-6535(02)00185-6 |
| [51] |
SUN L, WU R, SU W, et al. Physiological basis for isoxadifen-ethyl induction of nicosulfuron detoxification in maize hybrids[J]. PLoS One, 2017, 12(3): e0173502. DOI:10.1371/journal.pone.0173502 |
| [52] |
SUN L, XU H, SU W, et al. The expression of detoxification genes in two maize cultivars by interaction of isoxadifen-ethyl and nicosulfuron[J]. Plant Physiology and Biochemistry, 2018, 129: 101-108. DOI:10.1016/j.plaphy.2018.05.025 |
| [53] |
LENZ G, FLOOD C, ZHANG G. Herbicidal compositions with enhanced soil mobility: WO2022229654 A1[P]. 2022-11-03
|
| [54] |
BUNTING J A, SPRAGUE C L, RIECHERS D E. Corn tolerance as affected by the timing of foramsulfuron applications[J]. Weed Technology, 2004, 18(3): 757-762. DOI:10.1614/WT-03-178R1 |
| [55] |
龚 , 唐向阳, 齐欣, 等. 3-(3,4-亚甲基二氧苯基)-5-苯基异噁唑啉的合成[J]. 化学工业与工程, 2015, 32(1): 17-20. GONG Yan, TANG Xiangyang, QI Xin, et al. Synthesis of 3-(3,4-methylenedioxxyphenyl)-5-phenyl-2-isoxazoline[J]. Chemical industry and engineering, 2015, 32(1): 17-20. (in Chinese) |
| [56] |
WANG H. Preparation of herbicide safener isoxadifen: CN103709113A[P]. 2014-04-09
|
| [57] |
CREMONESI G, DALLA CROCE P, FONTANA F, et al. Stereoselective synthesis of β, ε-dihydroxy-α-amino acids by ring opening of 4,5-dihydroisoxazolyl derivatives[J]. Tetrahedron: Asymmetry, 2008, 19(24): 2850-2855. DOI:10.1016/j.tetasy.2008.11.034 |
| [58] |
WEI C, WU C, HUANG Y, et al. Experimental and DFT study of the tautomeric behavior of cobalt-containing secondary phosphine oxides[J]. Chemistry-A European Journal, 2007, 13(5): 1583-1593. DOI:10.1002/chem.200601051 |
 2024, Vol. 41
2024, Vol. 41





