2. 中国林业科学研究院高原林业研究所, 昆明 650233
2. Institute of Highland Forest Science, Chinese Academy of Forestry, Kunming 650233, China
鞣花酸(Ellagic acid,EA)是一种多酚二内酯,为没食子酸的二聚衍生物。它广泛存在于各种水果、蔬菜、草本植物和坚果中[1-3],是一种天然多酚类物质。根据相关文献报道,鞣花酸具有抗氧化[4, 5]、抗癌抗突变[6-8]、凝血[9]、降低血压[10]等多种生理和药理活性。塔拉(Tara),是一种豆科植物,盛产于秘鲁及其相邻诸国,最早由中国林业科学研究院成功引种国内西南地区[11, 12],是一种珍贵的经济植物。塔拉单宁是塔拉豆荚中的主要成分,含量约占55%~61%,塔拉单宁属于水解类没食子单宁,其结构为多没食子酰基奎宁酸。
鞣花酸现有的制备方法是从一些植物或植物组织中提取,如石榴皮、葡萄和蕨麻等[13-15],也可以鞣花单宁或五倍子单宁为原料制备得到鞣花酸。柳静[16]以塔拉粉为原料、甲醇为溶剂不断进行提取纯化得到塔拉单宁,再以纯化后的塔拉单宁为原料研究了塔拉单宁摇床氧化法生产鞣花酸的工艺,此反应耗时长达24 h。徐涓等[17]以高质量分数的单宁酸为原料采用液气射流氧化的方法,经过一系列纯化工艺的探索研究制备得到高质量分数的鞣花酸。刘宇文[18]研究了亚硫酸酸水解石榴皮工艺,最终得到的鞣花酸粗品的质量分数为27.71%,收率为6.66%,反应时间为14 h;同时也探讨了以五倍子为原料制备鞣花酸,其鞣花酸的收率达到44.13%,反应时间为16 h。
针对鞣花酸制备耗时长、成本高以及环境污染的问题,本工作利用水提法得到塔拉单宁溶液,以塔拉单宁溶液为基材采用液气射流氧化法制备鞣花酸。液气射流反应器是利用液体高速射流带入空气来传递能量和质量,液体以高的速度从喷嘴喷出,因负压而吸入空气,在强烈的剪切力作用下空气以微泡状态分散在液体中,增大了液气传质面积。微泡在液相中因密度小上升,不断地与液相进行物质交换,在整个过程中形成高效的物质传递,大幅度缩短了制备鞣花酸的反应时间、提高了效率。
1 实验部分 1.1 试剂与仪器塔拉粉(秘鲁,单宁质量分数57.18%),甲醇、氢氧化钠、磷酸、无水乙醇、溴化钾,分析纯,天津市风船化学试剂科技有限公司;冰醋酸、碳酸氢钠,分析纯,广东光华科技股份有限公司;超纯水、乙腈、甲醇,色谱级,西格玛奥德里奇(上海)贸易有限公司;鞣花酸标准品(EA,质量分数99.7%)。
TENSON 27型傅里叶变换红外光谱仪,德国布鲁克光谱仪器有限公司;Agilent Cary型紫外可见分光光度计、Agilent 1200型高效液相色谱仪,美国安捷伦科技有限公司;STA2500型同步热分析仪,德国耐驰科学仪器公司;HS153型水分测定仪,瑞士梅特勒托利多公司;干燥箱;台式高速离心机;DF-101S集热式恒温加热磁力搅拌器、SHZ-D(Ⅲ)型循环水式真空泵,巩义市予华仪器有限责任公司;AB204-S精密型电子天平,梅特勒-托利多(中国)有限司;SK8210HP型超声波清洗机,上海科导超声仪器有限公司;PSL-1400型低温恒温水槽,上海爱郎仪器有限公司。
1.2 实验方法 1.2.1 塔拉单宁溶液的提取以去离子水为提取溶剂,在搅拌状态下,提取3 h,水浴温度55 ℃, 料液比1 ∶8(单位为g·L-1)。
1.2.2 单宁含量检测方法根据林业行业标准LY/T 2005[19],采用皮粉-紫外分光光度法来测定单宁含量,结果测得塔拉单宁提取液中的单宁含量为57.23%(质量分数,下同)。
1.2.3 制备鞣花酸的单因素实验用 1.2.1方法提取得塔拉单宁溶液,向塔拉单宁提取液中加入一定质量分数12% NaOH溶液调节反应液pH值至8.5,加入0.3 mol·L-1的NaHCO3,在室温下反应8 h,通过液气射流氧化法制备装置氧化制得鞣花酸制备液,抽滤,在60 ℃烘箱中干燥20 h后冷却至室温,得到鞣花酸粗品,计算得率,每个样品做3个平行样。分别考察单因素:塔拉单宁浓度、反应温度及反应时间对鞣花酸粗品得率及质量分数的影响。
| $ \mathrm{EA} \text { 粗品得率 }=\frac{\mathrm{EA} \text { 粗品质量 }}{\text { 塔拉单宁质量 }} \times 100 \% $ | (1) |
取一定量的粗品鞣花酸,将其溶解在1.2%氢氧化钠溶液中,抽滤并收集滤液。在滤液中加入醋酸酸化,搅拌并将pH值调至为4.50,静置一段时间后抽滤得到滤饼。将滤饼上的沉淀用一定量的去离子水水洗,搅拌抽滤,收集沉淀并烘干,即得到鞣花酸的精制样品;所制得的精制样品用甲醇洗涤,抽滤,烘干,得到鞣花酸纯化样品。计算出其样品的收率并利用高效液相法检测出鞣花酸样品的质量分数。
| $ \mathrm{EA} \text { 精制样品收率 }=\frac{\mathrm{EA} \text { 精制样品质量 }}{\mathrm{EA} \text { 粗品质量 }} \times 100 \% $ | (2) |
| $ \mathrm{EA} \text { 纯化样品得率 }=\frac{\mathrm{EA} \text { 纯化样品质量 }}{\mathrm{EA} \text { 精制样品质量 }} \times 100 \% $ | (3) |
称取一定质量的鞣花酸标准品,配制浓度为0.1 g·L-1的鞣花酸甲醇溶液,采用液相外标法进行质量分数测定,标准品的浓度在0.05~0.25 g·L-1范围内呈现良好的线性关系。
1.2.6 高效液相色谱条件Agilent 1200型号高效液相色谱仪,Agilent ZORBAX SB-C18(4.6 mm×250 mm×5 μm)色谱柱,流动相:乙腈(A)-0.2%(体积比)磷酸水溶液(B),按照表 1进行梯度洗脱。色谱柱温30 ℃、流速1 mL·min-1,进样量15 μL,UV检测器的波长为266 nm。
| 时间/min | 洗脱/% | |
| 流动相A | 流动相B | |
| 0 | 20 | 80 |
| 0~5 | 40 | 60 |
| 6~10 | 100 | 0 |
配制一定质量浓度的鞣花酸甲醇溶液,用 1.2.6的检测条件进行检测分析,得到不同样品的高效液相色谱图。
1.3.2 紫外-可见光谱配制一定质量浓度的鞣花酸甲醇溶液,用紫外-可见光进行全波长扫描。波长范围:800~200 nm。
1.3.3 红外光谱取少量鞣花酸样品,放入烘干的溴化钾研钵中研磨均匀,用傅里叶红外光谱仪进行扫描分析。扫描范围:4 000~400 cm-1,分辨率4 cm-1。
1.3.4 热重分析取少量样品于氧化铝陶瓷坩埚中,在35~800 ℃内,升温速度10 ℃·min-1,进行热重分析,使用高纯氮为吹扫和保护气氛,流速分别为50和20 mL·min-1 (体积分数≥99.99%)。
2 结果与讨论 2.1 单宁酸标准曲线单宁在276 nm处有特征吸收,单宁的水溶液浓度与吸光度成正比。精确称取100.00 mg单宁酸标品,溶解并定容在100 mL容量瓶中。精密移取不同体积的上述单宁溶液稀释至100 mL,配置成一系列浓度的单宁溶液,用皮粉-紫外分光光度法测定吸光度。以单宁浓度为横坐标,吸光度值为纵坐标,绘制标准曲线,见图 1,得到回归方程: y=40.85564x+0.03812,R2=0.9994。单宁酸水溶液的吸光值在3.0~50 μg·mL-1的浓度范围内呈线性。本工作通过此标准曲线计算单宁浓度。
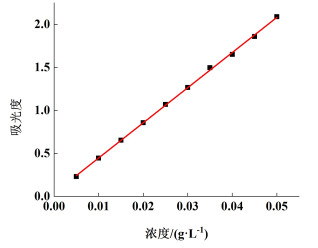
|
| 图 1 单宁酸水溶液浓度与吸光度的标准曲线 Fig.1 Standard curve of concentration and absorbance of tannic acid aqueous solution |
| |
液气射流氧化法制备鞣花酸粗品实验中的射流速度均控制为15 m·s-1。在反应温度为25 ℃,反应时间8 h的条件下,分别考察塔拉单宁溶液的浓度为10、20、30、40和50 g·L-1时对鞣花酸粗品得率以及质量分数的影响,如图 2。
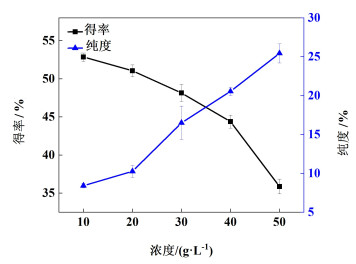
|
| 图 2 塔拉单宁浓度对鞣花酸粗品得率和质量分数的影响 Fig.2 Effect of Tara Tannin concentration on yield and purity of crude ellagic acid |
| |
由图 2可见,鞣花酸粗品的得率随塔拉单宁浓度的增大而降低。塔拉单宁浓度由10 g·L-1增加到30 g·L-1时,鞣花酸粗品的得率由52.87%下降到48.14%,在浓度为50 g·L-1时得率最低为35.86%。可能原因是,随着塔拉单宁浓度的增加,反应液的黏稠度增大,流动性小,在传质过程中增加了难度。鞣花酸粗品的质量分数随着塔拉单宁浓度的增大而增大,塔拉单宁浓度由10 g·L-1增加到50 g·L-1时鞣花酸的质量分数由8.41%增加到25.43%。可能原因是,反应浓度相对较小时,反应结束后溶液体系的pH值较高,生成的鞣花酸过度氧化,导致反应浓度较小的最终制得的鞣花酸质量分数较小。综合考虑较优反应浓度为30 g·L-1。
2.2.2 反应温度对鞣花酸粗品得率及质量分数的影响选取塔拉单宁溶液浓度为30 g·L-1,反应时间为8 h,分别考察反应温度为10、20、30、40和50 ℃时对鞣花酸粗品得率以及质量分数的影响,如图 3。
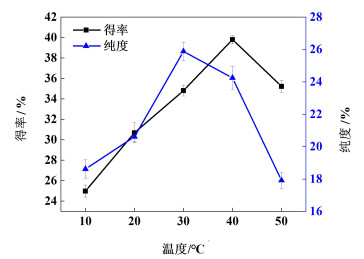
|
| 图 3 反应温度对鞣花酸粗品得率和质量分数的影响 Fig.3 Effect of reaction temperature on yield and purity of crude ellagic acid |
| |
由图 3可见,随着温度的升高,鞣花酸粗品的得率和质量分数呈现先增加后降低的趋势,在40 ℃时鞣花酸粗品得率最大为39.81%,此时鞣花酸的质量分数为24.24%。30 ℃时鞣花酸粗品质量分数最大为25.88%,此时鞣花酸的得率为34.80%。可能原因是,随着温度的升高,分子运动越快,分子间碰撞的几率越大,生成鞣花酸的这一反应速率加快,但是温度过高,会使其他非单宁物质进入溶剂的速度加快,单宁也容易被过度氧化,生成新的杂质,造成鞣花酸粗品的得率和质量分数降低。考虑到能量消耗的问题,选取为30 ℃为较适宜反应温度。
2.2.3 反应时间对鞣花酸粗品得率及质量分数的影响选取塔拉单宁溶液浓度为30 g·L-1,反应温度为30 ℃,考察反应时间为1、2、3、4、5、6、7、8和9 h时对鞣花酸粗品得率以及质量分数的影响,如图 4。
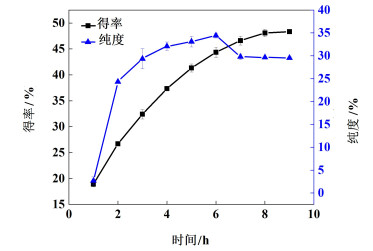
|
| 图 4 反应时间对鞣花酸粗品得率和质量分数的影响 Fig.4 Effect of reaction time on yield and purity of crude ellagic acid |
| |
由图 4可见,鞣花酸的得率随着时间的延长先增加,后缓慢增加最后趋于平缓,鞣花酸质量分数则先增高,达到某一时间点后缓慢降低。当反应时间为6 h时,鞣花酸粗品的质量分数达到最高为34.42%,得率为44.35%。可能原因是,随着体系中传质过程的进行,反应体系在碱性环境以及通气氧化的条件下,更多的塔拉单宁进行水解,越来越多的水解产物没食子酸进行反应生成鞣花酸直至反应完全。但质量分数随之下降,可能是因为生成的鞣花酸随着时间的增长在碱性条件下被氧化所致。综合考虑较适宜反应时间为6 h。
2.3 鞣花酸粗品的纯化在塔拉单宁浓度30 g·L-1,反应时间6 h,温度30 ℃的条件下大量制备粗品鞣花酸。配置1.2%NaOH溶液,分别称取10.00 g粗鞣花酸于3个烧杯中,加入300 mL配置好的氢氧化钠水溶液,45 ℃搅拌1.0~1.5 h,使其充分溶解,抽滤。收集滤液,搅拌并用醋酸调节滤液pH值为4.50,静置、抽滤并烘干,通过碱溶酸沉的方法得到鞣花酸的精制样品。
对上述制得的鞣花酸精制样品进行纯化,方法如下:分别称取1.433 2 g的鞣花酸精制样品放置在3份一定量的甲醇溶液中(料液比1 ∶200,单位为g·mL-1),在65 ℃下搅拌1 h,采用溶剂洗涤法得到鞣花酸的纯化样品。如表 2所示,得到鞣花酸精制样品的收率为44.58%,质量分数88.69%;鞣花酸纯化样品的收率为61.70%,质量分数94.69%。
| EA收率/% | 平均值/% | w(EA)/% | 平均值/% | |
| 精制 | 46.16 | 44.58±1.660 | 88.56 | 88.69±0.217 |
| 44.73 | 88.57 | |||
| 42.85 | 88.94 | |||
| 纯化 | 61.72 | 61.70±2.065 | 94.42 | 94.69±0.243 |
| 63.75 | 94.76 | |||
| 59.62 | 94.89 |
表征时选取鞣花酸标准样品、鞣花酸精制样品和鞣花酸纯化样品进行对比,分别通过液相色谱法、紫外-可见光谱法、红外光谱法以及热重分析法等仪器设备进行结构鉴定及分析。
2.4.1 高效液相色谱图分析利用高效液相色谱检测纯度,由图 5可知,在高效液相色谱检测条件相同时,鞣花酸标准样品、鞣花酸精制样品和鞣花酸纯化样品的出峰时间均在5.5 min,但3组鞣花酸样品在鞣花酸出峰面积上有一定的差异,其中:鞣花酸标准样品>鞣花酸纯化样品>鞣花酸精制样品。分析结果表明,鞣花酸的精制样品与纯化样品的质量分数没有鞣花酸标准品的质量分数高。
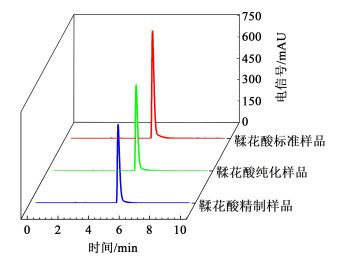
|
| 图 5 鞣花酸的液相色谱图 Fig.5 Liquid chromatogram of ellagic acid |
| |
3种样品的紫外可见光谱图见图 6。

|
| 图 6 鞣花酸的紫外可见光谱图 Fig.6 UV-Vis spectrum of ellagic acid |
| |
由图 6可知,发现所制得的鞣花酸精制样品、鞣花酸纯化样品与标准品有一样的特征吸收峰,均在255、368 nm处有明显吸收峰,分别为C=C和C=O结构,三者相比结构正确。
2.4.3 红外光谱图分析扫描3种样品,其红外谱图见图 7。

|
| 图 7 鞣花酸红外光谱图 Fig.7 Infrared spectrum of ellagic acid |
| |
由图 7发现鞣花酸精制样品和鞣花酸纯化样品的结构分析与鞣花酸标准品的结构分析基本一致。3 241 cm-1处较强的峰是鞣花酸上酚羟基的伸缩振动吸收峰,1 710 cm-1处是内酯C=O的伸缩振动吸收峰,1 611、1 588、1 497和1 446 cm-1处是苯环上C=C的伸缩振动吸收峰,1 318、1 261和1 187 cm-1处是内酯中Ar—O—C的伸缩振动吸收峰。由此可看出,样品均具有鞣花酸的特征吸收峰。
2.4.4 热重分析扫描3种样品的热重曲线,表征了样品在程序温度过程中质量随温度变化的情况。见图 8。由图 8可知,鞣花酸标准样品、鞣花酸纯化样品、鞣花酸精制样品的初始热解温度分别为483.2、456.8和454.1 ℃。3组样品的初始热解温度大小为:鞣花酸标准样品>鞣花酸纯化样品>鞣花酸精制样品,均高于单宁酸的初始热解温度200 ℃,说明鞣花酸样品中没有单宁酸残留。

|
| 图 8 鞣花酸热重分析图 Fig.8 Thermogravimetric analysis of ellagic acid |
| |
本实验采用液气射流技术研究了塔拉单宁制备高质量分数鞣花酸的生产工艺,通过鞣花酸的单因素考察,得到较优制备工艺条件为:pH值为8.5、浓度30 g·L-1的塔拉单宁溶液、温度30 ℃,在该条件下反应6 h制备得到鞣花酸粗品。与已有塔拉单宁制备鞣花酸的方法相比,此方法大幅缩短制备鞣花酸的反应时间。以鞣花酸粗品为原料,碱溶酸沉后的鞣花酸精制样品收率为44.58%,质量分数为88.69%;继而以鞣花酸精制样品为提纯物,选用甲醇溶剂洗涤法在65 ℃下搅拌1 h,得到高质量分数鞣花酸样品的收率为61.70%,质量分数94.69%。
| [1] |
陆晶晶, 丁轲, 杨大进. 保健品功能因子鞣花酸研究进展[J]. 食品科学, 2010, 31(21): 451-454. LU Jingjing, DING Ke, YANG Dajin. Research progress of ellagic acid as a functional factor of health products[J]. Food Science, 2010, 31(21): 451-454. (in Chinese) |
| [2] |
BOBINAITĖ R, VIŠKELIS P, VENSKUTONIS P R. Variation of total phenolics, anthocyanins, ellagic acid and radical scavenging capacity in various raspberry (Rubus spp.) cultivars[J]. Food Chemistry, 2012, 132(3): 1495-1501. DOI:10.1016/j.foodchem.2011.11.137 |
| [3] |
DEROSA G, MAFFIOLI P, SAHEBKAR A. Ellagic acid and its role in chronic diseases[J]. Advances in Experimental Medicine and Biology, 2016, 928: 473-479. |
| [4] |
TOŠOVIĆ J, BREN U. Antioxidative action of ellagic acid-a kinetic DFT study[J]. Antioxidants (Basel, Switzerland), 2020, 9(7): 587. |
| [5] |
SALEM A M, MOHAMMADEN T F, ALI M A M, et al. Ellagic and ferulic acids alleviate gamma radiation and aluminium chloride-induced oxidative damage[J]. Life Sciences, 2016, 160: 2-11. DOI:10.1016/j.lfs.2016.07.006 |
| [6] |
GONZÁLEZ-SARRÍAS A, MIGUEL V, MERINO G, et al. The gut microbiota ellagic acid-derived metabolite urolithin A and its sulfate conjugate are substrates for the drug efflux transporter breast cancer resistance protein (ABCG2/BCRP)[J]. Journal of Agricultural and Food Chemistry, 2013, 61(18): 4352-4359. DOI:10.1021/jf4007505 |
| [7] |
LALL R K, SYED D N, ADHAMI V M, et al. Dietary polyphenols in prevention and treatment of prostate cancer[J]. International Journal of Molecular Sciences, 2015, 16(2): 3350-3376. |
| [8] |
SANTOS I S, PONTE B M, BOONME P, et al. Nanoencapsulation of polyphenols for protective effect against colon-rectal cancer[J]. Biotechnology Advances, 2013, 31(5): 514-523. DOI:10.1016/j.biotechadv.2012.08.005 |
| [9] |
KOSUGE T, ISHIDA H, YOKOTA M, et al. Studies on antihemorrhagic substances in herbs classified as hemostatics in Chinese medicine. Ⅲ. On the antihemorrhagic principle in Sanguisorba officinallis L[J]. Chemical & Pharmaceutical Bulletin, 1984, 32(11): 4478-4481. |
| [10] |
李素琴, 袁其朋, 徐健梅. 鞣花酸的生理功能及工艺开发研究现状[J]. 天然产物研究与开发, 2001, 13(5): 71-74, 79. LI Suqin, YUAN Qipeng, XU Jianmei. The physiological function of ellagic acid and the research development on its production process[J]. Natural Product Research and Development, 2001, 13(5): 71-74, 79. (in Chinese) |
| [11] |
陈笳鸿, 吴在嵩, 毕良武, 等. 塔拉提取物化学利用的研究进展[J]. 林产化学与工业, 1996, 16(3): 79-86. CHEN Jiahong, WU Zaisong, BI Liangwu, et al. Development of research on chemical utilization of Tara extractives[J]. Chemistry & Industry of Forest Products, 1996, 16(3): 79-86. (in Chinese) |
| [12] |
包松莲, 夏定久, 李定国. 塔拉的生态适应性及其在云南适生区域的划分[J]. 云南林业科技, 2001(4): 45-49. BAO Songlian, XIA Dingjui, LI Dingguo. Ecological adaptability of caesalpinia spinosa and division of its normal region[J]. Yunnan Forestry Science and Technology, 2001(4): 45-49. (in Chinese) |
| [13] |
王黎, 李峰. 石榴皮鞣花酸类色素的提取和性能测定[J]. 信阳农业高等专科学校学报, 2006(3): 133-135. Wang Li, L Feng. The extraction and property determination of granatum ellagic acid pigment[J]. Journal of Xinyang Agricultural College, 2006(3): 133-135. (in Chinese) |
| [14] |
PUECH J L, RABIER P, MOUTOUNET M. Preparative separation by high-performance liquid chromatography of an extract of oak wood and determination of the composition of each fraction[J]. Journal of Chromatography A, 1988, 457: 431-436. DOI:10.1016/S0021-9673(01)82097-5 |
| [15] |
晋艳曦. 葡萄汁中鞣花酸的定性与定量分析[J]. 饮料工业, 1999, 2(5): 33-36. JIN Yanxi. The qualitative and quantitative analysis of ellagic acid in grape juice[J]. Beverage Industry, 1999, 2(5): 33-36. (in Chinese) |
| [16] |
柳静. 塔拉单宁及鞣花酸的制备工艺研究[D]. 北京: 北京化工大学, 2012 LIU Jing. Study on preparation technology of Tara tannin and ellagic acid[D]. Beijing: Beijing University of Chemical Technology, 2012(in Chinese) |
| [17] |
徐涓, 张弘, 李坤, 等. 液气射流技术改进单宁酸氧化制备高纯度鞣花酸[J]. 精细化工, 2021, 38(5): 994-1001, 1037. XU Juan, ZHANG Hong, LI Kun, et al. Improved tannic acid oxidation by liquid-gas jet technology for preparation of high purity ellagic acid[J]. Fine Chemicals, 2021, 38(5): 994-1001, 1037. (in Chinese) |
| [18] |
刘宇文. 鞣花酸的生产制备工艺研究[D]. 北京: 北京化工大学, 2015 LIU Yuwen. Study on production and preparation technology of ellagic acid[D]. Beijing: Beijing University of Chemical Technology, 2015 (in Chinese) |
| [19] |
国家林业局. 单宁酸分析试验方法: LY/T 1642—2005[S]. 北京: 中国标准出版社, 2006 State Forestry Administration of the People's Republic of China. Test method for analysis of tannic acid: LY/T 1642—2005[S]. Beijing: Standards Press of China, 2006 (in Chinese) |
 2024, Vol. 41
2024, Vol. 41





