甲基丙烯酸丁酯(BMA)是一种重要的有机化学中间体,因具有不饱和双键而能与其它单体共聚或自聚,而被广泛用于合成塑料、丙烯酸黏合剂[1]、涂料、纸张[2, 3]和聚合物[4-8]等材料,每年市场需求量数百万吨。目前,BMA的制备方法主要有直接酯化法[9, 10]和酯交换法[11, 12]。由于直接酯化法工艺中必须使用剧毒的苯和甲苯等化学品且产生大量工业废水,这与国内日益严格的环保要求不符,所以市场逐渐倾向于更为绿色环保的酯交换生产工艺。
通常情况下,BMA的酯交换工艺经常会选择价格较为低廉的甲基丙烯酸甲酯(MMA)与正丁醇作为反应物。催化剂的选择主要有固体酸(碱)性催化剂[13-15]、杂多酸催化剂[16, 17]、离子交换树脂催化剂[18-21]、无机(酸)盐[22, 23]和有机(酸)盐[6, 24-29]等,由于多相催化剂存在热力学稳定性差、机械强度差、易失活和扩散阻力[15, 16, 30, 31]等缺点,显然,均相催化剂在反应速率方面具有明显优势[32]。但迄今工业生产中使用最为广泛的均相催化剂浓硫酸[22],存在腐蚀性强、设备和操作条件苛刻、反应时间长和副反应多等缺点,因此,迫切需要开发一种新型绿色催化剂替代浓硫酸。近几年来,研究者们陆续开展了对甲苯磺酸[27]、有机锡催化剂[28]和钛酸四丁酯[29]等催化剂合成甲基丙烯酸丁酯的研究。其中,钛酸四丁酯因具有选择性高、反应条件温和、易于纯化和高循环使用性等优点[6, 24, 29, 33],在酯交换反应等生产实践中有一定的应用,因此,以钛酸四丁酯为催化剂,MMA与正丁醇通过酯交换反应生成BMA的工艺被认为是一种非常具有应用潜力的绿色环保工艺,具体反应式如式(1)所示。但关于这个合成工艺较为深入系统地研究报道还比较少,特别是缺少必要的基本反应数据和热力学数据,使得后续的工艺模拟研究无法正常开展。
| $ \begin{array}{c} \mathrm{CH}_{2}=\mathrm{C}\left(\mathrm{CH}_{3}\right) \mathrm{COOCH}_{3}+\mathrm{C}_{4} \mathrm{H}_{9} \mathrm{OH} \stackrel{\mathrm{Ti}(\mathrm{OBu})_{4}}{\rightleftarrows} \\ \mathrm{CH}_{2}=\mathrm{C}\left(\mathrm{CH}_{3}\right) \mathrm{COOC}_{4} \mathrm{H}_{9}+\mathrm{CH}_{3} \mathrm{OH} \end{array} $ | (1) |
基于以上事实,本研究对钛酸四丁酯催化MMA与正丁醇酯交换法生产BMA的反应动力学进行了系统研究。首先,在合理假设和简化的基础上对该反应过程进行分析,提出了反应机理,并建立反应动力学模型。其次,通过酯交换反应实验,对反应的主要因素,如反应温度、反应物初始物质的量之比和催化剂用量等进行实验,获得基本反应实验数据,回归得到了反应动力学的模型参数和基本热力学数据,并将模型值与实验数据进行对比。
1 实验部分 1.1 实验试剂甲基丙烯酸甲酯(MMA)、正丁醇、酚噻嗪和钛酸四丁酯(TBT)均购自中国上海迈瑞尔化工科技有限公司,为分析级,质量分数>0.99。
1.2 样品分析所有样品分析通过配备氢火焰离子化检测器(FID) 和Rtx-5Sil MS(30 m×0.25 mm×0.25 μm)毛细管柱的Agilent-G1530A气相色谱仪进行分析。分析方法为内标法。空气、氮气和氢气的流速分别设置为300、30和25 mL·min-1。进样器、检测器和柱箱温度分别为523.15、523.15和343.15 K。
1.3 实验设备及流程以钛酸四丁酯为催化剂的MMA和正丁醇酯交换反应在250 mL三口圆底烧瓶中进行,实验装置示意图如图 1所示。催化剂浓度在实验开始前通过质量法确定,在整个反应过程中视为恒定。实验中使用的电子天平(Sartorius BSA124S)的不确定度为0.000 1 g。首先,将一定量的MMA、正丁醇、酚噻嗪(聚合抑制剂)按照一定比例加入烧瓶,密封后置于ZNCL-TS 250 mL智能数显磁力搅拌电热套上加热,并开通冷凝器冷却和回流挥发性物质。通过温度计测定烧瓶中反应物的温度,当反应温度达到设定值并恒定在(±0.1) K时,将催化剂加入反应物中并开始记录反应时间(注:在没有催化剂存在的情况下反应无法进行)。间隔一定时间通过取样口取0.2 mL液体样品并通过气相色谱进行样品分析。当测得各组分的浓度不再变化时,反应被认为已达平衡。
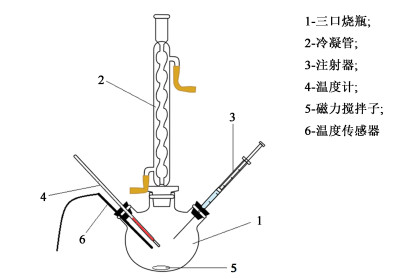
|
| 图 1 酯交换反应实验装置示意图 Fig.1 Schematic diagram of the experimental setup for the transesterification reaction |
| |
反应的基本实验参数如下:反应温度为331.15~ 349.15 K;MMA与正丁醇初始物质的量之比为0.5~2.0;催化剂质量占反应混合物总质量的比例为5%~10%;阻聚剂吩噻嗪质量浓度为0.003 g·mL-1反应混合物;搅拌速率设为600 r·min-1。
同时设置了一个标准反应条件作为对照实验:催化剂量为8%;反应温度为343.15 K;MMA与正丁醇初始物质的量之比为1∶1;吩噻嗪浓度为0.003 g·mL-1反应混合物;搅拌速率为600 r·min-1。
2 反应动力学模型推导 2.1 反应机理及动力学模型推导在MMA与正丁醇通过酯交换反应生成BMA的过程中,催化剂钛酸四丁酯作为过渡金属配合物,在反应中充当路易斯酸的作用。根据路易斯酸催化基本理论和已经报道的文献[34-36],本研究提出了钛酸四丁酯催化MMA与正丁醇酯交换反应的机理,其示意图如图 2所示。在该反应过程中,Ti4+作为活性中心,首先与MMA上的羰基配位,激发了羰基活性,使其更容易受到正丁醇上羟基氧的亲核攻击[37],所以,该反应主要包括3步基元反应。第1步,MMA上的羰基与催化剂上的活性中心Ti4+结合,使得羰基碳原子上的电子向阳离子Ti4+上转移,导致其电子密度显著降低,从而对亲核攻击高度敏感。该步反应速率被认为是相对较快的,所以,可以视为处于平衡状态。第2步,正丁醇中的羟基攻击MMA的羰基碳原子,形成四中心过渡态(Ⅱ)。这一步反应速率被认为是相对较慢的,所以,被视为该酯交换反应的速率控制步骤。第3步,MMA的羰基碳原子的C—O键断裂,形成O—H键,同时有机金属催化剂钛酸四丁酯从羰基上解离,进入下一个循环。同样,第3步反应速率也被认为是非常快的,视为处于平衡状态。

|
| 图 2 甲基丙烯酸甲酯(MMA)与正丁醇的反应机理 Fig.2 Reaction mechanism of methyl methacrylate (MMA) with n-butanol |
| |
根据以上对于反应过程的分析,在推导动力学模型时通常将第2步与第3步反应结合为1步反应,得到简化后的2步反应机理[38],如图 3所示。

|
| 图 3 甲基丙烯酸甲酯(MMA)与正丁醇的简化版反应机理 Fig.3 Simplified reaction mechanism of methyl methacrylate (MMA) with n-butanol |
| |
根据图 3所示的2步反应机理,推导得到了该酯交换反应的速率方程,结果如式(7)所示。
| $ r=\overrightarrow{k_{2}} c_{\mathrm{I}} c_{1 \text {-Butanol }}-\overleftarrow{k_{2}} c_{\mathrm{TBT}} c_{\mathrm{MeOH}} c_{\mathrm{BMA}} $ | (7) |
式(7)中:
因为式(5)总是处于平衡状态,所以cI可写为:
| $ c_{\mathrm{I}}=\frac{\overrightarrow{k_{1}} c_{\mathrm{MMA}} c_{\mathrm{TBT}}}{\overleftarrow{k_{1}}} $ | (8) |
式(8)中:
结合式(7)和(8),总反应速率方程可写为式(9)。
| $ r=\overrightarrow{k_{2}} \frac{\overrightarrow{k_{1}} c_{\mathrm{MMA}} c_{\mathrm{TBT}}}{\overleftarrow{k_{1}}} c_{1-\mathrm{Butanol}}-\overleftarrow{k_{2}} c_{\mathrm{TBT}} c_{\mathrm{MeOH}} c_{\mathrm{BMA}} $ | (9) |
进行反应变量变换,式(9)可进一步写为式(10)。
| $ \begin{array}{c} r=\overrightarrow{k_2} \frac{\overrightarrow{k_1} c_{\mathrm{TBT}}}{\overleftarrow{k_1}}\left(\frac{n}{V}\right)^2 x_{\mathrm{MMA}} x_{1-\text { Butanol }}-\overleftarrow{k_2} c_{\mathrm{TBT}}\left(\frac{n}{V}\right)^2 x_{\mathrm{MeOH}} x_{\mathrm{BMA}}= \\ \left(\frac{n}{V}\right)^{2} c_{\text {TвT }}\left(\vec{k} x_{\text {MMA }} x_{1-\text { Butanol }}-\stackrel{\leftarrow}{k} x_{\text {MeOH }} x_{\text {BMA }}\right) \end{array} $ | (10) |
式(10)中:
由于该反应的化学计量系数之和为0,即
| $ r=\frac{1}{V} \frac{1}{\nu_{i}} \frac{n \mathrm{~d} x_{i}}{\mathrm{~d} t}=c_{\mathrm{T}}^{2} c_{\mathrm{TBT}}\left(\vec{k} x_{\mathrm{MMA}} x_{1-\text { Butanol }}-\stackrel{\leftarrow}{k} x_{\mathrm{BMA}} x_{\mathrm{MeOH}}\right) $ | (11) |
因此,式(11)是基于理想溶液推导得到的酯化反应的动力学模型(IS)。但反应溶液通常会偏离理想状态,被认为是非理想溶液,所以,如果考虑反应混合物的非理想性,需要在基于理想溶液得到的动力学模型(IS)的基础上进行非理想性修正,得到非理想溶液动力学模型(NIS)。
2.2 非理想溶液动力学模型(NIS)对于非理想溶液,活度αi是计算化学平衡和反应动力学的基础。如果考虑溶液的非理想性,可将IS模型中的参数xi用活度αi表示,得到如式(12)所示的基于非理想溶液的动力学模型方程(NIS模型)。
| $ r=\frac{1}{V} \frac{1}{\nu_{i}} \frac{n \mathrm{~d} x_{i}}{\mathrm{~d} t}=c_{\mathrm{T}}^{2} c_{\mathrm{TBT}}\left(\vec{k} \alpha_{\mathrm{MMA}} \alpha_{1-\mathrm{Butanol}}-\stackrel{\leftarrow}{k} \alpha_{\mathrm{BMA}} \alpha_{\mathrm{MeOH}}\right) $ | (12) |
| $ \vec{k} =\vec{A} \exp \left(\frac{-\overrightarrow{E_{\mathrm{a}}}}{R T}\right) $ | (13) |
| $ \overleftarrow{k} =\overleftarrow{A} \exp \left(\frac{-\overleftarrow{E_{\mathrm{a}}}}{R T}\right) $ | (14) |
式(13)和(14)中:
NIS模型中的活度αi可由方程(15)计算得到。其中:xi是摩尔分数,可通过实验数据获得;γi为活度系数,可根据UNIQUAC模型求得,具体表达式见式(16)~式(21)。
| $ \alpha_{i}=\gamma_{i} x_{i} $ | (15) |
| $ \begin{array}{c} \ln \gamma_{i}=\ln \frac{\mathit{Ø}_{i}}{x_{i}}+\frac{z}{2} q_{i} \ln \frac{\theta_{i}}{\mathit{Ø}_{i}}-q_{i} \ln t_{i}- \\ q_{i} \sum\limits_{j} \frac{\theta_{i} \tau_{i j}}{t_{j}}+l_{i}+q_{i}-\frac{\mathit{Ø}_{i}}{x_{i}} \sum\limits_{j} x_{j} l_{j} \end{array} $ | (16) |
| $ \theta_{i}=\frac{q_{i} x_{i}}{q_{\mathrm{T}}} ; q_{\mathrm{T}}=\sum\nolimits_{k} q_{k} x_{k} $ | (17) |
| $ \mathit{Ø}_{i}=\frac{r_{i} x_{i}}{r_{\mathrm{T}}} ; r_{\mathrm{T}}=\sum\nolimits_{k} r_{k} x_{k} $ | (18) |
| $ l_{i}=\frac{z}{2}\left(r_{i}-q_{i}\right)+1-r_{i} $ | (19) |
| $ t_{i}=\sum\nolimits_{k} \theta_{k} \tau_{k i} $ | (20) |
| $ \tau_{i j}=\exp \left(a_{i j}+\frac{b_{i j}}{T}+c_{i j} \ln T+d_{i j} T+\frac{e_{i j}}{T^{2}}\right) $ | (21) |
式(16)~式(21)中:z为晶格配位数集,等于10;T为温度(K);qi和ri分别为组分i的相对范德华表面积和体积,具体数值见表 1;aij、bij、cij、dij、eij为二元交互作用参数,其中参数aij和bij见表 2,其他参数为0。
| 组分i | qi | ri |
| 甲醇 | 1.432 | 1.431 1 |
| 正丁醇 | 3.048 | 3.454 1 |
| 甲基丙烯酸甲酯 | 3.564 | 3.921 6 |
| 甲基丙烯酸丁酯 | 5.184 | 5.944 6 |
| 组分i | 组分j | aij | aji | bij | bji |
| 甲醇 | 正丁醇 | -0.313 60 | 0.226 70 | 82.636 | -125.29 |
| 甲醇 | 甲基丙烯酸甲酯 | 0 | 0 | 22.628 | -411.62 |
| 甲醇 | 甲基丙烯酸丁酯 | 0.119 06 | -0.269 70 | 11.757 | -389.99 |
| 正丁醇 | 甲基丙烯酸甲酯 | 0.074 36 | 0.069 72 | -82.482 | -49.33 |
| 正丁醇 | 甲基丙烯酸丁酯 | 1.072 10 | 1.304 70 | 372.690 | -545.29 |
| 甲基丙烯酸甲酯 | 甲基丙烯酸丁酯 | -0.334 08 | 0.369 850 | 139.320 | -159.50 |
为了得到IS模型和NIS模型的参数,以及该反应的基本热力学参数,需要通过实验测定该酯交换反应的几个主要影响因素,如反应温度、MMA与正丁醇初始物质的量之比和催化剂量等,对反应速率的影响。
保持其他反应参数为标准反应条件,改变反应温度分别为331.15、337.15、343.15和349.15 K进行实验,测定正丁醇转化率随时间的变化,结果如图 4所示。由图 4可以看出,随着反应温度的升高,正丁醇的初始反应速率和平衡转化率均增大。
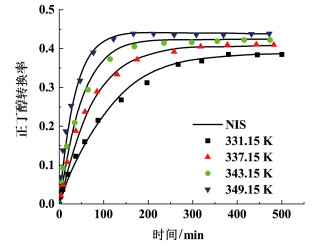
|
| 图 4 反应温度对正丁醇转化率的影响 Fig.4 Effect of reaction temperature on n-butanol conversion |
| |
保持其他反应参数为标准反应条件,改变MMA与正丁醇的初始物质的量之比,测定正丁醇的转化率随时间的变化规律,结果见图 5。由图 5可以看出,当MMA与正丁醇的初始物质的量之比在0.5~2.0时,随着MMA与正丁醇的初始比越高,正丁醇的最终转化率会增加,这是由于该酯交换为平衡反应,反应物的最终转化率会受平衡所限。由此可知,使用过量MMA可以提高正丁醇的转化率。

|
| 图 5 MMA与正丁醇初始物质的量之比对正丁醇转化率的影响 Fig.5 Effect of initial molar ratio of MMA to n-butanol on n-butanol conversion |
| |
保持其他反应参数为标准反应条件,改变催化剂质量与反应混合物总质量的比值来改变反应过程中催化剂浓度,研究其对于反应结果的影响,结果如图 6所示。需要指出的是,在平衡反应体系中,逆反应的存在会极大地影响总反应的速率,因此,在测定催化剂浓度对反应速率的影响时,必须在排除逆反应的影响的条件下进行实验。
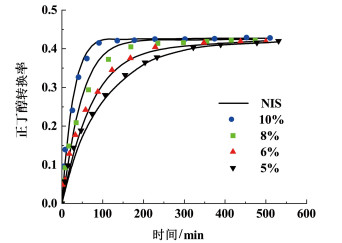
|
| 图 6 催化剂量对正丁醇转化率的影响 Fig.6 Effect of catalyst amount on n-butanol conversion |
| |
图 6结果表明,催化剂的浓度量对平衡转化率的影响不大,但随着催化剂量的增加,达到平衡所需时间明显减少。此外,测量催化剂活性数据时,考察了正(逆)反应的初始反应速率
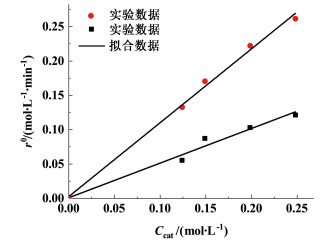
|
|
图 7 正(逆)反应的初始反应速率 |
| |
正反应:
| $ \vec{r}^{0}=0.5041 c_{\text {cat }} $ | (22) |
逆反应:
| $ \stackrel{\leftarrow}{r}^{0}=1.0749 c_{\text {cat }} $ | (23) |
在上述实验结果的基础上,对推导得到的理想溶液(IS)和非理想溶液(NIS)动力学模型进行模型参数回归。
利用非线性最小二乘法对反应温度分别为331.15、337.15、343.15和349.15 K的实验数据进行拟合得到不同反应温度下的正、逆反应速率常数
| 动力学模型 | IS | NIS | |||
| 温度/K | |||||
| 331.15 | 0.533 5 | 1.168 4 | 0.535 7 | 1.016 4 | |
| 337.15 | 0.805 3 | 1.573 5 | 0.819 1 | 1.402 2 | |
| 343.15 | 1.401 7 | 2.330 2 | 1.384 7 | 1.977 7 | |
| 349.15 | 1.891 5 | 2.906 7 | 1.933 8 | 2.622 6 | |
Arrhenius方程式(13)、(14)可变形成如下形式。
| $ \ln \vec{k}=\frac{-\overrightarrow{E_{\mathrm{a}}}}{R T}+\ln \vec{A} $ | (24) |
| $ \ln \overleftarrow{k}=\frac{-\overleftarrow{E_{\mathrm{a}}}}{R T}+\ln \overleftarrow{A} $ | (25) |
式(24)和(25)中:
图 8和图 9表明,

|
| 图 8 IS动力学模型的反应速率常数与温度的关系 Fig.8 Relationship between reaction rate constant and temperature for IS kinetic model |
| |
|
| 图 9 NIS动力学模型的反应速率常数与温度的关系 Fig.9 Relationship between reaction rate constant and temperature for NIS kinetic model |
| |
| 动力学模型 | 正反应 | 逆反应 | MRE | |||
| IS | 5.39×106 | 69.8 | 9.44×103 | 50.1 | 2.50×10-2 | |
| NIS | 6.21×106 | 70.2 | 1.17×104 | 51.1 | 1.93×10-2 | |
按照式(26)分别计算得到了IS动力学模型和NIS动力学模型的平均相对误差(MRE),结果见表 4。
| $ \operatorname{MRE}=\frac{1}{n}\left(\sum\limits_{k=1}^{n}\left|\frac{x_{1-\text { Butanol, exp }, k}-x_{1-\text { Butanol, cal }, k}}{x_{1-\text { Butanol }, \exp , k}}\right|\right) $ | (26) |
式(26)中:n为数据点个数;x1-Butanol, exp, k和x1-Butanol, cal, k分别为正丁醇的摩尔分数的实验值和模型计算值。
由表 4中所示的平均相对误差(MRE)可以看出,与IS模型相比,NIS动力学模型与实验数据的吻合性更好,准确性更高。最后,NIS反应动力学方程可表达为式(27)。
| $ \begin{array}{c} r=\frac{1}{V} \frac{1}{\nu_i} \frac{n \mathrm{~d} x_i}{\mathrm{~d} t}=c_{\mathrm{T}}^2 c_{\mathrm{TBT}} \\ {\left[\begin{array}{c} 6.21 \times 10^6 \exp \left(-\frac{7.02 \times 10^4}{R T}\right) \\ \alpha_{\text {MMA }} \alpha_{1 \text {-Butanol }}-1.17 \times 10^4 \exp \left(-\frac{5.11 \times 10^4}{R T}\right) \alpha_{\text {MeOH }} \alpha_{\text {BMA }} \end{array}\right]} \end{array} $ | (27) |
由式(27)可知,该酯交换反应的正、逆反应活化能分别为70.2和51.1 kJ·mol-1。利用NIS动力学模型,计算得到了正丁醇的转化率X1-Butanol, cal,结果如图 4~图 6所示。结果表明动力学模型的预测值与实验结果吻合良好,进一步表明了动力学模型的可靠性。
| $ \frac{\mathrm{d} X_{1-\text { Butanol, cal }}}{\mathrm{d} t}=\frac{1}{c_{\mathrm{T}} x_{1-\text { Butanol, cal }}^{0}} r_{1-\text { Butanol, cal }} $ | (28) |
化学平衡常数Ka与温度T密切相关。由图 4可以得到该反应在不同温度下的平衡转化率,对应化学平衡常数Ka由式(29)计算得到。
| $ \begin{gathered} K_{\mathrm{a}}=\prod \alpha_i^{v_i}=\left(\frac{\alpha_{\mathrm{MeOH}} \alpha_{\mathrm{BMA}}}{\alpha_{1-\mathrm{Butanol}} \alpha_{\mathrm{MMA}}}\right)_{\mathrm{eq}}= \\ \left(\frac{x_{\mathrm{MeOH}} x_{\mathrm{BMA}}}{x_{1-\mathrm{Butanol}} x_{\mathrm{MMA}}}\right)_{\mathrm{eq}}\left(\frac{\gamma_{\mathrm{MeOH}} \gamma_{\mathrm{BMA}}}{\gamma_{1-\mathrm{Butanol}} \gamma_{\mathrm{MMA}}}\right)_{\mathrm{eq}} \end{gathered} $ | (29) |
式(29)中,Ka为化学平衡常数;αi、vi、xi和γi分别为组分i的活度、化学计量系数、摩尔分数和活度系数,其中,摩尔分数xi和活度系数γi见表 5。
| T/K | xMeOH | x1-Butanol | xMMA | xBMA | γMeOH | γ1-Butanol | γMMA | γBMA |
| 331.15 | 0.200 3 | 0.299 0 | 0.295 7 | 0.197 4 | 1.529 2 | 1.151 9 | 1.201 2 | 1.324 2 |
| 337.15 | 0.205 1 | 0.295 2 | 0.286 6 | 0.204 4 | 1.515 2 | 1.148 7 | 1.198 7 | 1.313 6 |
| 343.15 | 0.211 8 | 0.288 4 | 0.283 7 | 0.216 1 | 1.511 7 | 1.148 5 | 1.192 1 | 1.295 2 |
| 349.15 | 0.217 9 | 0.282 9 | 0.280 5 | 0.218 9 | 1.499 4 | 1.142 9 | 1.190 6 | 1.284 9 |
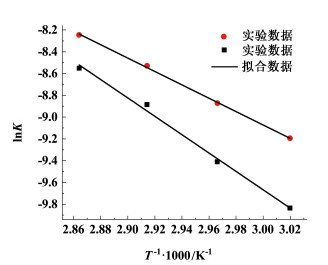
lnKa和T-1·1000的关系如图 10所示。回归得到了化学平衡常数Ka和T的关系式(30)。
| $ \ln K_{\mathrm{a}}=4.811-\frac{1732.8}{T} $ | (30) |

|
| 图 10 化学平衡常数Ka与反应温度T的关系 Fig.10 Relationship between chemical equilibrium constant Ka and reaction temperature T |
| |
另外,根据范特霍夫方程理论,反应温度T与化学平衡常数Ka之间存在如式(31)所示的关系。
| $ \frac{\mathrm{d}\left(\ln K_{\mathrm{a}}\right)}{\mathrm{d} T}=\frac{\Delta_r H^0}{R T^2} $ | (31) |
通常,标准摩尔反应焓与反应温度有关,但当温度变化很小时,标准摩尔反应焓可视为常数。因此,可得lnKa和T-1之间的线性关系,如式(32)所示。
| $ \ln K_{\mathrm{a}}=\ln K_{\mathrm{a}}\left(T^0\right)-\frac{\Delta_r H^0}{R}\left(\frac{1}{T}-\frac{1}{T^0}\right) $ | (32) |
根据图 10所示结果,可得到该反应的标准摩尔反应焓(ΔrH0)的值为14.406 kJ·mol-1。另外,标准摩尔反应焓(ΔrH0)理论上可由标准摩尔生成焓(ΔfH0)根据式(33)计算得到。其中,各组分的标准摩尔生成焓(ΔfH0)可从数据库检索获得,结果见表 6。理论计算得到该反应的标准摩尔反应焓(ΔrH0)值为12.16 kJ·mol-1。与实验结果相比,2者非常接近;且该值大0,表明该反应为吸热反应,所以,化学平衡常数随着反应温度的升高而增大,高温有利于该反应的进行。
| $ {\Delta _r}{H^0} = \sum\limits_{i = 1}^4 {\left( {{v_i}{\Delta _f}{H^0}} \right)} $ | (33) |
| 组分 | ΔfH0/(kJ·mol-1) |
| 甲醇 | 200.94 |
| 正丁醇 | -275.1 |
| 甲基丙烯酸甲酯 | -360 |
| 甲基丙烯酸丁酯 | -422 |
以钛酸四丁酯为催化剂,对甲基丙烯酸甲酯与正丁醇通过酯交换法合成甲基丙烯酸丁酯的反应及机理进行了初步研究。首先,根据路易斯酸催化理论,在合理假设和简化的基础上对该反应的机理进行了分析,提出了包含三步基元反应且第二步为速率控制步骤的反应机理,在此基础上,得到了基于理想溶液的动力学模型(IS)和基于UNIQUAC计算活度系数的非理想溶液动力学模型(NIS)。然后通过反应实验数据的测定,回归得到了NIS动力学模型的模型参数和基本的热力学数据。结果显示,NIS模型的平均相对误差(MRE)仅为1.93×10-2,可靠性更强。实验结果表明该酯交换反应为吸热反应,初始反应速率与催化剂浓度呈线性相关。计算得到的正反应活化能为70.2 kJ·mol-1,指前因子为6.21×106 L2·s-1·mol-2;逆反应活化能为51.1 kJ·mol-1,指前因子为1.17×104 L2·s-1·mol-2。最后,通过将动力学模型的计算结果与实验值进行比较,显示具有较高的吻合性。为今后钛酸四丁酯催化甲基丙烯酸甲酯与正丁醇酯交换合成甲基丙烯酸丁酯反应提供了一定的理论指导。
| [1] |
GOWER M D, SHANKS R A. Acrylic acid level and adhesive performance and peel master-curves of acrylic pressure-sensitive adhesives[J]. Journal of Polymer Science Part B: Polymer Physics, 2006, 44(8): 1237-1252. DOI:10.1002/polb.20779 |
| [2] |
ZENG K, KUO C, CHIEN I L. Design and control of butyl acrylate reactive distillation column system[J]. Chemical Engineering Science, 2006, 61(13): 4417-4431. DOI:10.1016/j.ces.2006.01.041 |
| [3] |
CONSTANTINO D S M, PEREIRA C S M, FARIA R P V, et al. Synthesis of butyl acrylate in a fixed-bed adsorptive reactor over Amberlyst 15[J]. AIChE Journal, 2015, 61(4): 1263-1274. DOI:10.1002/aic.14701 |
| [4] |
CHERNIKOVA E V, YULUSOV V V, GARINA E S, et al. Controlled synthesis of styrene-n-butyl acrylate copolymers with various chain microstructures mediated by dibenzyl trithiocarbonate[J]. Polymer Science Series B, 2013, 55(3): 176-186. |
| [5] |
ZHANG C, YANG D, ZHANG T, et al. Synthesis of MnO2/poly(n-butylacrylate-co-butyl methacrylate-co-methyl methacrylate) hybrid resins for efficient oils and organic solvents absorption[J]. Journal of Cleaner Production, 2017, 148: 398-406. DOI:10.1016/j.jclepro.2017.02.009 |
| [6] |
SAHA B, STREAT M. Transesterification of cyclohexyl acrylate with n-butanol and 2-ethylhexanol: Acid-treated clay, ion exchange resins and tetrabutyl titanate as catalysts[J]. Reactive and Functional Polymers, 1999, 40(1): 13-27. DOI:10.1016/S1381-5148(98)00004-2 |
| [7] |
李丽丽, 赵蕴慧, 贾强, 等. 甲基丙烯酸丁酯-PEG梳形共聚物的合成与表征[J]. 化学工业与工程, 2007, 24(6): 501-504. LI Lili, ZHAO Yunhui, JIA Qiang, et al. Synthesis and characterization of n-butyl methacrylate-PEG comb copolymer[J]. Chemical Industry and Engineering, 2007, 24(6): 501-504. (in Chinese) |
| [8] |
普敏莉, 李景庆. 聚丙烯酸酯/苯乙烯复合乳液制备及性能的研究[J]. 化学工业与工程, 2000, 17(1): 23-27, 55. PU Minli, LI Jingqing. Study on synthesis and properties of P(MA-BA)/P(BA-st) composite polymer latex[J]. Chemical Industry and Engineering, 2000, 17(1): 23-27, 55. DOI:10.3969/j.issn.1004-9533.2000.01.005 (in Chinese) |
| [9] |
CONSTANTINO D S M, FARIA R P V, RIBEIRO A M, et al. Butyl acrylate production: A review on process intensification strategies[J]. Chemical Engineering and Processing-Process Intensification, 2019. DOI:10.1016/j.cep.2019.107563 |
| [10] |
SERT E, ATALAY F S. N-Butyl acrylate production by esterification of acrylic acid with n-butanol combined with pervaporation[J]. Chemical Engineering and Processing: Process Intensification, 2014, 81: 41-47. DOI:10.1016/j.cep.2014.04.010 |
| [11] |
TANAKA S, NAKASHIMA T, SATOU N, et al. Epoxide as precatalyst for metal-free catalytic transesterification[J]. Tetrahedron Letters, 2019, 60(30): 2009-2013. DOI:10.1016/j.tetlet.2019.06.056 |
| [12] |
OTERA J. Transesterification[J]. Chemical Reviews, 1993, 93(4): 1449-1470. DOI:10.1021/cr00020a004 |
| [13] |
MANOHAR B, REDDY V R, REDDY B M. Esterification by ZrO2 and Mo-ZrO2 ECO-friendly solid acid catalysts[J]. Synthetic Communications, 1998, 28(17): 3183-3187. DOI:10.1080/00397919808004419 |
| [14] |
THAKKAR R, CHUDASAMA U. Synthesis of mono and diesters using eco-friendly solid acid catalyst-zirconium titanium phosphate[J]. Green Chemistry Letters and Reviews, 2009, 2(2): 61-69. DOI:10.1080/17518250903039774 |
| [15] |
ADRIANA M, NADINE E, LORRAINE C, et al. Transesterification of acrylates by heterogeneous basic catalysis[J]. Applied Catalysis A: General, 2013, 468: 1-8. DOI:10.1016/j.apcata.2013.08.001 |
| [16] |
CHEN X, XU Z, OKUHARA T. Liquid phase esterification of acrylic acid with 1-butanol catalyzed by solid acid catalysts[J]. Applied Catalysis A: General, 1999, 180(1/2): 261-269. |
| [17] |
ALSALME A, KOZHEVNIKOVA E F, KOZHEVNIKOV I V. Heteropoly acids as catalysts for liquid-phase esterification and transesterification[J]. Applied Catalysis A: General, 2008, 349(1/2): 170-176. |
| [18] |
BIN AHMAD M A A, CHIN S Y, ZAINAL ABIDIN S B. Kinetic studies of the esterification of acrylic acid with 2-ethyl hexanol catalysed by diaion resins[J]. Journal of Chemical Engineering of Japan, 2019, 52(4): 342-348. DOI:10.1252/jcej.17we063 |
| [19] |
CHAKRABARTI A, SHARMA M M. Cationic ion exchange resins as catalyst[J]. Reactive Polymers, 1993, 20(1/2): 1-45. |
| [20] |
CHIN S Y, AHMAD M A A, KAMARUZAMAN M R, et al. Kinetic studies of the esterification of pure and dilute acrylic acid with 2-ethyl hexanol catalysed by Amberlyst 15[J]. Chemical Engineering Science, 2015, 129: 116-125. DOI:10.1016/j.ces.2015.02.006 |
| [21] |
ALI S H. Kinetics of catalytic esterification of propionic acid with different alcohols over Amberlyst 15[J]. International Journal of Chemical Kinetics, 2009, 41(6): 432-448. DOI:10.1002/kin.20416 |
| [22] |
MALSHE V C, CHANDALIA S B. Kinetics of the liquid phase esterification of acrylic acid with methanol and ethanol[J]. Chemical Engineering Science, 1977, 32(12): 1530-1531. DOI:10.1016/0009-2509(77)80251-0 |
| [23] |
RÖNNBACK R, SALMI T, VUORI A, et al. Development of a kinetic model for the esterification of acetic acid with methanol in the presence of a homogeneous acid catalyst[J]. Chemical Engineering Science, 1997, 52(19): 3369-3381. DOI:10.1016/S0009-2509(97)00139-5 |
| [24] |
SILING M I, LARICHEVA T N. Titanium compounds as catalysts for esterification and transesterification[J]. Russian Chemical Reviews, 1996, 65(3): 279-286. DOI:10.1070/RC1996v065n03ABEH000210 |
| [25] |
JIANG P, ZHANG D, LI Q, et al. A new catalytic transesterification for the synthesis of N, N-dimethylaminoethyl acrylate with organotin catalyst[J]. Catalysis Letters, 2006, 110(1): 101-106. |
| [26] |
BAQUEY G, ALVèS M H, GRAULLIER M, et al. An efficient, practical and cost-effective polymer-supported catalyst for the transesterification of methyl methacrylate by 1-butanol[J]. Green Chemistry, 2009, 11(6): 868-872. DOI:10.1039/b820704f |
| [27] |
徐海燕, 王瑞. 丙烯酸丁酯对甲基苯磺酸法合成反应最优工艺条件的探索[J]. 化工中间体, 2012, 9(5): 39-42. XU Haiyan, WANG Rui. Explored the optimum process conditions of the p-toluenesulfonate methord in butyl acrylate synthesis reaction[J]. Chemical Intermediate, 2012, 9(5): 39-42. (in Chinese) |
| [28] |
孙西花, 刘福胜, 韩晶杰. 酯交换法合成甲基丙烯酸-3-环己烯基甲酯[J]. 化工科技, 2015, 23(6): 16-19. SUN Xihua, LIU Fusheng, HAN Jingjie. Synthesis of 3-cyclohexenylmethyl methacrylate by transesterification[J]. Science & Technology in Chemical Industry, 2015, 23(6): 16-19. (in Chinese) |
| [29] |
李明生, 何慧珠, 李俊, 等. 均相催化法合成甲基丙烯酸丁酯[J]. 化学世界, 1992, 33(6): 276-279. |
| [30] |
JIMÉNEZ L, COSTA-LÓPEZ J. The production of butyl acetate and methanol via reactive and extractive distillation. Ⅱ. process modeling, dynamic simulation, and control strategy[J]. Industrial & Engineering Chemistry Research, 2002, 41(26): 6735-6744. |
| [31] |
邵仕香, 郑嗣华, 张嘉填, 等. 离子交换树脂催化合成丙烯酸丁酯的研究[J]. 天津理工学院学报, 1994(3): 22-26. SHAO Shixiang, ZHENG Shihua, ZHANG Jiatian, et al. Synthesis of butyl acrylate catalyzed by ion exchange resin[J]. Journal of Tianjin Institute of Technology, 1994(3): 22-26. (in Chinese) |
| [32] |
LILJA J, MURZIN D Y, SALMI T, et al. Esterification of different acids over heterogeneous and homogeneous catalysts and correlation with the Taft equation[J]. Journal of Molecular Catalysis A: Chemical, 2002, 182/183: 555-563. DOI:10.1016/S1381-1169(01)00495-2 |
| [33] |
罗明陨. 酯交换法合成丙烯酸异壬醇酯[J]. 上海化工, 2020, 45(4): 5-8. LUO Mingyun. Synthesis of isononyl acrylate by transesterification method[J]. Shanghai Chemical Industry, 2020, 45(4): 5-8. (in Chinese) |
| [34] |
CHAN A. Homogeneous catalysis: The application and chemistry of catalysis by goluble transition metal complexes[J]. Applied Catalysis A: General, 1993, 97(2): N21-N22. |
| [35] |
GROB S, HASSE H. Reaction kinetics of the homogeneously catalyzed esterification of 1-butanol with acetic acid in a wide range of initial compositions[J]. Industrial & Engineering Chemistry Research, 2006, 45(6): 1869-1874. |
| [36] |
CUI X, CAI J, ZHANG Y, et al. Kinetics of transesterification of methyl acetate and n-butanol catalyzed by ionic liquid[J]. Industrial & Engineering Chemistry Research, 2011, 50(20): 11521-11527. |
| [37] |
WANG S, CHEN T, WANG G, et al. Influence of coordination groups on the catalytic performances of organo-titanium compounds for disproportionation of methyl phenyl carbonate to synthesize diphenyl carbonate[J]. Applied Catalysis A: General, 2017, 540: 1-6. |
| [38] |
PENG Y, CUI X, ZHANG Y, et al. Kinetic study of transesterification of methyl acetate with ethanol catalyzed by 4-(3-methyl-1-imidazolio)-1-butanesulfonic acid triflate[J]. Applied Catalysis A: General, 2013, 466: 131-136. |
 2024, Vol. 41
2024, Vol. 41





