2. 中国科学院山西煤炭化学研究所, 太原 030051;
3. 北京北方节能环保有限公司, 北京 100070
2. Institute of Coal Chemistry, Chinese Academy of Sciences; Taiyuan 030001, China;
3. China North Energy Conservation and Environment Protection Co., Ltd, Beijing 100070, China
丙烯作为一种重要的化工基础原料,大量用于生产聚丙烯、苯酚、丙烯酸等高附加值产品[1-4]。其中,产品聚丙烯作为生产口罩熔喷布的重要材料,在抗击全球新冠肺炎中发挥了巨大作用。目前,丙烯生产主要来源于石脑油、轻质油等原油产品的裂解和裂化,但“石油路线”生产丙烯工艺成本高、收率低,难以满足巨大的市场需求[5, 6]。因此,探索其它的丙烯生产方式迫在眉睫。
丙烷广泛存在于油田气、炼厂气及页岩气中,一般作为燃料使用,资源浪费较大。丙烷脱氢制丙烯(PDH)路线能够实现丙烷资源的高效利用,是一条更加经济合理的丙烯生产渠道。PDH虽已实现工业化,但反应所需温度高、能耗大,且高温环境易引发烃类深度裂解,加剧催化剂积炭失活[7, 8]。氧气氧化丙烷脱氢制丙烯为热力学有利的放热反应,能够打破热力学平衡限制,有效消除积炭,改善催化剂的稳定性,但不可避免地导致丙烷过度氧化生成COx。相比之下,CO2氧化丙烷脱氢制丙烯工艺不仅降低了热力学吸热需求,且CO2的弱氧化性可以减少积炭,避免产物深度氧化[9, 10],同时可以实现温室气体CO2的资源化利用,属于“绿色化学”途径。
目前,工业上PDH工艺所使用催化剂主要活性组分为Pt和CrOx[11, 12]。Pt为贵金属成本高昂,而CrOx会造成相应的环境问题。近年来研究发现,氮化镓和氧化锌表现出优异的PDH催化活性。Zhang等[13]将GaN负载在SiO2载体,证明了GaN可以作为活性组分催化丙烷脱氢。Chen等[14]和Zhao等[15]报告了ZnO纳米粒子(2~3 nm)也可以用于催化丙烷脱氢反应。在低碳烷烃脱氢制烯烃反应中,镓基催化剂普遍活性不高、选择性低且易积炭失活,而锌基催化剂高温稳定性差、易流失。然而,镓物种对ZnO催化低碳烷烃脱氢反应的活性具有显著的促进作用。这可能是由于两相界面存在双组分活性位点,而Ga-Zn复合结构特殊的电子效应有助于活化烷烃分子[16]。因此,将配位不饱和的镓物种与电子富集的ZnO制备成固溶体结构,有望实现高效协同催化丙烷脱氢反应。此外,固溶体具有优良的稳定性,且富含缺陷位点[17-20],这也有助于CO2分子的活化。GaN与ZnO晶型结构相同,Ga和Zn原子半径接近,能够形成良好的固溶体结构[19]。Dukovic等[20]将ZnO和ZnGa2O4纳米晶的混合物在高温氨气下热处理,制备出GaN-ZnO固溶体。然而,该固溶体颗粒团聚严重,比表面积相对较小,活性组分利用率低。通过合理的方式将固溶体分散在多孔载体的表面或孔道中,可以显著提高活性物种的利用率。因而,选择合适的氮源、金属前驱体以及载体构筑固溶体结构来提高催化剂中活性物种的分散是高效CO2氧化丙烷脱氢制丙烯催化剂研究的重要方向。
为此,通过固相氮化法将活性组分GaN-ZnO固溶体颗粒分散在介孔MCM-41载体上,构筑具有双功能活性中心的负载型催化剂。在GaN-ZnO/MCM-41中,GaN能够提供路易斯酸位点来选择性活化丙烷分子中的C—H键,同时ZnO作为反应中的促进剂能够增强丙烷脱氢活性,而催化剂稳定的固溶体结构有利于活性位点的分散。介孔MCM-41作为载体,其比表面积大、孔道规整、热稳定性好,可以实现GaN-ZnO固溶体组分的有效分散,从而赋予催化剂优异的CO2-OPDH性能。此外,研究了焙烧温度对GaN-ZnO固溶体组成结构的影响,并结合相关表征,将固溶体的组成结构与其催化活性进行了关联分析。
1 试剂与仪器 1.1 试剂硝酸镓水合物Ga(NO3)3 ·xH2O,AR,质量分数≥99.9%,麦克林试剂有限公司;硝酸锌水合物Zn(NO3)2 ·6H2O,AR,质量分数≥99.0%,天津市大茂化学试剂厂;三聚氰胺C3N3(NH2)3,AR,质量分数≥99.0%,国药集团化学试剂有限公司,无水乙醇C2H5OH,AR,质量分数≥99.7%,天津市汇杭化工科技有限公司;MCM-41,质量分数≥99.9%,上海阿拉丁生化科技股份有限公司。
1.2 仪器广角XRD(D8 Advance,Bruker)扫描范围为5°~85°,扫描速度为5(°) ·min-1,小角XRD扫描速度为1(°) ·min-1,扫描范围为1°~6°;使用SEM-EDX(Quanta200,Bruker)对样品的形貌及元素组成分布进行分析;使用TEM(TecnaiG2F20,FEI)对催化剂的结构进行观察。使用物理吸附仪(ASAP2020)进行氮气吸脱附分析测试。样品预先在200 ℃脱气8 h,然后在-196 ℃液氮温度下进行测试。TG-MS(Rigaku TG,Omnistar)在流动的空气流中以10 ℃ ·min-1的加热速率从环境温度至800 ℃进行积炭分析。Raman光谱(Nicolet Magna-IR 750)使用532 nm波长的激光测试。
2 实验方法 2.1 催化剂的制备将一定物质的量配比的硝酸镓水合物,硝酸锌水合物和三聚氰胺加入到装有乙醇的烧杯中。例如,n(Ga)∶n(Zn)=1∶1,而三聚氰胺的加入量等于2种金属前驱体的质量之和。将混合物磁力搅拌2 h后,在60 ℃旋转蒸发20 min,除去乙醇溶剂,收集白色固体粉末。随后,将粉末研磨均匀后放入管式炉中,在30 mL ·min-1的氮气流中于700~900 ℃焙烧1 h。升温程序为:以5 ℃ ·min-1的速率从室温升至300 ℃,然后在300 ℃恒温30 min。随后以2 ℃ ·min-1的升温速率升至目标温度,并在此温度下恒温处理1 h。为了除去样品中少量残余的碳氮物种,待样品冷却至室温后,将样品转移到马弗炉中,继续在600 ℃空气中焙烧1 h。冷却至室温后,收集白色固体样品并命名为Ga0.5-Zn0.5-T,其中T代表焙烧温度。负载型GaN-ZnO/MCM-41催化剂(GaN-ZnO理论负载量为10%)的制备与GaN-ZnO固溶体类似。例以GaN-ZnO固溶体n(Ga)∶n(Zn)=1∶1作为活性组分。将0.71 g硝酸镓水合物、0.44 g硝酸锌水合物和1.15 g三聚氰胺加入到装有80 mL乙醇的烧杯中。将混合物在室温下搅拌1 h,加入1.76 g MCM-41载体,继续搅拌1 h。将混合物在60 ℃下旋转蒸发20 min除去溶剂,并收集白色粉末。将收集到的粉末研磨均匀后放入管式炉中,在30 mL ·min-1的氮气流下加热至800 ℃,并恒温1 h。待样品在氮气流中冷却至室温后,将样品取出并转移到马弗炉中,继续在600 ℃空气中焙烧1 h。收集样品命名为Gax-Zn1-x/MCM-41-T,其中x代表镓物种的物质的量含量。
2.2 催化剂性能评价制备的催化剂使用固定床反应器(反应管内径8 mm,长度300 mm)在常压条件下进行评价。反应前需将催化剂粉末压片、造粒,筛分得到40~60目的催化剂颗粒。取0.20 g催化剂与等质量的40~60目石英砂混合均匀后,装填在反应管的恒温区位置。反应器通入21 mL ·min-1氮气流,以10 ℃ min-1的升温速率进行加热。待反应温度升至600 ℃时,恒温0.5 h,将气体总流量为30 mL ·min-1[n(C3H8)∶ n(CO2)∶n(N2)=1∶2∶7]的原料混合气通过催化剂床层。反应产物由在线气相色谱仪GC-920进行分析。色谱TCD检测反应产物中的CO2、N2和CO等气体,而FID主要检测未反应的丙烷以及生成的甲烷、乙烷、乙烯、丙烯产物。丙烷的转化率、丙烯的选择性和收率计算如式(1)~式(3)所示:
| $ C_{\mathrm{C}_3 \mathrm{H}_8}=\frac{F_{\text {in }, \left(\mathrm{C}_3 \mathrm{H}_8\right)}-F_{\text {out }, \left(\mathrm{C}_3 \mathrm{H}_8\right)}}{F_{\text {in }, \left(\mathrm{C}_3 \mathrm{H}_8\right)}} \times 100 \% $ | (1) |
| $ S_{\mathrm{C}_3 \mathrm{H}_6}=\frac{F_{\text {out }, \left(\mathrm{C}_3 \mathrm{H}_6\right)}}{F_{\text {in }, \left(\mathrm{C}_3 \mathrm{H}_8\right)}-F_{\text {out }, \left(\mathrm{C}_3 \mathrm{H}_8\right)}} \times 100 \% $ | (2) |
| $ \begin{gathered} Y_{\mathrm{C}_3 \mathrm{H}_6}=C_{\mathrm{C}_3 \mathrm{H}_8} \times S_{\mathrm{C}_3 \mathrm{H}_6} \times 100 \% \end{gathered} $ | (3) |
式(1)~式(3)中;CC3H8为丙烷转化率;SC3H6为丙烯选择性;YC3H6为丙烯收率;Fin, (C3H8)为原料气中丙烷气体所占的物质的量流量;Fout, (C3H8)和Fout, (C3H6)分别代表出口气体中丙烷和丙烯的物质的量流量。
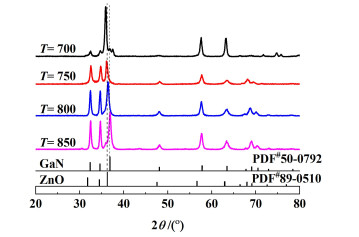
3 结果与讨论 3.1 XRD图 1显示了不同焙烧温度下所获得样品的广角XRD图谱。将图中的峰位分别与六方纤锌矿结构的GaN和ZnO的标准卡片比对。可以发现,当焙烧温度为700 ℃时,获得的样品为结构复杂的混合物。当焙烧温度为750 ℃时,主要产物为ZnO。当焙烧温度为800 ℃时,样品的XRD衍射峰位于GaN和ZnO的特征峰之间(36°~37°),且未检测到GaN和ZnO特征峰,表明形成了GaN-ZnO固溶体结构,而非ZnO和GaN的混合物[21]。当焙烧温度高达850 ℃时,主要产物为GaN。这可能是因为当焙烧温度低于750 ℃时,温度太低无法进行有效氮化,镓锌物种以混合氧化物的形式存在;而850 ℃焙烧时,温度太高导致Zn物种挥发难以形成稳定的固溶体结构;只有当焙烧温度为800 ℃时,才能制备出结构良好的GaN-ZnO固溶体。
|
| 图 1 Ga0.5-Zn0.5-T样品的广角XRD图谱 Fig.1 Wide-angle XRD patterns of Ga0.5-Zn0.5-T |
| |
为了考察在不同焙烧温度下制备的催化剂孔道结构有序性,采用小角XRD对制备的Ga0.5-Zn0.5/MCM-41-T样品进行表征分析,结果如图 2所示。可以看出,所有催化剂样品均表现出明显的二维六方有序介孔结构的MCM-41特征衍射峰[22]。这表明氮化过程中高温焙烧处理并没有破坏MCM-41载体原有孔道的有序性,焙烧后的催化剂仍保持一定的有序介孔结构。此外,随着焙烧温度的升高,样品的(110)和(200)衍射峰逐渐减弱直至几乎消失,同时(100)衍射峰都向高角度发生了一定的偏移。可见,焙烧温度越高,衍射峰的偏移程度也越大。这表明随着焙烧温度的增高,所获得的催化剂孔径逐渐缩小。这是由于高温焙烧导致MCM-41载体孔道收缩所致。

|
| 图 2 Ga0.5-Zn0.5/MCM-41-T的小角XRD图谱 Fig.2 Small-angle XRD patterns of Ga0.5-Zn0.5/MCM-41-T |
| |
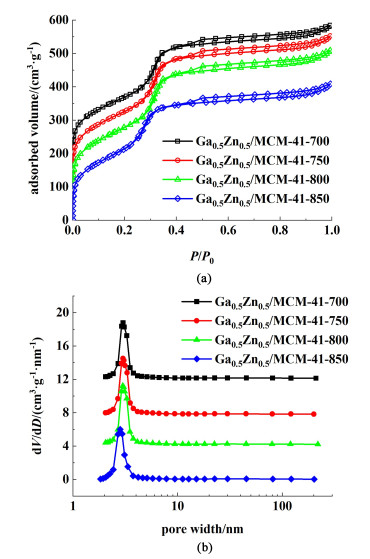
为探究焙烧温度对催化剂孔结构的影响,对制备的Ga0.5-Zn0.5/MCM-41-T样品进行了氮气-物理吸附分析。由图 3(a)可以看出,4种焙烧温度下得到的催化剂样品吸脱附等温曲线均属于典型的IV型,且在中压区出现明显的毛细凝聚现象,表明制备的催化剂具有介孔结构。当焙烧温度为700 ℃时,获得的样品的比表面积和孔体积分别为1 016 m2 ·g-1与0.80×10-3 m3 ·g-1,而当焙烧温度增加到750 ℃时,样品的比表面积和孔体积减小到997 m2 ·g-1与0.78×10-3 m3 ·g-1,当焙烧温度进一步增加到800和850 ℃,样品的比表面积和孔体积分别减小到917 m2 ·g-1与0.70×10-3 m3 ·g-1和864 m2 ·g-1与0.60×10-3 m3 ·g-1。此外,从图 3(b)可以看出,样品的孔径集中在3 nm左右,且随着焙烧温度升高,孔径表现出逐渐减小的趋势,这与XRD分析结果一致。
|
| 图 3 Ga0.5-Zn0.5/MCM-41-T的(a)氮气吸脱附曲线和(b)孔径分布图 Fig.3 (a)N2 adsorption-desorption and (b)pore size distribution of Ga0.5-Zn0.5/MCM-41-T |
| |
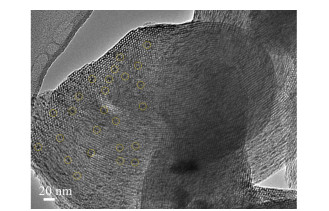
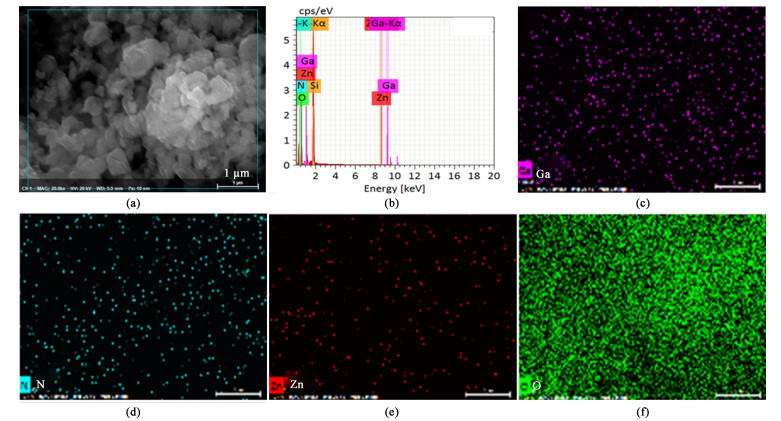
图 4是Ga0.5-Zn0.5/MCM-41-800的TEM图。可以看出,5~10 nm的颗粒均匀分散在催化剂表面,同时载体仍具有规整孔道结构。此外,SEM-EDX表明催化剂只含有5种元素(图 5),且Ga、N、Zn、O元素在催化剂表面分布均匀。这说明GaN-ZnO固溶体颗粒能均匀分散在MCM-41表面。
|
| 图 4 Ga0.5-Zn0.5/MCM-41-800样品的TEM图 Fig.4 TEM image of Ga0.5-Zn0.5/MCM-41-800 |
| |
|
| 图 5 Ga0.5-Zn0.5/MCM-41-800样品的元素分布图 Fig.5 Elemental mapping of Ga0.5-Zn0.5/MCM-41-800 |
| |
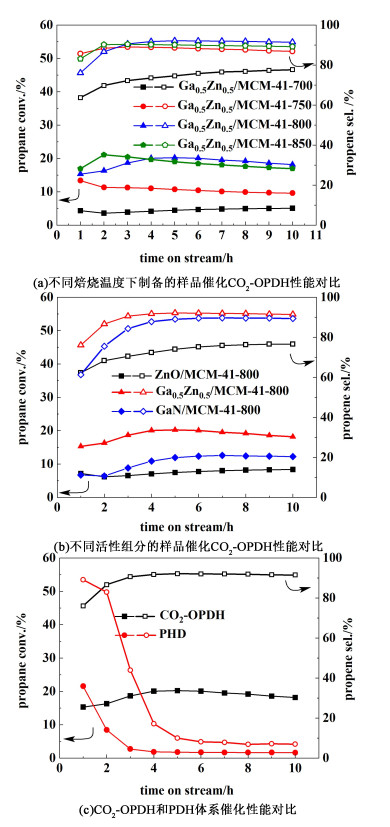
图 6(a)展示了不同焙烧温度下制备的Ga0.5-Zn0.5/MCM-41-T催化CO2-OPDH的性能。可以看出,4组样品的催化性能存在较大差别。样品Ga0.5-Zn0.5/MCM-41-800和Ga0.5-Zn0.5/MCM-41-850催化活性要高于低温焙烧的样品Ga0.5-Zn0.5/MCM-41-700和Ga0.5-Zn0.5/MCM-41-750的催化活性。通过进一步对比可以发现,随着反应进行,所有样品逐渐失活,而Ga0.5-Zn0.5/MCM-41-800催化剂失活相对较慢,稳定性最好。这可能因为800 ℃焙烧获得良好的固溶体结构具有更多的活性位点,且能够有效减少积炭的生成,改善催化剂的稳定性。图 6(b)展示了不同活性组分的Gax-Zn1-x/MCM-41-800样品催化CO2-OPDH反应的性能对比。可见看出,所制备Ga0.5-Zn0.5/MCM-41-800样品具有最好的催化活性和选择性。其在600 ℃时对丙烷的转化率为21%,同时选择性高达92%。显然,相比单独负载的GaN或ZnO组分,MCM-41负载GaN-ZnO固溶体颗粒后,催化剂的性能得到显著提高。这意味着GaN和ZnO组分之间可能形成了高效的协同作用。因此,MCM-41负载GaN-ZnO固溶体有助于改善催化剂的性能。此外,为了研究CO2对丙烷脱氢反应的影响,分别对Ga0.5-Zn0.5/MCM-41-800样品的CO2-OPDH和PDH催化性能进行对比。如图 6(c)所示,PDH反应丙烷的初始转化率为22%,略高于CO2-OPDH反应丙烷的初始转化率。但随着反应的进行,PDH反应丙烷转化率和丙烯选择性均出现大幅下降,且在反应进行到3.5 h左右,催化剂几乎完全失活,而在整个CO2-OPDH反应过程中催化剂相对稳定。由此可看出,CO2在丙烷脱氢制丙烯反应中起着极为重要的作用,能有效改善催化剂的稳定性。
|
| 图 6 不同反应体系催化剂性能对比 Fig.6 Comparisons of catalytic performances of the obtained catalysts for different reaction |
| |
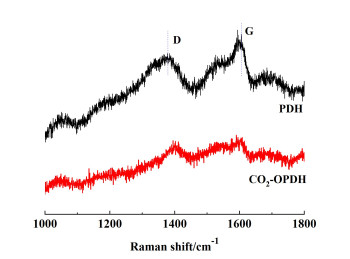
在PDH反应中,积炭被认为是催化剂失活的主要原因之一[23]。通过TG-MS分析了失活催化剂的积炭情况。由图 7可知,反应体系没有CO2时,失活后的催化剂在500 ℃到750 ℃有明显的失重行为,其积炭量约为19%,高于反应体系有CO2参与的情况。此外,没有CO2参与时,失活催化剂的积炭物种需要更高的烧除温度。利用Raman光谱催化剂积炭物种进一步表征,结果如图 8所示,1 350和1 610 cm-1处特征峰分别归属为无定型炭(D带)和石墨化炭(G带)物种,且D带和G带的面积比可以用来判断积炭的石墨化程度。一般而言,该面积比的值越小,石墨化程度越高。相比于在CO2气氛中反应,无CO2条件下催化剂表面的无定型炭和石墨化炭均处于较高水平,且石墨化程度相对更高。这表明CO2能够减少反应体系中积炭量,且相应失活催化剂炭物种更容易烧除。

|
| 图 7 PDH和CO2-OPDH失活催化剂的TG-MS图 Fig.7 TG-MS curves of the used catalysts for PDH and CO2-OPDH |
| |
|
| 图 8 PDH和CO2-OPDH失活催化剂的Raman图 Fig.8 Raman spectra of the used catalysts for PDH and CO2-OPDH |
| |
采用固相氮化法制备出具有双功能活性中心的GaN-ZnO/MCM-41催化剂,并对其催化CO2-OPDH反应性能进行了评价。结果表明,GaN-ZnO固溶体颗粒能够均匀地分散在MCM-41载体表面,且负载的固溶体颗粒具有比单独负载GaN或ZnO更好的催化CO2-OPDH反应性能。这可能是因为固溶体结构有利于活性组分的分散,能够产生更多的活性位点,且GaN和ZnO两相间的协同作用有助于改善催化剂的性能。此外,CO2在反应体系中能够减少积炭的生成,且积炭物种石墨化程度更低,更容易烧除,这对催化剂再生过程有利。GaN-ZnO/MCM-41催化剂的研究对CO2-OPDH催化剂的设计和工业应用具有重要意义。
| [1] |
SATTLER J J H B, RUIZ-MARTINEZ J, SANTILLAN-JIMENEZ E, et al. Catalytic dehydrogenation of light alkanes on metals and metal oxides[J]. Chemical Reviews, 2014, 114(20): 10613-10653. DOI:10.1021/cr5002436 |
| [2] |
ZHOU S, ZHOU Y, SHI J, et al. Synthesis of Ce-doped mesoporous γ-alumina with enhanced catalytic performance for propane dehydrogenation[J]. Journal of Materials Science, 2015, 50(11): 3984-3993. DOI:10.1007/s10853-015-8954-8 |
| [3] |
SONG Y, LIU G, YUAN Z. N-, P- and B-doped mesoporous carbons for direct dehydrogenation of propane[J]. RSC Advances, 2016, 6(97): 94636-94642. DOI:10.1039/C6RA20726J |
| [4] |
LIU L, ZHU Y P, SU M, et al. Metal-free carbonaceous materials as promising heterogeneous catalysts[J]. ChemCatChem, 2015, 7(18): 2765-2787. DOI:10.1002/cctc.201500350 |
| [5] |
LI Z, PETERS A W, BERNALES V, et al. Metal-organic framework supported cobalt catalysts for the oxidative dehydrogenation of propane at low temperature[J]. ACS Central Science, 2017, 3(1): 31-38. DOI:10.1021/acscentsci.6b00290 |
| [6] |
杜凯敏, 范杰. 丙烷氧化脱氢制丙烯研究进展[J]. 化工进展, 2019, 38(6): 2697-2706. DU Kaimin, FAN Jie. Research progress on oxidative dehydrogenation of propane to propene[J]. Chemical Industry and Engineering Progress, 2019, 38(6): 2697-2706. (in Chinese) |
| [7] |
VU B K, SONG M, AHN I Y, et al. Location and structure of coke generated over Pt-Sn/Al2O3 in propane dehydrogenation[J]. Journal of Industrial and Engineering Chemistry, 2011, 17(1): 71-76. DOI:10.1016/j.jiec.2010.10.011 |
| [8] |
ZHANG Y, ZHOU Y, WAN L, et al. Effect of magnesium addition on catalytic performance of PtSnK/γ-Al2O3 catalyst for isobutane dehydrogenation[J]. Fuel Processing Technology, 2011, 92(8): 1632-1638. DOI:10.1016/j.fuproc.2011.04.011 |
| [9] |
ATANGA M A, REZAEI F, JAWAD A, et al. Oxidative dehydrogenation of propane to propylene with carbon dioxide[J]. Applied Catalysis B: Environmental, 2018, 220: 429-445. DOI:10.1016/j.apcatb.2017.08.052 |
| [10] |
KORZYŃSKI M D, DINCǍ M. Oxidative dehydrogenation of propane in the realm of metal-organic frameworks[J]. ACS Central Science, 2017, 3(1): 10-12. DOI:10.1021/acscentsci.7b00013 |
| [11] |
PRAKASH N, LEE M H, YOON S, et al. Role of acid solvent to prepare highly active PtSn/θ-Al2O3 catalysts in dehydrogenation of propane to propylene[J]. Catalysis Today, 2017, 293/294: 33-41. DOI:10.1016/j.cattod.2017.02.027 |
| [12] |
WANG G, ZHU X, LI C. Recent progress in commercial and novel catalysts for catalytic dehydrogenation of light alkanes[J]. The Chemical Record, 2020, 20(6): 604-616. DOI:10.1002/tcr.201900090 |
| [13] |
ZHANG L, WANG Z, SONG J, et al. Facile synthesis of SiO2 supported GaN as an active catalyst for CO2 enhanced dehydrogenation of propane[J]. Journal of CO2 Utilization, 2020, 38: 306-313. DOI:10.1016/j.jcou.2020.02.010 |
| [14] |
CHEN C, HU Z, REN J, et al. ZnO nanoclusters supported on dealuminated zeolite β as a novel catalyst for direct dehydrogenation of propane to propylene[J]. ChemCatChem, 2019, 11(2): 868-877. DOI:10.1002/cctc.201801708 |
| [15] |
ZHAO D, LI Y, HAN S, et al. ZnO nanoparticles encapsulated in nitrogen-doped carbon material and silicalite-1 composites for efficient propane dehydrogenation[J]. iScience, 2019, 13: 269-276. DOI:10.1016/j.isci.2019.02.018 |
| [16] |
WANG G, LI C, SHAN H. Catalytic dehydrogenation of isobutane over a Ga2O3/ZnO interface: Reaction routes and mechanism[J]. Catalysis Science & Technology, 2016, 6(9): 3128-3136. |
| [17] |
MAPA M, SIVARANJANI K, BHANGE D S, et al. Structure, electronic structure, optical, and dehydrogenation catalytic study of (Zn1-zInz)(O1-xNx) solid solution[J]. Chemistry of Materials, 2010, 22(2): 565-578. DOI:10.1021/cm903368r |
| [18] |
MAEDA K, TAKATA T, HARA M, et al. GaN: ZnO solid solution as a photocatalyst for visible-light-driven overall water splitting[J]. Journal of the American Chemical Society, 2005, 127(23): 8286-8287. DOI:10.1021/ja0518777 |
| [19] |
LI J, LIU B, YANG W, et al. Solubility and crystallographic facet tailoring of (GaN)1-x(ZnO)x pseudobinary solid-solution nanostructures as promising photocatalysts[J]. Nanoscale, 2016, 8(6): 3694-3703. DOI:10.1039/C5NR08663A |
| [20] |
TONGYING P, LU Y, HALL L M G, et al. Control of elemental distribution in the nanoscale solid-state reaction that produces (Ga1-xZnx)(N1-xOx) nanocrystals[J]. ACS Nano, 2017, 11(8): 8401-8412. DOI:10.1021/acsnano.7b03891 |
| [21] |
LENG B, ZHANG X, CHEN S, et al. Highly efficient visible-light photocatalytic degradation and antibacterial activity by GaN: ZnO solid solution nanoparticles[J]. Journal of Materials Science & Technology, 2021, 94: 67-76. |
| [22] |
QIN J, LI B, ZHANG W, et al. Synthesis, characterization and catalytic performance of well-ordered mesoporous Ni-MCM-41 with high nickel content[J]. Microporous and Mesoporous Materials, 2015, 208: 181-187. DOI:10.1016/j.micromeso.2015.02.009 |
| [23] |
LIU G, ZENG L, ZHAO Z, et al. Platinum-modified ZnO/Al2O3 for propane dehydrogenation: Minimized platinum usage and improved catalytic stability[J]. ACS Catalysis, 2016, 6(4): 2158-2162. DOI:10.1021/acscatal.5b02878 |
 2023, Vol. 40
2023, Vol. 40





