电催化CO2还原反应(CO2 reduction reaction,CO2RR)生产高附加值化学品和燃料是一种可利用间歇性可再生能源的环境友好技术,对解决当今能源和环境问题具有重要意义[1, 2]。目前有许多研究工作致力于探索开发先进的电催化剂,以获得高能量密度和更高价值的多碳(C2+)碳氢化合物或氧化物。在各种催化剂中,铜基催化剂吸引了广泛的研究兴趣,因为铜具有适中的CO结合能,使CO中间体在解吸之前能够进行深度还原[3, 4]。然而,由于CO2RR制备C2+化合物涉及复杂的多个质子-电子转移还原步骤和C—C偶联反应的缓慢动力学限制,提高催化剂的C2+产物催化性能仍面临诸多挑战[5, 6]。
研究已表明,CO是生成C2+产物的关键C1中间体,其C—C偶联反应是CO2还原为C2+产物关键反应。目前广泛认为铜基催化剂的C—C偶联活性高度依赖于表面形态[7, 8]、尺寸[9, 10]、晶体结构[11]和铜氧化状态[12]。合适的催化剂纳米结构不仅可以增强反应动力学,还可以调节产物选择性[13, 14],通过改变催化剂的表面形貌来构建表面孔隙率被认为是促进C2生成的有效途径之一。目前有较多研究基于在铜基催化剂上构建多孔结构来研究对C2产物性能的影响[15-17],总体而言,具有多孔特征的催化剂上C2产物促进生成通常归因于中间体的富集或中间体保留时间的延长,以及电化学活性表面积(Electrochemical active surface area,ECSA)的显著增加[18, 19]。
本研究通过酸刻蚀实心Cu2O立方体(S-Cu2O)制备多孔结构Cu2O立方体(P-Cu2O)。结合物理化学表征、电化学表征及其催化CO2还原性能,与光滑表面的S-Cu2O相比,研究多孔结构对CO2还原活性和C2产物选择性的影响。本研究将为通过构建表面多孔形貌来设计具有高CO2RR催化活性和选择性的Cu2O基催化剂奠定基础。
1 实验部分 1.1 实验材料五水硫酸铜(CuSO4·5H2O,分析纯,北京百灵威科技有限公司);抗坏血酸钠(SA,分析纯,天津希恩思生化科技有限公司);十二烷基磺酸钠(SDS,分析纯,天津科密欧化学试剂有限公司);盐酸(HCl,分析纯,天津江天化工有限公司);氢氧化钾(KOH,分析纯,上海阿拉丁生化科技有限公司);碳酸氢钾(KHCO3,优级纯,北京百灵威科技有限公司)。H-型电解池配件如质子交换膜(Nafion 212,Dupont)、疏水碳纸等均购自天津英科联合科技有限公司,流动电解池配件如阴离子交换膜(Fumasep, PK130)、镍网、参比电极等购自天津高仕睿联科技有限公司,去离子水(1~3 μS·cm-1)购自天津永清源蒸馏水经营部。
1.2 催化剂制备 1.2.1 S-Cu2O制备[20]采用CuSO4·5H2O、抗坏血酸钠(SA)和SDS分别作为金属前驱体、还原剂和表面活性剂,合成Cu2O实心立方体。具体过程如下:在磁力搅拌下将SDS(2.88 g)溶解在400 mL去离子水中,然后添加5 mL CuSO4溶液(0.1 mol·L-1)。搅拌5 min后,逐滴加入8.5 mL NaOH溶液(1.0 mol·L-1)。混合溶液的颜色迅速变蓝,表明形成了Cu(OH)2。然后在5 min内搅拌并添加85 mL SA溶液(0.2 mol·L-1)。最后,通过离心分离沉淀物,并依次用去离子水和丙酮洗涤3次。所得固体在333 K的真空烘箱中干燥过夜。
1.2.2 P-Cu2O的制备采用酸蚀法,直接向S-Cu2O的母液中加入3.0 mL HCl水溶液(2.0 mol·L-1),制备Cu2O多孔立方体。磁力搅拌下,刻蚀反应持续5 h。然后通过离心分离出棕褐色沉淀,然后依次用去离子水和丙酮洗涤3次。得到的Cu2O多孔立方体在333 K的真空烘箱中干燥过夜。
1.3 电极制备 1.3.1 H-cell所用电极称取3 mg催化剂加入570 μL异乙醇/水混合溶液中(体积比1∶1),滴加30 μL Nafion溶液(质量分数5%),超声30 min使分散均匀,得到催化剂的ink溶液。用移液枪分2次滴加,每次滴加100 μL ink溶液均匀涂覆1.0 cm×1.0 cm的疏水碳纸上,在室温下保持12 h至晾干。
1.3.2 气体扩散电极(Gas diffusion electrode,GDE)将5 mg催化剂加入950 μL异丙醇和水的混合溶液中(体积比1∶1),加入50 μL Nafion溶液,超声30 min分散均匀后,用移液枪滴加到3 cm×1.5 cm的多孔疏水碳纸上,每次滴加100 μL,共滴加900 μL,每次滴加干燥后方可滴加下1滴,催化剂载量为1 mg·cm-2。
1.4 催化剂物理化学和电化学表征采用场发射扫描电子显微镜(SEM,S-4800,日本Hitachi)和透射电子显微镜(TEM,2100F,日本JEOL)对制备的催化剂形貌进行表征,并用X射线能谱分析仪(EDX)进行元素分析。通过X射线衍射仪(XRD,D8-Focus,德国Bruker)对催化剂粉末的晶体结构进行表征。采用X射线光电子能谱(XPS,K-Alpha+,英国Thermo Fisher)对催化剂的元素价态进行分析。
其他电化学表征均通过电化学工作站(Autolab 302N,瑞士万通)进行分析,在进行CO2电解反应前,在H-cell中利用线性伏安扫描(Linear voltammetric scanning, LSV)对2种催化剂的CO2还原活性进行比较。测试电压范围为-0.1~-1.2 V vs. RHE,电解质为N2(体积分数为99.999%)饱和的0.1 mol·L-1 KHCO3溶液中,对上述电极进行循环LSV扫描,待LSV曲线稳定后比较LSV曲线差异。
对于电化学表征所用的H型电解池,以0.1 mol·L-1 KHCO3为电解液,阴阳极室以质子交换膜(Nafion 212)隔开,2室容积分别为120和90 mL,实际填充电解液分别为90和45 mL。对电极为铂片电极,参比电极为饱和氯化钾溶液填充的饱和甘汞电极(SCE),参比电极通过鲁金毛细管与阴极室隔开,涂有催化剂的碳纸作为电极片。
本研究所报道的电位均转化为相对于可逆氢电极(Reversible hydrogen electrode,RHE)的电位,转换公式为:
| $E_{\mathrm{RHE}}=E_{\mathrm{SCE}}+0.241+0.0591 \mathrm{pH}$ | (1) |
| $E_{\mathrm{RHE}}=E_{\mathrm{Ag} / \mathrm{AgCl}}+0.241+0.0591 \mathrm{pH}$ | (2) |
电化学阻抗谱(EIS)的测试频率为100 kHz~0.01 Hz,所测电压为-0.5 V vs. RHE。电化学活性表面积(Electrochemical active surface area,ECSA)通过不同扫速的循环伏安法(Cyclic voltammetry, CV)计算双电层电容(Double-capacitance, Cdl)法评估,对中位电压处电流差值和扫速拟合得到的直线斜率即为Cdl。
1.5 电催化还原CO2性能评价电催化还原CO2性能评价在流动型气体扩散电解池中进行,气体扩散电极-流动型电解池结构如装置示意图如图 1所示。电解液为2.0 mol·L-1 KOH溶液,阴阳极室的暴露面积均为2×0.5 cm2,阳极为泡沫镍电极,阴极为涂有催化剂的疏水性气体扩散碳纸,2者以阴离子交换膜(Fumasep,PK130)隔开,参比电极为饱和氯化钾填充的银/氯化银电极。阴极液通过蠕动泵以1 mL·min-1的速度供给,而阳极部分以气液混流泵以50 mL·min-1的速度将阳极液和产生的氧气一起泵出。在CO2电解过程中,CO2原料气均通过气体流量计控制以20 mL·min-1的速度持续通入电解池中。在-0.6~-1.0 V vs. RHE的电压范围内,每个测试电位间隔0.1 V,电解15 min,用气体采样袋收集气相产物,电解结束后,收集液相产物,用于核磁分析,并记录电流随时间变化曲线。
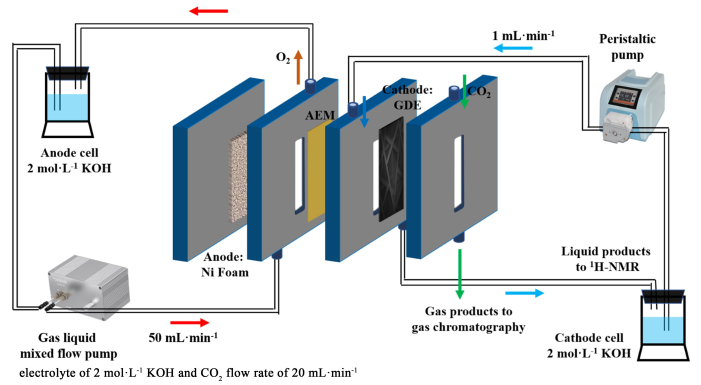
|
| 图 1 配有泡沫镍阳极、阴离子交换膜(AEM)和阴极气体扩散电极(GDE)的流动电解装置图 Fig.1 Diagram of flow reactor equipped with foam nickel anode, anion exchange membrane (AEM) and cathode gas diffusion electrode (GDE) |
| |
将气体采样袋中的气体注入气相色谱(GC-456,德国Bruker)中,通过热导检测器(TCD)和氢火焰监测器(FID)检测,TCD用于检测H2、CO产物,FID检测碳氢化合物。至于液相产物分析,将适量阴极电解液取出与内标物二甲基亚砜和氘代水混合,采用1H液相核磁共振分析,得到液相产物产量。二氧化碳还原气相产物的法拉第效率EF (Faradaic efficiency) 计算公式如式(3)~式(5)。
气相产物:
| $i_x=V_x \cdot q \cdot \frac{Z F P_0}{R T}$ | (3) |
| $E_{\mathrm{F}_x}=\frac{i_x}{i_{\text {total }}} \times 100 \%$ | (4) |
液相产物:
| $E_{\mathrm{F}_x}=\frac{Z n F}{Q} \times 100 \%$ | (5) |
式(3)~式(5)中:x为还原产物(CO,H2,CH4,C2H4,C2H5OH);EFx为还原产物x的法拉第效率;q为电解过程中CO2流速,20 mL·min-1;Z为生成1分子产物转移电子数;F为法拉第常数,96 485.3 C·mol-1;P0为大气压,1.013×105 Pa;T为室温,298.15 K;R为理想气体常数,8.314 J·mol-1·K-1;n为液相产物物质的量,mol;Q为电解过程总电量,C。
2 结果与讨论 2.1 物理化学表征如图 2所示,用扫描电子显微镜(SEM)和透射电子显微镜(TEM)对制备的2种不同形貌的Cu2O样品催化剂进行表征。可以看出S-Cu2O[图 2(a)和图 2 (c)]表面清晰光滑,尺寸分布约为150~180 nm,大小均匀。在母液中直接加入HCl进行刻蚀,S-Cu2O立方体表面覆盖的SDS会阻止盐酸刻蚀,同时SDS的不均匀覆盖,使得暴露出的Cu2O材料优先被刻蚀,因此形成孔洞结构[17, 21]。结合红框内局部放大图可以看到通过弱酸腐蚀条件得到的P-Cu2O表面上呈现出分散的孔洞[图 2(b)和图 2(d)], 同时透射图像中也可以观察到多孔的存在,表明通过酸刻蚀法成功的在实心Cu2O立方体的基础上制备除了表面含有多孔结构的Cu2O立方体。除此之外,P-Cu2O的HRTEM和EDS元素图如图 2(e)~图 2 (f)所示,结果表明Cu2O的结晶度较高,以及清晰对应(111)平面的晶格条纹。EDS图谱显示了Cu和O的均匀分布。形貌表征表明通过酸刻蚀法成功得以S-Cu2O为模板,制备出了表面多孔的Cu2O立方体,以便进一步研究Cu2O基催化剂的多孔结构对电化学催化还原CO2活性和选择性的影响。

|
| 图 2 不同形貌Cu2O的SEM图像和TEM图像(a, c) S-Cu2O;(b, d) P-Cu2O和P-Cu2O的(e) 高分辨TEM图;(f) Cu、O元素能谱图 Fig.2 SEM images and TEM images of as-prepared Cu2O samples, (a, c) S-Cu2O; (b, d) P-Cu2O; (e) HRTEM image and (f) the elemental mapping of Cu, O for P-Cu2O |
| |
为了单独探究表面多孔结构对CO2RR催化性能的影响,有必要确定2种Cu2O催化剂的组成区别。通过XRD和XPS分析了2种形貌Cu2O样品的晶相和成分,如图 3(a)所示,制备的2种催化剂晶面和组成一致,参照标准卡片(PDF#5-0667),位于36.42°、42.30°、61.34°和73.53°出的特征峰分别属于Cu2O的(111)、(200)、(220)和(311)晶面。图 3(b)中的XPS全谱图证实了2种Cu2O催化剂中存在元素Cu和O。具体分析发现,Cu 2p的高分辨率光谱[图 3(c)]在953.5和933.2 eV处的峰分别归属于Cu 2p1/2和Cu 2p3/2轨道,对应于Cu(I)氧化态[20]。由于Cu0和Cu+的结合能接近,很难具体区分价态,因此对Cu LMM Auger谱进行分峰分析,如图 3(d)所示,位于570.0 eV的峰位置表明Cu+的存在,与XRD中Cu2O的特征峰相对应。结合能位于572.9 eV处的Cu2+峰可能是由于催化剂在空气中部分被氧化形成的[20]。综合XRD和XPS结果表明,制备的S-Cu2O和P-Cu2O除了表面形貌的区别,2者组成和结构一致,不会对CO2RR性能差异造成影响。

|
| 图 3 (a) 制备的S-Cu2O和P-Cu2O的XRD谱图; (b) XPS全谱图; (c) Cu 2p谱图; (d) Cu俄歇谱图 Fig.3 (a) XRD patterns of as-prepared Cu2O catalysts; (b) XPS full spectrum; (c) Cu 2p spectrum; (d) Cu LMN Auger spectra for S-Cu2O and P-Cu2 |
| |
在-0.75~1.25 V vs. RHE的电位范围内,对分别涂敷S-Cu2O和P-Cu2O的电极进行CV扫描。通过对比不同电位下电极表面Cu氧化还原变化,分析2种Cu2O电催化剂在不同电压下相和价态的变化。
如图 4所示,CV曲线均在0.39 V(C1)、0.07 V(C2)和-0.33 V(C0)的位置出现3个还原峰,分别对应Cu2+还原为Cu+,Cu+还原为Cu0以及进一步还原为HCuO2-物种;在0.46和0.72 V处出现2个氧化峰,分别归属于Cu0氧化为Cu+,Cu+氧化为Cu2+过程[22],结果表明2种催化剂在相同电压的变化是一致的。

|
| 图 4 S-Cu2O和(b) P-Cu2O在N2饱和的0.1 mol·L-1 KHCO3溶液中的循环伏安曲线(扫速为10 mV·s-1) Fig.4 CV curves of (a) S-Cu2O and (b) P-Cu2O in N2-saturated 0.1 mol·L-1 KHCO3 solution(scan rate=10 mV·s-1) |
| |
利用双层电容法对S-Cu2O和P-Cu2O催化剂的电化学活性表面积进行评估,如图 5(a)~图 5 (b)所示。在-0.20~-0.46 V vs. RHE的电位范围内,分别以20、40、60、80和100 mV·s-1的扫描速率对电极进行循环伏安扫描(CV),同一样品可以得到一系列CV曲线,同时对中点电位(-0.33 V)下的电流密度和扫描速率作图,拟合得到的直线斜率即为对应电极的双层电容值。由于电化学活性表面积(ECSA)与双层电容值成正比,因此可以利用双层电容值来比较和计算不同电极的电化学活性表面积[23]。如图 5(c)所示,S-Cu2O和P-Cu2O3种催化剂的双层电容值分别是0.8和1.4 mF,结果说明酸蚀刻形成的多孔结构具有较大的电化学活性表面积,可以为电化学还原CO2提供较多的反应活性位点,提高其CO2电催化性能[24]。图 5(d)为在-0.5 V vs. RHE下获得的Nyquist阻抗图,测试频率范围为0.01 Hz~100 kHz,图 5(d)中插图为CO2电解过程中的拟合电路,圆弧左侧与X轴的交点为电解池液间阻抗,为25 Ω。圆弧半径的大小代表电极-电解质电荷转移电阻,弧长越短,电荷转移电阻越低,电子转移速率越快。P-Cu2O的阻抗弧比S-Cu2O小,较小的阻抗弧表明界面电荷转移电阻较低,从而确保电化学反应中更快的电子转移[25]。因此由于表面多孔的存在,P-Cu2O的电化学活性表面积更大,界面电荷转移电阻更低,在电化学CO2RR中有可能表现出更高的含碳产物活性和选择性[26]。
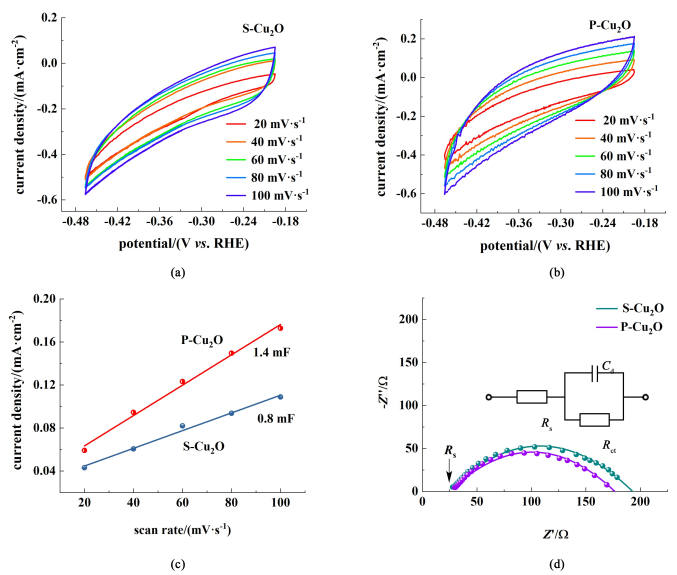
|
| 图 5 (a) S-Cu2O和(b) P-Cu2O在N2饱和的0.1 mol·L-1 KHCO3溶液中的循环伏安曲线, 扫描速率分别为20、40、60、80和100 mV·s-1;(c)双电层电容和(d)电化学阻抗谱的Nyquist曲线, 0.01 Hz~100 kHz Fig.5 CV curves for (a) S-Cu2O and (b) P-Cu2O, scan rates=20, 40, 60, 80 and 100 mV·s-1; (c) double-layer capacitance and (d) Nyquist plot of the impedance of three Cu2O electrodes in N2-saturated 0.1 mol·L-1 KHCO3 solution |
| |
在进行CO2电解之前,为探测2种催化剂对HER和CO2R的活性差异,在N2和CO2饱和的0.1 mol·L-1 KHCO3溶液中,分别对2个电极进行LSV扫描。根据LSV曲线之间的差异对催化剂的CO2RR性能进行初步评价。如图 6(a)所示,S-Cu2O和P-Cu2O催化剂在N2饱和的电解质中LSV曲线重合,表明2者析氢反应(Hydrogen evolution reaction,HER)的活性接近。值得注意的是,CO2饱和条件下的电流密度均大于在N2饱和条件下的电流密度,表明2种催化剂都具有CO2RR活性。此外,在N2和CO2饱和条件下得到的LSV曲线间的电流差值可以用来表示CO2RR部分电流密度,相比于S-Cu2O和P-Cu2O催化剂表现出更高的CO2RR部分电流密度,这表明P-Cu2O具有更高的CO2RR催化活性,可能更有利于C2产物的生成。

|
| 图 6 (a) S-Cu2O和P-Cu2O在N2和CO2饱和的0.1 mol·L-1 KHCO3溶液中的LSV曲线,扫描速率为50 mV·s-1;(b) S-Cu2O和(c) P-Cu2O的CO2电解产物分布,电位范围为-0.1~-1.2 V vs. RHE Fig.6 (a) LSV curves of S-Cu2O and P-Cu2O in 0.1 mol·L-1 KHCO3 solution saturated with N2 and CO2 with 50 mV·s-1, CO2 electrolysis products distribution of (b) S-Cu2O and (c) P-Cu2O, the potential range is -0.1—-1.2 V vs. RHE |
| |
考虑到在H型电解槽中进行CO2电解时,CO2在水相溶液中的溶解度较低(33 mmol·L-1,1.013×105 Pa),CO2传质速率较慢[27]。在气体扩散电极(GDE)上负载催化剂,构建气-液-固三相界面,可以改善CO2传质,促进CO2的还原,除此之外,采用强碱性电解质也有利于抑制HER,促进CO2RR[28]。因此将2种催化剂负载到疏水多孔碳纸上,装载到流动型电解池中,探究表面多孔形貌对电化学还原CO2产物选择性的影响。
以2 mol·L-1 KOH溶液作为电解质,在-0.6~-1.0 V vs. RHE的电位范围内进行电解测试,电位间隔为0.1 V,CO2流速控制在20 mL·min-1。由于电解池体系稳定性的限制,一般测量15 min内的CO2RR性能。CO2RR测试结果如图 6(b)和图 6(c)所示,除竞争性HER外,S-Cu2O和P-Cu2O的CO2还原产物主要有CO,HCOOH,C2H4,C2H5OH。由于HER和CO2R是竞争性关系,从-0.6~-0.9 V vs. RHE,随着施加电势的升高,析氢反应的竞争性减弱,CO2RR选择性提高,表明较高的过电位有利于促进CO2分子的吸附和活化[29]。然而当施加电位升高至-1.0 V vs. RHE时,2种催化剂对H2的选择性都有所提高,这可能是因为H2生成的过电势为0 V vs. RHE, 低于CO2还原过电位,过电位太高,电流密度升高,会明显加快H2的生成[4, 30]。但是值得注意的是,在-0.8~-1.0 V vs. RHE电压范围内的各个电位下,P-Cu2O HER的竞争强度仍然弱于S-Cu2O,这可能由于多孔形貌的存在,可能发挥限域效应,可以促进CO2的利用。
对于HCOOH,在全电压范围内,P-Cu2O也展示出低于S-Cu2O的法拉第效率,这可能是由于P-Cu2O催化剂具有较大的电化学活性表面积,可以提供较多的CO2RR反应活性位点,同时形成较高的局部pH值,从而抑制HER反应的进行,提高对CO的选择性,与文献报道中的结果相一致[31, 32]。
关于CO和C2产物,在较低电位(-0.6~-0.8 V vs. RHE)时,P-Cu2O的CO法拉第效率高于S-Cu2O,这是可能与P-Cu2O的更大的电化学活性表面积有关,增大ECSA有利于促进CO2还原为CO。随着还原电位的升高,S-Cu2O的CO法拉第效率维持在35%~40%之间,且C2的选择性缓慢提高,在最适宜电压-1.0 V vs. RHE下,C2产物的法拉第效率为29.4%(C2H4:17.8%,C2H5OH:11.6%)。而P-Cu2O则展现出不同的催化效果,其CO法拉第效率从37.3%降低到了29.3%,且其对C2产物的选择性明显高于S-Cu2O,在-1.0 V vs. RHE时,C2产物法拉第效率达到37.7%(C2H4:25.6%,C2H5OH:12.1%)。P-Cu2O催化剂展现出明显的CO和C2产物此消彼长的趋势,这表明CO是生成C2产物的关键中间产物。
2.4 催化剂活性分析CO2性能测试结果表明相比于S-Cu2O,P-Cu2O电催化剂对于C2产物的催化选择性较高,因此有必要通过进一步分析2种催化剂的C2产物的活性和选择性差异,来考察表面形貌对CO2催化性能的影响。首先对于关键中间产物*CO,如图 6(b)和图 6(c)所示,在较低的过电位下,P-Cu2O的CO选择性高于S-Cu2O,这是由于多孔特征可以增大ECSA,暴露更多活性位点,从而促进CO的生成[33]。2种催化剂对于目标C2产物的分电流密度如图 7(a)所示,可以看到施加电压高于-0.8 V vs. RHE后,P-Cu2O对C2产物的分电流密度明显高于S-Cu2O, 这可能时因为-0.8 V vs. RHE是克服C—C偶联反应动能的临界点,结果表明P-Cu2O对C2产物的催化活性高于S-Cu2O,其CO法拉第效率在-0.8 V vs. RHE时明显下降[图 6(c)],也表明此电位开始CO耦合加快,因此*CO脱附生成气态CO速率减缓。
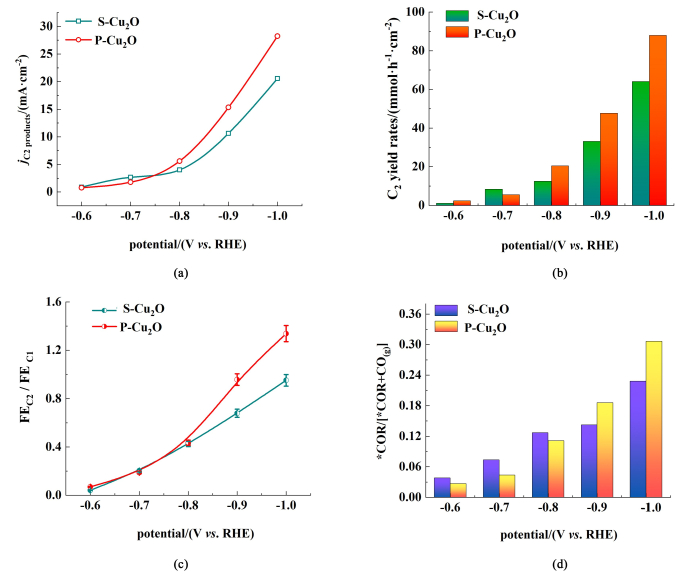
|
| 图 7 S-Cu2O和P-Cu2O的(a)C2产物分电流密度;(b) C2产物生成速率;(c)C2产物与C1产物选择性(即法拉第效率之比) 之比,和(d) *CO深度转化率,电位范围为-0.6~-1.0 V vs. RHE Fig.7 (a) C2 product partial current density; (b) C2 product formation rate; (c) FEs of C2/FEs of C1 ratio; and (d) the estimated *CO deep conversion rates of S-Cu2O and P-Cu2O, potential range is -0.6—-1.0 V vs. RHE |
| |
法拉第效率是从电流效率上面评价催化剂对目标产物选择性的差异,比较实际产物的产生速率也重要的评价指标,结合C2产物分电流密度计算结果如图 7(b)所示,同样地在较高的过电位下,P-Cu2O的生成速率显著高于S-Cu2O,在-1.0 V vs. RHE时,S-Cu2O的C2产物生成速率为64.0 mmol·h-1·cm-1,而P-Cu2O的C2生成速率则达到88.0 mmol·h-1·cm-1,为前者的1.38倍。结果表明P-Cu2O不仅具有较高的C2产物选择性和催化活性,其实际C2产物的生成速率也显著高于S-Cu2O。
在图 7(c)中计算了C2产物和C1产物选择性的比值,计算结果表明在克服动力学能垒-0.8 V vs. RHE之后,具有多孔结构的P-Cu2O的C2/C1的比值明显高于S-Cu2O,这表明多孔结构P-Cu2O能够促进C2产物的生成,而不是CO和HCOOH,这可能是由于相对表面光滑的S-Cu2O,多孔结构的存在能够进一步吸收和限制中间体*CO,促进C—C键的形成。结果表明中间体*CO对于C2产物的生成至关重要,因此有必要进一步分析*CO在不同结构的S-Cu2O和P-Cu2O上的变化趋势来探究多孔结构对C2产物生成的作用。
目前广泛认为在铜基催化剂上CO2分子可初步被还原为HCOOH和*CO,甲酸即为路径末端产物,而另一还原支路上的产物*CO可以作为气体解吸,也可以作为反应物进一步耦合生成多碳产物,因此评估关键中间产物*CO的转化趋势是评价催化剂性能的手段之一。有研究使用CO2RR[CO(g)+*COR]生成的CO转化为CH4、C2H4、C2H5OH(*COR)的比率来评估*CO深度转化率[34]。本研究计算的*CO深度转化率结果如图 7(d)所示,结果表明在-1.0 V vs. RHE时,P-Cu2O的*COR比例为30.0%,显著高于S-Cu2O的比例(21.8%)。这表明P-Cu2O上产生的CO分子由于多孔结构的特征倾向于发生深度还原,而不是作为气体产物解吸。对于S-Cu2O催化剂,由于表面无孔相对光滑,无法提供限域效应,表面产生的*CO不易达到足够的局部浓度从而发生碳碳偶联,因此倾向于作为气体产物解吸。值得注意的是,在较低过电位下(-0.6~-0.8 V vs. RHE), S-Cu2O的*CO转化率高于P-Cu2O,本研究认为是发生C—C偶联需要克服一定的能垒,在较低过电位下2种催化剂首先将CO2还原为CO,具有更大ECSA的P-Cu2O *CO选择性高于S-Cu2O,但是由于动力学能垒限制,*CO无法充分耦合,2者均只能生成少量的C2产物,此时公式中CO(g)占比远远高于深度还原产物(*COR),因此结果显示为在较低过电位下P-Cu2O的*CO转化率反而低于S-Cu2O,可以看到在-0.8 V vs. RHE以后,P-Cu2O的*CO深度转化率才高于S-Cu2O,这与图 7(a)中P-Cu2O的C2分电流密度在-0.8 V vs. RHE以后才显著高于S-Cu2O的结果相对应。
综合CO2电解测试结果以及对*CO和C2产物的催化活性分析,本研究认为是P-Cu2O的多孔特性导致了*CO深度转化率之间的差异,目前有许多研究认为多孔结构在促进*CO的吸附,进而深度还原(C—C耦合或氢化)方面起着至关重要的作用[35]。结合这一观点可以得结论,P-Cu2O上C2产选择性的提高可能归因于2点:多孔结构可以增大ECSA,为CO生成提供更多的活性位点,以及表面多孔结构可以促进中间体*CO的富集,促进C—C偶联反应,因此P-Cu2O *CO中间体的转化率更高。
2.5 稳定性测试P-Cu2O电催化剂的催化性能优于S-Cu2O,因此对P-Cu2O在最适宜电压-1.0 V vs. RHE下进行了稳定性测试,将电解时间延长到30 min,图 8(a)中结果表明i-t曲线总体保持平衡,其中H2的法拉第效率略微增加,C2产物的法拉第效率略有下降,但总体上各产物法拉第效率维持相对稳定,表明P-Cu2O在GDE中具有较好的稳定性。反应后催化剂样品SEM图如8(b)所示,可以看到催化剂形貌被部分损坏,多孔结构被破坏,孔结构存留较少,这可能是由于在较大的电流密度下,催化剂形貌发生演变,且在电解过程中Cu2O材料可能也会受到强碱性电解质的腐蚀。反应后负载到碳纸上P-Cu2O的XRD以及XPS表征如图 9所示,从图 9(a)中可以看到,电解过后催化剂表面出现金属态的铜,归属于Cu2O的特征峰强度降低,这是由于在CO2还原过程中采用负电位,Cu2O被部分还原为Cu0。从XPS全谱图[图 9(b)] 中可以看到Cu、O元素的存在,其中F元素的特征峰是制备ink溶液时所用的Nafion黏结剂,但是F元素的存在不会影响对Cu的分析。图 9(c)为Cu 2p的高分辨率光谱,在953.5和933.2 eV处的峰分别归属于Cu 2p1/2和Cu 2p3/2轨道,对应于Cu(I)氧化态[20]。对Cu的俄歇谱进行分峰分析,结果表明也表明Cu+和Cu0共存状态,其中位于572.9 eV处Cu2+特征峰可能是暴露在空气中部分氧化造成的。综合XRD以及XPS结果表明,Cu2O催化剂在CO2还原过程中会被部分还原为Cu0,形成Cu+/Cu0混合价态,有研究也报道了这一现象,同时混合价态也有利于C2产物的生成[36, 37]。综上所述,Cu2O催化剂受到强碱性电解质和大电流密度影响,形貌被部分破坏,同时在负电位下普遍存在部分还原现象,在之后的研究中,将针对这一现象,设计具有高稳定性、高活性和高选择性的铜基催化剂。随着时间的延长,电解体系会出现溢流和碳酸盐积聚的现象[38],GDE中多孔碳层孔道被占据,从而导致CO2RR活性和选择性降低,这一问题也限制着流动型电解池进一步推向工业化应用。
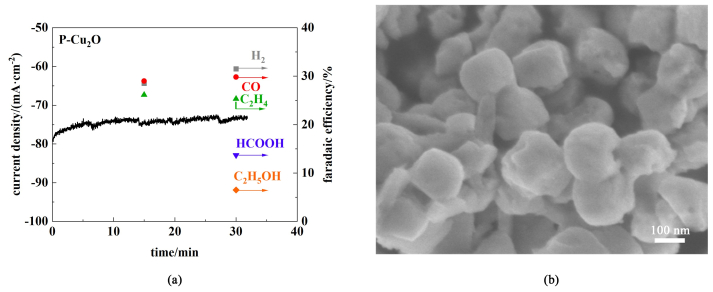
|
| 图 8 (a) P-Cu2O在-1.0 V vs. RHE,2.0 mol·L-1 KOH中30 min的电解i-t曲线以及产物分布; (b)电解30 min后P-Cu2O的SEM图像 Fig.8 (a) Electrolysis i-t curve and products distribution of P-Cu2O in -1.0 V vs. RHE and 2.0 mol·L-1 KOH for 30 min; (b) SEM image of P-Cu2O after 30 min electrolysis |
| |

|
| 图 9 P-Cu2O在-1.0 V vs. RHE,2.0 mol·L-1 KOH中30 min电解后的(a)XRD谱图;(b)XPS全谱图;(c)Cu 2p谱图以及(d)Cu俄歇谱图 Fig.9 (a) XRD pattern; (b) XPS full spectrum; (c) Cu 2p spectra and (d) Cu Auger spectra of P-Cu2O after 30 min electrolysis in -1.0 V vs. RHE, 2.0 mol·L-1 KOH |
| |
本研究以表面光滑的实心Cu2O立方体(S-Cu2O)为模板,通过酸刻蚀法进一步制备了表面多孔结构的Cu2O立方体(P-Cu2O)。物理表征和电化学表征结果表明,2者组成和结构一致,酸刻蚀法显著增大了P-Cu2O的电化学活性表面积,降低了界面电荷转移电阻,可能具有更高的CO2催化活性。电化学性能测试表明P-Cu2O的C2产物选择性由于S-Cu2O,在-1.0 V vs. RHE,电流密度为75 mA·cm-2时,P-Cu2O C2产物的法拉第效率高达37.7%(C2H4:25.6%,C2H5OH:12.1%)显著高于S-Cu2O (C2:29.4%,C2H4:17.8%,C2H5OH:11.6%)。除此之外,P-Cu2O还展现出更高的C2产物产生速率。且P-Cu2O的*CO的深度转化率接近30.0%,为S-Cu2O的1.38倍,表明具有多孔结构的P-Cu2O的*CO深度利用更高。结合以上研究,本研究将P-Cu2O更高的C2产物选择性归因于2个方面,首先表面多孔结构可以通过增大比表面积促进*CO生成,其次表面多孔结构还可以促进中间体*CO的富集,促进C—C偶联,提高深度转化率。本研究为通过构建表面多孔结构来促进中间体*CO深度转化从而增强C—C偶联制备C2产物提供了借鉴。
| [1] |
RUIZ-LÓPEZ E, GANDARA-LOE J, BAENA-MORENO F, et al. Electrocatalytic CO2 conversion to C2 products: Catalysts design, market perspectives and techno-economic aspects[J]. Renewable and Sustainable Energy Reviews, 2022, 161: 112329-112355. DOI:10.1016/j.rser.2022.112329 |
| [2] |
刘丹, 马哲, 刘梦晓, 等. CO2的电驱动还原[J]. 化学工业与工程, 2021, 38(5): 1-12. LIU Dan, MA Zhe, LIU Mengxiao, et al. Electricity-driven CO2 reduction[J]. Chemical Industry and Engineering, 2021, 38(5): 1-12. (in Chinese) |
| [3] |
ZHONG Y, WANG S, LI M, et al. Rational design of copper-based electrocatalysts and electrochemical systems for CO2 reduction: From active sites engineering to mass transfer dynamics[J]. Materials Today Physics, 2021, 18: 100354-100381. DOI:10.1016/j.mtphys.2021.100354 |
| [4] |
YE W, GUO X, MA T. A review on electrochemical synthesized copper-based catalysts for electrochemical reduction of CO2 to C2+products[J]. Chemical Engineering Journal, 2021, 414: 128825-128841. DOI:10.1016/j.cej.2021.128825 |
| [5] |
MA W, XIE S, LIU T, et al. Electrocatalytic reduction of CO2 to ethylene and ethanol through hydrogen-assisted C—C coupling over fluorine-modified copper[J]. Nature Catalysis, 2020, 3(6): 478-487. DOI:10.1038/s41929-020-0450-0 |
| [6] |
ZHENG Y, VASILEFF A, ZHOU X L, et al. Understanding the roadmap for electrochemical reduction of CO2 to multi-carbon oxygenates and hydrocarbons on copper-based catalysts[J]. Journal of the American Chemical Society, 2019, 141(19): 7646-7659. DOI:10.1021/jacs.9b02124 |
| [7] |
XIAO C, ZHANG J. Architectural design for enhanced C2 product selectivity in electrochemical CO2 reduction using Cu-based catalysts: A review[J]. ACS Nano, 2021, 15(5): 7975-8000. DOI:10.1021/acsnano.0c10697 |
| [8] |
WANG Y, ZHU Y, NIU C. Surface and length effects for aqueous electrochemical reduction of CO2 as studied over copper nanowire arrays[J]. Journal of Physics and Chemistry of Solids, 2020, 144: 109507-109513. DOI:10.1016/j.jpcs.2020.109507 |
| [9] |
JUNG H, LEE S, LEE C, et al. Electrochemical fragmentation of Cu2O nanoparticles enhancing selective C—C coupling from CO2 reduction reaction[J]. Journal of the American Chemical Society, 2019, 141(11): 4624-4633. DOI:10.1021/jacs.8b11237 |
| [10] |
CHEN Y, FAN Z, WANG J, et al. Ethylene selectivity in electrocatalytic CO2 reduction on Cu nanomaterials: A crystal phase-dependent study[J]. Journal of the American Chemical Society, 2020, 142(29): 12760-12766. DOI:10.1021/jacs.0c04981 |
| [11] |
FAN M, GARBARINO S, TAVARES A C, et al. Progress in the electrochemical reduction of CO2 on hierarchical dendritic metal electrodes[J]. Current Opinion in Electrochemistry, 2020, 23: 145-153. DOI:10.1016/j.coelec.2020.05.013 |
| [12] |
CHOU T, CHANG C, YU H, et al. Controlling the oxidation state of the Cu electrode and reaction intermediates for electrochemical CO2 reduction to ethylene[J]. Journal of the American Chemical Society, 2020, 142(6): 2857-2867. DOI:10.1021/jacs.9b11126 |
| [13] |
DUTTA A, RAHAMAN M, LUEDI N C, et al. Morphology matters: Tuning the product distribution of CO2 electroreduction on oxide-derived Cu foam catalysts[J]. ACS Catalysis, 2016, 6(6): 3804-3814. DOI:10.1021/acscatal.6b00770 |
| [14] |
RASHID N, BHAT M A, INGOLE P P. Dendritic copper microstructured electrodeposits for efficient and selective electrochemical reduction of carbon dioxide into C1 and C2 hydrocarbons[J]. Journal of CO2 Utilization, 2020, 38: 385-397. DOI:10.1016/j.jcou.2020.02.017 |
| [15] |
LV J, JOUNY M, LUC W, et al. A highly porous copper electrocatalyst for carbon dioxide reduction[J]. Advanced Materials, 2018, 30(49): 1803111-1803119. DOI:10.1002/adma.201803111 |
| [16] |
YANG K, KO W R, LEE J H, et al. Morphology-directed selective production of ethylene or ethane from CO2 on a Cu mesopore electrode[J]. Angewandte Chemie (International Ed in English), 2017, 56(3): 796-800. DOI:10.1002/anie.201610432 |
| [17] |
ZHUANG T, PANG Y, LIANG Z, et al. Copper nanocavities confine intermediates for efficient electrosynthesis of C3 alcohol fuels from carbon monoxide[J]. Nature Catalysis, 2018, 1(12): 946-951. DOI:10.1038/s41929-018-0168-4 |
| [18] |
YU Z, WU S, CHEN L, et al. Promoting the electrocatalytic reduction of CO2 on ultrathin porous bismuth nanosheets with tunable surface-active sites and local pH environments[J]. ACS Applied Materials & Interfaces, 2022, 14(8): 10648-10655. |
| [19] |
GIRI S D, MAHAJANI S M, SURESH A K, et al. Electrochemical reduction of CO2 on activated copper: Influence of surface area[J]. Materials Research Bulletin, 2020, 123: 110702-110710. DOI:10.1016/j.materresbull.2019.110702 |
| [20] |
CAO X, CAO G, LI M, et al. Enhanced ethylene formation from carbon dioxide reduction through sequential catalysis on Au decorated cubic Cu2O electrocatalyst[J]. European Journal of Inorganic Chemistry, 2021, 2021(24): 2353-2364. DOI:10.1002/ejic.202100229 |
| [21] |
TSAI Y H, CHIU C Y, HUANG M. Fabrication of diverse Cu2O nanoframes through face-selective etching[J]. The Journal of Physical Chemistry C, 2013, 117(46): 24611-24617. DOI:10.1021/jp4088018 |
| [22] |
LI Q, LI M, ZHANG S, et al. Tuning Sn-Cu catalysis for electrochemical reduction of CO2 on partially reduced oxides SnOx-CuOx-modified Cu electrodes[J]. Catalysts, 2019, 9(5): 476-489. DOI:10.3390/catal9050476 |
| [23] |
LI Z, YADAV R M, SUN L, et al. CuO/ZnO/C electrocatalysts for CO2-to-C2+ products conversion with high yield: On the effect of geometric structure and composition[J]. Applied Catalysis A: General, 2020, 606: 117829-117836. DOI:10.1016/j.apcata.2020.117829 |
| [24] |
WU M, ZHU C, WANG K, et al. Promotion of CO2 electrochemical reduction via Cu nanodendrites[J]. ACS Applied Materials & Interfaces, 2020, 12(10): 11562-11569. |
| [25] |
ALTAF N, LIANG S Y, HUANG L, et al. Electro-derived Cu-Cu2O nanocluster from LDH for stable and selective C2 hydrocarbons production from CO2 electrochemical reduction[J]. Journal of Energy Chemistry, 2020, 48: 169-180. DOI:10.1016/j.jechem.2019.12.013 |
| [26] |
BO J, LI M, ZHU X, et al. Bamboo-like N-doped carbon nanotubes encapsulating M(Co, Fe)-Ni alloy for electrochemical production of syngas with potential-independent CO/H2 ratios[J]. Frontiers of Chemical Science and Engineering, 2022, 16(4): 498-510. DOI:10.1007/s11705-021-2082-6 |
| [27] |
ZHANG J, LUO W, ZVTTEL A. Crossover of liquid products from electrochemical CO2 reduction through gas diffusion electrode and anion exchange membrane[J]. Journal of Catalysis, 2020, 385: 140-145. DOI:10.1016/j.jcat.2020.03.013 |
| [28] |
RABIEE H, GE L, ZHANG X, et al. Gas diffusion electrodes (GDEs) for electrochemical reduction of carbon dioxide, carbon monoxide, and dinitrogen to value-added products: A review[J]. Energy & Environmental Science, 2021, 14(4): 1959-2008. |
| [29] |
TOMBOC G M, CHOI S, KWON T, et al. Potential link between Cu surface and selective CO2 electroreduction: Perspective on future electrocatalyst designs[J]. Advanced Materials (Deerfield Beach, Fla), 2020, 32(17): 190398-190422. |
| [30] |
NITOPI S, BERTHEUSSEN E, SCOTT S B, et al. Progress and perspectives of electrochemical CO2 reduction on copper in aqueous electrolyte[J]. Chemical Reviews, 2019, 119(12): 7610-7672. DOI:10.1021/acs.chemrev.8b00705 |
| [31] |
WANG M, ZHANG S, LI M, et al. Facile synthesis of hierarchical flower-like Ag/Cu2O and Au/Cu2O nanostructures and enhanced catalytic performance in electrochemical reduction of CO2[J]. Frontiers of Chemical Science and Engineering, 2020, 14(5): 813-823. DOI:10.1007/s11705-019-1854-8 |
| [32] |
GUO W, SHIM K, ODONGO NGOME F O, et al. Highly active coral-like porous silver for electrochemical reduction of CO2 to CO[J]. Journal of CO2 Utilization, 2020, 41: 101242-101250. DOI:10.1016/j.jcou.2020.101242 |
| [33] |
韩真真, 王华, 王静, 等. 多孔锡电极的制备及其用于CO2电化学还原性能[J]. 化学工业与工程, 2016, 33(5): 8-13. HAN Zhenzhen, WANG Hua, WANG Jing, et al. Fabrication of porous tin and its application to electroreduction of CO2[J]. Chemical Industry and Engineering, 2016, 33(5): 8-13. (in Chinese) |
| [34] |
JIANG K, HUANG Y, ZENG G, et al. Effects of surface roughness on the electrochemical reduction of CO2 over Cu[J]. ACS Energy Letters, 2020, 5(4): 1206-1214. DOI:10.1021/acsenergylett.0c00482 |
| [35] |
LIU B, CAI C, YANG B, et al. Intermediate enrichment effect of porous Cu catalyst for CO2 electroreduction to C2 fuels[J]. Electrochimica Acta, 2021, 388: 138552-138559. DOI:10.1016/j.electacta.2021.138552 |
| [36] |
YANG P, ZHANG X, GAO F, et al. Protecting copper oxidation state via intermediate confinement for selective CO2 electroreduction to C2+ fuels[J]. Journal of the American Chemical Society, 2020, 142(13): 6400-6408. DOI:10.1021/jacs.0c01699 |
| [37] |
LYU Z, ZHU S, XIE M, et al. Controlling the surface oxidation of Cu nanowires improves their catalytic selectivity and stability toward C2+ products in CO2 reduction[J]. Angewandte Chemie (International Ed in English), 2021, 60(4): 1909-1915. DOI:10.1002/anie.202011956 |
| [38] |
WEEKES D M, SALVATORE D A, REYES A, et al. Electrolytic CO2 Reduction in a flow cell[J]. Accounts of Chemical Research, 2018, 51(4): 910-918. DOI:10.1021/acs.accounts.8b00010 |
 2023, Vol. 40
2023, Vol. 40





