随着工业化进程的不断深化,水污染问题日益突出,并受到广泛关注[1, 2]。典型的工业废水包括两大类,一类是含铬(Cr)、镉(Cd)、镍(Ni)和钴(Co)等有毒金属离子污染物废水;另一类是精细化工废水,主要是含各种芳烃类有机污染物废水。重金属离子是一种无法自然降解且人体无法代谢的污染物,对生态环境系统和人类健康产生严重的危害[3]。目前,常用处理金属离子污染物的方法有物理法、化学法和生物法3大类[4-6]。其中,属于物理法的吸附法由于具有高效、经济、绿色环保等优点,被广泛应用于处理重金属污染废水[7]。该方法通过吸附剂和重金属离子间的相互作用,把重金属离子富集到吸附剂上以达到从水体中去除重金属离子的目的[8]。
除金属离子污染物外,排放废水中的酚类等有机污染物也难以自然降解,严重危害人体健康[9, 10]。研究人员一直在探索通过吸附、生物降解、膜分离、高级氧化工艺(AOPs)等方法彻底去除这些有机污染物[11-14]。近年来,基于过氧单硫酸盐(PMS)的AOPs由于其生成的活性氧(ROS)的强氧化能力而受到广泛关注[15, 16]。经PMS活化后产生的ROS可在较宽的pH值范围内高效矿化多种有机污染物,且产生的二次污染少[17]。PMS可以通过多种方法激活,包括热处理、微波、紫外线照射、超声或过渡金属催化等[18, 19]。各种过渡金属,包括Fe、Co、Cu、Ni、Mn及其氧化物都能够激活PMS产生ROS[20]。其中,Co3+/Co2+具有较高的氧化还原电势(E0=1.92 V),因此Co基催化剂被认为是激活PMS最有效的催化剂之一[21]。然而传统的非均相Co基催化剂和Co氧化物催化剂存在严重的二次污染问题[22]。研究发现,将Co分散负载在碳材料上,可以暴露更多的活性位点,在提高催化活性的同时,可以减少Co金属浸出的二次污染问题[23]。钴修饰的碳纳米复合材料是近些年AOP催化材料研究热点之一。
“以废治废”是指通过利用废弃物来治理污染问题的方法。这种方法不仅可以解决环境污染问题,而且可以使废弃物得到充分利用,具有很高的经济和环境效益[24]。研究表明,含某些金属元素的水处理固废物,通过元素提取可制备成高附加值催化剂应用在多种催化领域[25]。
在本研究使用改性的羧甲基壳聚糖气凝胶作为吸附剂吸附含钴离子的废水,并对其吸附性能进行测试和评价。然后对吸附钴离子后的吸附剂进行改性和煅烧,得到Co纳米颗粒负载的碳催化剂,并对催化剂的组成、结构、形貌进行表征分析。将催化剂应用于活化PMS降解双酚A(BPA)的高级氧化反应中,并对其催化性能进行测试和评价。
1 实验部分 1.1 实验材料羧甲基壳聚糖(CMCS)、戊二醛(C5H8O2,质量分数为25%),乙醇(AR),六水合氯化钴(CoCl2·6H2O),氢氧化钠(NaOH),盐酸(HCl),双酚A(BPA),三聚氰胺Melamin(e),过氧单硫酸钾(2KHSO5·3KHSO4·K2SO4)等购自上海阿拉丁有限公司;腐殖酸(HA)Nafion溶液(1100W,质量分数为5%)购自上海西格玛有限公司;甲醇(MeOH),叔丁醇(TBA),L-组氨酸(L-His),对苯醌(p-BQ),阿特拉津(ATZ),苯酚(Phenol)二甲基亚砜(DMSO)等,色谱纯,购自天津元立化工有限公司。
1.2 羧甲基壳聚糖气凝胶吸附剂的制备将2 g羧甲基壳聚糖溶解在100 mL去离子水中,常温下搅拌1 h得到羧甲基壳聚糖溶液;然后向在高速搅拌的上述溶液中加入1 mL 25%的戊二醛溶液,继续搅拌5 min后静置交联固化4 h;将制备好的水凝胶,用乙醇和水洗涤抽滤3遍除去残留的戊二醛;最后,将制备的水凝胶放入冰箱冷冻处理12 h后,在冻干机中完全除去水分,得到白色蓬松气凝胶。
1.3 吸附剂性能测试通过净化模拟Co2+废水,对羧甲基壳聚糖气凝胶吸附剂的吸附性能进行了评价。将0.202 g六水合氯化钴(CoCl2·6H2O)溶解在1 L去离子水中,得到离子浓度为50 mg·L-1的模拟Co2+废水。首先,在模拟Co2+废水中加入一定量的羧甲基壳聚糖气凝胶吸附剂(0、250、500、1 000、1 500和2 000 mg)。然后用0.1 mol·L-1 HCl或NaOH将溶液pH值调至一定值(4、5、6、7、8、9、10和11),搅拌6 h,静置6 h得到静置底物。提取5 mL上清液收集待测。采用原子吸收光谱仪测定待测溶液中Co2+残留浓度。此外,通过净化模拟Fe3+、Cu2+和Ni2+废水,对CMCS气凝胶吸附剂对多种金属离子吸附性能进行了评价。将一定量的六水合氯化铁(FeCl3·6H2O)、二水合氯化铜(CuCl2·2H2O)和六水合氯化镍(NiCl2·6H2O)溶解在100 mL去离子水中,分别配制离子浓度为50 mg·L-1的模拟Fe3+、Cu2+和Ni2+废水。首先,在模拟Co2+、Fe3+、Cu2+和Ni2+废水中各加入100 mg的CMCS气凝胶吸附剂。然后用0.1 mol·L-1 HCl或NaOH将溶液pH值调至6,搅拌6 h,静置6 h。提取5 mL上清液收集待测。采用原子吸收光谱仪测定待测溶液中Co2+、Fe3+、Cu2+和Ni2+残留浓度。
1.4 催化剂的制备将上述得到的静置底物放入冰箱冷冻处理12 h后,在冻干机中完全去除水分,得到粉色蓬松粉末即吸附钴离子的吸附剂。然后,将得到的吸附钴离子的吸附剂与三聚氰胺(质量比为1∶2)混合研磨。之后,得到的混合粉末在N2气氛下,在一定温度煅烧(700、800和900 ℃),升温速率为5 ℃·min-1,煅烧2 h。将得到的黑色固体粉末样品Co@NC-700、Co@NC-800和Co@NC-900。不吸附Co2+,采用相同方法在800 ℃煅烧制备NC样品。在不添加三聚氰胺的情况下,对照样品按照相同的制备方法在800 ℃煅烧,命名为Co@C。将30 mg Co@NC-800置于200 mL 1 mol·L-1的H2SO4溶液中80 ℃搅拌24 h以除去Co@NC-800中的钴纳米颗粒。对酸洗后的溶液进行抽滤,去离子水洗涤3次,60 ℃鼓风烘干得到Co@NC-800(acid-washed)。
1.5 催化性能测试通过活化过氧单硫酸钾(PMS)降解双酚A(BPA)对样品的催化性能进行了评价。所有实验均在100 mL螺口瓶中进行。通常,使用初始浓度为20 mg·L-1的100 mL BPA。将样品10 mg加入BPA溶液中,超声均匀分散5 min。然后,加入50 mg PMS启动氧化降解过程,在室温下以300 r·min-1的速度搅拌反应溶液。每隔一定时间,提取0.5 mL溶液,与0.5 mL甲醇混合。溶液样品立即用0.22 μm微孔注射器过滤器过滤去除固体颗粒。采用高效液相色谱法(Agilent,U3000,XDB-C18色谱柱)测定BPA残留浓度。流动相为30%水和70%甲醇的混合液,流速为1 mL·min-1。对于中毒实验,在加入PMS之前,在溶液中加入一定量的硫氰化钾(KSCN)溶液。对于淬灭实验,在加入PMS之前,在溶液中加入一定量甲醇(MeOH)、T-丁醇(TBA)、L-组氨酸(L-His)、对苯醌(p-BQ)和二甲基亚砜(DMSO)。对于循环稳定性实验,每轮降解实验结束后将反应溶液迅速过滤并用乙醇和去离子水各洗涤2次,得到的样品在60 ℃鼓风干燥箱中干燥4 h,以备下次使用。
反应速率常数由下式得到:
| $\ln \left(\frac{C}{C_0}\right)=-k t$ | (1) |
式(1)中: C为不同时刻BPA的浓度;C0为初始浓度;k为准一阶反应速率常数。
1.6 电化学测试在CHI760E电化学工作站上,采用三电极系统进行电化学测量。将5 mg催化剂溶于475 μL乙醇和475 μL水中。在混合溶液中加入50 μL Nafion溶液,超声30 min后,将5 μL混合溶液滴于GCE表面。负载催化剂的GCE、Ag/AgCl和Pt电极分别作为工作电极、参比电极和对电极。将PMS和BPA依次加入溶液中,监测开路电位(OCP)的变化。BPA和PMS的最终浓度分别为20 mg·L-1和1 g·L-1。
1.7 催化剂表征利用原子吸收分光光度计(AAS,Persee TAS-990)测试了吸附性能和溶液中钴离子的浸出;利用扫描电子显微镜(SEM,Hitachi S-4800)观察样品的形貌;利用透射电子显微镜(TEM,JEOL JEM-2100F)观察样品形貌和元素分布;利用高角度环形暗场扫描透射电子显微镜(HAADF-STEM,JEM-ARM200F)观察原子状态;利用比表面积测试仪(BET,BJBulider SSA-7000)测试样品的比表面积;利用高分辨率的X射线衍射仪(XRD,Bruker-Nonius D8 Focus)进行了样品晶型结构分析;利用拉曼光谱(Renishaw in Via reflex,633 nm laser)研究了样品的缺陷程度;利用X射线光电子能谱(XPS,Thermo hermo ESCALAB 250XI)表征了样品化学成键结构。
2 结果与讨论 2.1 吸附剂的吸附性能及表征利用离子浓度为50 mg·L-1的Co2+溶液作为模拟金属离子废水对制备的羧甲基壳聚糖(CMCS)气凝胶吸附剂吸附性能进行了测试。将溶液pH值控制在6,通过改变羧甲基壳聚糖气凝胶吸附剂投加量,考察了吸附剂投加量对吸附效果的影响。如图 1(a)所示,Co2+的去除效果随着吸附剂投加量的增加而增加,当吸附剂投加量为1 000 mg·L-1时Co2+的去除率能达到99.3%。随着吸附剂投加量进一步添加到2 000 mg·L-1时Co2+的去除率能达到99.6%。从成本角度考虑,选择吸附剂投加量为1 000 mg·L-1为适宜投入量。接着在吸附剂投加量为1 000 mg·L-1的情况下,通过改变溶液值,考察了pH值对吸附效果的影响。如图 1(b)所示,当溶液pH值从4增加到6过程中,羧甲基壳聚糖气凝胶对于Co2+的去除率随着pH值的增大而增大。这是因为CMCS气凝胶吸附剂表面的氨基、羟基和羧基等活性官能团对Co2+进行螯合配位,吸附剂静置沉降实现Co2+的去除[8]。当pH值低时,吸附剂表面氨基质子化为NH3+,并且酸性使羧基电离平衡左移导致表面COO-基团数目也相对减少,导致对Co2+吸附效果变差[26]。随着pH值的升高,表面的氨基也逐渐脱离质子化,电离平衡右移使得表面COO-基团数目也相对增加,表面氨基和COO-基团的增加促进了对Co2+吸附。但是,pH值进一步增大到11的过程中,吸附剂对于Co2+的去除率随着pH值的增大而轻微减少。这可能是因为碱性条件下生成氢氧化钴,与气凝胶作用弱,导致的吸附效果变差[8]。上述结果表明,制备的羧甲基壳聚糖气凝胶是一种具有对Co2+良好吸附性能的吸附剂,且吸附剂投加量和溶液pH值在很大程度上影响吸附剂对于Co2+的吸附效果。综合考虑Co2+去除效果和经济成本,选取吸附剂投加量为1 000 mg·L-1、溶液pH值为6作为吸附实验条件用于之后的测试。在此条件下处理离子浓度为50 mg·L-1的Co2+废水后的溶液中Co2+浓度为0.35 mg·L-1,低于国家工业污水Co2+排放标准(1.0 mg·L-1)。此外,通过净化模拟Fe3+、Cu2+和Ni2+废水,对CMCS气凝胶吸附剂对多种金属离子吸附性能进行了评价。如图S1所示,CMCS气凝胶吸附剂净化Fe3+、Cu2+和Ni2+废水中Fe3+、Cu2+和Ni2+的去除率分别为97.7%、98.4%和98.7%。以上结果表明,制备的CMCS气凝胶吸附剂对Co2+、Fe3+、Cu2+和Ni2+金属离子均有优异的吸附效果,是一种高性能通用型吸附材料。

|
| 图 1 (a) 羧甲基壳聚糖气凝胶吸附剂投加量对吸附效果的影响;(b)pH值对吸附效果的影响 Fig.1 (a) The effect of carboxymethyl chitosan aerogel adsorbent dosage on adsorption; (b) The effect of pH on adsorption |
| |
随后利用扫描电子显微镜(SEM)对所制备的CMCS气凝胶吸附剂的微观形态及表面形貌进行了表征。如图S2所示,制备的白色CMCS气凝胶呈现出蓬松的交联气凝胶结构。如图 2(a)所示,制备的CMCS气凝胶吸附剂具有丰富的片层结构,这为Co2+的吸附提供了丰富的吸附位点。在更高放大倍数下观察可以发现其表面粗糙且有微小颗粒状凸起[图 2(b)]。吸附Co2+后的CMCS气凝胶吸附剂仍呈现出片层结构[图 2(c)],但是其片层表面变得平整光滑,这是由于表面官能团吸附了Co2+造成的[图 2(d)][27]。为了进一步验证对Co2+的吸附,利用X射线能谱仪(EDS)表征了使用后的CMCS气凝胶吸附剂中的元素分布。如图 2(e)所示,C、N、O和Co元素均匀地分散在吸附剂上,Co元素的存在表明CMCS气凝胶吸附剂可以有效吸附废水中Co2+。

|
| 图 2 (a) 和(b)羧甲基壳聚糖气凝胶吸附剂SEM图;(c)和(d)吸附钴离子后羧甲基壳聚糖气凝胶吸附剂SEM图;(e)图(c)的C、N、O和Co元素的EDS mapping图 Fig.2 (a) and (b) SEM images of CMCS aerogel adsorbent; (c) and (d) SEM images of CMCS aerogel adsorbent after adsorption of cobalt ions; (e) EDS mapping of C, N, O and Co elements of figure (c) |
| |
通过N2吸脱附测试测定了所制备的CMCS气凝胶吸附剂比表面积(SSA)为9.81 m2·g-1,其存在着一定的微孔和介孔结构[图S3(a)和S3(b)]。与报道的其他吸附剂相比,制备的CMCS气凝胶吸附剂有较大的SSA,具有更多的表面吸附位点,有利于对Co2+的吸附[28, 29]。
2.2 高级氧化催化剂合成与表征图 3为基于吸附了Co2+的CMCS吸附剂制备负载Co纳米颗粒N掺杂碳的合成工艺。将吸附Co2+后的CMCS吸附剂与三聚氰胺一起研磨后进行煅烧,富含氮元素的三聚氰胺在煅烧过程中分解,将N元素掺杂进碳骨架,最终得到负载Co纳米颗粒N掺杂碳材料。

|
| 图 3 吸附剂的转化及Co@NC-800的制备流程图 Fig.3 The schematic diagram for the conversion of the adsorbent and the preparation of Co@NC-800 |
| |
为了确定对使用后吸附剂进行改性和煅烧得到样品的物相组成,进行了X射线衍射(XRD)测试[图 4(a)]。NC的XRD谱图仅在22°和44°处有2个较宽的衍射峰,分别对应于石墨碳的(002)和(100)面。然而,Co@C、Co@NC-700、Co@NC-800和Co@NC-900样品的XRD图谱在44.2°和51.4°处出现了2个尖锐的窄峰,对应于金属Co的(111)和(200)面,表明Co@C、Co@NC-700、Co@NC-800和Co@NC-900中均有Co颗粒的存在,证明所得样品为Co颗粒修饰的N掺杂碳材料。

|
| 图 4 NC、Co@C、Co@NC-700、Co@NC-800和Co@NC-900的(a)XRD图和(b)Raman光谱图 Fig.4 (a) XRD patterns and (b) Raman spectra of NC, Co@C, Co@NC-700, Co@NC-800 and Co@NC-900 |
| |
利用拉曼光谱表征所有样品的石墨化程度和结构缺陷[30, 31]。D带与G带的强度之比(ID/IG)通常代表碳基材料的结构缺陷程度。如图 4(b)所示,NC、Co@C和Co@NC-800的ID/IG分别为1.23、1.01和1.05。NC的高缺陷程度可能源于较高程度的N掺杂和较低程度的石墨化程度,而加入钴源后的Co@C和Co@NC-800缺陷程度明显降低,这可能是因为Co的存在有助于提升碳的石墨化程度[32]。Co@C缺陷程度比Co@NC-800更低,这是由于制备过程中不加入三聚氰胺,避免了N掺杂导致的结构缺陷。Co@NC-700和Co@NC-900的ID/IG分别为1.23和0.97。样品的缺陷程度随着煅烧温度的升高而减少,这可能是因为随着煅烧温度的增加,样品的含氮量和表面的含氧官能团减少。
为了进一步确定Co颗粒的负载状态,利用透射电子显微镜(TEM)对样品进行了表征。从Co@NC-700、Co@NC-800和Co@NC-900的TEM图像可以清楚地观察到Co的纳米颗粒成功负载在碳载体上[图 5(a)、图 5(b)和图 5(c)]。从Co@NC-800的HRTEM图中观察到,所示间隔为0.205 nm和0.340 nm的清晰晶格条纹对应于立方相Co(111)面和C的(002)面,表明Co纳米颗粒被外层连续的石墨层包裹[图 5(d)][33, 34]。高角度环形暗场扫描透射电子显微镜(HAADF-STEM)验证了Co纳米颗粒分散负载在N掺杂碳载体上[图 5(e)]。对应的能量色散X射线能谱(EDS)映射图显示C、O和N均匀分布在整个碳骨架中[图 5(f)]。以上结果表明,一系列负载Co纳米颗粒N掺杂碳材料被成功制备。

|
| 图 5 (a) Co@NC-700、(b)Co@NC-800和(c)Co@NC-900的TEM图;(d)图(b)中红色圆圈位置的HRTEM图像;(e)Co@NC-800的HAADF-STEM图像及(f)相应的C、O、N和Co元素mapping图 Fig.5 TEM image of (a) Co@NC-700, (b) Co@NC-800 and (c) Co@NC-900; (d) HRTEM image of the position of the red circle in figure (b); (e) HAADF-STEM image of Co@NC-800 and (f) corresponding mapping of C, O, N and Co elements, respectively |
| |
利用X射线光电子能谱(XPS)进一步研究了所得材料的表面组成和元素状态。XPS结果表明,Co@NC-800的N、O和Co含量分别为7.35%、13.55%和0.97%(表 1)。Co@NC-800的Co 2p XPS谱如图 6(a)所示,在778.5、780.0和781.7 eV处的特征峰分别属于Co0、Co3+和Co2+组分[35]。在778.5 eV处的Co0峰表明Co@NC-800中有Co金属颗粒的存在,而Co2+和Co3+来源于样品在空气中的表面氧化。通过XPS结果还可以观察到,随着煅烧温度的提升,N元素和O元素在样品中的含量明显下降,这表明煅烧温度越高含氮量和表面的含氧官能团越少,与Raman结果一致。Co@NC-700、Co@NC-800和Co@NC-900的N 1s高分辨率XPS谱可以解卷积为4个峰,结合能分别为398.4、399.8、401.0和403.3 eV,分别对应吡啶N、吡咯N、石墨N和氧化N[图 6(b)、图 6(c)和图 6(d)][30, 36]。值得注意的是,随着煅烧温度的提升(700、800和900 ℃)样品中石墨N的比例从11.5%增加至43.7%。这些结果表明高温可以使碳的石墨化程度增加,并且有利于石墨N的形成,也与Raman结果一致。
| Samples | n(C)/% | n(N)/% | n(O)/% | n(Co)/% |
| NC | 76.18 | 9.19 | 15.63 | 0 |
| Co@C | 80.19 | 1.79 | 16.26 | 1.76 |
| Co@NC-700 | 69.79 | 12.59 | 16.24 | 1.38 |
| Co@NC-800 | 78.13 | 7.35 | 13.55 | 0.97 |
| Co@NC-900 | 81.57 | 5.86 | 11.68 | 0.89 |
| Co@NC-800 (used) | 77.02 | 4.21 | 18.46 | 0.31 |

|
| 图 6 (a) Co@NC-800的Co 2p XPS谱;(b)Co@NC-700、(c)Co@NC-800和(d)Co@NC-900中N 1s的XPS谱 Fig.6 (a) Co 2p XPS spectrum of the Co@NC-800; N 1s XPS spectra of (b) Co@NC-700, (c) Co@NC-800 and (d) Co@NC-900 |
| |
此外,利用N2吸脱附测试测定了样品的比表面积。经过对吸附Co2+的吸附剂改性煅烧后得到的Co@C和Co@NC-800的SSA分别为240.52和290.81 m2·g-1[图S3(c)]。其中Co@C中微孔较多,而Co@NC-800中主要以介孔形式存在[图S3(d)]。Co@NC-800中介孔的增加可能是由于煅烧过程中三聚氰胺分解和氮刻蚀碳导致微孔向介孔转化。此外,利用SEM对材料中的孔结构进行更加直观地表征分析。如图S4所示,Co@C和Co@NC-800都呈现出无规则的块状结构,Co@C中无法观察到明显的较大孔径的介孔及大孔结构,而观察到Co@NC-800中存在少量较大孔径的介孔及大孔。这些较大孔结构的产生可能是煅烧过程中三聚氰胺分解和氮刻蚀碳导致的。以上结果表明,Co@C和Co@NC-800的孔洞结构主要以微孔或较小孔径的介孔形式存在,较为丰富的孔洞结构,增加了传质速率和活性位点的暴露,有利于活化PMS降解有机污染物反应的进行。
2.3 催化氧化性能测试以双酚A(BPA)为污染物,过氧单硫酸钾(PMS)为氧化剂,评价所制备的样品活化PMS降解有机污染物的性能。
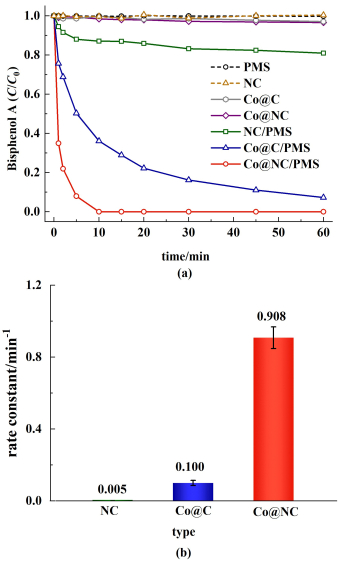
如图 7(a)所示,在不添加催化剂、只加入PMS的情况下,体系几乎不能降解BPA。此外,在不添加PMS的情况下,NC、Co@C和Co@NC-800在60 min内对BPA的去除率都小于3.5%。这表明物理吸附作用对去除BPA贡献很小。为了更好地研究样品的催化性能,通过拟合一阶动力学得到了各样品催化反应的准一阶反应速率常数(k,min-1)。以NC为催化剂活化PMS在60 min内只能降解29.1%的BPA(k=0.005 min-1),表明无金属负载的氮掺杂碳材料样品对PMS的活化效果较差[图 7(b)]。Co@C/PMS和Co@NC-800/PMS体系分别可以在60 min和10 min内完全降解BPA。Co@NC-800/PMS体系降解BPA的准一阶反应速率可达0.908 min-1。在煅烧过程中三聚氰胺分解将氮原子掺杂进碳骨架中,从而增加了碳骨架缺陷程度,调节了惰性碳质材料的自旋密度,增强了材料的电子迁移率,进而提高了催化活性[37]。此外,三聚氰胺的分解还利于增加孔道结构,有利于提高反应传质速率和活性位点的暴露。之后为了探究可能存在的Co-Nx活性位对PMS活化的贡献,对Co@NC-800进行酸洗处理得到Co@NC-800(acid-washed)。对Co@NC-800(acid-washed)进行降解性能测试,并使用2 mmol·L-1硫氰化钾(KSCN)对Co@NC-800(acid-washed)/PMS体系进行了中毒实验。如图S5所示Co@NC-800[acid-washed)]的XRD图仅在22°和44°处有2个较宽的衍射峰,分别对应于石墨碳的(002)和(100)面。44.2°和51.4°处2个尖锐的窄峰消失,表明酸洗去除了Co@NC-800中的Co颗粒成分。如图S6所示,Co@NC-800/PMS体系在10 min内即可完全降解BPA。然而NC/PMS、Co@NC-800(acid-washed)/PMS和Co@NC-800(acid-washed)/PMS/KSCN体系在60 min后BPA降解率分别为19.1%、22.0%和22.9%。上述结果表明,Co纳米颗粒是Co@NC-800活化PMS降解BPA的主要活性位点,可能存在的Co-Nx活性位对PMS活化的贡献很小。
|
| 图 7 (a) 在不同催化剂/PMS体系中的BPA去除率;(b)NC/PMS、Co@C/PMS和Co@NC-800/PMS体系的准一阶反应速率常数 Fig.7 (a) BPA removal efficiency in different catalysts/ PMS systems; (b) The pseudo-first order reaction rate constants of NC/PMS, Co@C/PMS and Co@NC-800/PMS systems |
| |
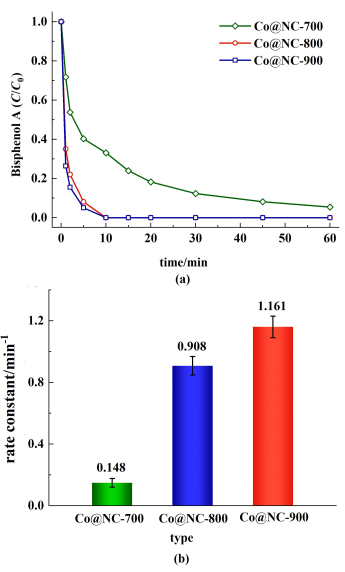
随后探究了催化剂煅烧温度对BPA降解性能的影响。以Co@NC-700为催化剂活化PMS在60 min后BPA降解率为96.7%(k=0.148 min-1)(图 8)。而Co@NC-800/PMS和Co@NC-900/PMS在10 min内即可完全降解BPA。Co@NC-900/PMS体系降解BPA的准一阶反应速率可达1.161 min-1。随着煅烧温度的升高,催化剂降解性能随之提升。由TEM结果可知,在不同煅烧温度下钴纳米颗粒的尺寸和形貌并没有明显变化,这表明煅烧温度对钴颗粒的生长影响不大。由XPS图可知,随着煅烧温度的升高,氮的构型有明显改变。随着温度的升高石墨N的比例从11.5%提升至43.7%。石墨N不仅可以作为活化PMS产生自由基的活性位点,而且可以通过与过渡金属活性位点的协同作用促进对PMS的活化[38-40]。因此随着煅烧温度的升高,催化剂降解性能的提升可能归因于石墨N含量的增加。选取Co@NC-800作为活化PMS的目标催化剂用于后续降解性能和机理的研究。
|
| 图 8 (a) 不同温度煅烧的催化剂对BPA降解性能;(b)Co@NC-700/PMS、Co@NC-800/PMS和Co@NC-900/PMS体系的准一阶反应速率常数 Fig.8 (a) BPA degradation performance of catalysts calcined at different temperatures; (b) The pseudo-first order reaction rate constants of Co@NC-700/PMS, Co@NC-800/PMS and Co@NC-900/PMS |
| |
进一步考察了PMS浓度和催化剂用量对BPA降解的影响。随着PMS用量从200 mg·L-1增加到500 mg·L-1,Co@NC-800/PMS体系完全降解BPA的时间从60 min降低到了10 min[图S7(a)]。然而,当PMS用量增加到800 mg·L-1时,Co@NC-800/PMS体系完全降解BPA的时间为20 min,降解效率反而下降。这说明PMS过量可能会导致体系自由基自淬灭现象发生,阻碍BPA降解[41]。从图S7(b)中可以看出,随着Co@NC-800的用量从50 mg·L-1增加到100 mg·L-1,BPA的降解速率显著增加,说明更多催化剂可以提供更多激活PMS的活性位点,并产生更多的ROS用于BPA降解。当Co@NC-800用量进一步增加到150 mg·L-1时,BPA的降解速率虽然有所增加,但是仍需要10 min才能完全降解BPA,这可能也是由于激发出的过量ROS发生了自淬灭。从经济效益和降解效率的考虑,选择催化剂投加量为100 mg·L-1,PMS投加量为500 mg·L-1作为催化活性评价的最适宜反应条件。
考虑到废水中可能存在多种共存物质,在多种阴离子(NO3-、HCO3-、Cl-和H2PO4-)和腐殖酸(HA)存在下,考察了Co@NC-800催化剂对BPA的降解情况[图S7(c)]。在10 mg·L-1 NO3-、10 mg·L-1 HCO3-、10 mg·L-1 Cl-、10 mg·L-1 H2PO4-和10 mg·L-1 HA存在情况下,Co@NC-800/PMS体系完全降解BPA的时间分别为20、45、10、20和40 min。NO3-、HCO3-和H2PO4-对BPA降解的抑制作用是因为这些离子能淬灭活性自由基形成活性较低的次级自由基[42]。HA对BPA降解的抑制作用是因为HA可以与BPA竞争ROS[43]。值得注意的是,Cl-的存在轻微促进了BPA的降解,这可能是由于Co@NC-800/PMS/Cl-体系可以产生更长寿命的HOCl自由基,从而提高了对BPA降解速率[44]。总体来说,Co@NC-800/PMS体系对多种无机阴离子具有良好的抗性。
此外,研究表明Co@NC-800/PMS体系具有很高的pH值适用性,在pH值为3~11的情况下,都可以在30 min内完全去除BPA[图S7(d)],这与典型的类Fenton反应体系相比具有很大的优势。在酸性环境(pH=3和5)中,Co@NC-800/PMS体系只需要10 min就可以完全降解BPA。而在溶液pH值为7、9和11时,分别需要20、30和30 min才能完全降解BPA。Co@NC-800在酸性环境中比在中性或碱性环境中表现出更好的催化活性,其主要原因可能是酸性条件下钴离子浸出量高,导致PMS快速分解[45];而在碱性条件下,高浓度的OH-会引起PMS的自分解,阻碍其吸附活化,从而减慢了反应速度[46]。探究了Co@NC-800/PMS体系对多种污染物的降解性能。图S8为Co@NC-800/PMS体系中对罗丹明B(RhB)、苯酚(Phenol)和2,4-二氯苯酚(2,4-DCP)、磺胺甲恶唑(SMX)和阿特拉津(ATZ)的降解性能图。Co@NC-800/PMS体系中对罗丹明B、苯酚和2,4-二氯苯酚,磺胺甲恶唑和阿特拉津完全降解所需的时间分别为10、10、15、20、30和30 min。Co@NC-800/PMS体系对不同污染物降解性能的差异是由于不同污染物中组分基团的供/吸电子能力不同导致的电离电位存在差异[10]。总的来说,Co@NC-800/PMS体系对多种污染物都有很好的降解效果。
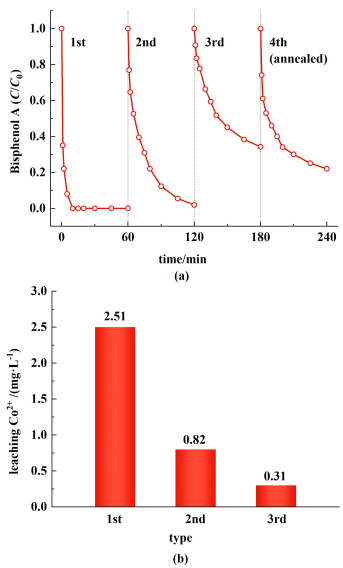
通过循环实验进一步评估了Co@NC-800催化剂的稳定性[图 9(a)]。在第2次和第3次稳定性循环实验中,Co@NC-800在60 min分别可以降解98.3%和65.5%的BPA。原子吸收光谱仪(AAS)用于检测反应后溶液中钴的浸出量。前3次循环后,反应后溶液中Co的浓度分别为2.51、0.82和0.31 mg·L-1[图 9(b)]。在第4次测试前,对使用3次循环后的催化剂在N2气氛下800 ℃煅烧2 h,以去除反应中吸附的反应中间体,还原被氧化的碳骨架,来部分恢复催化活性[40]。但实验结果显示,使用高温处理后的催化剂在60 min内降解了79.2%的BPA,降解性能只能得到较小的恢复。根据以上结果推测,反应后Co活性位点的丧失可能是Co@NC-800活性降低的主要原因。
|
| 图 9 (a) Co@NC-800催化剂稳定性测试;(b)溶液中Co2+浸出量 Fig.9 (a) Stability test of Co@NC-800 catalysts; (b) the leaching concentration of Co2+ in solution |
| |
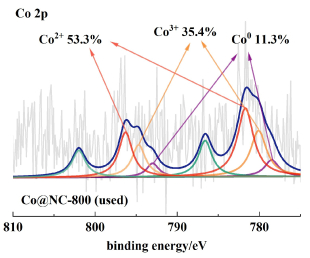
为了进一步探究催化剂的失活机理,对使用后的催化剂[Co@NC-800 (used)]进行了XPS表征分析。XPS结果显示,催化剂使用后,Co含量从0.97%减少为0.31%(表 1),并且Co0的含量从32.5%降低至11.3%(图 10)。这些结果表明反应后Co活性位点的大量流失,Co0可能是反应的活性位点。
|
| 图 10 Co@NC-800 (used)的Co 2p XPS谱 Fig.10 Co 2p XPS spectrum of the Co@NC-800 (used) |
| |
通过自由基淬灭实验确定了Co@NC-800/PMS体系中产生的活性氧物种。选择甲醇(MeOH)淬灭SO4·-和·OH[v(MeOH,SO4·-)=3.2×107 L·mol-1·s-1,v(MeOH,·OH)=9.7×108 L·mol-1·s-1][47]。如图 11所示,当MeOH加入到Co@NC-800/PMS体系中,在60 min内只能降解14.9%的BPA,准一阶反应速率从0.908降低到了0.004 min-1。MeOH的加入对BPA降解有很强的抑制效果,说明SO4·-和·OH在BPA降解过程中起到了重要作用。为了识别体系中·OH对BPA降解作用,使用叔丁醇(TBA)选择性淬灭·OH[v(TBA),·OH=3.8×108~7.6×108 L·mol-1·s-1]。当TBA加入到Co@NC-800/PMS体系中,在60 min内BPA降解率为72.0%的,反应速率从0.908 min-1降低到了0.048 min-1。这表明·OH在BPA的降解中具有重要作用。使用p-苯醌(p-BQ)和L-组氨酸(L-His)分别对体系中O2·-和1O2的进行选择性淬灭。结果表明,过量的p-BQ和L-His的加入对BPA降解都没有明显的抑制效果,都可以在20 min内完全降解BPA。这说明O2·-和1O2并不是该体系中主要参与反应的活性氧物种。降解速率的轻微降低可能是由于p-BQ作为BPA降解的中间产物影响反应平衡减缓了反应速率,L-His可直接与PMS反应消耗PMS[48]。最后,利用二甲基亚砜(DMSO)选择性淬灭高价金属氧物种,探究了体系中高价金属氧物种对BPA降解的贡献。结果表明,过量的DMSO加入时,BPA的降解速率几乎不受到影响。综上所述,SO4·-和·OH是Co@NC-800/PMS体系中主要的活性氧物种,在BPA降解过程中起到了重要作用。
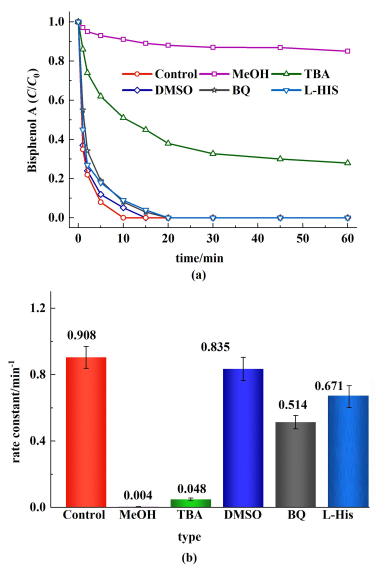
|
| 图 11 (a) Co@NC-800/PMS体系中不同淬灭剂对BPA降解的影响;(b)Co@NC-800在不同淬灭体系中的准一阶反应速率;m(MeOH)/m(PMS)=m(TBA)/m(PMS)=1000;[DMSO]=20 mg·L-1; [L-His]=[BQ]=10 mg·L-1 Fig.11 (a) The effect of different scavengers on BPA degradation in the Co@NC/PMS system; (b) Pseudo-first order reaction rate comparisons of the Co@NC-800 in different quenching systems; m(MeOH)/m(PMS)= m(TBA)/m(PMS)=1000; [DMSO]=20 mg·L-1; [L-His]=[BQ]=10 mg·L-1 |
| |
电化学技术通常用于研究直接电子转移(DET)过程对PMS活化的贡献。PMS可被催化剂活化形成活性PMS配合物,通过催化剂表面的电子转移直接氧化有机污染物。图 12显示了连续加入PMS和BPA后,负载在玻碳电极(GCE)上的Co@NC-800的开路电位(OCP)变化情况。加入PMS后,负载Co@NC-800的GCE的开路电位立即增加,这是由于活化的PMS与Co@NC-800结合形成催化剂PMS*配合物[49]。加入BPA后,由于活性PMS复合物与BPA发生反应,OCP只出现轻微的降低。因此,Co@NC-800/PMS体系降解BPA过程中几乎不存在直接电子转移过程。

|
| 图 12 Co@NC-800的开路电位测试 Fig.12 Open-circuit potential curves of the Co@NC-800 |
| |
本研究首先制备了一种羧甲基壳聚糖(CMCS)气凝胶吸附剂,其具有优异钴离子吸附性能。然后,对吸附了钴离子废弃吸附剂进行改性和煅烧,得到钴纳米颗粒负载的氮掺杂碳催化剂(Co@NC-800)。与无金属NC和没有加入氮源的Co@C相比,Co@NC-800表现出优异的活化PMS降解BPA的催化性能。通过调控煅烧温度,探明石墨N的含量随煅烧温度升高而增加,并可有效提升催化性能。Co@NC-800/PMS体系还具有较宽的pH值适用范围和较强的抗阴离子干扰能力,可以高效降解多种有机污染物。此外,对催化剂的稳定性进行了测试和分析,得出钴离子浸出可能是主要的失活原因。通过自由基淬灭实验以及电化学测试分析,确定了SO4·-和·OH是参与BPA降解过程的主要活性物质。本研究为废弃吸附剂高效利用制备高级氧化催化剂提供了一种新方法,对合成高效的钴-碳复合催化剂也具有一定的启示。
| [1] |
LUO H, ZENG Y, HE D, et al. Application of iron-based materials in heterogeneous advanced oxidation processes for wastewater treatment: A review[J]. Chemical Engineering Journal, 2021, 407: 127191. DOI:10.1016/j.cej.2020.127191 |
| [2] |
ROSTAM A B, TAGHIZADEH M. Advanced oxidation processes integrated by membrane reactors and bioreactors for various wastewater treatments: A critical review[J]. Journal of Environmental Chemical Engineering, 2020, 8(6): 104566. DOI:10.1016/j.jece.2020.104566 |
| [3] |
WAN N W S, TEONG L C, HANAFIAH M A K M. Adsorption of dyes and heavy metal ions by chitosan composites: A review[J]. Carbohydrate Polymers, 2011, 83(4): 1446-1456. DOI:10.1016/j.carbpol.2010.11.004 |
| [4] |
左鸣. 电镀废水处理工艺优化研究[D]. 广州: 华南理工大学, 2012 ZUO Ming. Study on optimization of electroplating wastewater treatment process[D]. Guangzhou: South China University of Technology, 2012 (in Chinese) |
| [5] |
胡必清, 朱亚伟. 印染废水的化学法处理研究进展[J]. 印染, 2016, 42(13): 46-50. HU Biqing, ZHU Yawei. Research progress in chemical treatment of printing and dyeing wastewater[J]. China Dyeing & Finishing, 2016, 42(13): 46-50. DOI:10.3321/j.issn.1000-4017.2016.13.013 (in Chinese) |
| [6] |
梁波, 徐金球, 关杰, 等. 生物法处理印染废水的研究进展[J]. 化工环保, 2015, 35(3): 259-266. LIANG Bo, XU Jinqiu, GUAN Jie, et al. Research progresses in treatment of dyeing wastewater by biological methods[J]. Environmental Protection of Chemical Industry, 2015, 35(3): 259-266. DOI:10.3969/j.issn.1006-1878.2015.03.008 (in Chinese) |
| [7] |
吴建明. 壳聚糖/聚乙烯醇基纳米复合材料的制备及其在污水处理中的应用[D]. 合肥: 合肥工业大学, 2019 WU Jianming. Preparation of chitosan/PVA nanocomposites and its application in wastewater treatment[D]. Hefei: Hefei University of Technology, 2019 (in Chinese) |
| [8] |
罗文强. 羧甲基壳聚糖吸附剂对钴离子的吸附特性研究[D]. 上海: 华东理工大学, 2018 LUO Wenqiang. Study on adsorption characteristics of carboxymethyl chitosan adsorbent for cobalt ions[D]. Shanghai: East China University of Science and Technology, 2018 (in Chinese) |
| [9] |
王祥名, 吴松海, 王琮, 等. Cu2(NO3)(OH)3催化过硫酸盐降解苯酚[J]. 化学工业与工程, 2021, 38(1): 69-78. WANG Xiangming, WU Songhai, WANG Cong, et al. Catalytic degradation of phenol by persulfate activation using Cu2(NO3)(OH)3[J]. Chemical Industry and Engineering, 2021, 38(1): 69-78. (in Chinese) |
| [10] |
QI Y, LI J, ZHANG Y, et al. Novel lignin-based single atom catalysts as peroxymonosulfate activator for pollutants degradation: Role of single cobalt and electron transfer pathway[J]. Applied Catalysis B: Environmental, 2021, 286: 119910. DOI:10.1016/j.apcatb.2021.119910 |
| [11] |
WANG F, YAO J, SUN K, et al. Adsorption of dialkyl phthalate esters on carbon nanotubes[J]. Environmental Science & Technology, 2010, 44(18): 6985-6991. |
| [12] |
LODERER C, WÖRLE A, FUCHS W. Influence of different mesh filter module configurations on effluent quality and long-term filtration performance[J]. Environmental Science & Technology, 2012, 46(7): 3844-3850. |
| [13] |
ZANG T, WANG H, LIU Y, et al. Fe-doped biochar derived from waste sludge for degradation of rhodamine B via enhancing activation of peroxymonosulfate[J]. Chemosphere, 2020, 261: 127616. DOI:10.1016/j.chemosphere.2020.127616 |
| [14] |
DUAN X, SU C, MIAO J, et al. Insights into perovskite-catalyzed peroxymonosulfate activation: Maneuverable cobalt sites for promoted evolution of sulfate radicals[J]. Applied Catalysis B: Environmental, 2018, 220: 626-634. DOI:10.1016/j.apcatb.2017.08.088 |
| [15] |
张未军, 齐崴, 苏荣欣, 等. 电芬顿-臭氧一体化工艺处理船舶生活污水[J]. 化学工业与工程, 2017, 34(2): 62-67. ZHANG Weijun, QI Wei, SU Rongxin, et al. Removal of COD from sewage by integrated E-Fenton and ozone[J]. Chemical Industry and Engineering, 2017, 34(2): 62-67. (in Chinese) |
| [16] |
HODGES B C, CATES E L, KIM J H. Challenges and prospects of advanced oxidation water treatment processes using catalytic nanomaterials[J]. Nature Nanotechnology, 2018, 13(8): 642-650. DOI:10.1038/s41565-018-0216-x |
| [17] |
ZHOU Y, WANG X, ZHU C, et al. New insight into the mechanism of peroxymonosulfate activation by sulfur-containing minerals: Role of sulfur conversion in sulfate radical generation[J]. Water Research, 2018, 142: 208-216. DOI:10.1016/j.watres.2018.06.002 |
| [18] |
AL HAKIM S, JABER S, ZEIN EDDINE N, et al. Degradation of theophylline in a UV254/PS system: Matrix effect and application to a factory effluent[J]. Chemical Engineering Journal, 2020, 380: 122478. DOI:10.1016/j.cej.2019.122478 |
| [19] |
WEAVERS L K. Kinetics and mechanism of ultrasonic activation of persulfate: An in situ EPR spin trapping study[J]. Environmental Science & Technology, 2017, 51(6): 3410-3417. |
| [20] |
REN Y, LIN L, MA J, et al. Sulfate radicals induced from peroxymonosulfate by magnetic ferrospinel MFe2O4 (M=Co, Cu, Mn, and Zn) as heterogeneous catalysts in the water[J]. Applied Catalysis B: Environmental, 2015, 165: 572-578. DOI:10.1016/j.apcatb.2014.10.051 |
| [21] |
ANIPSITAKIS G P, DIONYSIOU D D. Radical generation by the interaction of transition metals with common oxidants[J]. Environmental Science & Technology, 2004, 38(13): 3705-3712. |
| [22] |
ZHANG A, HE Y, CHEN Y, et al. Degradation of organic pollutants by Co3O4-mediated peroxymonosulfate oxidation: Roles of high-energy{0 0 1}-exposed TiO2 support[J]. Chemical Engineering Journal, 2018, 334: 1430-1439. DOI:10.1016/j.cej.2017.11.078 |
| [23] |
周丽. 钴基高级氧化法催化降解有机污染物的研究[D]. 北京: 北京化工大学, 2022 ZHOU Li. Study on catalytic degradation of organic pollutants by cobalt-based advanced oxidation[D]. Beijing: Beijing University of Chemical Technology, 2022 (in Chinese) |
| [24] |
曹志钦. 城市典型废弃物回收及在电芬顿处理废水中的再利用研究[D]. 天津: 天津大学, 2018 CAO Zhiqin. Study on recovery of typical municipal wastes and reuse in electro-Fenton treatment of wastewater[D]. Tianjin: Tianjin University, 2018 (in Chinese) |
| [25] |
YAO Y, ZHU M, ZHAO Z, et al. Hydrometallurgical processes for recycling spent lithium-ion batteries: A critical review[J]. ACS Sustainable Chemistry & Engineering, 2018, 6(11): 13611-13627. |
| [26] |
FAN L, LUO C, LV Z, et al. Removal of Ag+ from water environment using a novel magnetic thiourea-chitosan imprinted Ag+[J]. Journal of Hazardous Materials, 2011, 194: 193-201. DOI:10.1016/j.jhazmat.2011.07.080 |
| [27] |
李姗姗. 纤维素(CMC)基重金属吸附材料制备与性能研究[D]. 辽宁大连: 大连工业大学, 2021 LI Shanshan. Preparation and properties of cellulose (CMC)-based heavy metal adsorption materials[D]. Liaoning Dalian: Dalian Polytechnic University, 2021 (in Chinese) |
| [28] |
SHEKHAWAT A, KAHU S, SARAVANAN D, et al. Tin(Ⅳ) cross-linked chitosan for the removal of As(Ⅲ)[J]. Carbohydrate Polymers, 2017, 172: 205-212. DOI:10.1016/j.carbpol.2017.05.038 |
| [29] |
PIVARČČIOVÁÁ L, ROSSKOPFOVÁ O, GALAMBOŠ M, et al. Sorption of pertechnetate anions on chitosan[J]. Journal of Radioanalytical and Nuclear Chemistry, 2016, 308(1): 93-98. DOI:10.1007/s10967-015-4351-7 |
| [30] |
HE H, LI Z, LI K, et al. Bifunctional graphene-based metal-free catalysts for oxidative coupling of amines[J]. ACS Applied Materials & Interfaces, 2019, 11(35): 31844-31850. |
| [31] |
HE H, MA K, LIU H, et al. Unraveling the amine oxidative coupling activity of hierarchical porous Fe-N4-O1 single-atom catalysts: Oxygen atom-mediated dual reaction pathway[J]. Journal of Materials Chemistry A, 2022, 10(46): 24831-24838. DOI:10.1039/D2TA07198C |
| [32] |
CHANG J, WANG G, CHANG X, et al. Interface synergism and engineering of Pd/Co@N-C for direct ethanol fuel cells[J]. Nature Communications, 2023, 14(1): 1-15. DOI:10.1038/s41467-022-34464-6 |
| [33] |
TIAN W, ZHANG H, QIAN Z, et al. Bread-making synthesis of hierarchically Co@C nanoarchitecture in heteroatom doped porous carbons for oxidative degradation of emerging contaminants[J]. Applied Catalysis B: Environmental, 2018, 225: 76-83. DOI:10.1016/j.apcatb.2017.11.056 |
| [34] |
ZHANG S, WANG L, XIE T, et al. Heterointerface enhanced NiFe LDH/V-Co4N electrocatalysts for the oxygen evolution reaction[J]. Journal of Materials Chemistry A, 2022, 10(40): 21523-21530. DOI:10.1039/D2TA04120K |
| [35] |
LIU X, YU H, JI J, et al. Graphene oxide-supported three-dimensional cobalt-nickel bimetallic sponge-mediated peroxymonosulfate activation for phenol degradation[J]. ACS ES&T Engineering, 2021, 1(12): 1705-1714. |
| [36] |
CAI A, HE H, ZHANG Q, et al. Synergistic effect of N-doped sp2 carbon and porous structure in graphene gels toward selective oxidation of C—H bond[J]. ACS Applied Materials & Interfaces, 2021, 13(11): 13087-13096. |
| [37] |
DU N, LIU Y, LI Q, et al. Peroxydisulfate activation by atomically-dispersed Fe-Nx on N-doped carbon: Mechanism of singlet oxygen evolution for nonradical degradation of aqueous contaminants[J]. Chemical Engineering Journal, 2021, 413: 127545. DOI:10.1016/j.cej.2020.127545 |
| [38] |
王清, 张凤宝, 范晓彬, 等. 氮掺杂中空多孔碳材料活化过一硫酸盐催化降解双酚A[J]. 化学工业与工程, 2022, 39(6): 1-13. WANG Qing, ZHANG Fengbao, FAN Xiaobin, et al. Activation of peroxymonosulfate for bisphenol A degradation by nitrogen-doped hollow porous carbon materials[J]. Chemical Industry and Engineering, 2022, 39(6): 1-13. (in Chinese) |
| [39] |
ZHAO C, MENG L, CHU H, et al. Ultrafast degradation of emerging organic pollutants via activation of peroxymonosulfate over Fe3C/Fe@N-C-x: Singlet oxygen evolution and electron-transfer mechanisms[J]. Applied Catalysis B: Environmental, 2023, 321: 122034. DOI:10.1016/j.apcatb.2022.122034 |
| [40] |
WANG Q, LIU X, CAI A, et al. Atomically Fe doped hollow mesoporous carbon spheres for peroxymonosulfate mediated advanced oxidation processes with a dual activation pathway[J]. Journal of Materials Chemistry A, 2022, 10(38): 20535-20544. DOI:10.1039/D2TA03268F |
| [41] |
DUAN X, SU C, ZHOU L, et al. Surface controlled generation of reactive radicals from persulfate by carbocatalysis on nanodiamonds[J]. Applied Catalysis B: Environmental, 2016, 194: 7-15. DOI:10.1016/j.apcatb.2016.04.043 |
| [42] |
YANG J, LIN Y, PENG H, et al. Novel magnetic rod-like Mn-Fe oxycarbide toward peroxymonosulfate activation for efficient oxidation of butyl paraben: Radical oxidation versus singlet oxygenation[J]. Applied Catalysis B: Environmental, 2020, 268: 118549. DOI:10.1016/j.apcatb.2019.118549 |
| [43] |
LI H, SHAN C, PAN B. Fe(Ⅲ)-doped g-C3N4 mediated peroxymonosulfate activation for selective degradation of phenolic compounds via high-valent iron-oxo species[J]. Environmental Science & Technology, 2018, 52(4): 2197-2205. |
| [44] |
WANG J, WANG S. Effect of inorganic anions on the performance of advanced oxidation processes for degradation of organic contaminants[J]. Chemical Engineering Journal, 2021, 411: 128392. DOI:10.1016/j.cej.2020.128392 |
| [45] |
ZHAO Y, HUANG B, JIANG J, et al. Polyphenol-metal network derived nanocomposite to catalyze peroxymonosulfate decomposition for dye degradation[J]. Chemosphere, 2020, 244: 125577. DOI:10.1016/j.chemosphere.2019.125577 |
| [46] |
REN W, NIE G, ZHOU P, et al. The intrinsic nature of persulfate activation and N-doping in carbocatalysis[J]. Environmental Science & Technology, 2020, 54(10): 6438-6447. |
| [47] |
ZHOU Y, JIANG J, GAO Y, et al. Activation of peroxymonosulfate by benzoquinone: A novel nonradical oxidation process[J]. Environmental Science & Technology, 2015, 49(21): 12941-12950. |
| [48] |
LI B, MA B, WEI M, et al. Synthesis of Co-NC catalysts from spent lithium-ion batteries for Fenton-like reaction: Generation of singlet oxygen with ~100% selectivity[J]. Carbon, 2022, 197: 76-86. DOI:10.1016/j.carbon.2022.06.029 |
| [49] |
LIU X, WANG J, WU D, et al. N-doped carbon dots decorated 3D g-C3N4 for visible-light driven peroxydisulfate activation: Insights of non-radical route induced by Na+ doping[J]. Applied Catalysis B: Environmental, 2022, 310: 121304. DOI:10.1016/j.apcatb.2022.121304 |
 2023, Vol. 40
2023, Vol. 40





