2. 天津化学化工协同创新中心,天津 300072
2. Collaborative Innovation Center of Chemical Science and Engineering, Tianjin 300072, China
有机光电功能材料因其独特的性能促进了发光二极管(LEDs)[1]、光伏电池(PVCs)[2]、场效应晶体管(FET)[3]等器件的发展,使其展现出良好的应用前景。有机光电功能材料结构多样,性能优异的材料多数为基于电子给体-受体组合而成的化合物,使得这类结构化合物成为了有机光电功能材料重点发展方向之一。电子给体主要包含噻吩衍生物和芳香胺类诸如二苯胺[4, 5]、三苯胺[6, 7]、吲哚啉[8]、咔唑和卟啉[9-11]等,电子给体的给电性能对有机光电功能材料性能至关重要,开发新的电子给体砌块对有机光电功能材料的发展具有重要意义。
电子给体砌块目前常见的设计思路主要有2种:1)在给体母环引入不同的给电基团[12];2)提高给体结构整体的平面性,也可以改善电子给体性能。Do等[13]报道了以平面化三苯胺为给体的染料,其平面性的结构还拓宽了吸收光谱,使得所制备的染料敏化太阳能电池(DSSC)的光电转换效率相对非平面型染料提升了45%。Lu等[14]通过将给体平面化设计并合成了染料CS-32-34,使得DSSC的器件效率提高了20%。Liu等[15]在吲哚啉衍生物的基础上,将2个苯环连接起来,使二面角从53.5°降至3.71°,极大增强了给体的平面性,不仅将吸收光谱拓宽了41 nm,更使得DSSC器件的光电转换效率提高了64%。虽然给体的平面化可以明显提高其给电子能力和捕光效率,但是由于其合成难度较大,导致相关报道较少。
三苯胺具有较强的给电子能力和较高的空穴迁移率[16-18],平面化的三苯胺报道较多[15, 19, 20]。然而,没有取代基修饰时,平面化对三苯胺给电子能力的提升有限,烷氧基的引入可以有效提高三苯胺给电子能力[13, 14, 21, 22]。本研究合成了1种甲氧基修饰的平面化三苯胺化合物,并通过能级及吸收光谱表明其具有很大的电子转移驱动力和很好的给电子能力,适用于新型有机光电功能材料的构筑。
1 实验部分 1.1 试剂与仪器2-氨基苯甲酸甲酯、H3PO4、甲醇钠甲醇溶液、铜粉、N-溴代丁二酰亚胺、硝酸银(上海阿拉丁科技有限公司);2-溴-5-甲氧基苯甲酸甲酯、带分子筛N, N-二甲基甲酰胺、(天津希恩思生化科技有限公司);碘化亚铜(九鼎化学);联苯醚(毕得医药)、甲基碘化镁3 mol ·L-1乙醚溶液(北京伊诺凯科技有限公司);无水碳酸钾(天津博迪化工股份有限公司);氢氧化钠、无水硫酸钠(利安隆博华医药化学有限公司);三氯甲烷(天津大茂化学试剂厂);四正丁基溴化铵(梯希爱化成工业发展有限公司);柱层析硅胶(青岛鼎康硅胶有限公司);所有试剂测试均为色谱纯,实验为分析纯,其中甲苯经过重蒸、干燥处理。
VARIAN INOVA 500 MHz和400 MHz核磁共振波谱仪(美国Varian公司);紫外可见吸收光谱仪(美国Agilent公司);Zennium型电化学工作站(德国Zahner公司)。
1.2 化合物合成方法与表征 1.2.1 2, 2′, 2″-三氟三苯甲酸三甲酯(2)的合成向100 mL Schlenk反应瓶中加入2-氨基苯甲酸甲酯(2 g,13.2 mmol),2-碘苯甲酸甲酯(8.66 g,33 mmol),铜粉(168 mg,2.6 mmol),碘化亚铜(252 mg,1.3 mmol),无水碳酸钾(3.66 g,26.5 mmol),以联苯醚作溶剂,190 ℃下反应45 h,反应结束后,用乙酸乙酯过滤洗涤滤饼并旋干溶剂,粗产品以V(乙酸乙酯)∶V(石油醚)=4∶1为淋洗剂,得淡黄色固体产物4.2 g,收率70%,熔点142.0~143.4 ℃。1H NMR (400, CDCl3), δ: 7.58 (d, J=7.7 Hz, 3H, ArH), 7.35 (t, J=7.6 Hz, 3H, ArH), 7.00~7.14 (m, 6H, ArH), 3.37 (s, 9H, OCH3)。
1.2.2 2, 2′-((((2-(2-羟基丙-2-基)环己-2-烯-1基)氮杂二基)双(2, 1-亚苯基))双(丙-2-醇)(3)的合成500 mL干燥后的反应瓶中,通N2除氧之后用注射器注入3 mol ·L-1乙醚溶液的甲基碘化镁200 mL,再逐滴用注射器加入溶于重蒸后甲苯的化合物2 (1 g,2.4 mmol),全程通氩气除氧,逐渐从80 ℃间歇缓慢升温至120 ℃反应12 h,TLC监控反应,反应结束后加入200 mL水溶液猝灭反应,二氯甲烷和水萃取3次,放入带有无水Na2SO4的烧杯中除水后旋干溶剂,粗产品以V(乙酸乙酯)∶V(石油醚)=5∶1为淋洗剂进行硅胶柱层析,得到白色固体500 mg,收率50%。1H NMR (400 MHz, CDCl3), δ: 7.32 (d, J=9.0 Hz, 3H, ArH), 7.00~7.15 (m, 6H, ArH), 6.68 (d, J=7.3 Hz, 3H, ArH), 5.37 (s, 3H, OH), 1.67 (s, 9H, OCH3), 0.84 (s, 9H, CH3)。
1.2.3 4, 4, 8, 8, 12, 12-六甲基-8,12-二氢-4H-苯并[9,1]喹喔啉[3, 4, 5, 6, 7-DEFG]吖啶(4)的合成100 mL干燥后的三口烧瓶中,加入化合物3 (1.5 g,3.6 mmol),质量分数为85%的H3PO4 20 mL溶解反应物,常温下反应4 h,反应结束后倒入NaOH水溶液中调pH值至中性,用二氯甲烷萃取并除水后旋干溶剂,粗产品以石油醚为淋洗剂,硅胶柱层析得白色固体1.0 g,产率76.9%。1H NMR (400 MHz, CDCl3), δ: 7.37 (d, J 7.7 Hz, 6H, ArH), 7.12 (t, J 7.8 Hz, 3H, ArH), 1.63 (s, 18H, CH3)。
1.2.4 2, 6-二溴-4, 4, 8, 8, 12, 12-六甲基-8, 12-二氢-4H-苯并[9,1]喹啉并[3, 4, 5, 6, 7-DEFG]吖啶(5)的合成250 mL三口烧瓶中,加入化合物4 (1 g,2.7 mmol),CDCl3 40 mL,N-溴代丁二酰亚胺(973 mg,5.5 mmol),室温下反应8 h,直至反应物反应完全,反应结束DCM萃取,石油醚硅胶柱层析得黏稠白色液体,2 mL乙醇中重结晶得1.2 g白色固体,收率83.8%。1H NMR (400 MHz, CDCl3), δ: 7.47~7.40 (m, 4H, ArH), 7.37 (d, J=7.7 Hz, 2H, ArH), 7.18~7.11 (m, 1H, ArH), 1.60 (s, 10H, CH3), 1.58 (s, J=1.6 Hz, 8H, CH3)。
1.2.5 2, 6-二甲氧基-4, 4, 8, 8, 12, 12-六甲基-8, 12-二氢-4H-苯并[9,1]喹啉并[3, 4, 5, 6, 7-DEFG]吖啶(6)的合成50 mL Schlenk瓶中加入化合物6 (210 mg,0.4 mmol),甲醇钠甲醇溶液1 mL,CuI(0.77 g,4.0 mmol),抽真空后加入DMF 12 mL,100 ℃下反应10 h,溶液由绿色变为红色再变为无色,反应结束后倒入饱和氯化铵溶液,用DCM萃取,V(石油醚)∶ V(乙酸乙酯)=10∶1硅胶柱层析,得白色固体137 mg,收率80%。1H NMR (500 MHz, CDCl3), δ: 7.40 (d, J=7.7 Hz, 2H, ArH), 7.13 (t, J=7.7 Hz, 1H, ArH), 7.03~6.96 (m, 4H, ArH), 3.91 (s, 6H,OCH3), 1.69 (s, 6H, CH3), 1.67 (d, J=2.5 Hz, 12H, CH3). HRMS (ESI) m/z: [M+H]+ calcd for C29H31NO2, 426.242 8;found,426.242 7。
1.3 实验方法 1.3.1 紫外-可见光吸收光谱测试配制浓度为1×10-5 mol ·L-1的3个染料的甲苯溶液10 mL。用甲苯空白样做基线校正,然后将配置的3个染料的溶液样品放入比色池中测试紫外可见吸收光谱。
1.3.2 循环伏安测试以三电极体系测试,工作电极:玻璃碳电极,参比电极:Ag/AgNO3电极,辅助电极:铂丝电极。每次测试前都采用二茂铁对参比电极进行标定。配制浓度为1×10-3 mol ·L-1的样品溶液,电解质浓度为0.1 mol ·L-1四丁基铵六氟磷酸盐。实验前用氩气或者氮气对待测溶液鼓泡除氧20 min,测试时保持氩气或者氮气气氛,扫描速率为30 mV ·s-1。
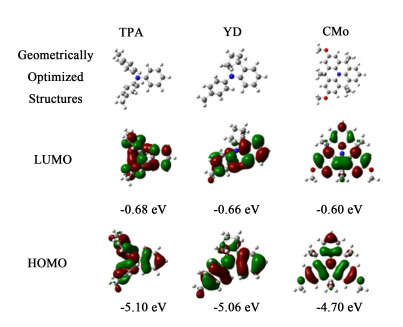
2 理论计算3个给体的化学结构如图 1所示,最优化几何构型和轨道分布如图 2所示。TPA苯环间的二面角为69.52°,呈现为三维螺旋结构;YD因为芴环的存在,2个苯环的二面角减小了,为53.5°;CMo由于将苯环之间通过亚甲基连接起来,二面角仅为0.22°,近乎于共面。苯环间共面性越好,它们之间的共轭作用增强,即电子的离域性提高,更容易给出电子。分子能级的计算结果表明(图 2),3个化合物的HOMO能级和LUMO能级呈现为CMo>YD>TPA。对于同一电子受体,电子给体的LUMO能级越高,其与电子受体LUMO能级间的能极差越大,电子转移的驱动力也越大;电子给体的HOMO能级越高,其与电子受体的HOMO能级间的能级差也越大,其接受空穴的能力也越大[23]。正因此,大量的研究结果已经证明,YD的给电子能力比TPA强,是目前优异的电子给体之一。这里的计算结果表明,CMo的给电子能力应该优于YD,有望成为一个新的电子给体。

|
| 图 1 3个给体的化学结构 Fig.1 Chemical structures of the three donors |
| |
|
| 图 2 在甲苯中计算的给体最优化几何构型、分子轨道分布和能级 Fig.2 Optimized geometrical structures, calculated molecular orbitals and energies in toluene |
| |
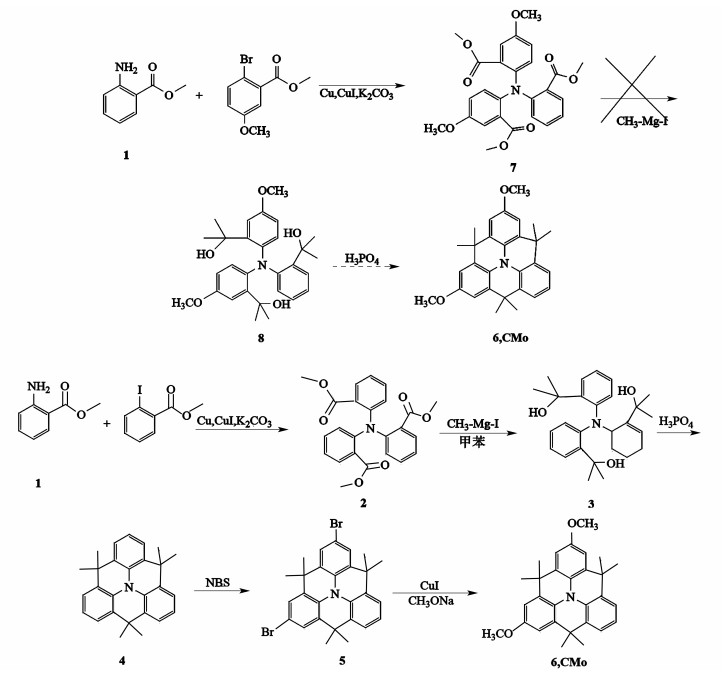
CMo可以选用不同原料来合成,如图 3所示,以2-氨基苯甲酸甲酯和2-溴-5-甲氧基苯甲酸甲酯为原料的合成路线较短,然而中间体化合物8的反应却没有成功。这是一个亲核加成反应,甲氧基的存在使得中间体化合物8羰基碳的碳正性减弱,虽然改变了反应温度、反应时间和加料方式等,都没有得到产物。因此本工作最终选择以2-氨基苯甲酸甲酯和2-碘苯甲酸甲酯为原料的合成路线,即先合成平面化三苯胺,再引入甲氧基。其中合成中间体3时,反应物的加料顺序至关重要。如果先投入中间体2再投入甲基碘化镁,收率仅为10%;然而,先加入甲基碘化镁再投入中间体2,收率可达45%。这是因为反应过程中,甲基碘化镁进攻羰基,烷氧基离去先得到中间体酮,酮再与甲基碘化镁反应生成醇。若先加入中间体2,反应过程原料过量,导致生成的中间体酮无法转化为醇。中间体5在溴化时可能在3个苯环上溴化,因此要严格控制NBS的摩尔用量为中间体2的2倍,收率最大,约为80%以上。CMo总收率为18%,虽然增加了2个甲氧基,但其整体收率与参考文献[15-17](16%~20%)相差不大。
|
| 图 3 CMo的合成路线 Fig.3 Synthetic route of CMo |
| |
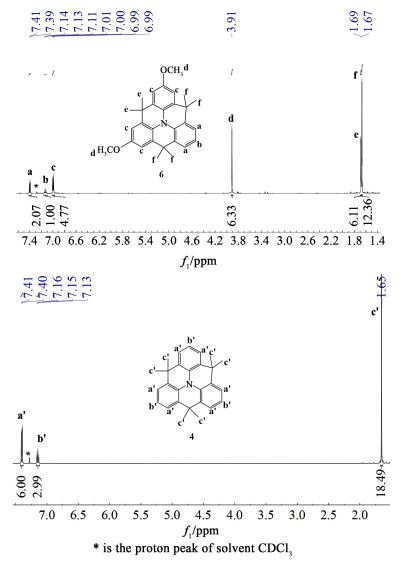
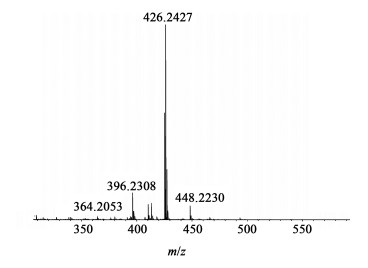
图 4为目标产物的1H NMR图谱。甲氧基的引入使得CMo出现不对称性,相比于中间体6导致苯环与苯环相连接的甲基裂分成2∶1 2个单峰,对应于e组峰和f组峰;苯环上的质子峰由2组变成3组,分别对应于a组、b组和c组峰,总共有6组质子信号峰。HRMS-ESI谱图(图 5)显示1个核质比为426.242 7的分子离子峰,与其[M+H]+计算结果(426.242 8)完全一致,进一步确认了化合物CMo的结构正确性。
|
| 图 4 目标化合物CMo和中间体4的1H NMR图谱 Fig.4 1H NMR spectrum of the target compound CMo and intermediate 4 |
| |
|
| 图 5 CMo的HRMS-ESI谱图 Fig.5 HRMS-ESI spectrum of CMo |
| |
图 6给出了目标化合物CMo的紫外吸收谱图,作为参照,TPA和YD的谱图也列于组合图中。其中,化合物YD在最大吸收波长右侧处出现了1个肩峰,根据密度泛函理论的计算结果,这个肩峰与YD二聚体的吸收峰一致。YD分子中平面部分位阻很小,很容易形成如图 7所示的二聚体结构;相比之下,三维螺旋的TPA分子和具有6个甲基存在的CMo分子,由于空间位阻存在,无论是实验还是理论计算都没有发现二聚体的存在。除去YD二聚体吸收肩峰的影响,CMo的最大吸收波长为304 nm,相对于YD(298 nm)和TPA(297 nm),红移了6 nm和7 nm,表明三苯胺的平面化使得目标化合物的共轭作用明显增强,有利于所构筑的有机光电功能材料的吸收光谱拓宽,

|
| 图 6 给体在甲苯中的紫外-可见吸收光谱 Fig.6 UV-vis absorption spectra of the donors in toluene |
| |

|
| 图 7 YD二聚体的分子构型 Fig.7 Molecular configuration of YD dimer |
| |
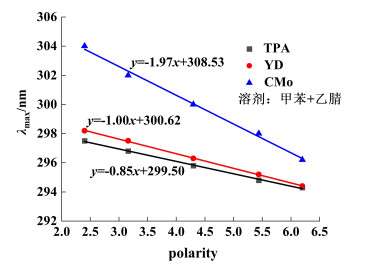
将甲苯和乙腈以不同的比例混合,配制成不同极性的溶剂,分别测试了3个给体在不同极性条件下的最大吸收峰,如图 8所示。由图 8可知,随着极性的增强,最大吸收峰都发生了蓝移。对其进行线性拟合,其中CMo的斜率绝对值是1.97,远高于YD(1.00)和TPA(0.85),表明CMo可离域化程度很大,远优于YD和TPA,体现出更好的给电子能力[24]。
|
| 图 8 给体最大吸收波长随溶剂极性的变化曲线 Fig.8 Variation curve of maximum absorption wavelength with solvent polarity |
| |
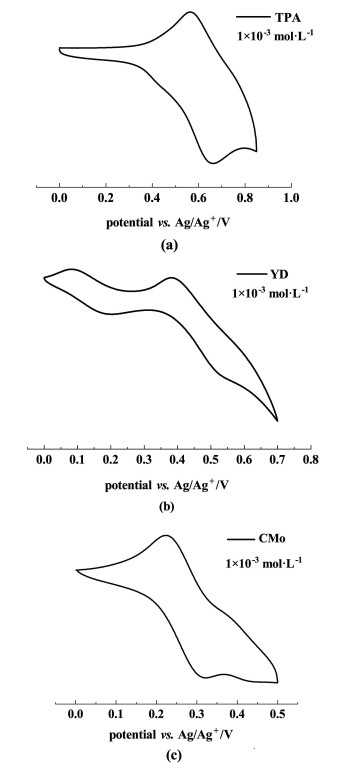
以银/硝酸银为参考电极,测试了给体分子CMo的循环伏安曲线。如图 9,3个化合物都具有1对可逆的氧化峰,说明化合物的氧化过程是可逆的,氧化还原电位和所涉及的化合物的能级列于表 1中。给体CMo的HOMO能级为-5.21 eV,高于YD(-5.38 eV)和TPA(-5.53 eV),LUMO能级为-1.48 eV,高于YD(-1.70 eV)和TPA(-1.79 eV),实验结果与理论计算规律一致,确认了CMo作为电子给体,具有很好的给电子能力和接受空穴的能力。
|
| 图 9 3个给体在二氯甲烷中测得的循环伏安曲线 Fig.9 Cyclic voltammograms of the three donors in dichloromethane |
| |
| Eoxa/eV | Eg, opb/eV | EHOMOc/eV | ELUMOd/eV | |
| TPA | 0.60 | 3.74 | -5.53 | -1.79 |
| YD | 0.45 | 3.68 | -5.38 | -1.70 |
| CMo | 0.28 | 3.73 | -5.21 | -1.48 |
| aV vs. Ag/Ag+;b is estimated from the UV absorption band edge of the compound in Figure 4;c EHOMO=-Eox -4.93 eV;d ELUMO=EHOMO+Eg, op。 | ||||
合成了1个甲氧基修饰的平面化三苯胺化合物CMo。紫外吸收光谱和循环伏安测试结果表明,CMo可离域化程度很大,具有很好的给电子能力。本工作结果显示,CMo是一种很好的电子给体,甚至优于吲哚和三苯胺,有利于有机光电功能材料的吸收光谱拓宽,可用于新型有机光电功能材料的构筑。
| [1] |
EARMME T. Solution-processed efficient blue phosphorescent organic light-emitting diodes (PHOLEDs) enabled by hole-transport material incorporated single emission layer[J]. Materials (Basel, Switzerland), 2021. DOI:10.3390/ma14030554 |
| [2] |
ZHOU Z, QIAO H, HOU Y, et al. Epitaxial halide perovskite-based materials for photoelectric energy conversion[J]. Energy & Environmental Science, 2021, 14(1): 127-157. DOI:10.1039/D0EE02902E |
| [3] |
ZHANG J, ZHANG W, WU Y, et al. Wafer-scale Si-GaN monolithic integrated E-mode cascode FET realized by transfer printing and self-aligned etching technology[J]. IEEE Transactions on Electron Devices, 2020, 67(8): 3304-3308. DOI:10.1109/TED.2020.3001083 |
| [4] |
SUN H, LIU D, WANG T, et al. Enhanced internal quantum efficiency in dye-sensitized solar cells: Effect of long-lived charge-separated state of sensitizers[J]. ACS Applied Materials & Interfaces, 2017, 9(11): 9880-9891. DOI:10.1021/acsami.6b14993 |
| [5] |
SUN H, LIU D, WANG T, et al. Charge-separated sensitizers with enhanced intramolecular charge transfer for dye-sensitized solar cells: Insight from structure-performance relationship[J]. Organic Electronics, 2018, 61: 35-45. DOI:10.1016/j.orgel.2018.06.045 |
| [6] |
DEVADIGA D, SELVAKUMAR M, SHETTY P, et al. Recent developments in metal-free organic sensitizers derived from carbazole, triphenylamine, and phenothiazine for dye-sensitized solar cells[J]. International Journal of Energy Research, 2021, 45(5): 6584-6643. DOI:10.1002/er.6348 |
| [7] |
于奕峰, 胡智超, 吕海军, 等. 三苯胺类太阳能电池染料敏化剂的研究进展[J]. 河北科技大学学报, 2015, 36(2): 210-218. YU Yifeng, HU Zhichao, LYU Haijun, et al. Research progress of triphenylamine dye sensitizers of solar cells[J]. Journal of Hebei University of Science and Technology, 2015, 36(2): 210-218. (in Chinese) |
| [8] |
HORIUCHI T, YASHIRO T, KAWAMURA R, et al. Indoline dyes with benzothiazole unit for dye-sensitized solar cells[J]. Chemistry Letters, 2016, 45(5): 517-519. |
| [9] |
KOTTESWARAN S, RAMASAMY P. The influence of triphenylamine as a donor group on Zn-porphyrin for dye sensitized solar cell applications[J]. New Journal of Chemistry, 2021, 45(5): 2453-2462. DOI:10.1039/D0NJ05060A |
| [10] |
KURUMISAWA Y, HIGASHINO T, NIMURA S, et al. Renaissance of fused porphyrins: Substituted methylene-bridged thiophene-fused strategy for high-performance dye-sensitized solar cells[J]. Journal of the American Chemical Society, 2019, 141(25): 9910-9919. DOI:10.1021/jacs.9b03302 |
| [11] |
EZHOV A V, VYAL'BA F Y, ZHDANOVA K A, et al. Synthesis of donor-π-acceptor porphyrins for DSSC: DFT-study, comparison of anchoring mode and effectiveness[J]. Journal of Porphyrins and Phthalocyanines, 2020, 24(4): 538-547. DOI:10.1142/S1088424619501694 |
| [12] |
SUN H, LI P, LIU D, et al. Tuning photophysical properties via alkoxyl groups in charge-separated triphenylamine sensitizers for dye-sensitized solar cells[J]. Journal of Photochemistry and Photobiology A: Chemistry, 2019, 368: 233-241. DOI:10.1016/j.jphotochem.2018.09.033 |
| [13] |
DO K, KIM D, CHO N, et al. New type of organic sensitizers with a planar amine unit for efficient dye-sensitized solar cells[J]. Organic Letters, 2012, 14(1): 222-225. DOI:10.1021/ol203012s |
| [14] |
TIAN L, WANG Y, ZHANG Y, et al. Molecular engineering of indoline dyes and their application in dye-sensitized solar cells: Effect of planarity and side chain on interfacial charge-transfer processes[J]. ACS Applied Energy Materials, 2021, 4(1): 242-248. DOI:10.1021/acsaem.0c02199 |
| [15] |
LIU Y, ZHANG X, LI C, et al. Energy-level control via molecular planarization and its effect on interfacial charge-transfer processes in dye-sensitized solar cells[J]. The Journal of Physical Chemistry C, 2019, 123(22): 13531-13537. DOI:10.1021/acs.jpcc.9b03986 |
| [16] |
LIANG M, CHEN J. Arylamine organic dyes for dye-sensitized solar cells[J]. Chemical Society Reviews, 2013, 42(8): 3453-3488. DOI:10.1039/c3cs35372a |
| [17] |
FANG Z, CHELLAPPAN V, WEBSTER R D, et al. Bridged-triarylamine starburst oligomers as hole transporting materials for electroluminescent devices[J]. Journal of Materials Chemistry, 2012. DOI:10.1039/c2jm32840b |
| [18] |
CAI L P, TSAO H N, ZHANG W, et al. Organic sensitizers with bridged triphenylamine donor units for efficient dye-sensitized solar cells[J]. Advanced Energy Materials, 2013, 3(2): 200-205. DOI:10.1002/aenm.201200435 |
| [19] |
XU M, ZHOU D, CAI N, et al. Electrical and photophysical analyses on the impacts of arylamine electron donors in cyclopentadithiophene dye-sensitized solar cells[J]. Energy & Environmental Science, 2011, 4(11): 4735-4742. |
| [20] |
WANG S, GUO J, HE L, et al. Influence of thiophene and benzene unit in triphenylamine dyes on the performance of dye-sensitized solar cells[J]. Synthetic Metals, 2013, 168: 1-8. DOI:10.1016/j.synthmet.2013.02.010 |
| [21] |
LU X, FENG Q, LAN T, et al. Molecular engineering of quinoxaline-based organic sensitizers for highly efficient and stable dye-sensitized solar cells[J]. Chemistry of Materials, 2012, 24(16): 3179-3187. DOI:10.1021/cm301520z |
| [22] |
徐清, 陈红征, 施敏敏, 等. 甲氧基取代三苯胺的合成及其性能研究[J]. 材料科学与工程学报, 2007, 25(2): 190-192, 217. XU Qing, CHEN Hongzheng, SHI Minmin, et al. Synthesis and properties of methoxy-substituted triphenylamines[J]. Journal of Materials Science and Engineering, 2007, 25(2): 190-192, 217. (in Chinese) |
| [23] |
ZENG W, CAO Y, BAI Y, et al. Efficient dye-sensitized solar cells with an organic photosensitizer featuring orderly conjugated ethylenedioxythiophene and dithienosilole blocks[J]. Chemistry of Materials, 2010, 22(5): 1915-1925. DOI:10.1021/cm9036988 |
| [24] |
SANKAR M, BHYRAPPA P. Effect of solvent on the electronic absorption spectral properties of Ni(Ⅱ) and Cu(Ⅱ)-complexes of some mixed β-octasubstituted-meso-tetraphenylporphyrins[J]. Chemical Physics Letters, 2019, 730: 643-648. DOI:10.1016/j.cplett.2019.06.053 |
 2023, Vol. 40
2023, Vol. 40





