聚氯乙烯(PVC)具有便于加工、结构稳定、成本低廉等优越的物化性能,因而广泛应用于生产生活中的诸多领域[1-5]。氯乙烯(VCM)作为合成PVC的重要中间体,其合成工艺主要有乙烯法、乙烷法、乙烯乙烷法和乙炔法。由于我国独特的贫油富煤能源结构,乙炔法成为国内生产VCM的主要工艺方法。传统的电石乙炔法生产VCM使用HgCl2作为活性组分。由于HgCl2的毒性、挥发性和危害性,2013年,联合国环境规划署通过了《关于汞的水俣公约》,旨在限制汞的应用[6]。这给传统的乙炔氢氯化催化剂带来了许多挑战。
因此,寻找高性能无汞催化剂是一项迫切的需求。Hutchings等[2, 7, 8]开拓了金(Au)基催化剂在乙炔氢氯化中的应用,并取得了重大进展。但Au的成本过高,经济可行性问题严重限制了其规模化应用。Cu[9]、Bi[10]等金属较为经济,但活性较低。钌(Ru)相对于Au具有较低的成本,同时又具有相对较高的活性,因此倍受研究者关注[1]。目前,为了提升Ru基催化剂的稳定性和活性,研究者进行了大量尝试,比如引入离子液体的负载离子液相技术。尚珊珊等[11]通过四苯基溴化鏻(TPPB)改性,成功制备了高性能催化剂1%Ru@TPPB/AC,在170 ℃和360 h-1的条件下转化率高达99.7%。研究证明TPPB增加了Ru的分散,同时增强了氯化氢(HCl)的吸附进而抑制了积碳的发生。张金利等[12]开发了氮杂环卡宾配体(N-heterocyclic carbenes,NHC)改性的Ru基催化剂。通过NHC向Ru的电子转移,提高了HCl吸附能力,从而提高了反应活性。但是离子液体成本较高,氮杂化卡宾本身合成复杂且不稳定,这限制了其在氢氯化工业应用中的推广。而有机配体与过渡金属配合后具有独特的电子结构,使其也具有广泛的应用和研究前景。张海洋等研究了含磷配体[13]和咪唑类配体[14]对钌基催化剂的协同作用,取得了良好的催化活性和稳定性,其中氮、磷杂原子起了主要作用。李航等[15]研究发现N, N-二甲基丙撑脲(DMPU)配位后也可以提高反应活性,此类酰胺类有机物主要靠氧原子配位。但王小龙等[16]发现L-乳酸配位后削弱了反应活性,这证明氧原子的配位有赖于独特的分子结构。而氮氧吡啶(Py-NO)作为配体改性Ru基催化剂,这证明N—O键中的氧原子对催化性能也具有促进作用。在氢氯化研究中尚未有相关报导。
密度泛函理论(DFT)近年来常被应用于催化机理的研究中,为研究者提供了诸多深刻的理论见解。在乙炔氢氯化中,DFT同样被广泛用于机理分析中。朱明远等[17]研究了不同金属催化乙炔氢氯化的分子催化路径,Hg、Au和Ru的催化路径都显示出较低的能垒,这为Ru的催化活性提供理论基础。韩优等[18]研究了不同Cl配位的Ru团簇的催化过程,结果显示不同配位环境影响了其具体催化过程。有鉴于此,本研究也借助DFT研究了催化剂的催化机理。
基于以上考量,本论文选择氮氧吡啶作为配体,研究了不同氮氧吡啶含量对催化性能的影响。同时,根据实验和表征手段,分析了催化剂的活性和稳定性。并进行了DFT理论研究,结合TPD表征,分析了催化剂中的吸附过程。此外,基于前线轨道(FMO)理论,分析了催化剂的电子转移过程,印证了动力学分析。
1 实验部分 1.1 试剂与仪器椰壳炭(AC,16~45目),分析纯,福建鑫森炭业;三氯化钌(RuCl3),w(Ru)≥37%,毕得医药;氮氧吡啶(C5H5NO,Py-NO),分析纯,上海迈瑞尔;无水乙醇(C2H5OH),蒸馏水(H2O),氢氧化钠(NaOH),分析纯,天津市元立化工技术有限公司;高纯氮气(N2),体积分数99.999%,高纯氢气(H2),体积分数99.999%,天津环宇气体有限责任公司;氯化氢(HCl),体积分数99.9%,乙炔(C2H2),体积分数99.9%,东祥特种气体有限公司。
1.2 催化剂制备采用湿法浸渍技术制备系列催化剂[11]。以制备Ru-1%Py-NO/AC为例。首先,将0.270 g前驱体RuCl3溶解于去离子水中,加入到含有0.1 g Py-NO的水溶液中。然后,将混合物溶液滴加到10 g AC(已进行酸洗预处理)中,接着将混合物超声处理30 min。随后,样品于烘箱中80 ℃下加热12 h。最终将样品干燥处理,得到的催化剂记为Ru-1%Py-NO/AC,其中1%为配体与载体的质量比。为优化配体的添加量,保持w(Ru)为1%,调整配体用量,依次按照上述方法制备了Ru-5%Py-NO/AC,Ru-10%Py-NO/AC,Ru-15%Py-NO/AC和Ru-20%Py-NO/AC。另外制备了w(Ru)为1%的无配体催化剂Ru/AC,以及只负载10%配体的催化剂10%Py-NO/AC。
1.3 催化剂测试采用固定床反应器对催化剂活性和稳定性进行评价,装置如图 1所示。具体过程为:将2 mL催化剂置于反应管中,启动装置后首先用N2吹扫装置30 min,然后通入HCl气体对催化剂进行活化,时间为30 min。活化处理后通入C2H2气体进行反应,控制反应条件为:170 ℃,乙炔空速360 h-1,HCl与C2H2流量比为1.15。反应后气体经NaOH溶液吸收除去HCl,然后干燥除去水分,最终气体进入气相色谱(北分瑞利GC-3420A)确定组成。C2H2转化率(XA)、VCM选择性(SVC)如公式(1)和(2)所示。
| $ X_{\mathrm{A}}=1-\varphi_{\mathrm{A}} $ | (1) |
| $ S_{\mathrm{VC}}=\frac{\varphi_{\mathrm{VC}}}{1-\varphi_{\mathrm{A}}} $ | (2) |
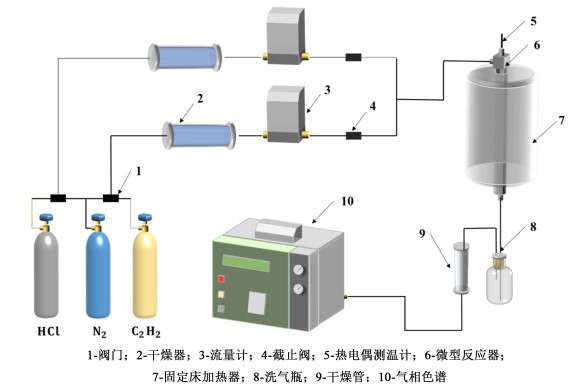
|
| 图 1 催化活性评价装置示意图 Fig.1 The schematic diagram of catalytic activity evaluation equipment |
| |
其中:φA为产物中剩余的C2H2体积分数;φVC为产物中剩余的VCM体积分数。
1.4 催化剂表征样品的比表面积和孔结构由彼奥德公司的SSA-7000型仪器测定,表面积采用BET方法,孔容采用HK方法;使用PHI500型X射线光电子能谱仪对催化剂表征获得X射线光电子能谱(XPS);采用美国康塔公司的AutoChem BET TPR/TPD型化学吸附仪对催化剂进行TPR和TPD检测;TEM图像由JEM-2100F型透射电镜拍摄;X射线衍射(XRD)分析是在布鲁克公司的D8 ADVANCE型X射线分析仪上进行的;热重(TG)分析是在Rigaku TG-DTA8122进行的。电感耦合等离子体光谱(ICP)是在iCAP 7400上测试的。
1.5 DFT模拟本研究中所有的理论计算都是基于Gaussian 09软件实现的[19]。所有计算都采取了DFT-D3方法对理论计算进行矫正[20]。所有结构在B3LYP-D3/def2-svp的计算级别下进行了优化[21, 22],所有稳定结构都进行了振动分析确保其没有虚频。为了获得更高精度,在M06L-D3/def2-tzvp计算级别下对所有结构进行了单点能计算,波函数分析和能量计算是基于这一精度实现的[23-26]。所有分子结构采用CYLview软件输出[27]。采用Multiwfn软件进行了波函数分析[28]。吸附能(Eads)的计算基于公式(3)计算。
| $ E_{\mathrm{ads}}=E_{\mathrm{R}}+E_{\mathrm{C}}-E_{\mathrm{RC}} $ | (3) |
式(3)中:ERC、ER和EC分别对应了催化剂-反应物复合吸附结构、反应物和催化剂的能量。
2 结果与讨论 2.1 催化剂性能测试催化剂性能评价主要基于催化剂在乙炔氢氯化反应中的转化率和选择性,测试条件为170 ℃,C2H2空速360 h-1,HCl与C2H2流量比为1.15。为了确定Py-NO的引入对活性的影响,分别测试AC、Ru/AC、Ru-10%Py-NO/AC以及10%Py-NO/AC的活性,其结果如图 2所示,在引入氮氧吡啶配体进行改性前,Ru/AC催化剂的活性和稳定性较差,转化率仅有58.3%,并在20 h内下降至44.4%。而在引入氮氧吡啶后,Ru-10%Py-NO/AC活性和稳定性都大为改善,转化率在20 h内维持在95%以上(96.1%至95.3%)。为了消除配体本身的影响,进一步分析AC和10%Py-NO/AC的活性。结果显示,AC的活性不足10%,其仅有的活性可能是载体的碳缺陷位点和官能团带来的[29, 30];负载Py-NO后,催化剂活性提升非常微弱,转化率不足13%,证明氮氧吡啶本身活性很低。这些数据表明,适量配体引入后可以显著提升催化剂活性与稳定性,可能是因为Py-NO与金属活性中心Ru之间产生了非常显著的协同作用,极大提升了催化剂的活性和稳定。此外所有样品的选择性都非常高,均超过99%。

|
| 图 2 催化剂的(a)乙炔转化率XA;(b)氯乙烯选择性SVC Fig.2 (a) Conversion of acetylene and (b) selectivity to VCM of different catalysts |
| |
为了深入分析Py-NO配体的添加量对催化性能的影响,进一步测试了不同Py-NO含量的催化剂的转化率和选择性,如图 3所示。随着氮氧吡啶含量的逐渐升高,Ru-1%Py-NO/AC、Ru-5%Py-NO/AC、Ru-10%Py-NO/AC、Ru-15%Py-NO/AC和Ru-20%Py-NO/AC对应转化率在20 h内变化分别由94.7%下降至81.1%,95.6%至88.0%,96.1%至95.3%,95.7%至93.1%和95.5至91.5%。结果显示Ru-10%Py-NO/AC在相同时间内转化率最高且降低程度最小。
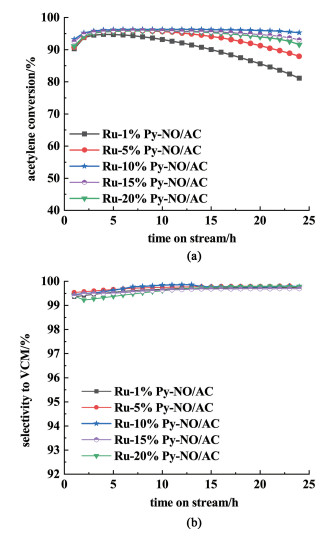
|
| 图 3 不同氮氧吡啶含量的催化剂的(a)乙炔转化率XA;(b)氯乙烯选择性SVC Fig.3 (a) Conversion of C2H2 and (b) selectivity to VCM of Ru-Py-NO/AC catalysts |
| |
将图 3(a)得到的催化剂失活速率数据展示在表 1。可以发现,随着Py-NO添加量升高,催化剂失活速率显著降低;但过量的配体使得失活速率上升。这意味着随着配体含量升高,协同效应逐渐增强,稳定性和活性逐渐升高,其中Ru-10%Py-NO/AC拥有最佳的活性和稳定性。但是,配体的进一步上升导致了催化剂稳定性和活性的下降,如Ru-20%Py-NO/AC。这可能是由于过量的配体引入堵塞了载体的孔道,影响了催化反应中的传质过程[11]。另外,所有催化剂都表现出了极高的选择性,全部超过99%。
| Catalysts | kD/(%·h-1) |
| Ru/AC | 0.70 |
| Ru-1%Py-NO/AC | 0.68 |
| Ru-5%Py-NO/AC | 0.38 |
| Ru-10%Py-NO/AC | 0.04 |
| Ru-15%Py-NO/AC | 0.13 |
| Ru-20%Py-NO/AC | 0.20 |
为了证明Py-NO与Ru之间的协同作用,参照文献[15],我们选择未改性的催化剂Ru/AC和优化配比后的催化剂Ru-10%Py-NO/AC作为研究对象,探究了催化剂的动力学性质。动力学测试的反应条件为:乙炔空速3 000 h-1,HCl与C2H2流量比为1.15,测试结果如图 4所示,Ru/AC和Ru-10%Py-NO/AC活性均随温度的升高而增加。通过进一步处理数据可以获得两种催化剂的反应活化能,结果如图 5所示。可以发现在Py-NO引入后,催化反应的活化能从34.95 kJ·mol-1下降至25.58 kJ·mol-1,这充分证明了Py-NO配体的引入改变了钌基催化剂的催化机理,使得其活化能显著下降,极大提高了反应速率。

|
| 图 4 不同温度下催化剂的反应活性:(a)Ru/AC;(b)Ru-10%Py-NO/AC Fig.4 Evaluations at different temperatures: (a) Ru/AC; (b) Ru-10%Py-NO/AC |
| |
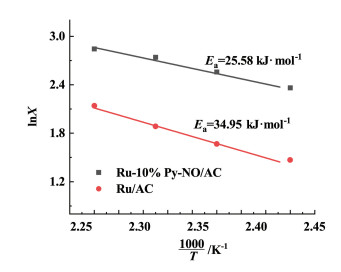
|
| 图 5 基于乙炔转化率的阿仑尼乌斯曲线 Fig.5 Arrhenius plots for C2H2 conversion over Ru/AC and Ru-10%Py-NO/AC |
| |
图 6展示了催化剂Ru-10%Py-NO/AC的元素分布状况,从mapping图可以发现,C、O、Cl、N、Ru元素在催化剂中都均匀分布,说明催化剂中Ru纳米颗粒的分散程度高,同时证明了Py-NO配体成功引入催化剂中,并且与钌混合存在。这种均匀分布的状态有利于增加催化活性位点的数量,进而提高反应活性。

|
| 图 6 Ru-10%Py-NO/AC的(a)高倍暗场扫描透射电镜图像;(b)~(f)对应元素扫描mapping图:C(蓝色),O(绿色),Cl(青色),N(红色),Ru(黄色) Fig.6 (a) HAADF-STEM image; (b)-(f) elemental mapping images of C (blue), O (green), Cl (cyan), N (red) and Ru (yellow), respectively for the Ru-10%Py-NO/AC catalyst |
| |
图 7进一步通过高分辨透射电镜(HRTEM)图像统计了催化剂Ru/AC和Ru-10%Py-NO/AC中Ru纳米颗粒的粒径。引入氮氧吡啶配体后Ru纳米颗粒的初始粒径从2.2 nm下降至1.5 nm,这证明了Py-NO的引入促进了Ru物种的分散。反应后无配体的Ru/AC的平均粒径为7.4 nm,这说明反应过程中Ru纳米颗粒发生了团聚,使得粒径变大。而Ru-10%Py-NO/AC在反应后的平均粒径为2.8 nm,远小于无配体的Ru/AC反应后的粒径。这证明配体的引入可以抑制反应过程中Ru物种的团聚。

|
| 图 7 催化剂的粒径统计:(a)新鲜Ru-10%py-NO/AC; (b)反应后Ru-10%py-NO/AC; (c)新鲜Ru/AC; (d)反应后Ru/AC Fig.7 The particle size distribution of (a) fresh Ru-10%py-NO/AC; (b) used Ru-10%py-NO/AC; (c) fresh Ru/AC; (d) used Ru/AC |
| |
同时对反应前后催化剂进行ICP分析结果如表 2所示。数据表明Ru含量基本符合添加量,且反应前后含量基本不变。这证明了Ru在催化反应过程中基本不存在质量损失,与过去研究结果[15, 31]是一致的。
| Catalysts | Ru content/% | |
| fresh | used | |
| Ru/AC | 0.920 | 0.917 |
| Ru-10%Py-NO/AC | 0.908 | 0.910 |
采用XRD分析了AC、Ru/AC、Ru-10%Py-NO/AC等样品的晶体结构,如图 8所示。3个样品均展示出了典型的非晶态碳结构。其中25°的衍射峰对应碳载体的(002)晶面,而43°的衍射峰对应碳载体的(101)晶面[30]。在含Ru的催化剂样品中均没有出现任何Ru的特征峰[32, 33]。这可能是因为Ru的含量太低,同时也代表钌本身分散性比较好,低于XRD的检测限。这和mapping结果相符,共同证明了Ru在催化剂中的优越分散性。
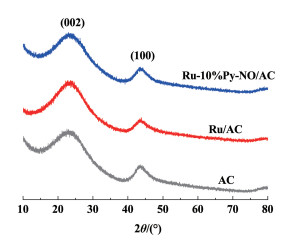
|
| 图 8 催化剂样品的X射线衍射结果 Fig.8 The XRD patterns of catalysts |
| |
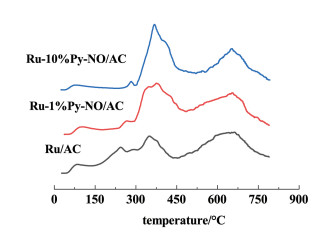
H2-TPR的结果可以用来分析催化剂中氧化态金属的价态信息及其化学环境。Ru/AC、Ru-1%Py-NO/AC、Ru-10%Py-NO/AC 3个催化剂的H2-TPR结果如图 9所示。
|
| 图 9 催化剂的H2-TPR表征结果 Fig.9 The H2-TPR profiles of Ru-Py-NO/AC catalysts |
| |
3个催化剂都在700 ℃附近出现了还原峰,这对应的是催化剂载体本身的官能团在高温下被氢气还原所体现出的结果[13]。而在200~400 ℃之间的还原峰可以对应催化剂中钌物种的还原[32, 34, 35]。在200~300 ℃的还原峰对应了RuO2物种[12, 13, 34, 36, 37],其中Ru/AC在245 ℃的还原峰对应了RuO2物种,而Ru-1%Py-NO/AC中该物种对应还原峰出现于265 ℃,Ru-10%Py-NO/AC的对应还原峰温度进一步升到280 ℃。在300~450 ℃的还原峰对应了RuCl3物种[12, 13, 34, 36, 37],其中Ru/AC、Ru-1%Py-NO/AC和Ru-10%Py-NO/AC的还原峰峰值分别出现在350 ℃、375 ℃和405 ℃。结果表明,随着Py-NO的引入,氧化态Ru物种的还原温度逐渐升高。这表明处于氧化态的Ru物种被还原的难度增加,换言之Py-NO的引入可以保护Ru物种免于被还原。先前的研究表明,Ru物种被还原后形成的Ru0是活性较差的钌物种[38]。韩优等[18]之前的理论工作里分析了不同Cl配位的含Ru团簇的催化机理。结果显示,Ru3团簇相对于Ru3Cl9,Ru3Cl7,Ru3Cl3和Ru5Cl7等团簇而言,对乙炔和VCM的吸附能力均较强。这阻碍了产物的脱附和反应的进行,而且过于强烈地吸附很可能会导致不饱和烯烃的聚合副反应的进行,这可能导致催化剂的积碳和失活[39, 40]。
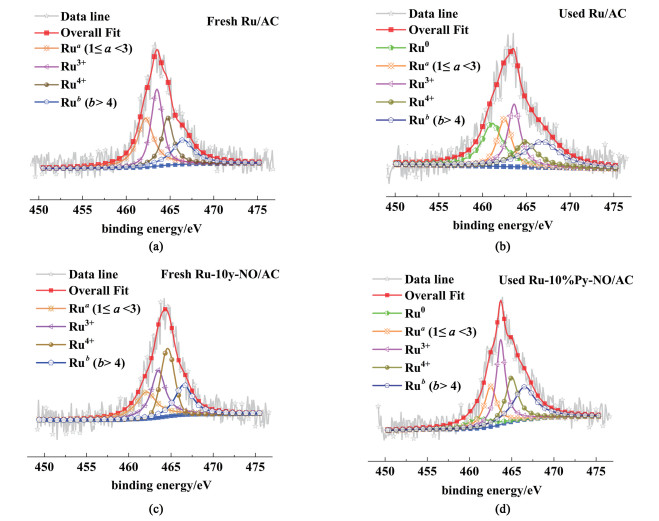
此外,本研究进一步利用XPS分析了催化剂Ru/AC和Ru-10%Py-NO/AC在反应前后Ru的价态分布的变化。Ru3p XPS结果如图 10所示。其中不同价态Ru对应了5个去卷积峰,分别为:Ru0 [461.1(±0.3) eV], Rua (1≤a < 3)[462.3(±0.3) eV], Ru3+[463.5(±0.3) eV], Ru4+[464.8(±0.3) eV]以及Rub(b>4)[466.7(±0.5)eV][11, 15, 41]。
|
| 图 10 不同催化剂的Ru3p XPS图谱:(a)新鲜Ru/AC催化剂;(b)反应后Ru/AC催化剂;(c)新鲜Ru-10%Py-NO/AC催化剂;(d)反应后Ru-10%Py-NO/AC催化剂 Fig.10 Ru3p XPS spectra for (a) fresh Ru/AC; (b) used Ru/AC; (c) fresh Ru-10%Py-NO/AC; (d) used Ru-10%Py-NO/AC |
| |
具体的价态分布信息展示在表 3中,对于新鲜催化剂而言,在引入Py-NO后,催化剂中氧化态Ru物种含量略有提高,但并不明显,这说明Py-NO的引入在提升Ru物种的价态方面影响并不显著。但对比催化反应前后,可以发现催化剂Ru/AC和Ru-10%Py-NO/AC在反应过程中还原态Ru0物种均出现增长的趋势,这证明反应过程中催化剂被还原了,可能是乙炔将催化剂中氧化态的Ru物种还原为还原态Ru0物种[11, 39]。但是值得注意的是,Ru/AC在反应前后Ru0增长了24.2%, 同时Ru3+下降了8.4%;与之形成对比的是引入配体后,Ru-10%Py-NO/AC中的Ru0物种反应前后仅增加了8.1%,而Ru3+下降了0.4%,都远低于Ru/AC。这充分证明Py-NO的引入能够抑制了RuCl3被还原为Ru0的过程。这与H2-TPR中还原温度延后的趋势一致,XPS结果进一步印证了这一论断。
| Catalysts | The percentage of different Ru species/% | ||||
| Ru0 | Rua | Ru3+ | Ru4+ | Rub | |
| Fresh Ru/AC | 30.0 | 28.8 | 20.6. | 20.6 | |
| Used Ru/AC | 24.2 | 16.1 | 20.4 | 17.1 | 22.2 |
| Fresh Ru-10%Py-NO/AC | 23.2 | 28.2 | 27.7 | 20.9 | |
| Used Ru-10% Py-NO/AC | 8.1 | 17.6 | 27.8 | 20.3 | 26.2 |
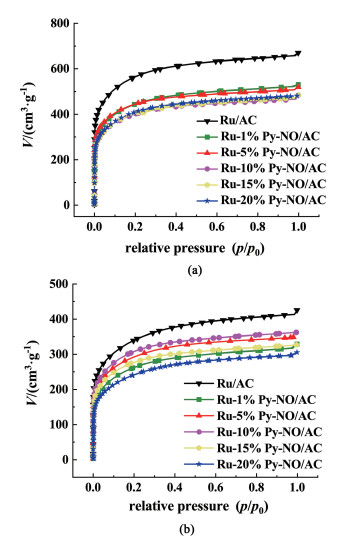
通过N2吸脱附表征分析了催化剂的孔道结构,其结果如图 11和表 4所示。当Py-NO配体引入后,催化剂的比表面积(SBET)和总孔容(Vtotal)下降。这说明配体成功引进催化剂中,并且随着配体含量的增加,催化剂的SBET和Vtotal逐渐下降。直至含量超过10%,变化不再明显。对比新旧催化剂,可以发现反应前后,SBET和Vtotal都大幅下降,这是因为反应过程中发生了积碳,堵塞了部分孔道。所以衡量这一变化可以在一定程度上反应催化剂积碳的程度[14]。表面积下降的比例(ΔSBET)和总孔容下降的比例(ΔVtotal)呈现出了一致的趋势:初期,随着配体含量的增加积碳的程度不断下降;而在引入过量配体后,积碳的程度又逐渐增强。积碳的程度和催化剂失活呈正相关,并且当Py-NO质量分数为10%时,抑制积碳的效果最佳,此时催化剂Ru-10%Py-NO/AC的活性和稳定性都很高,与前面得到的结果一致,说明积碳是该催化剂失活的重要原因。
|
| 图 11 (a) 新鲜催化剂的N2吸脱附等温线;(b)反应后催化剂的N2吸脱附等温线 Fig.11 The N2 adsorption/desorption isotherms of (a) fresh catalysts and (b) used catalysts |
| |
| Catalysts | SBET/(m2·g-1) | Vtotal/(cm3·g-1) | ΔSBET/% | ΔVtotal/% | |||
| fresh | used | fresh | used | ||||
| Ru/AC | 1 884.3 | 1 125.8 | 1.06 | 0.67 | 40.3 | 36.8 | |
| Ru-1%Py-NO/AC | 1 480.2 | 886.4 | 0.82 | 0.51 | 40.1 | 37.8 | |
| Ru-5%Py-NO/AC | 1 443.2 | 983.6 | 0.80 | 0.53 | 31.8 | 33.8 | |
| Ru-10%Py-NO/AC | 1 322.4 | 1 009.2 | 0.75 | 0.56 | 23.7 | 25.3 | |
| Ru-15%Py-NO/AC | 1 324.6 | 908.3 | 0.74 | 0.50 | 31.4 | 31.6 | |
| Ru-20%Py-NO/AC | 1 329.9 | 818.5 | 0.74 | 0.47 | 38.5 | 36.5 | |
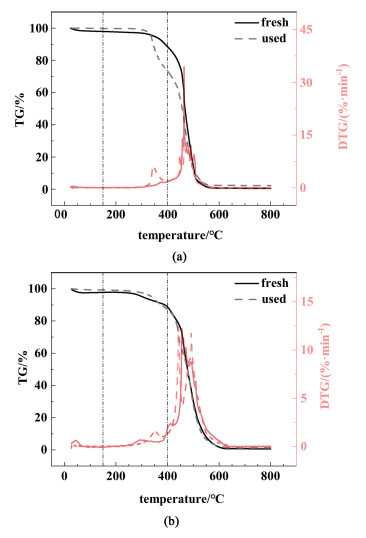
同时对反应前后的催化剂Ru/AC和Ru-10%Py-NO/AC进行了热重分析,参照过往文献[11, 12, 32, 35],以150~400 ℃的质量损失差值来代表其中积碳的含量。结果如图 12所指示,Ru/AC和Ru-10%py-NO/AC的积碳含量分别为17.0%和2.8%。这进一步印证了配体的引入抑制了催化反应过程的积碳。
|
| 图 12 反应前后催化剂的热重分析:(a)Ru/AC;(b)Ru-10%py-NO/AC Fig.12 TG and DTG profiles of the fresh and used catalysts: (a) Ru/AC; (b) Ru-10%py-NO/AC |
| |
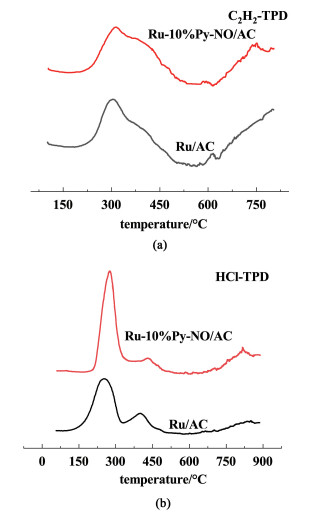
在气固相催化中,反应物的吸附是催化过程的重要环节。TPD可以表征样品对不同气体的吸附能力,这正是催化过程中备受关注的信息。因此分析了催化剂对C2H2和HCl的吸附性能,其TPD结果如图 13所示。
|
| 图 13 不同催化剂的(a)C2H2吸脱附曲线;(b)HCl吸脱附曲线 Fig.13 (a) C2H2-TPD and (b) HCl-TPD curves of the different Ru-based catalysts |
| |
分析结果发现,引入Py-NO配体后催化剂对C2H2和HCl的吸附面积都有所增强,C2H2的脱附温度从304 ℃上升至314 ℃,而HCl的脱附温度从253 ℃上升至276 ℃。这表明Py-NO的引入对HCl吸附促进作用更大。
本研究进行了DFT模拟分析,使用的分子结构如图 14所示。对比图 15中展示的吸附能结果可以发现,RuCl3对C2H2的吸附性能(105.4 kJ·mol-1)强于HCl(50.6 kJ·mol-1),这证明反应中C2H2优先吸附。而相对于RuCl3,Py-NO对HCl的吸附性能(41.8 kJ·mol-1)远强于C2H2(18.4 kJ·mol-1)。这对应了TPD分析中,引入Py-NO配体后对HCl的吸附性能提升显著强于C2H2。过去的文献研究[15]显示,HCl的活化是反应过程的重要环节。在反应中,乙炔作为π电子供体,吸附于过渡金属团簇,这使得其不饱和键被削弱进而被活化,这时需要被活化的HCl提供Cl从而生成产物,如果HCl的供应不足,则会导致载体积碳和金属被还原的增强。而配位后的络合Ru团簇RuCl3-Py-NO对反应物的吸附能则较为均衡,这有助反应的进行和催化剂稳定[42]。
|
| 图 14 本研究中使用的分子结构示意图 Fig.14 The optimized geometries used in this work |
| |

|
| 图 15 分子间的吸附结构及其吸附能:吸附于RuCl3的(a) C2H2;(b) HCl;吸附于RuCl3-Py-NO的(c) C2H2; (d) HCl;吸附于Py-NO的(e) C2H2; (f) HCl;(g) RuCl3 Fig.15 The optimized geometries and adsorption energies of (a) C2H2 and (b) HCl absorbed on RuCl3; (c) C2H2 and (d) HCl absorbed on RuCl3-Py-NO; (e) C2H2; (f) HCl and (g) RuCl3 absorbed on Py-NO |
| |
同时,值得注意的是,RuCl3与Py-NO之间吸附能可达136.8 kJ·mol-1,而C2H2与RuCl3之间的吸附能为105.4 kJ·mol-1,这意味着Py-NO与RuCl3的配位作用强于C2H2与RuCl3的配位作用,这也印证了Py-NO抑制RuCl3还原的猜测。
2.6 催化机理的讨论催化机理的研究,对设计催化剂具有极为重要的意义。本研究采用了波函数分析的方式,以电子结构等微观信息作为手段,分析催化过程中最重要的微观过程,即电子转移,初步讨论了乙炔氢氯化过程的催化机理。分析手段基于前线轨道理论,在图 16和表 5中展示了C2H2和HCl的最高被占据轨道(HOMO)和最低未占据轨道(LUMO)信息。
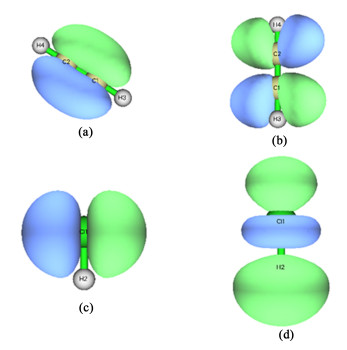
|
| 图 16 C2H2和HCl的前线轨道:(a) C2H2-HOMO; (b) C2H2-LUMO; (c) HCl-HOMO; (d) HCl-LUMO Fig.16 The frontier molecular orbital of C2H2 and HCl: (a) C2H2-HOMO; (b) C2H2-LUMO; (c) HCl-HOMO; (d) HCl-LUMO |
| |
| Molecular | The frontier molecular orbital energies/eV | |
| HOMO | LUMO | |
| C2H2 | -7.26 | 0.16 |
| HCl | -8.23 | -0.21 |
根据前线轨道理论分子间发生电子转移,主要是发生在FMO,位于HOMO的电子能量最高,所以易于失去;LUMO的轨道能量最低,容易接受新的电子。因此,电子转移一般是电子从供体分子的HOMO转移至受体分子的LUMO,而能量差值衡量了这一转移过程的难易程度。
图 16中,图 16(a)为C2H2的HOMO,其主体是C原子之间的共轭π键的分子轨道;图 16(b)是C2H2的LUMO,其主要为碳原子之间的反键轨道π*;图 16(c)为HCl的HOMO,这主要是由Cl原子的p电子轨道构成的;图 16(d)是HCl的LUMO,这是H原子s电子轨道和Cl原子p电子轨道之间的反键轨道σ*。由表 5数据计算可以发现,C2H2的LUMO和HCl的HOMO间的能量差值为8.40 eV;而C2H2的HOMO和HCl的LUMO间能量差值为7.04 eV。这说明电子更倾向于从C2H2转移到HCl。更进一步说,C2H2失去其HOMO即π共轭轨道的电子,这削弱了
当这一过程存在催化剂参与后,情况则有所不同。RuCl3和Py-NO的分子轨道信息如图 17与表 6所示。RuCl3的HOMO和LUMO都是Ru原子的3d轨道与Cl原子的p轨道混合成的复杂轨道;而Py-NO的HOMO和LUMO则主要是N原子与O原子的p轨道构成的;Py-NO配位RuCl3后,分子结构的HOMO和LUMO与RuCl3的结构很接近,证明Py-NO配位后活跃的前线轨道仍然主要位于RuCl3附近。此外,Py-NO的O原子具有孤对电子,电子密度较高,这使得其HOMO的能量更高,故而更容易提供电子。Py-NO作为配体与RuCl3配位后,分析2者的HOMO和LUMO,发现Py-NO提供HOMO进行供电子的能量差为0.27 eV,这代表此电子转移过程极易发生。配体向Ru原子提供电子后使得其附近的HOMO轨道能量升高。
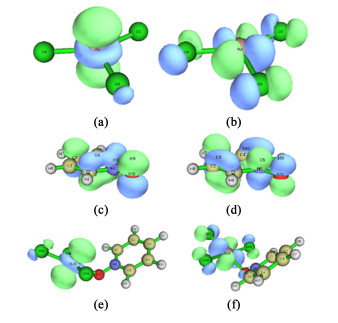
|
| 图 17 RuCl3、Py-NO和RuCl3-Py-NO配位结构的前线轨道:(a) RuCl3-HOMO; (b) RuCl3-LUMO; (c) Py-NO-HOMO; (d) Py-NO-LUMO; (e) RuCl3-Py-NO-HOMO; (f) RuCl3-Py-NO-LUMO Fig.17 The frontier molecular orbital of RuCl3, Py-NO and RuCl3-Py-NO: (a) C2H2-HOMO; (b) C2H2-LUMO; (c) Py-NO-HOMO; (d) Py-NO-LUMO; (e) RuCl3-Py-NO-HOMO; (f) RuCl3-Py-NO-LUMO |
| |
| Molecular | The frontier molecular orbital energies/eV | |
| HOMO | LUMO | |
| RuCl3 | -6.55 | -5.17 |
| Py-NO | -5.44 | -1.88 |
| RuCl3-Py-NO | -5.53 | -4.30 |
含Ru团簇参与催化过程进而改变了其中的电子转移过程,计算了不同的分子团簇与反应物的不同电子轨道发生转移的能量差,如表 7所示。当RuCl3与反应物的HOMO发生电子转移时,显然RuCl3的LUMO与C2H2的能量差值比HCl更小,这代表RuCl3更倾向于接受C2H2的π电子与之形成配位结构。而当RuCl3的HOMO参与电子转移时,HCl的LUMO能量与其更为接近,也即RuCl3倾向于将电子转移给HCl的反键轨道σ*。RuCl3在整个催化过程的电子转移中一方面接受C2H2的电子,另一方面向HCl提供电子,完成了电子转移过程。但Py-NO参与催化过程时,2种电子转移路径的能量差都只有轻微的下降,这与Py-NO催化活性十分微弱的结果是一致的。对比上述分析可以发现,RuCl3作为催化剂参与反应,深刻地影响了催化过程的机理。它起到了电子转移中转站的作用,将整个电子转移过程一分为二,同时也降低了电子转移的能量差,使反应易于发生。
| Molecular | The frontier molecular orbital energy difference/eV | ||||
| C2H2 | HCl | ||||
| HOMO | LUMO | HOMO | LUMO | ||
| RuCl3 | 2.09 | 6.71 | 3.07 | 6.34 | |
| Py-NO | 5.37 | 5.60 | 6.35 | 5.22 | |
| RuCl3-Py-NO | 2.96 | 5.69 | 3.93 | 5.32 | |
进一步分析其原因,RuCl3显著降低反应物HOMO提供电子的过程。这是因为Ru作为过渡金属,具有空余的d电子轨道,从而使得Ru团簇的LUMO轨道能量非常低,易于接受电子。与之对应的,RuCl3团簇的HOMO轨道能量更低。这限制了团簇向HCl转移电子,使其活化的过程。表 7数据的分析证明,Py-NO配位后团簇的HOMO能量提高,这使得RuCl3-Py-NO与反应物的LUMO发生电子转移的能量差小于RuCl3。所以从电子转移的角度出发,配体的引入提高了含Ru团簇接受C2H2电子的能量差,但是降低了含Ru团簇向HCl供电过程的能量差,而后者是电子转移过程能量差较大的部分。电子转移能量的下降与前文中活化能的下降相吻合,这从微观层面揭示了Py-NO配体影响催化过程的方式。
3 结论1) 通过湿法浸渍创新性地制备了Py-NO配位的新型钌基催化剂,具有良好的活性和稳定性。其中优化配比后的催化剂Ru-10%Py-NO/AC在170 ℃,乙炔空速360 h-1,HCl与乙炔流量比为1.15下,转化率高达96.1%,20 h内只下降了0.8%。且Py-NO的引入使得反应活化能从34.95 kJ·mol-1降至25.58 kJ·mol-1。
2) TEM和XRD结果证明了催化剂中Ru的优良分散性。H2-TPR和XPS结果揭示了Py-NO配体抑制了氧化态Ru物种在反应过程中的还原。BET和TG数据表明Py-NO的引入抑制了催化剂的积碳。TPD数据说明配体的引入增强了催化剂对反应物的吸附。
3) 基于FMO理论,分析了催化过程的电子转移。理论计算发现,Ru可以作为电子转移的中转站,大大降低了其能量差。而配体的引入,进一步减弱了Ru向HCl提供电子的能量差,这可能是协同作用的微观机理,与上述实验结果相印证,为钌基催化剂的进一步研发提供了理论启发。
| [1] |
ZHONG J, XU Y, LIU Z. Heterogeneous non-mercury catalysts for acetylene hydrochlorination: Progress, challenges, and opportunities[J]. Green Chemistry, 2018, 20(11): 2412-2427. DOI:10.1039/C8GC00768C |
| [2] |
JOHNSTON P, CARTHEY N, HUTCHINGS G J. Discovery, development, and commercialization of gold catalysts for acetylene hydrochlorination[J]. Journal of the American Chemical Society, 2015, 137(46): 14548-14557. DOI:10.1021/jacs.5b07752 |
| [3] |
DAVIES C J, MIEDZIAK P J, BRETT G L, et al. Vinyl chloride monomer production catalysed by gold: A review[J]. Chinese Journal of Catalysis, 2016, 37(10): 1600-1607. DOI:10.1016/S1872-2067(16)62482-8 |
| [4] |
SCHOBERT H. Production of acetylene and acetylene-based chemicals from coal[J]. Chemical Reviews, 2014, 114(3): 1743-1760. DOI:10.1021/cr400276u |
| [5] |
XU H, LUO G. Green production of PVC from laboratory to industrialization: State-of-the-art review of heterogeneous non-mercury catalysts for acetylene hydrochlorination[J]. Journal of Industrial and Engineering Chemistry, 2018, 65: 13-25. DOI:10.1016/j.jiec.2018.05.009 |
| [6] |
MACKEY T K, CONTRERAS J T, LIANG B A. The Minamata Convention on Mercury: Attempting to address the global controversy of dental amalgam use and mercury waste disposal[J]. Science of the Total Environment, 2014, 472: 125-129. DOI:10.1016/j.scitotenv.2013.10.115 |
| [7] |
NKOSI B, COVILLE N J, HUTCHINGS G J. Vapour phase hydrochlorination of acetylene with group VⅢ and IB metal chloride catalysts[J]. Applied Catalysis, 1988, 43(1): 33-39. DOI:10.1016/S0166-9834(00)80898-2 |
| [8] |
HUTCHINGS G J. Vapor phase hydrochlorination of acetylene: Correlation of catalytic activity of supported metal chloride catalysts[J]. Journal of Catalysis, 1985, 96(1): 292-295. DOI:10.1016/0021-9517(85)90383-5 |
| [9] |
LI H, WANG F, CAI W, et al. Hydrochlorination of acetylene using supported phosphorus-doped Cu-based catalysts[J]. Catalysis Science & Technology, 2015, 5(12): 5174-5184. |
| [10] |
LIAN L, WANG L, YAN H, et al. Non-mercury catalytic acetylene hydrochlorination over Bi/CNTs catalysts for vinyl chloride monomer production[J]. Journal of Materials Research and Technology, 2020, 9(6): 14961-14968. DOI:10.1016/j.jmrt.2020.10.072 |
| [11] |
SHANG S, ZHAO W, WANG Y, et al. Highly efficient Ru@IL/AC to substitute mercuric catalyst for acetylene hydrochlorination[J]. ACS Catalysis, 2017, 7(5): 3510-3520. DOI:10.1021/acscatal.7b00057 |
| [12] |
CAI M, ZHANG H, MAN B, et al. Synthesis of a vinyl chloride monomer via acetylene hydrochlorination with a ruthenium-based N-heterocyclic carbene complex catalyst[J]. Catalysis Science & Technology, 2020, 10(11): 3552-3560. |
| [13] |
LI J, ZHANG H, LI L, et al. Synergistically catalytic hydrochlorination of acetylene over the highly dispersed Ru active species embedded in P-containing ionic liquids[J]. ACS Sustainable Chemistry & Engineering, 2020, 8(27): 10173-10184. |
| [14] |
LI J, ZHANG H, CAI M, et al. Enhanced catalytic performance of activated carbon-supported ru-based catalysts for acetylene hydrochlorination by azole ligands[J]. Applied Catalysis A: General, 2020. DOI:10.1016/j.apcata.2020.117431 |
| [15] |
LI H, WU B, WANG F, et al. Achieving efficient and low content Ru-based catalyst for acetylene hydrochlorination based on N, N'-dimethylpropyleneurea[J]. Chem Cat Chem, 2018, 10(18): 4090-4099. |
| [16] |
WANG X, LAN G, CHENG Z, et al. Carbon-supported ruthenium catalysts prepared by a coordination strategy for acetylene hydrochlorination[J]. Chinese Journal of Catalysis, 2020, 41(11): 1683-1691. DOI:10.1016/S1872-2067(20)63616-6 |
| [17] |
ZHU M, KANG L, SU Y, et al. MClx (M=Hg, Au, Ru; x=2, 3) catalyzed hydrochlorination of acetylene—A density functional theory study[J]. Canadian Journal of Chemistry, 2013, 91(2): 120-125. DOI:10.1139/cjc-2012-0308 |
| [18] |
HAN Y, SUN M, LI W, et al. Influence of chlorine coordination number on the catalytic mechanism of ruthenium chloride catalysts in the acetylene hydrochlorination reaction: A DFT study[J]. Physical Chemistry Chemical Physics: PCCP, 2015, 17(12): 7720-7730. DOI:10.1039/C5CP00231A |
| [19] |
FRISCH M J, TRUCKS G W, SCHLEGEL H B, et al. Gaussian 09 (Revision D.01)[M]. Wallingford, CT: Gaussian Inc., 2010.
|
| [20] |
GRIMME S, ANTONY J, EHRLICH S, et al. A consistent and accurate ab initio parametrization of density functional dispersion correction (DFT-D) for the 94 elements H-Pu[J]. The Journal of Chemical Physics, 2010. DOI:10.1063/1.3382344 |
| [21] |
EICHKORN K, WEIGEND F, TREUTLER O, et al. Auxiliary basis sets for main row atoms and transition metals and their use to approximate Coulomb potentials[J]. Theoretical Chemistry Accounts, 1997, 97(1/2/3/4): 119-124. |
| [22] |
MIEHLICH B, SAVIN A, STOLL H, et al. Results obtained with the correlation energy density functionals of Becke and Lee, Yang and Parr[J]. Chemical Physics Letters, 1989, 157(3): 200-206. DOI:10.1016/0009-2614(89)87234-3 |
| [23] |
WEIGEND F, HÄSER M, PATZELT H, et al. RI-MP2: Optimized auxiliary basis sets and demonstration of efficiency[J]. Chemical Physics Letters, 1998, 294(1/2/3): 143-152. |
| [24] |
WEIGEND F, AHLRICHS R. Balanced basis sets of split valence, triple zeta valence and quadruple zeta valence quality for H to Rn: Design and assessment of accuracy[J]. Physical Chemistry Chemical Physics: PCCP, 2005, 7(18): 3297-3305. DOI:10.1039/b508541a |
| [25] |
ZHAO Y, TRUHLAR D G. Improved description of nuclear magnetic resonance chemical shielding constants using the M06-L meta-generalized-gradient-approximation density functional[J]. The Journal of Physical Chemistry A, 2008, 112(30): 6794-6799. DOI:10.1021/jp804583d |
| [26] |
ZHAO Y, TRUHLAR D G. A new local density functional for main-group thermochemistry, transition metal bonding, thermochemical kinetics, and noncovalent interactions[J]. The Journal of Chemical Physics, 2006. DOI:10.1063/1.2370993 |
| [27] |
Legault C Y. CYLview, 1.0b[EB/L]. Université de Sherbrooke, 2009, http://www.cylview.org
|
| [28] |
LU T, CHEN F. Multiwfn: A multifunctional wavefunction analyzer[J]. Journal of Computational Chemistry, 2012, 33(5): 580-592. DOI:10.1002/jcc.22885 |
| [29] |
LIU Y, ZHANG H, DONG Y, et al. Characteristics of activated carbons modulate the catalytic performance for acetylene hydrochlorination[J]. Molecular Catalysis, 2020. DOI:10.1016/j.mcat.2019.110707 |
| [30] |
QIU Y, ALI S, LAN G, et al. Defect-rich activated carbons as active and stable metal-free catalyst for acetylene hydrochlorination[J]. Carbon, 2019, 146: 406-412. DOI:10.1016/j.carbon.2019.01.102 |
| [31] |
KAISER S K, LIN R H, KRUMEICH F, et al. Preserved in a shell: High-performance graphene-confined ruthenium nanoparticles in acetylene hydrochlorination[J]. Angewandte Chemie International Edition, 2019, 58(35): 12297-12304. DOI:10.1002/anie.201906916 |
| [32] |
PU Y, ZHANG J, YU L, et al. Active ruthenium species in acetylene hydrochlorination[J]. Applied Catalysis A: General, 2014, 488: 28-36. DOI:10.1016/j.apcata.2014.09.037 |
| [33] |
CUI X, CHEN L, WANG Y, et al. Fabrication of hierarchically porous RuO2-CuO/Al-ZrO2 composite as highly efficient catalyst for ammonia-selective catalytic oxidation[J]. ACS Catalysis, 2014, 4(7): 2195-2206. DOI:10.1021/cs500421x |
| [34] |
ZHANG H, LI W, JIN Y, et al. Ru-co(Ⅲ)-Cu(Ⅱ)/SAC catalyst for acetylene hydrochlorination[J]. Applied Catalysis B: Environmental, 2016, 189: 56-64. DOI:10.1016/j.apcatb.2016.02.030 |
| [35] |
ZHAO W, LI W, ZHANG J. Ru/N-AC catalyst to produce vinyl chloride from acetylene and 1, 2-dichloroethane[J]. Catalysis Science & Technology, 2016, 6(5): 1402-1409. |
| [36] |
LI X, ZHANG H, MAN B, et al. Activated carbon-supported tetrapropylammonium perruthenate catalysts for acetylene hydrochlorination[J]. Catalysts, 2017. DOI:10.3390/catal7100311 |
| [37] |
MAN B, ZHANG H, ZHANG C, et al. Effect of Ru/Cl ratio on the reaction of acetylene hydrochlorination[J]. New Journal of Chemistry, 2017, 41(23): 14675-14682. DOI:10.1039/C7NJ03863A |
| [38] |
WANG X, LAN G, LIU H, et al. Effect of acidity and ruthenium species on catalytic performance of ruthenium catalysts for acetylene hydrochlorination[J]. Catalysis Science & Technology, 2018, 8(23): 6143-6149. |
| [39] |
NKOSI B, ADAMS M D, COVILLE N J, et al. Hydrochlorination of acetylene using carbon-supported gold catalysts: A study of catalyst reactivation[J]. Journal of Catalysis, 1991, 128(2): 378-386. DOI:10.1016/0021-9517(91)90296-G |
| [40] |
LI X, LI P, PAN X, et al. Deactivation mechanism and regeneration of carbon nanocomposite catalyst for acetylene hydrochlorination[J]. Applied Catalysis B: Environmental, 2017, 210: 116-120. DOI:10.1016/j.apcatb.2017.03.046 |
| [41] |
HAN Y, ZHANG H, LI Y, et al. Ruthenium catalyst coordinated with[N4444+][PF6-] ionic liquid for acetylene hydrochlorination[J]. Catalysis Today, 2020, 355: 205-213. DOI:10.1016/j.cattod.2019.03.042 |
| [42] |
CEN Y, YUE Y, WANG S, et al. Adsorption behavior and electron structure engineering of Pd-based catalysts for acetylene hydrochlorination[J]. Catalysts, 2019. DOI:10.3390/catal10010024 |
 2023, Vol. 40
2023, Vol. 40





