2. 广西壮族自治区产品质量检验研究院, 南宁 530007
2. Guangxi Zhuang Autonomous Region Testing Institute of Product Quality, Nanning 530007, China
锂在储能材料和清洁核能开发中占有重要地位,被称为“21世纪的战略元素”,因此,锂资源开发利用直接关系到国家能源安全与战略需求。中国目前已探明锂资源为700万t,位列全球第4,其中盐湖锂资源占71%份额,主要集中在柴达木盆地盐区(察尔汗、东台吉乃尔、西台吉乃尔、大柴旦、一里坪盐湖)和西藏的扎布耶盐湖等。由于卤水中锂的赋存形式简单,便于富集浓缩,其提锂工艺相对简单,生产成本低,相比矿石法提锂而言,具有较大的资源优势和成本优势。因此,从盐湖卤水中分离提取锂盐产品已成为当前各国争夺能源战略高地的重中之重。
目前,适用于中国高Mg/Li比卤水提锂方法主要有萃取法、膜法和吸附法等[1-6]。对于含锂浓度低的卤水,吸附法是一种比较有应用前景的方法。吸附法关键是找到对锂有特殊选择性的吸附剂,能从卤水中选择性地提取锂。目前,研究较多的吸附剂有铝盐吸附剂[7-9]和离子筛型氧化物,离子筛型氧化物主要分为钛系离子筛[10, 11]和锰系离子筛[12-15],其中锰系离子筛具有成本低、选择性高和吸附量大等优点,因此得到广泛关注。
本课题组前期研究了锂离子筛粉体制备,该吸附剂在水盐复杂体系中具有良好的Li+选择性。但由于其形态为粉状,颗粒尺寸仅有数百纳米,对卤水连续吸附分离锂离子带来很大的操作困难,无法直接工业应用,需对粉体吸附材料进行成型,以便工业化应用。根据成型离子筛的形状,可以分为造粒和成膜。肖国萍[16]以PVC采用相转化法制备锂离子筛前驱体小球,研究表明球状离子筛酸洗和吸附速率较快。
膜成型相对于造粒而言,可以有效地降低内扩散阻力,同时也能够增加卤水和吸附材料的接触面积,使提锂效率上升。为此,国内外研究者在锂离子筛成型方面进行了相关的研究工作。陈小棉[17]分别制备了H1.6Mn1.6O4-PVC杂化膜和H1.6Mn1.6O4-PVDF杂化膜,杂化膜表现出对Li+较高的吸附容量;Myoung Jun Park等[18]制备并评价PAN锂离子筛膜,研究表明纳米-微米级的纤维可以有效地作为支撑材料;Myoung Jun Park等[19]采用静电纺丝法制备PSF锂离子筛膜,并将其制备成反应器应用于连续操作,在短周期内体现了良好的动态吸附容量。这些研究证明,膜成型可以有效地降低内扩散,同时也能够增加卤水和吸附材料的接触面积。但这些研究都未对制备条件对所制备的无机-有机杂化膜的力学性能和吸附性能影响进行系统研究。
聚氯乙烯是由氯乙烯单体在引发剂(如过氧化物、偶氮化合物等),或光、热作用下按自由基聚合反应机理聚合而生成的聚合物。聚氯乙烯膜具有耐酸碱、耐微生物侵蚀、耐磨性、机械强度好以及通量大的优点,主要用于制备超滤膜。本工作采用PVC为成膜材料,N, N-二甲基乙酰胺(DMAC)作为溶剂,相转化法制备锂离子筛膜,系统研究了制膜条件、铸膜液浓度、Li4Mn5O12的含量、膜厚以及成孔剂含量对膜吸附性能和力学性能的影响。研究目的是为离子筛膜成型、PVC与其他材料共混膜以及杂化膜制备提供思路和对比参数。
1 实验部分 1.1 膜材料制备准确称取一定量的DMAC,在搅拌条件下加入定量PVC以及聚乙二醇(PEG),配制成PVC铸膜液,混合后于70 ℃加热搅拌,使PVC以及PEG溶于DMAC,最后加入实验室自制的一定量Li4Mn5O12离子筛前驱体,使用乳化机将铸膜液进行乳化,使Li4Mn5O12充分分散于溶剂中,配制成含锂离子筛的铸膜液,用涂膜机在洁净的玻璃板上涂制1层一定厚度的液膜,从而制得棕色的离子筛前驱体膜M[Li]。将膜连同玻璃板浸入去离子水中,膜固化并自动剥离玻璃,每隔4 h换1次水,24 h后放入60 ℃的烘箱烘干备用。将一定量的前驱体膜M[Li]加入到一定体积的0.5 mol·L-1 HCl(pH=0.301)中进行完全脱附,用去离子水多次洗涤,得M[H]即为PVC离子筛膜,具体流程见图 1。
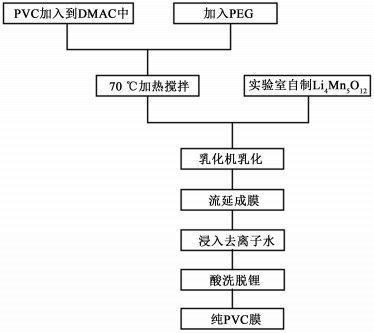
|
| 图 1 制膜流程图 Fig.1 Flow chart of membrane preparation |
| |
使用涂膜机在洁净的玻璃板上涂制一层一定厚度的液膜过程中,保持其他制膜条件相同,控制涂膜速度不同(10、20、30、40、50 mm·s-1),分别考察其饱和吸附量及酸洗脱附率,研究涂膜速度对锂离子筛膜性能的影响。
另外,实验中保持其他制膜条件相同,控制涂膜后液膜与玻璃板分离时间的不同,分别考察其饱和吸附量及酸洗脱附率。
1.1.2 PVC浓度实验中改变PVC铸膜液的质量浓度(11.11%、13.64%、16.28%、19.05%和21.95%),保持Li4Mn5O12含量63.83%(质量分数, 下同),以及PEG含量4.44%不变,研究铸膜液中PVC浓度对吸附量、脱附率以及膜物理性能影响。PVC、Li4Mn5O12以及PEG含量分别根据式(1)~式(3) 计算。
| $ w(\mathrm{PVC})=\frac{m(\mathrm{PVC})}{m(\mathrm{DMAC})} \times 100 \% $ | (1) |
| $ w\left(\mathrm{Li}_4 \mathrm{Mn}_5 \mathrm{O}_{12}\right)=\frac{m\left(\mathrm{Li}_4 \mathrm{Mn}_5 \mathrm{O}_{12}\right)}{m\left(\mathrm{Li}_4 \mathrm{Mn}_5 \mathrm{O}_{12}\right)+m(\mathrm{PVC})} \times 100 \% $ | (2) |
| $ w(\mathrm{PEG})=\frac{m(\mathrm{PEG})}{m(\mathrm{DMAC})} \times 100 \% $ | (3) |
随着Li4Mn5O12前驱体含量的增高,理论上PVC-离子筛膜的吸附容量亦会随之增高,但过高的前驱体含量可能会导致膜对前驱体的粘结程度减弱,膜表面出现缺陷,从而导致前驱体从膜表面脱落下来,膜的机械性能和吸附性能降低。实验中改变Li4Mn5O12含量(49.72%、57.69%、63.83%、68.70%和72.66%),同时保持PVC浓度19.05%,以及PEG含量4.44%不变,研究铸膜液中Li4Mn5O12加入量对吸附量、脱附率以及膜物理性能影响。
1.1.4 膜厚在制备膜过程中,改变涂膜厚度(0.3、0.6、0.9和1.2 mm),同时保持PVC含量19.05%,Li4Mn5O12含量63.83%,以及PEG含量4.44%不变,分别考察其饱和吸附量及酸洗脱附率,研究膜厚对吸附量、脱附率以及膜物理性能影响。
1.1.5 成孔剂含量在制备膜过程中,改变PEG质量分数(0、2.32%、4.44%、6.98%和9.30%),同时保持PVC浓度19.05%以及Li4Mn5O12质量分数63.83%不变,分别考察其饱和吸附量及酸洗脱附率,研究成孔剂含量对吸附量、脱附率以及膜物理性能影响。
1.2 分析方法 1.2.1 pH值及电导率测试实验过程中所使用溶液的pH值采用雷磁公司PHSJ-3F型pH计检测,电导率则采用DDS-307型电导率仪取样检测。
1.2.2 离子浓度测定本实验中,主要采用德国斯派克分析仪器公司ARCOSFHS12型号的电感耦合等离子体发射光谱仪(ICP-AES)对Li+、Na+、K+、Ca2+、Mg2+和Mn2+等阳离子浓度进行测定。
固体中的元素含量测定是通过将其完全溶解在盐酸和双氧水混合溶液中,再测定溶液中的离子浓度。
1.3 膜性能评价方法 1.3.1 膜拉伸强度测定单位截面薄膜在拉伸断裂时的拉力,表示物质抵抗拉伸的能力。拉伸强度是指材料在拉伸时(直至断裂)所经受的最大拉伸力与应变的比。
首先采用扬州市精卓试验机械厂哑铃型制样机(JZ-6010)将膜材料制备成为哑铃型,然后将其放置24 h以上使其结构稳定,膜的拉伸强度和最大(即断裂)伸长倍数采用深圳新三思材料检测有限公司万能试验机(CMT 2203)测定。
1.3.2 膜亲水性测定在膜制备过程中,其亲水性也是其考察的重要指标之一,可对膜进行接触角测试,以确定其亲水性。接触角是指在气、液、固三相交点处所作的气-液界面的切线穿过液体与固-液交界线之间的夹角θ,是润湿程度的量度。润湿过程与体系的界面张力有关,1滴液体落在水平固体表面上,当达到平衡时,形成的接触角与各界面张力之间符合杨氏公式,因此可以根据接触角大小预测材料的润湿情况:当θ=0°,完全润湿;当θ < 90°,部分润湿或润湿;当θ=90°,是润湿与否的分界线;当θ>90°,不润湿;当θ=180°,完全不润湿。
为了进一步研究不同成膜材料的亲水性,将膜洗净干燥后以采用水悬滴法测定其接触角,所有的测试实验都是在光滑的膜表面进行,待水滴稳定后读取接触角值。
1.3.3 样品形貌分析膜的表面、样品形貌及其断面形貌采用美国FEI公司的Quanta 250环境扫描电子显微镜(Scanning Electron Microscope,SEM)进行分析。
1.3.4 织构分析样品的织构特征分别采用美国Micromeritics 3020 SIN 993全自动比表面积及微孔物理吸附仪测定。首先将样品在200 ℃下恒温真空脱气3 h,再用-196 ℃的低温下用氮气测定低温吸附数据,在190 ℃脱气6 h测试高温解吸数据。使用BET法计算样品的比表面积,使用BJH法计算吸附数据得到孔径分布。
1.3.5 冲击强度分析冲击强度用于评价材料的抗冲击能力或判断材料的脆性和韧性程度,因此冲击强度也称冲击韧性。
膜的冲击强度采用郑州南北仪器设备有限公司FIT-01薄膜冲击试验仪,在温度23(±2) ℃,相对湿度(50±5)%环境进行实验,具体工作参数为:冲击容量:1 J;夹具直径:Φ60 mm;冲头尺寸:Φ25.4 mm。
1.3.6 饱和吸附容量Q分别将一定量的酸洗脱锂后的粉状锂离子筛和一定面积的锂离子筛膜M[H]加入到一定体积氯化锂-氯化氨缓冲溶液中进行吸附,一段时间后,分别测定吸附前后溶液中锂离子的浓度,由式(4)和式(5)求吸附量,分别记为Q1和Q2。
| $ Q_1=\frac{\left(C_0-C\right) V}{m} $ | (4) |
| $ Q_2=\frac{\left(C_0-C\right) V}{\mathrm{~S}} $ | (5) |
式(4)和式(5)中:Q1为粉状锂离子筛吸附容量,mg·g-1;Q2为锂离子筛膜吸附容量,mg·m-2;C0为吸附前溶液中锂离子浓度,mg·L-1;C为吸附后溶液中锂离子浓度,mg·L-1;V为吸附液体积,L;m为粉状锂离子筛质量,g;S为锂离子筛膜的面积,m2。
1.3.7 脱附率分别准确称量一定的粉状离子筛前驱体和前驱体膜M[Li],加入适量浓盐酸及H2O2,待粉末全部溶解后定容至100 mL容量瓶,适量稀释后测定其锂离子浓度CLi0。
分别将一定量的粉状锂离子筛前驱体和前驱体膜M[Li]加入到一定体积的0.5 mol·L-1 HCl(pH=0.301)中进行脱附,测定脱附液中锂离子浓度以CLi。由式(6)和式(7)求锂离子脱附率记为TLi1(第0次酸洗)和TLi2(后期酸洗)。
| $ T_{\mathrm{Li} 1}=\frac{C_{\mathrm{Li}} V}{C_{\mathrm{Li} 0} V_0} \times 100 \% $ | (6) |
| $ T_{\mathrm{Li} 2}=\frac{C_{\mathrm{Li}} V}{Q} \times 100 \% $ | (7) |
式(6)和式(7)中:TLi1为第0次酸洗锂离子脱附率,%;TLi2为后期酸洗锂离子脱附率,%;CLi0、CLi为吸附前后溶液中锂离子浓度,mg·L-1;V为脱附液体积,L;Q为粉状锂离子筛以及锂离子筛膜锂吸附量,mg。
1.3.8 锂离子筛膜吸附-脱附过程将制备得到PVC前驱体膜剪裁成长方形膜片,准确称取一定量膜,将其加入到装有100 mL 0.5 mol·L-1 HCl (pH=0.301)的三角烧瓶中,将烧瓶置于30 ℃、转速为120 r·min-1的摇床中进行振荡,分别于0.5、1、2、3、5、7、9、12和24 h取少量溶液,测定不同酸洗时间时溶液中锂离子浓度,利用公式(6)计算其锂离子脱附率,研究酸洗时间对粉状以及PVC前驱体膜酸洗效果的影响,以确定脱附达到平衡所需时间。
酸洗脱后膜用去离子水多次洗涤,得M[H]即为离子筛膜。将膜M[H]加入到装有100 mL 10 mmol·L-1 LiCl氯化氨缓冲溶液的三角烧瓶,将其置于30 ℃、转速为120 r·min-1的摇床中进行振荡,分别于1、3、5、8、11、14、22、24、36和48 h取少量溶液,经稀释定容后,用ICP分别测定其Li+浓度以及吸附原液的浓度,根据式(5)计算其吸附量,以确定其最大吸附容量以及吸附平衡所需时间。
吸附后膜用去离子水多次洗涤,得M[Li]即为离子筛前驱体膜。使用与前面所述方法进行酸脱附(2 h)以及锂吸附实验(吸附时间为12 h),考察膜的循环稳定性。
2 实验结果与讨论 2.1 涂膜速度对膜性能影响采用1.1所述方法对不同涂膜速度下制得膜以及锂离子筛前驱体粉末进行酸洗过程研究,其锂离子脱出率与酸洗时间的关系见图 2。
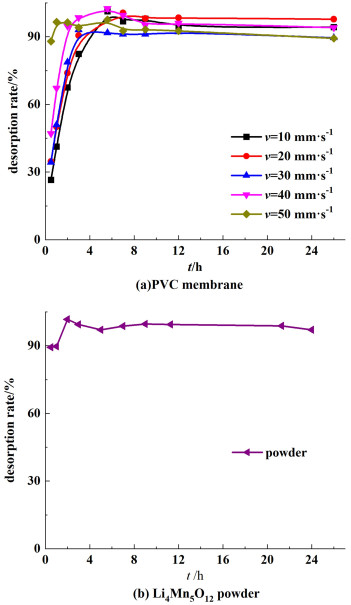
|
| 图 2 膜以及锂离子筛前驱体粉末的锂离子脱附时间与脱出率的关系 Fig.2 Desorption rate of membrane and Li4Mn5O12 powder with reaction time |
| |
结合图 2以及表 1可知,随着涂膜速度增大,锂离子筛膜酸洗达到平衡时间变短,这能够提高膜的利用效率。同时,无论其刮膜速度如何变化,其锂离子的脱附效率均能够达到90%以上,能够保证膜的进一步使用。与此同时,由图 2可知,5 h时所有涂膜速度下的前驱体膜均已达到脱附平衡。
| 涂膜速度/(mm·s-1) | 脱附效率/% |
| 10 | 101.27 |
| 20 | 100.59 |
| 30 | 93.03 |
| 40 | 102.48 |
| 50 | 97.58 |
| 粉末 | 101.70 |
对不同涂膜速度下制得的离子筛膜进行吸附过程研究,其锂离子吸附容量与吸附时间的关系见图 3。
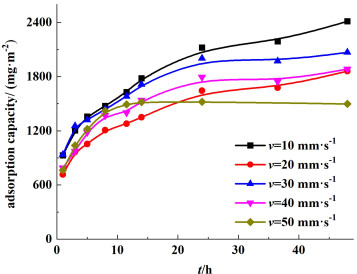
|
| 图 3 不同涂膜速度下锂离子吸附容量与吸附时间的关系 Fig.3 Adsorption capacity of Li+ at different rates of filming with reaction time |
| |
提锂过程是离子交换的过程,可以运用离子交换动力学模型进行阐述,根据基础理论可以分成经验模型和机理模型两类。其中经验模型形式简单,能够定性判断交换速率。
经验模型主要有拟一级、拟二级及韦伯-莫内斯扩散(W-M)模型3种。其中拟一级动力学模型又被称为Lagergren模型,是最常见的动力学模型,具有式(8)的表达形式[20]。
| $ \ln \left(Q_{\mathrm{e}}-Q_t\right)=\ln Q_{\mathrm{e}}-k t $ | (8) |
式(8)中:Qe为拟一级动力学方程计算的Li+最大吸附量,mmol·g-1,mg·m-2;Qt为t时刻的吸附量,mmol·g-1,mg·m-2;k为拟一级动力学速率常数,h-1;t为吸附时间,h。
根据公式(8),本研究中所有拟一级动力学方程拟合的相关性系数均大于0.99,说明了Li+的吸附过程遵从拟一级动力学。
结合图 3以及表 2可以得知,吸附主要发生前24 h内,在24 h以后,吸附达到平衡。随着涂膜速度的增大,吸附容量有所降低。可能是由于涂膜速度增大,前驱体膜表面变得致密,此时有些锂离子吸附位点可能会被包埋起来,导致PVC锂离子筛膜吸附量降低。
| 涂膜速度/(mm·s-1) | 拉伸强度/MPa | 断裂伸长率/% | 接触角/(°) | 速率常数/h-1 |
| 10 | 5.17 | 18.92 | 66.5 | 0.071 2 |
| 20 | 4.81 | 7.43 | 70.5 | 0.103 4 |
| 30 | 4.62 | 9.26 | 72.0 | 0.104 7 |
| 40 | 4.64 | 9.42 | 69.3 | 0.122 9 |
| 50 | 5.96 | 21.87 | 66.0 | 0.346 1 |
对于同一组分的膜材料而言,断裂伸长率越大,说明其抗冲击强度越大,由表 2可知随着涂膜速度增大,膜的抗冲击强度呈现先下降后上升的趋势。而拉伸强度和亲水性变化趋势基本与抗冲击强度变化趋势相同,但涂膜速度对二者影响不大。综合考虑,选取30 mm·s-1的涂膜速度。
2.2 PVC浓度对膜性能影响铸膜液中高分子材料的浓度会影响其制膜工艺及所制备膜的性能,聚合物浓度太低,铸膜液流动性好但成膜性差,所制备膜的机械强度较差,聚合物浓度太高则铸膜液黏度急剧增大,流动性差易形成凝胶,影响成膜。
对不同PVC浓度下制得PVC前驱体膜进行锂脱附过程研究,其锂离子脱出率与脱附时间关系见图 4。
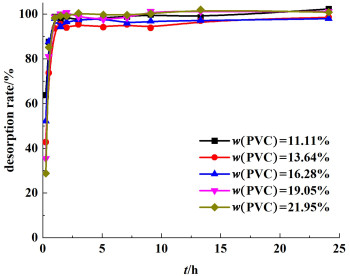
|
| 图 4 不同PVC浓度下锂离子脱附时间与脱出率的关系 Fig.4 Desorption rate of Li+ in different PVC concentration with reaction time |
| |
结合图 4及表 3可以看出,PVC前驱体膜中锂离子的脱附过程是一个快速的过程,酸洗脱锂2 h基本已达到平衡,且脱附效率均可达到90%以上,说明了膜的可重复利用性。
| w(PVC)/% | 脱附效率/% |
| 11.11 | 101.27 |
| 13.64 | 100.59 |
| 16.28 | 93.03 |
| 19.05 | 102.48 |
对不同PVC浓度下制得PVC离子筛膜进行吸附过程研究,其锂离子吸附容量与吸附时间的关系见图 5。
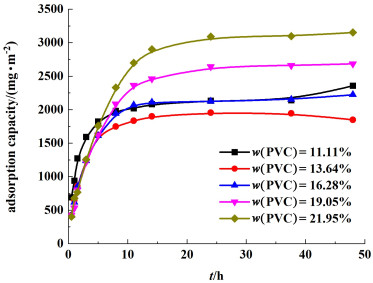
|
| 图 5 不同PVC浓度下锂离子吸附容量与吸附时间的关系 Fig.5 Adsorption capacity of Li+ in different PVC concentration with reaction time |
| |
结合图 5及表 4可以得知,随着PVC浓度的增加,吸附容量有所提高,但其吸附反应速率呈现下降趋势,可能是由于随着PVC浓度的增大,对前驱体粉末的交联程度增大,从而导致单位膜面积中锂锰氧化物的平均含量增多,进而使得PVC锂离子筛膜吸附量增大,但PVC锂离子筛前驱体膜表面亦变得致密,其亲水性变差,导致其吸附速率下降,但12 h基本都可达到吸附平衡。随着PVC浓度的增加,膜亲水性逐步降低,但拉伸强度及抗冲击强度逐步上升,综合考虑其吸附容量以及拉伸强度,PVC浓度选择19.05%。
| w(PVC)/% | 拉伸强度/MPa | 断裂伸长率/% | 接触角/(°) | 速率常数/h-1 |
| 11.11 | 0.62 | 6.98 | 64.8 | 0.286 6 |
| 13.64 | 0.55 | 6.95 | 67.5 | 0.307 6 |
| 16.28 | 1.76 | 7.15 | 66.5 | 0.271 3 |
| 19.05 | 2.36 | 9.50 | 69.3 | 0.185 0 |
| 21.95 | 2.96 | 10.46 | 70.0 | 0.181 1 |
对不同前驱体含量下制得的PVC前驱体膜进行锂脱附过程研究,其锂离子脱出率与脱附时间的关系见图 6。
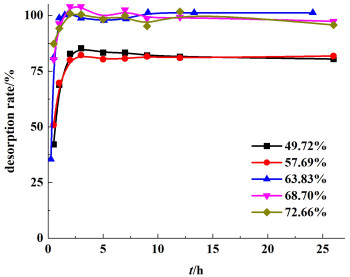
|
| 图 6 不同前驱体含量下锂离子脱附时间与脱出率的关系 Fig.6 Desorption rate of Li+ in different Li4Mn5O12 concentration with reaction time |
| |
结合图 6及表 5可以得知,当前驱体含量低于63.83%时,基本上均在2~3 h时达到平衡,脱附率维持在80%~90%;随着前驱体含量增高,在1.5~2.0 h基本达到平衡,可能是由于前驱体含量较低时,相对而言,PVC含量较高,PVC包裹作用阻碍了溶液进入膜孔与前驱体进行反应。
| 前驱体质量分数/% | 脱附效率/% |
| 49.72 | 85.26 |
| 57.69 | 82.21 |
| 63.83 | 101.28 |
| 68.70 | 104.12 |
| 72.66 | 101.72 |
对不同前驱体含量下所制得PVC前驱体膜进行吸附过程研究,其锂离子吸附容量与吸附时间关系见图 7。由图 7可知,吸附主要发生在开始5 h,在12 h后吸附达到平衡。结合表 6可以看出,前驱体含量由49.72%增大到63.83%过程中,吸附容量呈现变大趋势,一方面可能是前驱体在膜中比例增加,从而导致单位膜面积中锂锰氧化物含量增加,故吸附量增大;另一方面可能是前驱体含量增大过程中,PVC含量较低,PVC前驱体膜亲水性较高,从而使锂离子筛膜吸附量增大。而当前驱体含量进一步增大时,其吸附量又有所降低,这是由于前驱体含量过高导致膜对前驱体的黏结程度减弱,导致前驱体从膜表面脱落下来,膜吸附性能降低。与此同时,随着前驱体含量增加,膜亲水性逐步上升,但拉伸强度及抗冲击强度逐步下降,综合考虑其吸附容量以及拉伸强度,前驱体含量选择63.83%。
| 前驱体质量分数/% | 拉伸强度/MPa | 断裂伸长率/% | 接触角/(°) | 速率常数/h-1 |
| 49.72 | 2.84 | 11.66 | 72.0 | 0.905 2 |
| 57.69 | 2.46 | 10.54 | 71.5 | 0.146 3 |
| 63.83 | 2.33 | 9.50 | 69.0 | 0.177 7 |
| 68.70 | 1.75 | 7.42 | 65.0 | 0.170 9 |
| 72.66 | 0.77 | 5.46 | 64.0 | 0.466 0 |
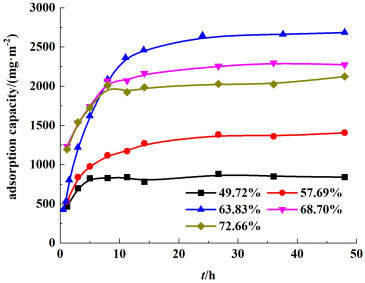
|
| 图 7 不同Li4Mn5O12前驱体含量下锂离子吸附容量与吸附时间的关系 Fig.7 Adsorption capacity of Li+ in different Li4Mn5O12 concentration with reaction time |
| |
随着涂膜厚度的增大,单位膜面积上锂锰氧化物含量有所增大,理论上PVC前驱体膜吸附容量亦会随之增高。但过大涂膜厚度,会导致部分锂离子吸附位点被包埋起来,导致其吸附速率下降,进而影响其吸附效率。
对不同膜厚的PVC前驱体膜进行酸脱附过程研究,其锂离子脱出率与脱附时间的关系见图 8。
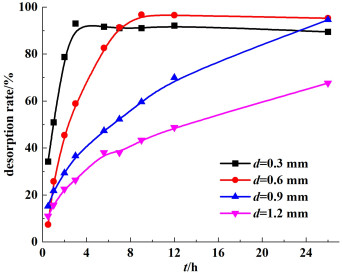
|
| 图 8 不同膜厚下锂离子脱附时间与脱附率的关系 Fig.8 Desorption rate of Li+ in different thicknesses with reaction time |
| |
| 膜厚d/mm | 脱附效率/% |
| 0.3 | 93.03 |
| 0.6 | 96.71 |
| 0.9 | 94.62 |
| 1.2 | 67.64 |
从图 8可知,随着膜厚度增大,锂离子筛膜酸洗达到平衡时间呈现明显增大趋势,一方面是由于随着膜厚增加,相同质量的膜与脱附液接触面积减小;另一方面是由于随着膜厚的增加,有些离子筛被包裹至较为中心的区域,脱附液要与其反应需要较长时间。同时,当涂膜厚度小于0.9 mm时,其锂离子的脱附效率均能够达到90%以上,能够保证膜的进一步使用。但当涂膜厚度达到1.2 mm,其脱附效率明显下降,当达到67 h时,其脱附效率也只能达到77.68%。
对不同膜厚锂离子筛膜进行吸附过程研究,其锂离子吸附容量与吸附时间的关系见图 9。由图 9可以明显看出,当膜厚为0.3 mm时吸附主要发生前24 h内,在24 h以后,图中曲线逐渐趋于水平,吸附达到平衡。而随着膜厚增大,吸附进行到48 h其吸附还未达到最终的平衡。结合表 8可以看出,随着膜厚增大,吸附达平衡的时间呈现增大的趋势,吸附速率明显降低,但单位膜面积吸附容量有所升高。一方面是由于随着膜厚的增加,相同质量的膜与脱附液接触面积减小;另一方面是由于随着膜厚的增加,单位面积中所含有的锂离子筛增加,从而增大了其吸附容量。但吸附容量增大的比例与膜厚增大的比例并不成正比,且吸附饱和时间大幅度的增长,不利于膜的应用,故不宜采用增大膜厚的方法提高吸附容量。与此同时,膜的拉伸强度以及亲水性随着膜厚的增加并无明显的变化,但抗冲击强度有所增大,综合考虑膜的吸附效率,涂膜厚度选择0.3 mm。
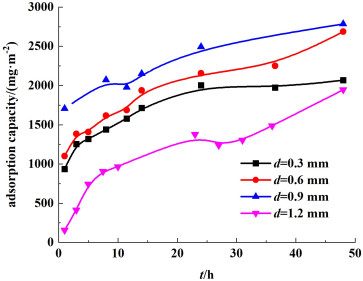
|
| 图 9 不同膜厚下锂离子吸附容量与吸附时间的关系 Fig.9 Adsorption capacity of Li+ in different thicknesses with reaction time |
| |
| 膜厚/mm | 拉伸强度/MPa | 断裂伸长率/% | 接触角/(°) | 速率常数/h-1 |
| 0.3 | 4.62 | 9.26 | 72.0 | 0.112 0 |
| 0.6 | 5.63 | 12.66 | 70.8 | 0.044 0 |
| 0.9 | 5.15 | 16.03 | 75.8 | 0.027 6 |
| 1.2 | 4.21 | 15.05 | 71.5 | 0.045 0 |
通过向PVC中掺入成孔剂PEG,希望能够为PVC前驱体膜创造更多的膜孔,增加膜亲水性的同时降低离子筛粉体吸附位点被包裹的风险。但成孔剂过多的加入,有可能会导致膜结构的坍塌,且成孔剂的加入会导致制膜成本的提高。
对不同成孔剂含量下所制得PVC前驱体膜进行锂脱附过程研究,其锂离子脱出率与脱附时间的关系见图 10。从图 10中可以得知,当PEG浓度为0时,7 h可以达到脱附平衡。随着PEG从无到有,脱附达到平衡所需时间有所降低,但进一步提高PEG浓度,速率提高并不明显。由表 9我们可以看出,无论PEG浓度为多少,PVC前驱体膜可达到最大脱附效率均为90%以上,可以保证膜的有效利用,亦说明了膜的可重复利用性。
| 前驱体质量分数/% | 脱附效率/% |
| 0 | 98.47 |
| 2.32 | 104.38 |
| 4.44 | 93.03 |
| 6.98 | 96.75 |
| 9.30 | 94.62 |
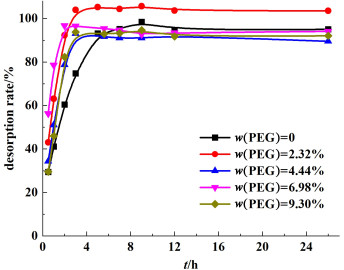
|
| 图 10 不同PEG含量下对锂离子脱附时间与脱出率的关系 Fig.10 Desorption rate of Li+ in different PEG concentration with reaction time |
| |
对不同成孔剂含量下制得的PVC前驱体膜进行吸附过程研究,其锂离子吸附容量与吸附时间的关系见图 11。由图 11可知,PEG引入有助于提高吸附反应速率,当PEG浓度由0增大到4.44%的过程中,吸附容量有所提高,但当PEG浓度进一步增大时,吸附容量基本保持不变。这是由于PEG浓度由0增大到4.44%过程中,PEG浓度的增加能够有效提高离子筛膜的孔隙率,保证离子筛的吸附位点不被包裹,而进一步提高PEG浓度,则效果不明显。与此同时,膜的拉伸强度以及亲水性随着PEG含量的增加并无明显的变化,但抗冲击强度有所降低,综合考虑膜的吸附效率,PEG含量选择2.32%(表 10)。
| w(PEG)/% | 拉伸强度/MPa | 断裂伸长率/% | 接触角/(°) | 速率常数/h-1 |
| 0 | 5.48 | 12.63 | 64.5 | 0.019 6 |
| 2.32 | 5.41 | 19.68 | 65.5 | 0.098 2 |
| 4.44 | 4.62 | 9.26 | 72.0 | 0.112 0 |
| 6.98 | 8.13 | 8.15 | 72.8 | 0.097 5 |
| 9.30 | 5.78 | 5.57 | 65.5 | 0.051 1 |
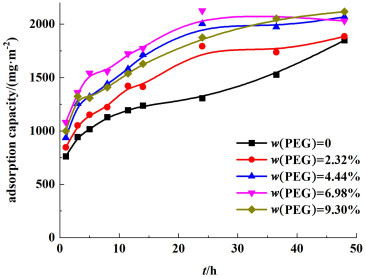
|
| 图 11 不同PEG含量下锂离子吸附容量与吸附时间的关系 Fig.11 Adsorption capacity of Li+ in different PEG concentration with reaction time |
| |
通过前期研究,最终确定了制膜工艺条件:PVC浓度19.05%,Li4Mn5O12含量63.83%,以及PEG含量2.32%,涂膜厚度0.3 mm,涂膜速度30 mm·s-1。将所制得的PVC离子筛膜进行多次锂吸附-脱附实验,研究膜的循环稳定性。
从图 12中可以看出,所合成的离子筛膜经过多次吸附-脱附实验后,其吸附量虽略有下降,但均可保持在1 600 mg·m-2左右。
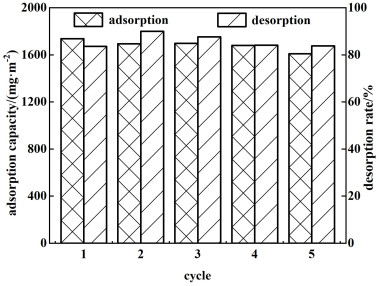
|
| 图 12 膜循环稳定性评价 Fig.12 Results of repeated adsorption and desorption |
| |
图 13是最适宜制膜工艺条件下,离子筛膜表面及断面的扫描电镜图。由图 13(b)断面形态上看,离子筛前驱体粉体被包裹在PVC聚合物孔隙中。

|
| 图 13 PVC前驱体膜表面及断面的扫描电镜图 Fig.13 Scanning electron microscopy of PVC precusor membrane |
| |
采用美国Micromeritics ASAP-2010C吸附仪测定了膜的氮气在77 K下吸附等温线,如图 14所示。
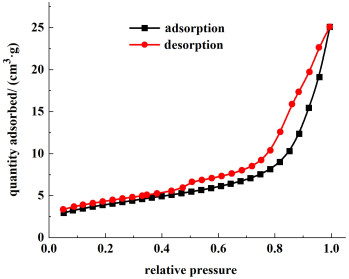
|
| 图 14 PVC前驱体膜在77 K下的N2吸附等温曲线 Fig.14 N2 adsorption isotherm of PVC precursor membrane at 77 K |
| |
从吸附等温线可以发现样品的N2吸附量随着相对压力的升高而缓慢增加,当相对压力升高到0.80附近,由于毛细管凝结现象的产生,导致N2吸附量急剧上升,饱和吸附量为25.09 cm3·g-1。样品的等温线的解吸迟滞现象较弱,吸附分支和解吸分支基本上重合,说明了材料的孔径较小。
膜的比表面积采用Brunauer-Emmett-Teller (BET)方法计算,膜的冲击强度采用FIT-01薄膜冲击试验仪进行测试,其比表面积及其它结构参数列于表 11。
| 样品名称 | 比表面积/(m2·g-1) | 孔容/(cm3·g-1) | 最可几孔径/nm | 吸附等温线类型 | 冲击能量/J |
| PVC-MnO2锂离子筛前驱体膜 | 14.017 6 | 0.038 8 | 1.74 | Ⅲ | 0.032 |
以PVC为成膜材料,采用N, N-二甲基乙酰胺(DMAC)作为溶剂,相转化法制备PVC锂离子筛前驱体膜。研究了涂膜速度、涂膜后处理方式、PVC铸膜液浓度、Li4Mn5O12的含量、膜厚以及成孔剂含量对膜物理化学性能影响。
研究发现随着PVC浓度增加,膜的吸附速率和亲水性呈现下降趋势,但拉伸强度及抗冲击强度逐步上升。随着前驱体粉末含量增加,膜吸附容量呈现先变大后减小的趋势,与此同时,随着前驱体含量的增加,膜的亲水性逐步上升,但拉伸强度及抗冲击强度逐步下降。随着膜厚度增大,吸附速率明显降低。成孔剂引入有助于提高材料的吸附速率和吸附容量。通过前期的研究,最终确定了较适宜的制膜条件:PVC浓度19.05%,Li4Mn5O12含量63.83%,PEG含量2.32%,涂膜厚度0.3 mm,涂膜速度30 mm·s-1。将所制得锂离子筛膜进行多次吸附-脱附实验,研究发现锂离子筛膜具有良好的循环稳定性。
| [1] |
ZHOU Z, QIN W, CHU Y, et al. Elucidation of the structures of tributyl phosphate/Li complexes in the presence of FeCl3 via UV-visible, Raman and IR spectroscopy and the method of continuous variation[J]. Chemical Engineering Science, 2013, 101: 577-585. DOI:10.1016/j.ces.2013.07.020 |
| [2] |
SHI D, CUI B, LI L, et al. Lithium extraction from low-grade salt lake brine with ultrahigh Mg/Li ratio using TBP-kerosene-FeCl3 system[J]. Separation and Purification Technology, 2019, 211: 303-309. DOI:10.1016/j.seppur.2018.09.087 |
| [3] |
SHI D, CUI B, LI L, et al. Removal of calcium and magnesium from lithium concentrated solution by solvent extraction method using D2EHPA[J]. Desalination, 2020. DOI:10.1016/j.desal.2019.114306 |
| [4] |
NIE X, SUN S, SONG X, et al. Further investigation into lithium recovery from salt lake brines with different feed characteristics by electrodialysis[J]. Journal of Membrane Science, 2017, 530: 185-191. DOI:10.1016/j.memsci.2017.02.020 |
| [5] |
FENG Q, KANOH H, OOI K. Manganese oxide porous crystals[J]. Journal of Materials Chemistry, 1999, 9(2): 319-333. DOI:10.1039/a805369c |
| [6] |
ZHANG Q, LI S, SUN S, et al. Lithium selective adsorption on low-dimensional titania nanoribbons[J]. Chemical Engineering Science, 2010, 65(1): 165-168. DOI:10.1016/j.ces.2009.06.001 |
| [7] |
ZHONG J, LIN S, YU J. Li+ adsorption performance and mechanism using lithium/aluminum layered double hydroxides in low grade brines[J]. Desalination, 2021. DOI:10.1016/j.desal.2021.114983 |
| [8] |
CHEN J, LIN S, YU J. High-selective cyclic adsorption and magnetic recovery performance of magnetic lithium-aluminum layered double hydroxides (MLDHs) in extracting Li+ from ultrahigh Mg/Li ratio brines[J]. Separation and Purification Technology, 2021. DOI:10.1016/j.seppur.2020.117710 |
| [9] |
ZHONG J, LIN S, YU J. Lithium recovery from ultrahigh Mg2+/Li+ ratio brine using a novel granulated Li/Al-LDHs adsorbent[J]. Separation and Purification Technology, 2021. DOI:10.1016/j.seppur.2020.117780 |
| [10] |
钟辉. 偏钛酸型锂离子交换剂的交换性质及从气田卤水中提锂[J]. 应用化学, 2000, 17(3): 307-309. ZHONG Hui. Property of H2TiO3 type ion exchangers and extraction of lithium from brine of natural gas wells[J]. Chinese Journal of Applied Chemistry, 2000, 17(3): 307-309. DOI:10.3969/j.issn.1000-0518.2000.03.019 (in Chinese) |
| [11] |
李少鹏, 张钦辉, 孙淑英, 等. TiO2离子筛的制备及表征[J]. 天津大学学报, 2007, 40(4): 453-456. LI Shaopeng, ZHANG Qinhui, SUN Shuying, et al. Preparation and characterization of titania ion-sieves[J]. Journal of Tianjin University, 2007, 40(4): 453-456. DOI:10.3969/j.issn.0493-2137.2007.04.014 (in Chinese) |
| [12] |
CHITRAKAR R, KANOH H, MIYAI Y, et al. Recovery of lithium from seawater using manganese oxide adsorbent (H1.6Mn1.6O4) derived from Li1.6Mn1.6O4[J]. Industrial & Engineering Chemistry Research, 2001, 40(9): 2054-2058. |
| [13] |
SUN S, XIAO J, WANG J, et al. Synthesis and adsorption properties of Li1.6Mn1.6O4 by a combination of redox precipitation and solid-phase reaction[J]. Ind. & Eng. Chem. Res, 2014, 53(40): 15517-15521. |
| [14] |
XIAO J, NIE X, SUN S, et al. Lithium ion adsorption-desorption properties on spinel Li4Mn5O12 and pH-dependent ion-exchange model[J]. Advanced Powder Technology, 2015, 26(2): 589-594. DOI:10.1016/j.apt.2015.01.008 |
| [15] |
XIAO J, SUN S, WANG J, et al. Synthesis and adsorption properties of Li1.6Mn1.6O4 spinel[J]. Ind. & Eng. Chem. Res, 2013, 52(34): 11967-11973. |
| [16] |
XIAO G, TONG K, ZHOU L, et al. Adsorption and desorption behavior of lithium ion in spherical PVC-MnO2 ion sieve[J]. Industrial & Engineering Chemistry Research, 2012, 51(33): 10921-10929. |
| [17] |
陈小棉. 提锂杂化膜制备及提锂性能研究[D]. 天津: 天津大学, 2013 CHEN Xiaomian. Preparation of hybrid membrane for uptaking lithium and its adsorption properties[D]. Tianjin: Tianjin University, 2013 (in Chinese) |
| [18] |
PARK M J, NISOLA G M, BELTRAN A B, et al. Recyclable composite nanofiber adsorbent for Li+ recovery from seawater desalination retentate[J]. Chemical Engineering Journal, 2014, 254: 73-81. DOI:10.1016/j.cej.2014.05.095 |
| [19] |
PARK M J, NISOLA G M, VIVAS E L, et al. Mixed matrix nanofiber as a flow-through membrane adsorber for continuous Li+ recovery from seawater[J]. Journal of Membrane Science, 2016, 510: 141-154. DOI:10.1016/j.memsci.2016.02.062 |
| [20] |
ÖZCAN A S, ÖZCAN A. Adsorption of acid dyes from aqueous solutions onto acid-activated bentonite[J]. Journal of Colloid and Interface Science, 2004, 276(1): 39-46. DOI:10.1016/j.jcis.2004.03.043 |
 2023, Vol. 40
2023, Vol. 40





