2. 陕西省冶金工程技术研究中心, 西安 710055
2. Shaanxi Engineering Research Center of Metallurgy, Xi'an 710055, China
钴和镍在元素周期表中的位置相邻,常在自然界中共生、伴生,并且在废旧锂离子电池、催化剂、合金废料等二次资源中共存。由于2种元素的化学性质非常相似,因此镍钴分离问题具有一定的挑战性[1-3]。目前,溶剂萃取法是分离镍钴的有效方法,其中应用最广泛的萃取剂是酸性膦(磷)萃取剂,包括2-乙基己基磷酸酯(P204)、2-乙基己基磷酸单-2-乙基己酯(P507)和二(2,4,4-三甲基戊基)膦酸(Cyanex272)[4-6]。溶剂萃取法中,萃取体系的组成除萃取剂外,还包括稀释剂,如煤油、十二烷和甲苯等,这些稀释剂有生物毒性、易挥发,容易造成环境问题,且存在安全隐患[7-9]。
低共熔溶剂(DES)是一种新型的绿色溶剂,由一定化学计量比的氢键受体与氢键供体组合而成。DES具有许多优势,例如合成简单、成本低和蒸汽压低等[10-14]。疏水性低共熔溶剂(HDES)是不溶于水的一类DES,可用于有机物的萃取和气体的吸收,也可以用于金属离子的萃取[15-19]。例如,Hanada等[20]分别以三辛基氧膦和磷酸三苯酯为氢键受体,以苯甲酰三氟丙酮和2-噻吩甲酰三氟丙酮为氢键供体,合成多种HDES从含有Na(Ⅰ)、K(Ⅰ)的溶液中选择性萃取Li(Ⅰ)。Ola等[19]以利多卡因氢键受体,以癸酸为氢键供体,合成HDES萃取分离Fe(Ⅲ)和Mn(Ⅱ)。由于多种试剂可以作为氢键受体或氢键供体使用,HDES具有良好的可设计性。通过改变氢键供体(或氢键受体)的种类,可以改变HDES的物理和化学性能[21]。例如,Schaeffer等[22]分别以薄荷醇、麝香草酚为氢键受体,不同烷基链长度的羧酸分别为氢键供体,合成多种HDES萃取Cu(Ⅱ),随着羧酸烷基链长度的增加,分配比明显下降。Cao等[23]以三辛基甲基氯化铵(Aliquat 336)为氢键受体,多种有机酸和醇分别为氢键供体,合成HDES提取银杏叶中的聚戊烯乙酸酯,发现氢键供体的烷基链长度和类型会影响提取效率。
为深入了解HDES组成及工艺条件对Co(Ⅱ)、Ni(Ⅱ)萃取分离效果的影响,本研究以Aliquat 336为氢键受体,5种脂肪醇(CnH(2n+1)OH; n=6,8,10,12,14)作为氢键供体,制备了一系列HDES,研究酸度、温度等条件对HDES萃取分离Co(Ⅱ)、Ni(Ⅱ)的影响,并且比较分析氢键供体对萃取分离性能的影响规律。
1 试验 1.1 原料和试剂三辛基甲基氯化铵(Aliquat 336)(≥97%,阿拉丁,质量分数,下同)、正己醇(≥98%,阿拉丁)、正辛醇(≥99.5%,阿拉丁)、正癸醇(≥98%,阿拉丁)、正十二烷醇(≥99%,阿拉丁)、正十四烷醇(≥98%,阿拉丁)、七水合氯化钴(≥99.5%,天津大茂)、氯化钠(≥99.5%,郑州银丰)、六水合氯化镍(≥98.5%,天津福晨)、HCl(≥37%,罗恩)、Na2SO4(≥99.5%,郑州银丰)。本研究中使用的所有试剂均未纯化,直接使用。
1.2 实验仪器旋涡混合器(GL-88B,海门市其林贝尔仪器制造有限公司);离心机(金坛区西城新瑞仪器厂);恒温磁力搅拌器(天津市赛得利斯实验分析仪器制造厂);磁力搅拌水浴锅(HH-4J,常州朗越仪器制造有限公司);紫外-可见分光光度计(TU-1901,北京普析通用仪器有限责任公司);傅里叶全反射红外光谱仪(Summit,Thermo Fisher);原子吸收分光光度计(AA-6800,SHIMADZU)。
1.3 实验方法HDES的制备采用Aliquat 336与多种脂肪醇(结构式如图 1所示)分别作为氢键受体与氢键供体,按照物质的量之比1∶1将二者混合。然后将混合物放置于恒温磁力搅拌器上,加热至80 ℃,搅拌60 min,直至形成均匀的透明液体。表 1列出了合成的HDES。
|
| 图 1 三辛基甲基氯化铵和脂肪醇的化学结构 Fig.1 Chemical structures of the Aliquat 336 and aliphatic alcohols |
| |
| 简称 | 氢键受体 | 氢键供体 | 物质的量之比 | 室温下外观 |
| DES-1 | Aliquat 336 | 正己醇 | 1∶1 | 透明液体 |
| DES-2 | Aliquat 336 | 正辛醇 | 1∶1 | 透明液体 |
| DES-3 | Aliquat 336 | 正癸醇 | 1∶1 | 透明液体 |
| DES-4 | Aliquat 336 | 正十二醇 | 1∶1 | 透明液体 |
| DES-5 | Aliquat 336 | 正十四醇 | 1∶1 | 透明液体 |
反萃实验中,采用1 mol ·L-1 Na2SO4溶液为反萃剂,设定相比为1∶1,用旋涡混合器将负载有机相(HDES相)与反萃取剂混合5 min,离心分相,测定反萃液或有机相中的金属离子浓度,由此计算反萃率。
Co(Ⅱ)和Ni(Ⅱ)浓度采用原子吸收分光光度计测定,其中水相金属离子浓度稀释一定倍数后直接测定,有机相金属离子浓度采用硝酸和硫酸的混酸溶液硝化后测定。
采用式(1)计算分配比D,采用式(2)计算分离因子(βCo/Ni),采用式(3)计算反萃率(S)。
| $ D=\frac{C_{\mathrm{DES}, \mathrm{ex}}}{C_{\mathrm{aq}}} $ | (1) |
| $ \beta_{\mathrm{Co}/ \mathrm{Ni}}=\frac{D_{\mathrm{Co}}}{D_{\mathrm{Ni}}} $ | (2) |
| $ \begin{aligned} S=\left(1-\frac{C_{\text {DES, strip }}}{C_{\mathrm{EDS}, \mathrm{int}}}\right) \times 100 \% \end{aligned} $ | (3) |
式(1)~式(3)中:Caq与CDES, ex分别为萃取平衡时的水相金属离子浓度与有机相金属离子浓度,mol ·L-1;CDES, strip表示反萃后HDES中的金属离子浓度,mol·L-1;CDES, int表示初始HDES中的金属离子浓度,mol ·L-1。
2 结果与讨论 2.1 疏水性低共熔溶剂的表征以Aliquat 336为氢键受体,5种脂肪醇分别为氢键供体,按照物质的量之比1∶1合成HDES。图 2为HDES及其组分的红外吸收光谱,Aliquat 336的主要红外吸收峰位于2 854.1和2 922.6 cm-1处,为烷基的伸缩振动吸收峰。脂肪醇的主要红外吸收峰位于2 869.6、2 925.5和3 321.5 cm-1处,分别对应烷基的伸缩振动吸收峰与和O—H的伸缩振动吸收峰。形成HDES后O—H伸缩振动吸收峰红移,在3 285.0 cm-1附近形成了较弱的宽峰,表明脂肪醇中的O—H与Aliquat 336中的Cl-形成了氢键[24]。

|
| 图 2 三辛基甲基氯化铵,脂肪醇与疏水性低共熔溶剂的红外光谱 Fig.2 FTIR spectra of Aliquat 336, aliphatic alcohols and HDESs |
| |
Cl-浓度对HDES萃取分离Co(Ⅱ)、Ni(Ⅱ)有很大影响,设定Co(Ⅱ)、Ni(Ⅱ)的初始浓度均为0.2 mol ·L-1,测定不同Cl-浓度下Co(Ⅱ)、Ni(Ⅱ)的分配比,结果如图 3所示。可以看出,初始Cl-浓度由1 mol ·L-1增加至4.5 mol ·L-1时,5种HDES萃取Co(Ⅱ)的分配比显著增大,而Ni(Ⅱ)的分配比仅略微增加,分离因子βCo/Ni也随之增大。与传统的溶剂萃取体系相比,HDES表现出相近的萃取分离效果。例如,在3.4 mol ·L-1 Cl-浓度,相比1∶1的条件下,30% Aliquat 336-烃体系萃取Co(Ⅱ)的分配比为2.59,分离因子βCo/Ni为70[25]。这与本研究中5种HDES萃取分离Co(Ⅱ)、Ni(Ⅱ)的性能相似。不同种类的HDES相比,氢键供体的烷基链长度增加,Co(Ⅱ)、Ni(Ⅱ)的分配比略有下降,分离因子βCo/Ni在低Cl-浓度下(<3.0 mol ·L-1)基本不变,高Cl-浓度(>3.0 mol ·L-1)时略微下降。

|
| 图 3 Cl-初始浓度对Co(Ⅱ)和Ni(Ⅱ)萃取分离效果的影响 Fig.3 Effect of initial Cl- concentration on the extraction and separation behaviors of Co(Ⅱ) and Ni(Ⅱ) |
| |
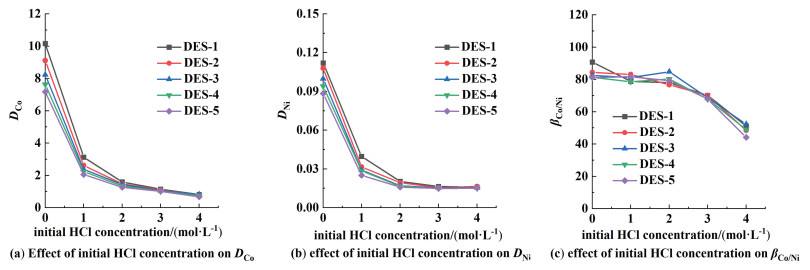
设定Co(Ⅱ)、Ni(Ⅱ)的初始浓度均为0.2 mol ·L-1,HCl+NaCl的总浓度为4 mol ·L-1,在室温条件下研究酸度对HDES萃取分离Co(Ⅱ)、Ni(Ⅱ)性能的影响,结果如图 4所示。可以看出,初始HCl浓度由0增加至4 mol ·L-1时,5种HDES萃取Co(Ⅱ)、Ni(Ⅱ)的分配比下降,分离因子βCo/Ni在高酸度时略有下降,低酸度时基本不变。相对于酸性膦萃取体系,酸度对该HDES萃取性能的影响较小。在保持Cl-总浓度为4 mol ·L-1的条件下,初始HCl浓度由0增加至4 mol ·L-1时,Aliquat 336-正己醇HDES的βCo/Ni由91降低至51,而对于0.1 mol · L-1 Cyanex272-煤油体系,pH值从5.46降低至3.99时,βCo/Ni由1 109降低至37[26]。因此,采用HDES可以在较宽的酸度范围内实现Co(Ⅱ)、Ni(Ⅱ)的分离。不同的HDES相比,随着氢键供体的烷基链长度增加,Co(Ⅱ)、Ni(Ⅱ)的分配比均下降,βCo/Ni基本不变。
|
| 图 4 HCl初始浓度对Co(Ⅱ)和Ni(Ⅱ)萃取分离性能的影响 Fig.4 Effect of initial HCl concentration on the extraction and separation behaviors of Co(Ⅱ) and Ni(Ⅱ) |
| |
设定Co(Ⅱ)、Ni(Ⅱ)的初始浓度均为0.2 mol ·L-1,NaCl浓度为4 mol ·L-1,研究温度对HDES萃取分离Co(Ⅱ)、Ni(Ⅱ)的影响,结果如图 5所示。温度由15 ℃增加至85 ℃时,HDES萃取Co(Ⅱ)的分配比大幅度增长,而Ni(Ⅱ)的分配比小幅度减少,分离因子βCo/Ni随温度升高明显增加,并且在85 ℃时超过500,说明升高温度能够促进Co(Ⅱ)、Ni(Ⅱ)的分离。随着氢键供体的烷基链长度增加,Co(Ⅱ)、Ni(Ⅱ)的分配比均有不同程度的下降,而分离因子βCo/Ni无明显变化。

|
| 图 5 温度对Co(Ⅱ)和Ni(Ⅱ)萃取分离性能的影响 Fig.5 Effect of temperature on the extraction and separation behaviors of Co(Ⅱ) and Ni(Ⅱ) |
| |
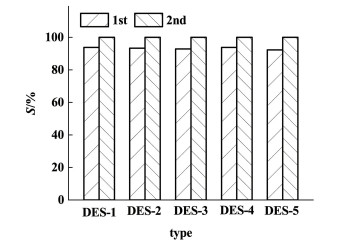
Co(Ⅱ)的反萃采用1 mol ·L-1 Na2SO4溶液,结果如图 6所示。5种HDES体系的反萃结果类似,经过1次反萃,可将90%以上的Co(Ⅱ)反萃到水相,2次反萃后,Co(Ⅱ)反萃率达到99.5%以上。综合比较各HDES的萃取和反萃结果可以看出,减少氢键供体的烷基链长度,可以增加Co(Ⅱ)的分配比,以及Co(Ⅱ)、Ni(Ⅱ)之间的分离因子,但不影响Co(Ⅱ)的反萃性能。为此,季铵盐和醇组成HEDS萃取分离Co(Ⅱ)、Ni(Ⅱ)时,可以优先选择短烷基链的醇作为氢键供体,以提高Co(Ⅱ)的萃取率和Co(Ⅱ)、Ni(Ⅱ)分离效果。
|
| 图 6 HDES相中Co(Ⅱ)的反萃 Fig.6 Stripping behaviors of Co(Ⅱ) from HDES phase |
| |
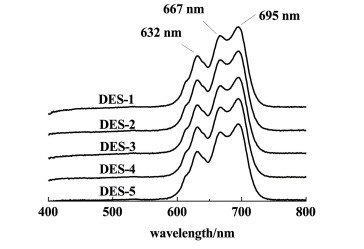
传统的溶剂萃取体系中,季铵盐萃取Co(Ⅱ)的机理为阴离子交换[25, 27]。为确定HDES萃取Co(Ⅱ)的机理,测定了HDES相中Co(Ⅱ)的紫外-可见吸收光谱,结果如图 7所示。由图 7可以看出,对于不同的HDES,Co(Ⅱ)的紫外-可见吸收光谱相同,特征吸收峰位于634、668和696 nm,这与文献[28]中CoCl42-的谱图一致,表明HDES相中的Co(Ⅱ)是以CoCl42-的形式存在。
|
| 图 7 Co(Ⅱ)在HDES相中的紫外-可见吸收光谱 Fig.7 UV-Vis spectra of Co(Ⅱ) in HDES phase |
| |
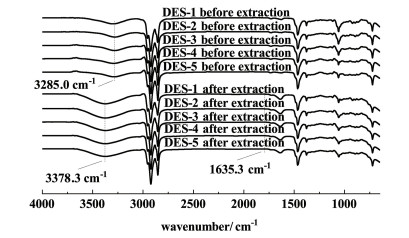
HDES萃取Co(Ⅱ)后的红外光谱如图 8所示。对于不同的HDES,萃取后的变化规律相同,位于3 285.0 cm-1的O—H伸缩振动吸收峰蓝移,在3 378.3 cm-1形成了新的吸收峰,这表明,Co(Ⅱ)萃入HDES相后,HDES中Cl-和O—H之间的氢键被破坏。结合紫外-可见吸收光谱可知,萃取过程中,Co(Ⅱ)是以CoCl42-的形式由水相进入了HDES相,而HDES中的Cl-进入水相。为此,萃取过程符合阴离子离子交换机理,可以用式(4)表示。除此之外,萃取后的光谱在1 635.3 cm-1附近出现了1个新的峰,这是由于萃取后少量水进入HDES相产生的吸收。
| $ \begin{aligned} & 2 \text { Aliquat } \cdot \mathrm{Cl}_{(\mathrm{DES})}+\mathrm{CoCl}_{4(\mathrm{aq})}^{2-}= \\ & {\left[\text { Aliquat }_2 \cdot \mathrm{CoCl}_4\right]_{(\mathrm{DES})}+2 \mathrm{Cl}_{(\mathrm{aq})}^{-}} \end{aligned} $ | (4) |
|
| 图 8 HDES萃取Co(Ⅱ)前后的红外吸光谱 Fig.8 FTIR spectra of HDESs before and after extraction of Co(Ⅱ) |
| |
式(4)中:Aliquat ·Cl表示Aliquat 336。
阴离子交换机理能很好地解释Cl-浓度、HCl浓度和温度对HDES萃取Co(Ⅱ)和Ni(Ⅱ)的影响机制。
1) 水相Cl-浓度增加时,Co(Ⅱ)与Cl-形成的络阴离子CoCl42-的浓度增加,由于HDES萃取Co(Ⅱ)的机理是阴离子交换[式(4)],所以CoCl42-浓度增加使得DCo增加。对于Ni(Ⅱ),其与Cl-能形成NiCl+,但很难形成络阴离子[29]。因此,Ni(Ⅱ)无法与HDES发生阴离子交换反应,所以增加Cl-浓度时,DNi的增加幅度较小,βCo/Ni增加。
2) 在保持Cl-浓度不变,HCl浓度增加时,H+和CoCl42-形成的中性络合物H2CoCl4的浓度增加[30, 31]。该中性络合物浓度的增加导致CoCl42-浓度下降,进而使得DCo下降,而HCl浓度对DNi的影响小于DCo,所以βCo/Ni随HCl浓度的增加呈下降趋势。
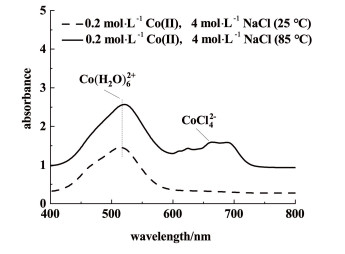
3) 温度升高时,Co(Ⅱ)与Cl-的络合常数增加,CoCl42-浓度升高,如图 9所示。因此,温度升高,DCo增加。对于Ni(Ⅱ),温度升高,水在HDES中的溶解度降低,随水相进入HDES的Ni(Ⅱ)浓度降低,使得DNi下降,βCo/Ni增加。
|
| 图 9 Co(Ⅱ)在水相中的紫外-可见吸收光谱 Fig.9 UV-Vis spectra of Co(Ⅱ) in water phase |
| |
三辛基甲基氯化铵与脂肪醇(CnH(2n+1)OH; n=6,8,10,12,14)组成的HDES能够在NaCl水溶液中实现Co(Ⅱ)和Ni(Ⅱ)的有效分离。萃入HDES中的Co(Ⅱ)可以采用1 mol ·L-1 Na2SO4溶液反萃,对于各HDES,经过2级反萃,Co(Ⅱ)反萃率均可达到99.5%以上。5种HDES萃取Co(Ⅱ)的机理相同,为阴离子交换。
| [1] |
FLETT D S. Cobalt-nickel separation in hydrometallurgy: A review[J]. Chemistry for sustainable development, 2004, 12(1): 81-91. |
| [2] |
PARK K H, MOHAPATRA D. Process for cobalt separation and recovery in the presence of nickel from sulphate solutions by Cyanex 272[J]. Metals and Materials International, 2006, 12(5): 441-446. DOI:10.1007/BF03027712 |
| [3] |
李亮. 钴镍的溶剂萃取分离工艺研究综述[J]. 湖南有色金属, 2015, 31(6): 51-54. LI Liang. Research review on the separation of cobalt and nickel by solvent extraction[J]. Hunan Nonferrous Metals, 2015, 31(6): 51-54. DOI:10.3969/j.issn.1003-5540.2015.06.014 (in Chinese) |
| [4] |
TAIT B K. Cobalt-nickel separation: The extraction of cobalt(Ⅱ) and nickel(Ⅱ) by Cyanex 301, Cyanex 302 and Cyanex 272[J]. Hydrometallurgy, 1993, 32(3): 365-372. DOI:10.1016/0304-386X(93)90047-H |
| [5] |
DEVI N B, NATHSARMA K C, CHAKRAVORTTY V. Separation and recovery of cobalt(Ⅱ) and nickel(Ⅱ) from sulphate solutions using sodium salts of D2EHPA, PC 88A and Cyanex 272[J]. Hydrometallurgy, 1998, 49(1/2): 47-61. |
| [6] |
李英, 张利华, 郭胜惠, 等. P507微乳液膜萃取分离钴镍研究[J]. 有色金属工程, 2016, 6(6): 40-44. LI Ying, ZHANG Lihua, GUO Shenghui, et al. Extraction and separation of cobalt from nickel by P507 microemulsion liquid membrane[J]. Nonferrous Metals Engineering, 2016, 6(6): 40-44. DOI:10.3969/j.issn.2095-1744.2016.06.009 (in Chinese) |
| [7] |
SWAIN N, PRADHAN S, MISHRA S. Efficiency of Aliquat 336 for hydrometallurgical separation of Sm(Ⅲ) and Co(Ⅱ) from nitrate medium[J]. Miner als Engineering, 2019. DOI:10.1016/j.mineng.2019.105872 |
| [8] |
徐志刚, 季尚军, 王朝华, 等. 溶液中镍钴萃取分离技术研究状况[J]. 湿法冶金, 2018, 37(5): 342-348. XU Zhigang, JI Shangjun, WANG Chaohua, et al. Review on separation of nickel and cobalt in solution by solvent extraction technology[J]. Hydrometallurgy of China, 2018, 37(5): 342-348. DOI:10.13355/j.cnki.sfyj.2018.05.002 (in Chinese) |
| [9] |
WELLENS S, THIJS B, BINNEMANS K. An environmentally friendlier approach to hydrometallurgy: Highly selective separation of cobalt from nickel by solvent extraction with undiluted phosphonium ionic liquids[J]. Green Chemistry, 2012. DOI:10.1039/c2gc35246j |
| [10] |
TIECCO M, CAPPELLINI F, NICOLETTI F, et al. Role of the hydrogen bond donor component for a proper development of novel hydrophobic deep eutectic solvents[J]. Journal of Molecular Liquids, 2019, 281: 423-430. DOI:10.1016/j.molliq.2019.02.107 |
| [11] |
JANICKA P, PRZYJAZNY A, BOCZKAJ G. Novel "acid tuned" deep eutectic solvents based on protonated L-proline[J]. Journal of Molecular Liquids, 2021. DOI:10.1016/j.molliq.2021.115965 |
| [12] |
SOROURADDIN S M, FARAJZADEH M A, OKHRAVI T. Development of dispersive liquid-liquid microextraction based on deep eutectic solvent using as complexing agent and extraction solvent: Application for extraction of heavy metals[J]. Separation Science and Technology, 2020, 55(16): 2955-2966. DOI:10.1080/01496395.2019.1666874 |
| [13] |
MENGHWAR P, YILMAZ E, SHERAZI S T H, et al. A sensitive and selective deep eutectic solvent-based ultrasound-assisted liquid phase microextraction procedure for separation-preconcentration and determination of copper in olive oil and water samples[J]. Separation Science and Technology, 2019, 54(15): 2431-2439. DOI:10.1080/01496395.2018.1547317 |
| [14] |
ZHU X L, XU C Y, TANG J, et al. Selective recovery of zinc from zinc oxide dust using choline chloride based deep eutectic solvents[J]. Transactions of Nonferrous Metals Society of China, 2019, 29(10): 2222-2228. DOI:10.1016/S1003-6326(19)65128-9 |
| [15] |
CAO J, YANG M, CAO F L, et al. Well-designed hydrophobic deep eutectic solvents as green and efficient media for the extraction of artemisinin from Artemisia annua leaves[J]. ACS Sustainable Chemistry & Engineering, 2017, 5(4): 3270-3278. |
| [16] |
VAN OSCH D J G P, DIETZ C H J T, WARRAG S E E, et al. The curious case of hydrophobic deep eutectic solvents: A story on the discovery, design, and applications[J]. ACS Sustainable Chemistry & Engineering, 2020. DOI:10.1021/acssuschemeng.0c00559 |
| [17] |
RIBEIRO B D, FLORINDO C, IFF L C, et al. Menthol-based eutectic mixtures: Hydrophobic low viscosity solvents[J]. ACS Sustainable Chemistry & Engineering, 2015, 3(10): 2469-2477. |
| [18] |
VAN OSCH D J G P, PARMENTIER D, DIETZ C H J T, et al. Removal of alkali and transition metal ions from water with hydrophobic deep eutectic solvents[J]. Chemical Communications, 2016, 52(80): 11987-11990. DOI:10.1039/C6CC06105B |
| [19] |
OLA P D, MATSUMOTO M. Use of deep eutectic solvent as extractant for separation of Fe (Ⅲ) and Mn(Ⅱ) from aqueous solution[J]. Separation Science and Technology, 2019, 54(5): 759-765. DOI:10.1080/01496395.2018.1517796 |
| [20] |
HANADA T, GOTO M. Synergistic deep eutectic solvents for lithium extraction[J]. ACS Sustainable Chemistry & Engineering, 2021, 9(5): 2152-2160. |
| [21] |
TAYSUN M B, SERT E, ATALAY F S. Effect of hydrogen bond donor on the physical properties of benzyltriethylammonium chloride based deep eutectic solvents and their usage in 2-ethyl-hexyl acetate synthesis as a catalyst[J]. Journal of Chemical & Engineering Data, 2017, 62(4): 1173-1181. |
| [22] |
SCHAEFFER N, MARTINS M A R, NEVES C M S S, et al. Sustainable hydrophobic terpene-based eutectic solvents for the extraction and separation of metals[J]. Chemical Communications (Cambridge, England), 2018, 54(58): 8104-8107. DOI:10.1039/C8CC04152K |
| [23] |
CAO J, YANG M, CAO F, et al. Tailor-made hydrophobic deep eutectic solvents for cleaner extraction of polyprenyl acetates from Ginkgo biloba leaves[J]. Journal of Cleaner Production, 2017, 152: 399-405. DOI:10.1016/j.jclepro.2017.03.140 |
| [24] |
MAKOŚ P, PRZYJAZNY A, BOCZKAJ G. Hydrophobic deep eutectic solvents as "green" extraction media for polycyclic aromatic hydrocarbons in aqueous samples[J]. Journal of Chromatography A, 2018, 1570: 28-37. DOI:10.1016/j.chroma.2018.07.070 |
| [25] |
WASSINK B, DREISINGER D, HOWARD J. Solvent extraction separation of zinc and cadmium from nickel and cobalt using Aliquat 336, a strong base anion exchanger, in the chloride and thiocyanate forms[J]. Hydrometallurgy, 2000, 57(3): 235-252. DOI:10.1016/S0304-386X(00)00116-X |
| [26] |
PARHI P K, PANIGRAHI S, SARANGI K, et al. Separation of cobalt and nickel from ammoniacal sulphate solution using Cyanex 272[J]. Separation and Purification Technology, 2008, 59(3): 310-317. DOI:10.1016/j.seppur.2007.07.026 |
| [27] |
SOBEKOVA FOLTOVA S, VANDER HOOGERSTRAETE T, BANERJEE D, et al. Samarium/cobalt separation by solvent extraction with undiluted quaternary ammonium ionic liquids[J]. Separation and Purification Technology, 2019, 210: 209-218. DOI:10.1016/j.seppur.2018.07.069 |
| [28] |
BARRERA N M, MCCARTY J L, DRAGOJLOVIC V. Effects of concentration on hexaaquacobalt(Ⅱ)/tetrachlorocobalt(Ⅱ) equilibrium. A discovery-oriented experiment for chemistry students[J]. The Chemical Educator, 2002, 7(3): 142-145. |
| [29] |
LIU Y, LEE M S. Separation of cobalt and nickel from chloride leach solution of nickel laterite ore by solvent extraction[J]. Geosystem Engineering, 2016, 19(5): 214-221. |
| [30] |
GENG Y, XIANG Z, LV C, et al. Recovery of gold from hydrochloric medium by deep eutectic solvents based on quaternary ammonium salts[J]. Hydrometallurgy, 2019, 188: 264-271. |
| [31] |
申婧, 杜志平, 李恩泽, 等. 离子液体对Cd(Ⅱ)的萃取性能的研究[J]. 工业水处理, 2017, 37(2): 87-90. SHEN Jing, DU Zhiping, LI Enze, et al. Research on the extraction capacity of ionic liquid for Cd(Ⅱ)[J]. Industrial Water Treatment, 2017, 37(2): 87-90. (in Chinese) |
 2023, Vol. 40
2023, Vol. 40





