由于具有对环境友好、生产效率高、适应性广和成本低等优点,光聚合已广泛用于电子电路板[1, 2]、平板显示器[3, 4]、光致抗蚀剂[5, 7]、光固化涂料[8, 9]和牙科医疗材料[10, 11]等各个领域。几十年来,由于聚合物颗粒在涂料、药物输送和催化中的广泛应用,光聚合合成聚合物颗粒一直是人们日益关注的话题。利用传统反应器进行光聚合制备聚合物颗粒缺乏对颗粒大小、形态和形状的控制,且需要多步过程。连续微流体的发展为光聚合提供了一种快速、有效和可控的方法,可以精确地处理微体积的流体,其优点包括具有高重复性和高合成精度以及聚合物颗粒的形态、尺寸、多分散性和内部结构的可控性。与宏观管式反应器相比,使用连续微流体进行光聚合能显著提高透光率、传质和传热效率,减少光衰减和试剂消耗,且能高度控制复杂的平行或连续反应。此外,能有效筛选配方,增强聚合物颗粒的性能,如聚合物颗粒的窄相对分子质量分布或高单分散性,有助于进行新材料的开发。
根据初始反应体系的相数,在连续微流体中以光聚合方式合成聚合物颗粒的方法可以分为单相连续微流体方法和多相连续微流体方法。用于合成聚合物颗粒的单相连续微流体方法主要是光刻法[12, 13],可聚合液体通过具有图案化掩模的连续微流体来实现光聚合。用于合成聚合物颗粒的多相连续微流体方法则主要是液滴微流控法,其利用了微流体通道内多相之间的剪切力、黏性力和界面张力的相互作用生成液滴,然后使用光聚合实现液滴中的交联。这篇综述将从以上分类分别介绍连续微流体在光聚合制备纳米到微米聚合物颗粒中的应用,目的是强调连续微流体在这一应用中的高精度控制潜力。
1 单相连续微流体光聚合单相连续微流体光聚合制备聚合物颗粒的原理是利用特定形状的光掩膜限制光照射来引发局部光聚合。与多相连续微流体光聚合相比,其颗粒的形态和化学性质可以独立选择,能一次性制备多种复杂形状的聚合物颗粒,用于药物输送、生物传感器、微致动器以及自组装和流变学的基础研究。利用连续流微流体,研究者们前后提出了连续流光刻技术和停流光刻技术,并引入了数字镜面设备(DMD)提出了无掩膜光刻技术,利用双光子吸收、相掩膜干涉和锁定释放等方法不断提升3D粒子的合成能力。
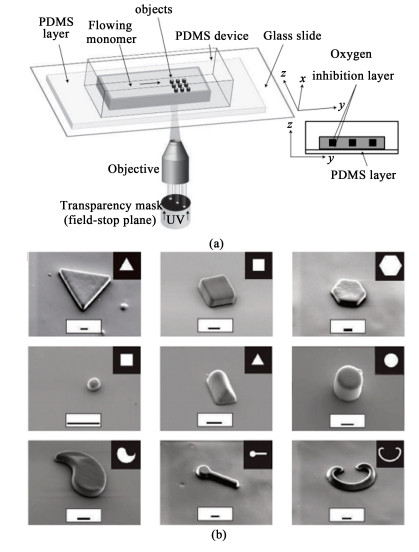
1.1 连续流光刻技术Dendukuri小组[12]最早提出了连续流光刻法的概念,该方法结合了显微镜投影光刻和连续微流体技术的优势,可连续形成直至胶体长度的复杂多功能颗粒,如图 1所示。通过抑制聚二甲基硅氧烷(PDMS)表面附近的自由基聚合,他们能够在不到0.1 s的时间内重复图案化并使一排颗粒流动,提供每秒近100个颗粒的产量。该方法的优点是设备简单,可使用标准荧光显微镜直接实现,并且可以轻松地扩展以创建在一步合成中具有2个以上不同编码(例如化学、荧光、磁性)区域的颗粒。
然而,使用固定的光掩膜进行光刻很难统一控制聚合物颗粒制造过程中的曝光模式和时间。于是,Chung等[14]提出了一种具有可编程图案的无掩膜微流体光刻技术,使用DMD代替了标准掩模来实时改变掩膜形状, 显著提高了微流体光刻系统的性能和灵活性。
掩模光刻和DMD无掩膜光刻在制备聚合物颗粒方面存在一些不足,其对粒子的几何形状限制基本是二维(2D)形状限制,且难以形成亚微米级的粒子结构。于是,Laza等[15]将双光子吸收原理应用到光刻系统中,引入了双光子连续流光刻新方法。该技术利用双光子吸收的高分辨率来创建具有亚微米和三维(3D)特征的物体,并通过使用多光束生产,克服了双光子光刻的传统工艺限制,制造了具有任意复杂形状和特征尺寸低于衍射极限的3D聚合物颗粒。
1.2 停流光刻技术在连续流光刻技术中,由于粒子在流动中合成并暴露于有限的紫外线脉冲光中,当使用高流速时,聚合物颗粒会被涂抹。为了保证颗粒的分辨率,连续流光刻技术的最大流速有限,这限制了颗粒的吞吐量,并且随着颗粒尺寸的减小,这个问题更加突出。
Dendukuri小组[13]在原本的研究基础上提出了停流光刻技术,顾名思义,在进行原位光刻前先停止前体溶液在微流体通道中的流动,将前体溶液以规则的间隔暴露在由光掩模构图的光下聚合产生离散的颗粒,然后以高流速冲洗形成的颗粒,再重复停止-聚合-流动循环。该技术大大提高了合成聚合物颗粒的分辨率。与连续流光刻技术相比,高流速让停流光刻技术的粒子吞吐量提高了几个数量级。此方法已被用于生产用于各种应用的聚合物颗粒[16-18]。
与连续流光刻技术相同,停流光刻技术对纳米粒子的形状控制只停留在2D层面。为了提高3D粒子的合成能力,研究者们付出了不断的努力。Jang等[19]报道了一种新型的微流控干涉光刻技术,该技术集成了相掩模干涉光刻和停流光刻技术的互补方面。可以使用生物相容性低聚物前体溶液高通量合成具有亚微米特征尺寸的3D图案化透明掩模定义的聚合物颗粒。这种方法的独特优势在于它不必使用图案化的光掩模来定义粒子的横截面,而是可以使用光干涉来定义粒子的横截面形状和尺寸结构。
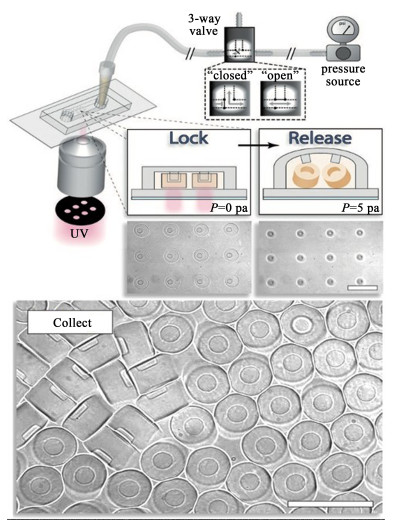
1.3 锁定释放光刻技术在连续流光刻技术和停流光刻技术的基础上,引入了锁定释放光刻技术[20],该技术结合了通道的形貌、掩模设计和压力引起的通道变形,以周期性的方式形成和释放颗粒。在图 2中,他们将微流体通道上的正浮雕特征用作模具,以增加对投影光刻制造的颗粒几何形状的约束。随后通过压力诱导的通道变形释放颗粒。这种方法允许粒子的多种介质交换或多材料图案化,因为它们可以在制备过程中固定到位。该技术通过通道形貌、掩模特征和压力引起的通道变形的巧妙结合轻松生成各种3D和多功能复合粒子。
2 多相连续微流体光聚合液滴微流控技术作为最普遍的技术之一,已经具有许多应用,例如基因突变、蛋白质晶体鉴定研究和DNA突变研究等[21, 25],被认为是一种基于微流体技术的新方法,用于研究微米至数百微米范围内的微滴的产生、操作和应用。在光聚合领域中可以通过将固化剂直接掺入液滴或连续相中来实现液滴的聚合。
在微流体装置中产生液滴的方法有2种:主动方法和被动方法。主动方法包括不同的机械方法(电、热、气动、光学、磁方法等)。被动方法包括T型接头[26-31]、Y型接头、流聚焦设备[32-38]、同轴毛细管微流体设备[39-43]和其他方法[44]。被动方法利用微通道的几何限制,通过流动剪切力和表面张力之间的相互作用,产生微升及以下的液滴。与主动方法相比,被动方法产生的液滴具有更好的单分散性以及更均匀的尺寸和空间分布,可以形成连续的液滴串并可以有效避免交叉污染和外部干扰。在大多数情况下,通道内原位生成的多功能单体液滴会在紫外线或可见光下固化[45, 46],然后可以获得具有可控和复杂形态的单分散微尺寸颗粒,例如球形[47]、Janus[48]、核-壳颗粒[49, 50]和微胶囊[39]。与单相流相比,多相液滴微流控法的特征在于快速的传热传质速度以及理想的混合情况,显著降低甚至消除了轴向分散带来的不良影响[51, 52]。通常,液滴是在以下3种类型的微流体液滴生成器中生成的,即T型结或Y型结[26-31]、流聚焦液滴生成器[32-38]和基于毛细管的同流设备[39-43]。通过调节微通道的尺寸、液体的宏观特性以及流速,可以控制形成液滴的大小。
2.1 T型结结构一些研究人员已经相继研究了T型微流体中液滴形成的原理。液滴的产生过程采用“两步法”模型:液滴头的生长阶段和颈部的挤压、断裂分离阶段。分散相的头部迅速进入两相接触区域,并在主管道中继续增大。随着液滴头的体积增加,主通道被部分阻塞,这增加了液滴头与通道壁之间的阻力并阻塞了连续相流体。连续相只能在液滴头和通道壁之间的薄层中向前流动,这反过来增加了液滴头所受的压力。同时,在压力的驱使下,分散相的头部继续向下游增大,最后分散相被挤压破碎形成液滴。
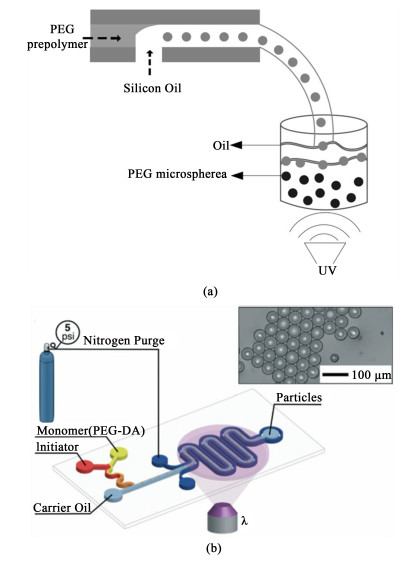
通常,制备聚乙二醇(PEG)微球要先通过超声、涡旋、均质化或微流控形成乳液。悬浮在不混溶油相中的稳定颗粒再通过辐射进行光聚合[53, 54]。Ren等[55]使用T型微流控芯片结合光聚合技术制备了单分散的PEG微球。如图 3(a)所示,基于T型接头微流体通道中的鞘效应,形成了在硅油中均匀分散的PEG预聚物液滴。通过改变连续相和分散相的相对流速比,可以很好地控制形成的PEG预聚物液滴的直径。然而,氧气的存在对聚合具有抑制作用,难以在高氧浓度环境中制备水凝胶。Krutkramelis等[56]设计了一种通过微流体乳化、氮气吹扫和光聚合“一锅”制备水凝胶颗粒的装置。如图 3(b)所示,使用T形结构形成微滴,并引入用于现场吹氧的带氮夹套的微流体装置。该方法采用了温和的聚合条件和与细胞相容的液滴组成,可用于生产功能性生物材料。
除了球形聚合物颗粒外,研究者们也致力于利用T型结微流控设备制备特殊形状的粒子。利用液滴根据通道的几何形状和流动参数而变形或拉紧的性质,形成盘状或塞状的聚合物颗粒[57]。使用图 4(a)所示的T型结装置,首先剪切前体溶液使其在T型结处形成液滴,然后通过特定几何形状的微通道中来约束液滴变形。在低剪切速率下剪切聚合物相产生塞状形状颗粒[图 4(b)],而通过减小微通道的高度使液滴变平而获得盘状形状颗粒[图 4(c)]。该方法证明可以通过操纵前驱物的流动参数或通道几何形状来改变聚合物颗粒的粒径和形态,为制备不同形状聚合物颗粒的研究提供了更多思路。
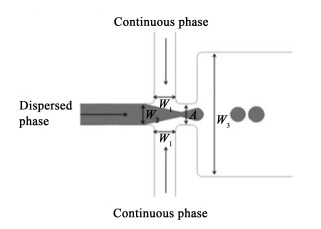
在流聚焦方法中,3个流路聚焦在1根管子上,分散相和流动相在横管处会聚。在相交处的连续相流体从2侧挤压分散相流体的前部,分散相流体的前部由于下游通道的“颈状”结构收缩并变形,从而形成离散的液滴。如图 5所示,液滴的产生过程分为3个阶段:1)分散相和连续相在相交处形成界面并流向位置A和下游。2)在位置A的几何结构和连续相压力的共同约束下,分散相形成“收缩颈”。3)增大的挤压力梯度使“收缩颈”前端的液体完全不稳定,从而形成液滴。
|
| 图 5 流聚焦结构图 Fig.5 Stream focus structure diagram |
| |
通过Lin小组[58, 59]和Zhao[60]的研究,提出了一种使用交叉连接微通道产生粒子的方法。Lin小组[32]开发了具有交叉连接通道的微流控芯片。如图 6所示,油相流体将在分散相流体上产生鞘力,在微流体通道中形成连续的乳液液滴,再将液滴暴露于紫外线下发生光聚合形成颗粒。乳液液滴的尺寸随分散相流体平均速度的增加而增加,随连续相流体平均速度的增加而减小。该方法可以通过流体压力控制聚合物颗粒的均匀性和大小,而无需后续的尺寸调节过程。该方法可用于组织工程应用中高通量制造微凝胶[61],为高通量单细胞封装或筛选提供了潜在的工具[62-64]。
研究者们通过不断探究,利用流聚焦装置开发出制备复杂形状聚合物颗粒的方法。Choi等[65]从Janus液滴中制备具有高柔韧性的各向异性颗粒,并通过原位光聚合来控制其形状。如图 7所示,微流体装置使用2个单体相(由引发剂和单体溶液组成的光固化相,由引发剂类似物和单体溶液组成的模板相)和疏水性油相形成Janus液滴。使用化学类似物可以使油相与每个单体相之间的界面张力保持一致。通过组合具有不同扩散系数的多种流体,可以生成核-壳液滴、Janus液滴和分离液滴3种双相颗粒形态,可应用于自组装、光子学、诊断和药物输送领域。他们还通过流体的黏度比,使用模板辅助的多相微流体来合成具有复杂形状的微纤维[66]。
同轴流聚焦方法将毛细管插入通道的中心轴,分散相和连续相在管道中平行。当在连续相流体的剪切力作用下进入连续相管道时,分散相被挤压并破碎成液滴。与流聚焦方法不同,同轴毛细管微流体通道不具有“颈状”结构。连续相围绕分散相“挤出”以形成“收缩颈”,而不是从两侧“挤出”分散相,从而扰乱了分散相流体的前部并产生了液滴。
具有非球形形状的微尺寸聚合物颗粒的受控合成变得越来越重要,同轴毛细管微流体在制备复杂形状的聚合物颗粒上的应用潜力很大。利用同轴毛细管微流体装置可以形成复合乳液液滴,并在此基础上通过填充可后处理除去的油滴或用于改善性能的微粒等方法,制备各种复杂形状的微胶囊、Janus、壳-核聚合物颗粒。根据图 8(a)所示的同轴毛细管微流体装置,Amato等[40]成功获得了单分散双乳液液滴。该设备包含2个圆锥形的玻璃毛细管。1个用于注射,另1个用于收集。将小的毛细管插入注射毛细管中,以注射形成双乳剂最内层液滴的水相。通过方形毛细管和收集毛细管之间的间隙将表面活性剂水溶液作为连续相注入。通过连续水相的剪切,来自注入毛细管中的毛细管液滴的活塞流被分解为具有薄硫醇-烯层的单分散双乳液液滴。然后,所得的液滴流过收集毛细管,并受到紫外线辐射,形成薄壳微囊。
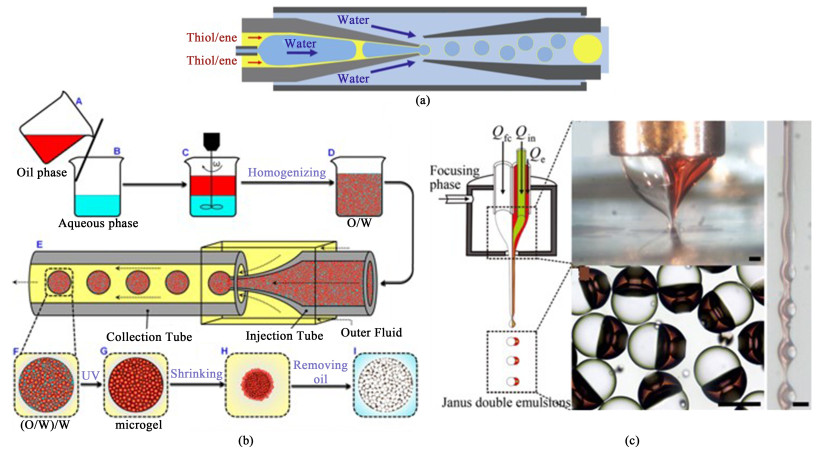
|
| 图 8 (a) 用于制备薄壳硫醇-烯双乳液滴的玻璃毛细管微流体装置的横截面示意图[40]; (b) 开放式多孔PNIPAM微凝胶的制备过程示意图[67]; (c) 通过MCFF法制造复合乳液的实验装置的示意图[41] Fig.8 (a) Cross-sectional schematic of the glass capillary microfluidic device for preparation of thin-shell thiol-ene double emulsion drops[40]; (b) Schematic diagram of the preparation process of open porous PNIPAM microgel[67]; (c) Schematic diagram of the experimental device for manufacturing composite emulsions by the MCFF method[41] |
| |
利用同轴毛细管微流体装置可以制备具有开放的多孔结构制备单分散和快速响应性聚(N-异丙基丙烯酰胺)(PNIPAM)微凝胶[67]。如图 8(b)中所示,首先,将通过均相乳化法制备的水包油(O/W)初乳液用作内相,然后在同轴毛细管微流体装置中进一步乳化,形成单分散(O/W)/O乳液模板。通过在(O/W)/O乳化剂模板中聚合水相,可以获得具有大量嵌入的小油滴的PNIPAM微凝胶。随后,当由刺激引起的微凝胶的体积迅速收缩时,嵌入在PNIPAM微凝胶中的微小油滴被挤出,在PNIPAM微凝胶内部形成了海绵状的开放多孔结构,有效地提高了PNIPAM微凝胶的动态热响应收缩率和溶胀率。利用类似的方法,通过将纳米粒子(例如热响应纳米凝胶和金纳米粒子)加入到内部液滴中以涂覆核心表面进行改性,可以实现对核心界面特性的控制。Wang等[68]使用双重乳液作为模板制造了具有精确控制的结构和灵活改性的核表面的单分散孔-壳微粒。通过改变内部液滴的体积和数量,可以进一步控制孔-壳结构。
将同轴毛细管与流聚焦装置相结合,利用Janus液滴的特性,Wu等[41]使用多重同轴流聚焦(MCFF)工艺生产了具有不规则形状的复杂乳液。如图 8(c)所示,使用包括内相、2个外相和聚焦相的4个流动相来牢固地形成多相锥形喷雾结构。由于沿射流界面传播的干扰,复合液体射流最终分裂成Janus液滴。通过调节所有相的界面张力和流速,可以精确控制复杂乳液的形状和大小。通过在Janus液滴的UV聚合之后除去碳氟化合物油半球,可以获得月牙形的颗粒和微胶囊。这种具有不规则形状的复杂乳液可用于多种领域,包括功能材料、微透镜、光子晶体和细胞培养。
3 结论与展望用于光聚合的微流体装置可以精确地控制聚合物颗粒的合成,实现高通量制备,可以用于筛选和优化配方。一方面,单相微流聚合可以一次制备各种形状的3D聚合物颗粒,并允许自动和半连续合成。另一方面,液滴微流控技术具有样品消耗少,无交叉污染和液滴操作准确的优点被广泛用于药物输送、生物工程等领域。
从简单的光聚合反应到制备复杂结构的聚合物颗粒,连续微流体在光聚合中的应用潜力一直被不断挖掘。未来,连续微流体在光聚合制备聚合物材料领域有望实现高通量合成材料库,实现在线监测和自动合成,这在生物医学研究和材料工程中具有重要意义。然而,连续微流体利用光聚合的大规模商业生产仍然是很大的挑战,特别是在液滴微流体的光聚合应用中。尽管已经提出了具有多个液滴产生器的新型芯片结构,包括步进式乳化剂和平行化的微流体液滴产生器,但是仍有很多改进的空间。此外,从连续微流体光聚合衍生的聚合物材料仍然缺乏多样性和功能性,需要更多的研究来激发应用潜力。
| [1] |
KASISOMAYAJULA S, JADHAV N, GELLING V J. Conductive polypyrrole and acrylate nanocomposite coatings: Mechanistic study on simultaneous photopolymerization[J]. Progress in Organic Coatings, 2016, 101: 440-454. DOI:10.1016/j.porgcoat.2016.07.023 |
| [2] |
HEYDARNEZHAD H R, POURABBAS B, TAYEFI M. Conducting electroactive polymers via photopolymerization: A review on synthesis and applications[J]. Polymer-Plastics Technology and Engineering, 2018, 57(11): 1093-1109. DOI:10.1080/03602559.2017.1370111 |
| [3] |
ALLONAS X, DIETLIN C, FOUASSIER J P, et al. Barton esters as new radical photoinitiators for flat panel display applications[J]. Journal of Photopolymer Science and Technology, 2008, 21(4): 505-509. DOI:10.2494/photopolymer.21.505 |
| [4] |
LEE K M, WARE T H, TONDIGLIA V P, et al. Initiatorless photopolymerization of liquid crystal monomers[J]. ACS Applied Materials & Interfaces, 2016, 8(41): 28040-28046. |
| [5] |
LUO C, XU C, LV L, et al. Review of recent advances in inorganic photoresists[J]. RSC Advances, 2020, 10(14): 8385-8395. DOI:10.1039/C9RA08977B |
| [6] |
CHENG E, TANG S, LI C, et al. Nano-patterns of photoresist fabricated by ultraviolet lithography technology[J]. Journal of Nanoscience and Nanotechnology, 2020, 20(4): 2508-2513. DOI:10.1166/jnn.2020.17208 |
| [7] |
OLESHKEVICH A N, LAPCHUK N M, ODZHAEV V B, et al. Electronic conductivity in a P+-ion implanted positive photoresist[J]. Russian Microelectronics, 2020, 49(1): 55-61. DOI:10.1134/S1063739719060076 |
| [8] |
JOLANKI R, KANERVA L, ESTLANDER T. Occupational allergic contact dermatitis caused by epoxy diacrylate in ultraviolet-light-cured paint, and bisphenol A in dental composite resin[J]. Contact Dermatitis, 1995, 33(2): 94-99. DOI:10.1111/j.1600-0536.1995.tb00508.x |
| [9] |
HOPE J. Light in weight: UV curing paint systems increase the versatility of plastics in weight saving applications[J]. Transactions of the IMF, 2013, 91(6): 301-305. DOI:10.1179/0020296713Z.000000000143 |
| [10] |
HUANG S, PODGÓRSKI M, ZHANG X, et al. Dental restorative materials based on thiol-michael photopolymerization[J]. Journal of Dental Research, 2018, 97(5): 530-536. DOI:10.1177/0022034518755718 |
| [11] |
ABEDIN F, YE Q, SPENCER P. Hydrophilic dyes as photosensitizers for photopolymerization of dental adhesives[J]. Journal of Dentistry, 2020. DOI:10.1016/j.jdent.2020.103405 |
| [12] |
Dendukuri D, Pregibon D C, Collins J, et al. Continuous-flow lithography for high-throughput microparticle synthesis[J]. Nature Materials, 2006, 5: 365-369. DOI:10.1038/nmat1617 |
| [13] |
DENDUKURI D, GU S S, PREGIBON D C, et al. Stop-flow lithography in a microfluidic device[J]. Lab on a Chip, 2007, 7(7): 818-828. DOI:10.1039/b703457a |
| [14] |
CHUNG S E, PARK W, PARK H, et al. Optofluidic maskless lithography system for real-time synthesis of photopolymerized microstructures in microfluidic channels[J]. Applied Physics Letters, 2007. DOI:10.1063/1.2759988 |
| [15] |
LAZA S C, POLO M, NEVES A A R, et al. Two-photon continuous flow lithography[J]. Advanced Materials, 2012, 24(10): 1304-1308. DOI:10.1002/adma.201103357 |
| [16] |
TSOU T Y, CHEN H, HSIEH C C. Bihydrogel particles as free-standing mechanical pH microsensors[J]. Applied Physics Letters, 2013. DOI:10.1063/1.4788718 |
| [17] |
WANG S, WANG P, HSIEH I M, et al. Microfluidic synthesis of silica microcomponents using sol-gel process and stop-flow lithography[J]. Journal of the Taiwan Institute of Chemical Engineers, 2018, 93: 103-108. DOI:10.1016/j.jtice.2018.09.015 |
| [18] |
CHEN L, AN H, DOYLE P S. Synthesis of nonspherical microcapsules through controlled polyelectrolyte coating of hydrogel templates[J]. Langmuir, 2015, 31(33): 9228-9235. DOI:10.1021/acs.langmuir.5b02200 |
| [19] |
JANG J H, DENDUKURI D, HATTON T, et al. A route to three-dimensional structures in a microfluidic device: Stop-flow interference lithography[J]. Angewandte Chemie International Edition, 2007, 46(47): 9027-9031. DOI:10.1002/anie.200703525 |
| [20] |
BONG K W, PREGIBON D C, DOYLE P S. Lock release lithography for 3D and composite microparticles[J]. Lab on a Chip, 2009, 9(7): 863-866. DOI:10.1039/b821930c |
| [21] |
Whitesides G M. The origins and the future of microfluidics[J]. Nature, 2006, 442(7101): 368-373. DOI:10.1038/nature05058 |
| [22] |
WEIGL B H, BARDELL R L, CABRERA C R. Lab-on-a-chip for drug development[J]. Advanced Drug Delivery Reviews, 2003, 55(3): 349-377. DOI:10.1016/S0169-409X(02)00223-5 |
| [23] |
NEUZI P, GISELBRECHT S, LANGE K, et al. Revisiting lab-on-a-chip technology for drug discovery[J]. Nat Rev Drug Discov, 2012, 11(8): 620-632. DOI:10.1038/nrd3799 |
| [24] |
DITTRICH P S, MANZ A. Lab-on-a-chip: Microfluidics in drug discovery[J]. Nat Rev Drug Discov, 2006, 5(3): 210-218. DOI:10.1038/nrd1985 |
| [25] |
FIGEYS D, PINTO D. Lab-on-a-chip: A revolution in biological and medical sciences[J]. Analytical Chemistry, 2000, 72(9): 330A-335A. DOI:10.1021/ac002800y |
| [26] |
SONG H, TICE J D, ISMAGILOV R F. A microfluidic system for controlling reaction networks in time[J]. Angewandte Chemie International Edition, 2003, 42(7): 768-772. DOI:10.1002/anie.200390203 |
| [27] |
THORSEN T, ROBERTS R W, ARNOLD F H, et al. Dynamic pattern formation in a vesicle-generating microfluidic device[J]. Physical Review Letters, 2001, 86(18): 4163-4166. DOI:10.1103/PhysRevLett.86.4163 |
| [28] |
NISISAKO T, TORⅡ T, HIGUCHI T. Droplet formation in a microchannel network[J]. Lab on a Chip, 2002, 2(1): 24-26. DOI:10.1039/B108740C |
| [29] |
TICE J D, SONG H, LYON A D, et al. Formation of droplets and mixing in multiphase microfluidics at low values of the Reynolds and the capillary numbers[J]. Langmuir, 2003, 19(22): 9127-9133. DOI:10.1021/la030090w |
| [30] |
TICE J D, LYON A D, ISMAGILOV R F. Effects of viscosity on droplet formation and mixing in microfluidic channels[J]. Analytica Chimica Acta, 2004, 507(1): 73-77. DOI:10.1016/j.aca.2003.11.024 |
| [31] |
LIU H, NAKAJIMA M, KIMURA T. Production of monodispersed water-in-oil emulsions using polymer microchannels[J]. Journal of the American Oil Chemists' Society, 2004, 81(7): 705-711. DOI:10.1007/s11746-004-965-9 |
| [32] |
YEH C H, LIN Y. Using a cross-flow microfluidic chip for monodisperse UV-photopolymerized microparticles[J]. Microfluidics and Nanofluidics, 2009, 6(2): 277-283. DOI:10.1007/s10404-008-0333-1 |
| [33] |
XIA B, JIANG Z, DEBROY D, et al. Cytocompatible cell encapsulation via hydrogel photopolymerization in microfluidic emulsion droplets[J]. Biomicrofluidics, 2017. DOI:10.1063/1.4993122 |
| [34] |
ANNA S L, BONTOUX N, STONE H A. Formation of dispersions using "flow focusing" in microchannels[J]. Applied Physics Letters, 2003, 82(3): 364-366. DOI:10.1063/1.1537519 |
| [35] |
QUEVEDO E, STEINBACHER J, MCQUADE D T. Interfacial polymerization within a simplified microfluidic device: Capturing capsules[J]. Journal of the American Chemical Society, 2005, 127(30): 10498-10499. DOI:10.1021/ja0529945 |
| [36] |
DREYFUS R, TABELING P, WILLAIME H. Ordered and disordered patterns in two-phase flows in microchannels[J]. Physical Review Letters, 2003. DOI:10.1103/PhysRevLett.90.144505 |
| [37] |
XU Q, NAKAJIMA M. The generation of highly monodisperse droplets through the breakup of hydrodynamically focused microthread in a microfluidic device[J]. Applied Physics Letters, 2004, 85(17): 3726-3728. DOI:10.1063/1.1812380 |
| [38] |
WARD T, FAIVRE M, ABKARIAN M, et al. Microfluidic flow focusing: Drop size and scaling in pressure versus flow-rate-driven pumping[J]. Electrophoresis, 2005, 26(19): 3716-3724. DOI:10.1002/elps.200500173 |
| [39] |
WANG J, HU Y, DENG R, et al. Construction of multifunctional photonic crystal microcapsules with tunable shell structures by combining microfluidic and controlled photopolymerization[J]. Lab on a Chip, 2012, 12(16): 2795-2798. DOI:10.1039/c2lc40419b |
| [40] |
AMATO D V, LEE H, WERNER J G, et al. Functional microcapsules via thiolene photopolymerization in droplet-based microfluidics[J]. ACS Applied Materials & Interfaces, 2017, 9(4): 3288-3293. |
| [41] |
WU Q, YANG C, YANG J, et al. Photopolymerization of complex emulsions with irregular shapes fabricated by multiplex coaxial flow focusing[J]. Applied Physics Letters, 2018. DOI:10.1063/1.5018207 |
| [42] |
ORTIZ DE SOLORZANO I, MENDOZA G, ARRUEBO M, et al. Customized hybrid and NIR-light triggered thermoresponsive drug delivery microparticles synthetized by photopolymerization in a one-step flow focusing continuous microreactor[J]. Colloids and Surfaces B: Biointerfaces, 2020. DOI:10.1016/j.colsurfb.2020.110904 |
| [43] |
MICHAE KÖHLERL J, KRAUS I, FAERBER J, et al. Continuous-flow preparation of nanoporous metal/polymer composite particles by in situ synthesis of silver nanoparticles in photopolymerized acrylate/diethylene glycol droplets[J]. Journal of Materials Science, 2013, 48(5): 2158-2166. DOI:10.1007/s10853-012-6991-0 |
| [44] |
VLADISAVLJEVIĆ G T, KHALID N, NEVES M A, et al. Industrial lab-on-a-chip: Design, applications and scale-up for drug discovery and delivery[J]. Advanced Drug Delivery Reviews, 2013, 65(11/12): 1626-1663. |
| [45] |
SEO M, NIE Z, XU S, et al. Continuous microfluidic reactors for polymer particles[J]. Langmuir, 2005, 21(25): 11614-11622. DOI:10.1021/la050519e |
| [46] |
YEH C H, HUNG C Y, CHANG T, et al. An immunoassay using antibody-gold nanoparticle conjugate, silver enhancement and flatbed scanner[J]. Microfluidics and Nanofluidics, 2009, 6(1): 85-91. DOI:10.1007/s10404-008-0298-0 |
| [47] |
SEO K D, KIM D S, SÁNCHEZ S. Fabrication and applications of complex-shaped microparticles via microfluidics[J]. Lab on a Chip, 2015, 15(18): 3622-3626. DOI:10.1039/C5LC90091C |
| [48] |
NIE Z, LI W, SEO M, et al. Janus and ternary particles generated by microfluidic synthesis: Design, synthesis, and self-assembly[J]. Journal of the American Chemical Society, 2006, 128(29): 9408-9412. DOI:10.1021/ja060882n |
| [49] |
GONG X, PENG S, WEN W, et al. Design and fabrication of magnetically functionalized core/shell microspheres for smart drug delivery[J]. Advanced Functional Materials, 2009, 19(2): 292-297. DOI:10.1002/adfm.200801315 |
| [50] |
KÖHLER J M, ROMANUS H, HVBNER U, et al. Formation of star-like and core-shell AuAg nanoparticles during two- and three-step preparation in batch and in microfluidic systems[J]. Journal of Nanomaterials, 2007. DOI:10.1155/2007/98134 |
| [51] |
SHUI L L, EIJKEL J C T, VAN DEN BERG A. Multiphase flow in microfluidic systems—Control and applications of droplets and interfaces[J]. Advances in Colloid and Interface Science, 2007, 133(1): 35-49. DOI:10.1016/j.cis.2007.03.001 |
| [52] |
GVNTHER A, JENSEN K F. Multiphase microfluidics: From flow characteristics to chemical and materials synthesis[J]. Lab on a Chip, 2006, 6(12): 1487-1503. DOI:10.1039/B609851G |
| [53] |
Landfester K, Musyanovych A. Hydrogels in miniemulsions[J]. Springer Science and Media, 2010, 234: 39-63. |
| [54] |
AHMED E M. Hydrogel: Preparation, characterization, and applications: A review[J]. Journal of Advanced Research, 2015, 6(2): 105-121. DOI:10.1016/j.jare.2013.07.006 |
| [55] |
REN Y, YU B, CONG H, et al. Preparation of monodisperse PEG microspheres by a T-junction microfluidic chip[J]. Advanced Materials Research, 2012, 465: 178-181. DOI:10.4028/www.scientific.net/AMR.465.178 |
| [56] |
KRUTKRAMELIS K, XIA B, OAKEY J. Monodisperse polyethylene glycol diacrylate hydrogel microsphere formation by oxygen-controlled photopolymerization in a microfluidic device[J]. Lab on a Chip, 2016, 16(8): 1457-1465. DOI:10.1039/C6LC00254D |
| [57] |
DENDUKURI D, TSOI K, HATTON T A, et al. Controlled synthesis of nonspherical microparticles using microfluidics[J]. Langmuir: the ACS Journal of Surfaces and Colloids, 2005, 21(6): 2113-2116. DOI:10.1021/la047368k |
| [58] |
HUANG K, LAI T, LIN Y. Manipulating the generation of Ca-alginate microspheres using microfluidic channels as a carrier of gold nanoparticles[J]. Lab on a Chip, 2006, 6(7): 954-957. DOI:10.1039/b606424h |
| [59] |
HUANG K, LAI T, LIN Y. Using a microfluidic chip and internal gelation reaction for monodisperse calcium alginate microparticles generation[J]. Frontiers in Bioscience: A Journal and Virtual Library, 2007, 12: 3061-3067. DOI:10.2741/2295 |
| [60] |
ZHAO B, VIERNES N O L, MOORE J S, et al. Control and applications of immiscible liquids in microchannels[J]. Journal of the American Chemical Society, 2002, 124(19): 5284-5285. DOI:10.1021/ja025835j |
| [61] |
SILTANEN C, YAGHOOBI M, HAQUE A, et al. Microfluidic fabrication of bioactive microgels for rapid formation and enhanced differentiation of stem cell spheroids[J]. Acta Biomaterialia, 2016, 34: 125-132. DOI:10.1016/j.actbio.2016.01.012 |
| [62] |
REECE A, XIA B, JIANG Z, et al. Microfluidic techniques for high throughput single cell analysis[J]. Current Opinion in Biotechnology, 2016, 40: 90-96. DOI:10.1016/j.copbio.2016.02.015 |
| [63] |
TORRES-PADILLA M E, CHAMBERS I. Transcription factor heterogeneity in pluripotent stem cells: A stochastic advantage[J]. Development (Cambridge, England), 2014, 141(11): 2173-2181. DOI:10.1242/dev.102624 |
| [64] |
MACOSKO E Z, BASU A, SATIJA R, et al. Highly parallel genome-wide expression profiling of individual cells using nanoliter droplets[J]. Cell, 2015, 161(5): 1202-1214. DOI:10.1016/j.cell.2015.05.002 |
| [65] |
CHOI C H, HWANG S, JEONG J M, et al. Microfluidic synthesis of anisotropic particles from Janus drop by in situ photopolymerization[J]. Biomedical Engineering Letters, 2012, 2(2): 95-99. DOI:10.1007/s13534-012-0057-8 |
| [66] |
CHOI C H, YI H, HWANG S, et al. Microfluidic fabrication of complex-shaped microfibers by liquid template-aided multiphase microflow[J]. Lab on a Chip, 2011, 11(8): 1477-1483. DOI:10.1039/c0lc00711k |
| [67] |
MOU C, JU X, ZHANG L, et al. Monodisperse and fast-responsive poly(N-isopropylacrylamide) microgels with open-celled porous structure[J]. Langmuir: the ACS Journal of Surfaces and Colloids, 2014, 30(5): 1455-1464. DOI:10.1021/la4046379 |
| [68] |
WANG W, ZHANG M, XIE R, et al. Hole-shell microparticles from controllably evolved double emulsions[J]. Angewandte Chemie International Edition, 2013, 52(31): 8084-8087. DOI:10.1002/anie.201301590 |
 2023, Vol. 40
2023, Vol. 40