2. 四川大学新能源与低碳技术研究院, 成都 610207
2. Institute of New Energy and Low-Carbon Technology, Sichuan University, Chengdu 610207, China
CO2的大量排放是全球变暖的源头之一。现代工业对化石燃料的依赖直接导致了前所未有的二氧化碳排放[1]。为实现CO2的减排,开发了各种碳捕集、利用和封存(CCUS)技术,其中包括将CO2转化为其他增值产品[2]。在CO2转化利用中,催化加氢(CO2与H2反应生成甲醇、二甲醚、甲酸、甲烷、碳氢化合物或其他物质催化剂)是有吸引力的过程[3]。它被认为是有前途的低碳技术之一,从原子经济的角度来看,CO2加氢成甲酸是一种原子经济高的反应[4]。甲酸广泛用于农业、食品技术、皮革和橡胶工业等。此外,它还可以用作储存和运输氢气的载体极具研究前景[5]。
金属催化剂是常见的加氢催化剂,其中贵金属催化剂在工业上使用广泛。比如Ag基催化剂:Ag/SiO2、Ag/CNT(碳纳米管)、Ag/SBA-15(介孔二氧化硅)、Ag/AC-N(掺氮活性炭)、Ag-Au/SBA-15和Ag/KCC-1(纤维状纳米二氧化硅)等催化剂[6-8]。有研究表明,纯金属作为催化剂相比负载催化剂活性更低,由于纯金属表面暴露的活性位点少,同时金属内部的金属原子没有参与反应造成原子利用率不高。最近的研究证明单原子催化剂(SACs)具有高的原子利用率,是理想的负载催化剂的形式。当金属粒子达到原子形式,比表面积激增,导致金属原子表面能增加。传统催化剂在制备和反应过程容易团聚失活,使催化剂活性降低。单原子催化剂由于表面能增加,使团聚可能性降低[9]。单原子催化剂最重要的是找到合适的载体,二维材料如:石墨烯[10]、碳纳米管和水滑石[11]等近年常用做单原子催化剂的载体。它们都有极好的物理化学性质,如比表面积大、热稳定性和机械稳定性好。特别是单空位缺陷石墨烯增强了外来金属原子在缺陷部位的沉积,防止金属原子团聚。Cu、Ru、Ti、Au、Ni、Pt和Ag等掺杂石墨烯对CO2都表现出良好的催化性能[12-14]。这可能归因于掺杂原子与配位原子之间的电负性差异[15]。大量的电荷从掺杂原子转移到金属原子的配位原子以调节金属位点的配位环境来活化反应物。
除了减少负载的金属量,调整载体的结构和组成对改良催化活性也是一种方法[15]。将其他元素原子(例如O、N和S原子)引入配位环境可以提高催化活性[16]。由于氮原子(3.04)比碳原子(2.55)有更高的电负性,N掺杂石墨烯是更适合用于固定金属单原子。N引入石墨烯会改变金属活性中心的配位环境进而可能影响催化剂吸附能力和反应能垒。根据对N掺杂石墨烯的研究,主要有3种N掺杂石墨烯构型,包括吡啶N、吡咯N和石墨N[17]。理论[18]和实验[19, 20]研究证明了空缺吡啶型N掺杂石墨烯更有利于金属单原子的固定。所以,N原子调控Ag掺杂石墨烯的配位环境可能是提高CO2加氢制甲酸的催化性能的可行方法。
在本研究中,利用DFT计算研究了金属单原子(Ag)负载N改性石墨烯(AgNn-Gr)并考察了引入不同的N数目对催化活性的影响,利用各种模型催化CO2加氢制甲酸。考察反应物在催化剂上的吸附态、中间态和过渡态来探究可能存在的反应路线。利用各基元反应的能垒分析出最优路线并探究出N的引入对催化活性的影响。
1 计算 1.1 AgNn-Gr模型六角形石墨烯超胞(3×3×1)包含72个原子作为原始石墨烯载体。其中1个碳原子被Ag原子取代,然后将金属Ag原子的配位原子用不同数目的N原子取代分别记为:Ag-Gr、AgN-Gr、AgN2-Gr和AgN3-Gr。为了避免周期性结构的影响,真空层设置为2 nm。AgNn-Gr的原子结构展示在图 1中。
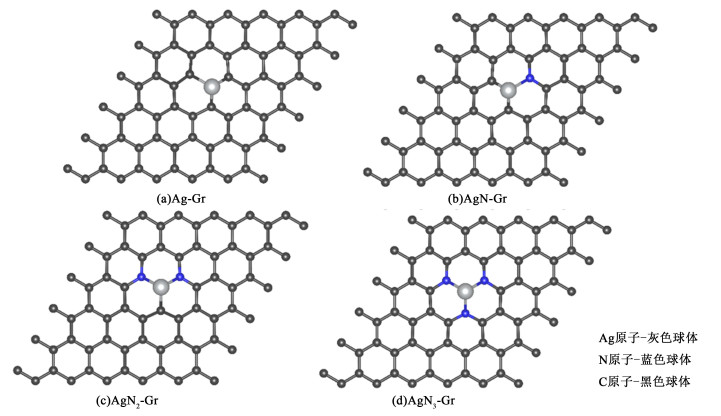
|
| 图 1 AgNn-Gr原子结构的俯视图 Fig.1 A top view of the atomic structure of AgNn-Gr |
| |
以前的研究[21]揭示了在催化加氢反应中H2分子首先被催化剂活化,形成1个Ag-H中间体,另外1个H与载体配位形成C(N)—H。对于AgN-Gr和AgN2-Gr 2种模型,考察了C—H中间体和N—H中间体。CO2加氢制甲酸在AgNn-Gr的可能反应路径如图 2所示[22]。CO2加氢制CO在本研究也被考虑,路线由图 2中灰色所示。
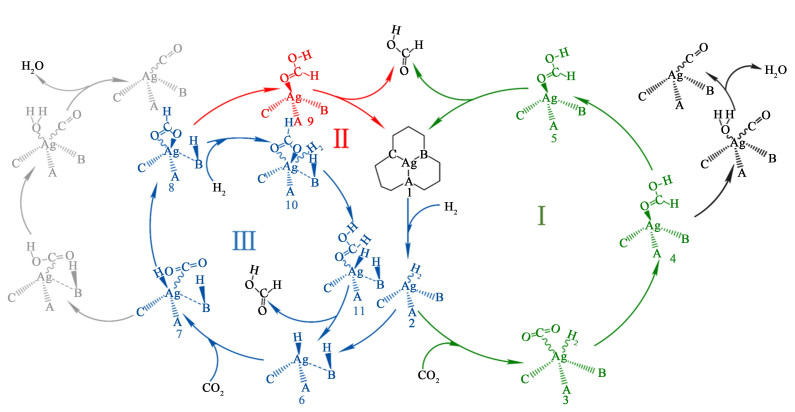
|
| 图 2 CO2在AgNn-Gr催化模型上催化加氢制甲酸的路线图 Fig.2 The possible route of CO2 catalytic hydrogenation to formic acid on AgNn-Gr |
| |
路线Ⅰ:H2和CO2首先共吸附在AgNn-Gr的Ag上面。吸附的H2分子断键,1个H向CO2的O上移动,形成中间体(COOH*),此时COOH*中间体的C原子与Ag位点配位。然后中间体加氢得到吸附态的甲酸,最后甲酸从Ag位点脱附。相关的基本步骤是:1→2→3→4→5→1。
路线Ⅱ和路线Ⅲ:H2的吸附与路线Ⅰ是一致的。吸附的H2断键,1个H与Ag位点形成Ag-H,另1个H与配位原子(C/N)形成C(N)—H键。然后CO2在Ag-H复合物发生吸附,这Ag-H上面的H向CO2上的C移动形成中间体(HCOO*)。随后反应可以通过2条路径得到目的产物:1)这C(N)—H的H向HCOO*中间体移动去形成甲酸。2)另1个分子的H2吸附在Ag位点上并发生解离,1个H向HCOO*中间体的O移动形成甲酸,另1个H向Ag位点移动形成Ag-H,反应开始了循环。这路线Ⅱ的基本步骤是:1→2→6→7→8→9→1。路线Ⅲ的基本步骤是:1→2→6→7→8→10→11→6。
1.3 计算细节在本研究中,所有的计算都是用VASP(Vienna Ab-initio Simulation Package)完成的,计算采用交换相关势,采用广义梯度积分(GGA)和PBE (Perdew-Burke-Ernzerfhof),利用DFT-D3对范德华力进行修正。相关截断能、结构优化的能量和力收敛的标准分别为:400 eV、10-4 eV和1×10-3 eV ·nm-1。过渡态搜索采取CI-NEB的方法,布里渊区积分的Monkhorst-Pack网格参数设置为3×3×1,电荷变化采用bader电荷分析得到,3D可视模型利用VESTA-3.0软件得到。
Ag原子在AgNn-Gr的结合能(ΔEb)定义为:
| $ \Delta E_{\mathrm{b}}=E\left(\mathrm{AgN}_n-\mathrm{Gr}\right)-E\left(\mathrm{~N}_n-\mathrm{Gr}\right)-E(\mathrm{Ag}) $ | (1) |
式(1)中:E(CuNn-Gr)是AgNn-Gr的总能量,E(Nn-Gr)和E(Ag)分别代表掺氮石墨烯和Ag原子的能量。
吸附物在催化剂上的吸附能(ΔEads)定义为:
| $ \Delta E_{\mathrm{ads}}(A)=E(\mathrm{A}-\mathrm{S})-E(\mathrm{S})-E(\mathrm{A}) $ | (2) |
式(2)中:E(A-S)、E(S)和E(A)分别代表吸附物吸附在催化剂上的总能量、催化剂的总能量和吸附物的能量。
2 结果和讨论 2.1 AgNn-Gr模型将上述4种模型经过结构优化,发现Ag原子都固定在掺氮石墨烯形成的缺陷位上并形成Ag—C(N) 键。Ag原子由于有更大的原子半径位于缺陷位的上方,同时与其配位的C(N)原子也稍微向上偏移。优化后,关键键长、结合能和Ag的电荷变化(qAg)总结在表 1。可以看出金属单原子良好地固定在掺氮石墨烯上。
| Key data | Ag-Gr | AgN-Gr | AgN2-Gr | AgN3-Gr |
| Bond distance/nm | Cm-Ag | C1/2-Ag | N1-Ag | C1-Ag |
| 0.212 | 0.220 | 0.238 | 0.213 | |
| HAg-base/nm | 0.204 | 0.205 | 0.205 | 0.206 |
| Eb(Ag-base)/eV | 0.268 | 0.251 | 0.244 | 0.232 |
| qAg | -0.32 | -0.38 | -0.44 | -0.53 |
| 注:HAg-base表示1个距离(Ag-base)。 | ||||
H2、CO2和甲酸在AgNn-Gr的吸附结构如图 3所示。H2在AgNn-Gr中以平行石墨烯表面的形式在Ag位点发生吸附,随着N原子的增多,H—H键长伸长。CO2以O=C=O⋯AgNn-Gr方向吸附。H2与CO2共吸附时H2的吸附特征与H2单独吸附的特征一样,CO2远离Ag位点,表明在AgNn-Gr上CO2加氢,优先发生H2的吸附。相关的吸附能总结在表 2中,从表 2中可以看出,N的引入增加了催化剂对反应物的吸附,同时H2的键长随着N的增多而增长。
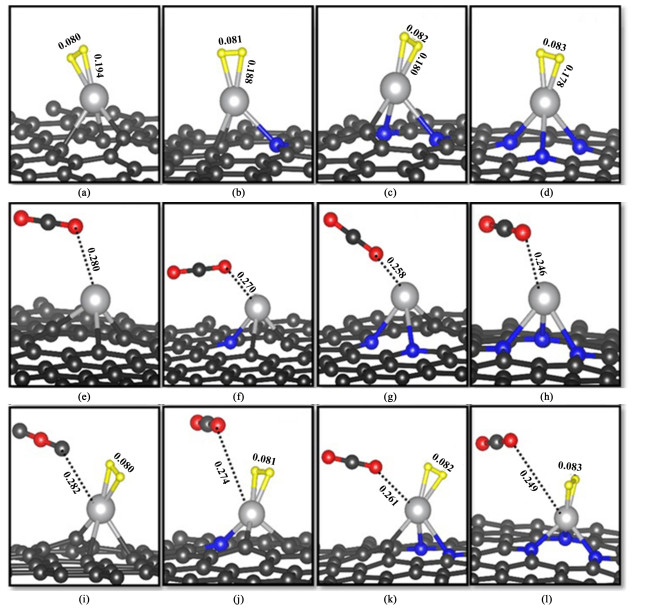
|
| (a)-(d) means H2, is absorbed on AgNn, -Gr, (e)-(h) means CO2, is absorbed on AgNn, -Gir, (i)-(l) means H2/CO2 is absorbed on AgNn, -Gr absorb. Ag, 0, C and H atoms are represented by gray, red, black and yellow spheres, respectively. The relative interatomic distance is given in nm 图 3 气体分子在AgNn-Gr上的吸附优化结构 Fig.3 The optimized structure of the adsorption of gas molecules on AgNn-Gr |
| |
| surface | adsorbate | Eads/eV | bond distance/nm |
| H2 | -0.25 | 0.194 | |
| Ag-Gr | CO2 | -0.08 | 0.280 |
| H2+CO2 | -0.32 | 0.282 | |
| H2 | -0.36 | 0.188 | |
| AgN-Gr | CO2 | -0.17 | 0.270 |
| H2+CO2 | -0.48 | 0.274 | |
| H2 | -0.48 | 0.180 | |
| AgN2-Gr | CO2 | -0.25 | 0.258 |
| H2+CO2 | -0.65 | 0.261 | |
| H2 | -0.69 | 0.174 | |
| CO2 | -0.41 | 0.246 | |
| AgN3-Gr | H2+CO2 | -0.79 | 0.249 |
在AnNn-Gr上的不同路线在第1节已经被研究。本节讨论不同催化剂上不同路径的能垒图,在本节中将Ag-Gr、AgN-Gr、AgN2-Gr和AgN3-Gr用A、B、C和D代表。CO2在AgNn-Gr催化CO2加氢制甲酸的能垒图如图 4所示。

|
| 图 4 CO2在AgNn-Gr模型催化加氢制甲酸的反应能垒图 Fig.4 The potential energy profile for CO2 hydrogenation to FA over AgNn-Gr |
| |
4种催化模型上CO2加氢制甲酸的反应特征一致。如图 4所示,在Ag-Gr和AgN-Gr催化模型上,CO2都通过路线Ⅰ得到甲酸,其中决速步骤是3→4。在AgN2-Gr和AgN3-Gr催化模型上,CO2都更倾向于通过路线Ⅲ得到甲酸,其中的决速步骤是2→6,但是接下来的路线Ⅲ的催化循环的决速步骤是10→11。
H2和CO2在AgNn-Gr上的吸附能都小于0(1→2,6→7和8→10)。这证明单原子铜负载在石墨烯对H2和CO2表现出良好的吸附能力。N的引入提高了对反应物的吸附能力,提高了吸附的H2在催化中心直接解离的能垒(3→4),但是降低了吸附的H2在催化活性中心的活化解离(2→6)。AgNn-Gr通过不同路径在第一次反应和催化循环的决速步骤的能垒总结在表 3中。
| Route | step | Ag-Gr | AgN-Gr | AgN2-Gr | AgN3-Gr |
| Ⅰ (First reaction) | Rate-determine, 3→4 | 1.00 | 1.12 | 1.30 | 1.49 |
| Ⅱ (First reaction) | Rate-determine, 8→9 | 1.78 | 1.68 | 1.60 | 1.52 |
| Ⅲ (First reaction) | Rate-determine, 2→6 | 1.45 | 1.21 | 1.08 | 0.92 |
| Reaction cycle | Rate-determine, / | 1.00 | 1.12 | 0.92 | 0.82 |
再结合图 4可知:在第1次反应中,Ag-Gr和AgN-Gr更倾向于通过路径Ⅰ来生成甲酸,而AgN2-Gr和AgN3-Gr更倾向于通过路径Ⅲ生成甲酸。根据决速步骤的能垒高低体现的催化剂活性排序是:AgN3-Gr>Ag-Gr>AgN2-Gr>AgN-Gr。在第1次反应完成后,Ag-Gr和AgN-Gr催化循环反应路线不变,而AgN2-Gr和AgN3-Gr则是沿着6→7→8→10→11→6循环反应。按照决速步骤的反应能垒体现的催化剂催化活性排序是:AgN3-Gr>AgN2-Gr>Ag-Gr>AgN-Gr。可以看出通过N的引入改变活性中心的配位环境有降低催化剂反应能垒的作用,提高催化剂的活性的作用。
CO2加氢产物除了HCOOH,还有CO、CH2O和CH4等产物。其中,CO为CH2O和CH4的中间物种,本研究考察了CO2加氢生成CO的2条可能路线,如图 2灰色部分所示。路线Ⅰ:H2(g)+CO2(g)→H2*+CO2(g)→H2*+CO2*→HCOOH*+H*→CO*+H2O*→CO*+H2O(g),路线Ⅱ:H2(g)+CO2(g)→H2*+CO2(g)→2H*+CO2(g)→2H*+CO2*→COOH*+H*→CO*+H2O*→CO*+H2O(g)。相关的CO路径能垒图如图 5,能垒对比如表 4,可以看出在AgNn-Gr上CO2加氢制CO能垒较高,该模型上CO2加氢有利于HCOOH生成。

|
| 图 5 CO2在AgNn-Gr模型催化加氢制CO的反应能垒图 Fig.5 The potential energy profile for CO2 hydrogenation to CO over AgNn-Gr |
| |
| Reaction | Ag-Gr | AgN-Gr | AgN2-Gr | AgN3-Gr |
| COOH+H→HCOOH | 0.17 | 0.20 | 0.28 | 0.34 |
| COOH+H→CO+H2O | 0.68 | 0.58 | 0.51 | 0.43 |
| CO2+H→HCOO | 0.56 | 0.64 | 0.70 | 0.87 |
| CO2+H→COOH | 0.62 | 0.73 | 0.63 | 0.58 |
| HCOO+H→HCOOH | 1.78 | 1.68 | 1.60 | 1.52 |
| COOH+H→CO+H2O | 1.82 | 1.76 | 1.62 | 1.58 |
对比其他研究[23],CO2加氢制甲酸在没有催化剂存在的情况下,活化能是3.29 eV,远远高于在AgNn-Gr催化形成甲酸所需要的活化能。对于银基单原子催化剂,改变活性中心的配位环境可以提高催化剂的催化活性。这可以为新型2D催化剂催化CO2加氢制甲酸提供理论基础。
3 结论通过DFT计算探究CO2加氢制甲酸在AgNn-Gr中可能的路线。N引入石墨烯调控活性中心的配位环境有效地提高了催化剂对反应物的吸附能力,但同时也改变了H2在催化剂解离所需的活化能,使得CO2加氢制甲酸由路线Ⅰ(Ag-Gr和AgN-Gr)变成路线Ⅲ(AgN2-Gr和AgN3-Gr),降低了活化能,提高了催化活性。通过调控活性中心的配位环境可以实现单原子催化剂的催化活性,为新型2D催化材料催化CO2加氢制甲酸提供了理论基础。
| [1] |
GRIMM N B, FAETH S H, GOLUBIEWSKI N E, et al. Global change and the ecology of cities[J]. Science, 2008, 319(5864): 756-760. DOI:10.1126/science.1150195 |
| [2] |
ÁLVAREZ A, BANSODE A, URAKAWA A, et al. Challenges in the greener production of formates/formic acid, methanol, and DME by heterogeneously catalyzed CO2 hydrogenation processes[J]. Chemical Reviews, 2017, 117(14): 9804-9838. DOI:10.1021/acs.chemrev.6b00816 |
| [3] |
ZHANG T, XUE Q, SHAN M, et al. Adsorption and catalytic activation of O2 molecule on the surface of Au-doped graphene under an external electric field[J]. The Journal of Physical Chemistry C, 2012, 116(37): 19918-19924. DOI:10.1021/jp3073359 |
| [4] |
SWAPNESH A, SRIVASTAVA V C, MALL I D. Comparative study on thermodynamic analysis of CO2 utilization reactions[J]. Chemical Engineering & Technology, 2014, 37(10): 1765-1777. |
| [5] |
BELLER M, BORNSCHEUER U T. CO2 fixation through hydrogenation by chemical or enzymatic methods[J]. Angewandte Chemie International Edition, 2014, 53(18): 4527-4528. DOI:10.1002/anie.201402963 |
| [6] |
段新平, 林清瑞, 周俊夫, et al. 草酸酯加氢制乙醇酸甲酯高效银基催化剂的研究[C]. 第十五届全国催化学术会议, 2010
|
| [7] |
ZHOU J, DUAN X, YE L, et al. Enhanced chemoselective hydrogenation of dimethyl oxalate to methyl glycolate over bimetallic Ag-Ni/SBA-15 catalysts[J]. Applied Catalysis A: General, 2015, 505: 344-353. DOI:10.1016/j.apcata.2015.08.022 |
| [8] |
郭向前, 钱俊峰. 草酸二甲酯催化加氢制备乙醇酸甲酯工艺研究[J]. 广州化工, 2015, 43(18): 91-93. GUO Xiangqian, QIAN Junfeng. Study on the process for catalytic hydrogenation of dimethyl oxalate to methyl glycollate[J]. Guangzhou Chemical Industry, 2015, 43(18): 91-93. (in Chinese) |
| [9] |
YANG X, WANG A, QIAO B, et al. Single-atom catalysts: A new frontier in heterogeneous catalysis[J]. Accounts of Chemical Research, 2013, 46(8): 1740-1748. DOI:10.1021/ar300361m |
| [10] |
ESRAFILI M D, MOHAMMADIAN-SABET F, NEMATOLLAHI P. Oxidation of CO by N2O over Al- and Ti-doped graphene: A comparative study[J]. RSC Advances, 2016, 6(69): 64832-64840. DOI:10.1039/C6RA04326G |
| [11] |
XU M, WEI M. Layered double hydroxide-based catalysts: Recent advances in preparation, structure, and applications[J]. Advanced Functional Materials, 2018. DOI:10.1002/adfm.201802943 |
| [12] |
BULUSHEV D A, CHUVILIN A L, SOBOLEV V I, et al. Single Au atoms on the surface of N-free and N-doped carbon: Interaction with formic acid and methanol molecules[J]. Topics in Catalysis, 2019, 62(5/6): 508-517. |
| [13] |
SREDOJEVIĆ D N, ŠLJIVANČANIN Ž, BROTHERS E N, et al. Formic acid synthesis by CO2 hydrogenation over single-atom catalysts based on Ru and Cu embedded in graphene[J]. Chemistry Select, 2018, 3(9): 2631-2637. |
| [14] |
ESRAFILI M D, DINPARAST L. A DFT study on the catalytic hydrogenation of CO2 to formic acid over Ti-doped graphene nanoflake[J]. Chemical Physics Letters, 2017, 682: 49-54. DOI:10.1016/j.cplett.2017.06.011 |
| [15] |
LI X, RONG H, ZHANG J, et al. Modulating the local coordination environment of single-atom catalysts for enhanced catalytic performance[J]. Nano Research, 2020, 13(7): 1842-1855. DOI:10.1007/s12274-020-2755-3 |
| [16] |
YANG S, ZHI L, TANG K, et al. Efficient synthesis of heteroatom (N or S)-doped graphene based on ultrathin graphene oxide-porous silica sheets for oxygen reduction reactions[J]. Advanced Functional Materials, 2012, 22(17): 3634-3640. DOI:10.1002/adfm.201200186 |
| [17] |
HAN Y, WANG Y, CHEN W, et al. Hollow N-doped carbon spheres with isolated cobalt single atomic sites: Superior electrocatalysts for oxygen reduction[J]. Journal of the American Chemical Society, 2017, 139(48): 17269-17272. DOI:10.1021/jacs.7b10194 |
| [18] |
SUN X, LI K, YIN C, et al. CoN3 embedded graphene, a potential catalyst for the oxygen reduction reaction from a theoretical perspective[J]. Physical Chemistry Chemical Physics: PCCP, 2017, 19(27): 17670-17676. DOI:10.1039/C7CP02622F |
| [19] |
JIANG K, SIAHROSTAMI S, ZHENG T T, et al. Isolated Ni single atoms in graphene nanosheets for high-performance CO2 reduction[J]. Energy & Environmental Science, 2018, 11(4): 893-903. |
| [20] |
LI F, HAN G, NOH H J, et al. Boosting oxygen reduction catalysis with abundant copper single atom active sites[J]. Energy & Environmental Science, 2018, 11(8): 2263-2269. |
| [21] |
GRABOW L C, MAVRIKAKIS M. Mechanism of methanol synthesis on Cu through CO2 and CO hydrogenation[J]. ACS Catalysis, 2011, 1(4): 365-384. DOI:10.1021/cs200055d |
| [22] |
SIRIJARAENSRE J, LIMTRAKUL J. Hydrogenation of CO2 to formic acid over a Cu-embedded graphene: A DFT study[J]. Applied Surface Science, 2016, 364: 241-248. |
| [23] |
GUO X, FANG G, LI G, et al. Direct, nonoxidative conversion of methane to ethylene, aromatics, and hydrogen[J]. Science, 2014, 344(6184): 616-619. DOI:10.1126/science.1253150 |
 2023, Vol. 40
2023, Vol. 40





