2. 华北制药河北华民药业有限责任公司, 石家庄 052160
2. NCPC Hebei Huamin Pharmaceutical Co., Ltd., Shijiazhuang 052165, China
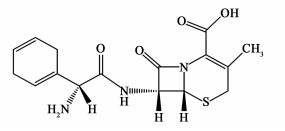
头孢拉定(Cephradine, Velosef) (CAS Registry No. 38821-53-3),属于第一代半合成头孢菌素,主要用于治疗呼吸道及皮肤等感染疾病[1-3],其化学结构式如图 1所示。工业生产中头孢拉定结晶一般采用反应结晶,操作方式基本为间歇操作。间歇结晶工艺研究[4-7]日渐成熟,但是这种生产方式不仅生产效率低而且产品各批次之间差别较大。连续结晶过程可以有效地解决以上问题,其操作稳定,便于获得质量均一的产品。连续结晶技术作为一种重要的过程强化方法,将其应用于头孢拉定的生产过程对于减少能耗、提高生产效率和产品质量以及增加企业效益非常必要。
|
| 图 1 头孢拉定结构式 Fig.1 Chemical structure of cefradine |
| |
药物连续结晶技术[8, 9]近年来得到快速发展。Schaber等[10]通过研究相同生产规模下,连续结晶工艺和间歇结晶工艺的成本,发现虽然连续结晶工艺单次产量比间歇结晶工艺低,但是从企业长期运作出发,连续结晶工艺更加节省生产成本。除此之外,选择合适的连续结晶器也是成功实现药物连续结晶的重要因素。应用较广泛的连续结晶器[11],可以分为混合悬浮混合产品出料结晶器(Mixed suspension mixed product removal, MSMPR)和连续管式结晶器(The tubolar crystallizer)[12]。其中,MSMPR结晶器更容易实现间歇操作到连续操作的转换。Alvarez等[13]已经成功实现环孢素在多级连续MSMPR结晶器中结晶,而且连续结晶器级数的不同会造成产品质量和产量的差异。张军立等[14]实现了头孢氨苄连续结晶工艺单条生产线规模500 t·a-1产业化应用。
对于头孢拉定连续结晶工艺相关研究文献目前尚未报导。蒋翠媛等[15]提出了头孢拉定双股进料的结晶工艺,这种工艺仍属于半连续过程,没有对连续过程进行深入的研究。本论文通过构建头孢拉定三级MSMPR结晶器的连续结晶实验,研究了不同操作条件[16]对连续结晶产品的产率及粒度分布的影响,并进一步对比分析,得到相对优化的操作条件。研究结果为头孢拉定的连续化工业化生产提供基础数据,同时对连续结晶器的设计和放大有一定的指导意义。
1 实验部分 1.1 实验试剂及仪器试剂及来源:头孢拉定原料由华北制药河北华民药业有限公司提供;去离子水由实验室自制;氨水由石家庄市化学试剂有限责任公司购入,质量分数为25%~28%;盐酸由石家庄市化学试剂有限责任公司购入,质量分数为37%;丙酮由西陇科学股份有限公司购入,分析纯;亚硫酸氢钠由天津永大化学试剂有限公司购入,分析纯。
仪器及来源:ME204E分析天平购自梅特勒-托利多仪器有限公司;DALTA320 pH计购自梅特勒-托利多仪器有限公司;78-1磁力加热搅拌器购自常州荣华仪器制造有限公司;BT01-100蠕动泵购自保定兰格恒流泵有限公司;YYDC-0506低温恒温槽购自上海叶拓科技有限公司;JJ-1机械搅拌购自常州荣华仪器制造有限公司;Mastersizer 3000激光粒度分析仪购自马尔文仪器有限公司;OLYMPUS-BX53光学显微镜购自奥林巴斯公司;SHZ-D(Ⅲ) 循环水式多用真空泵购自郑州博科仪器设备有限公司。
1.2 实验过程及实验装置 1.2.1 实验装置头孢拉定连续结晶实验装置图如图 2所示。上级结晶器上端出口与下级结晶器下端出口使用硅胶管连接。随着原料液不断加入,第1级结晶器液面达到上端出口处后经过连接的硅胶管进入第2级结晶器,最终连续结晶产品从第3级结晶器上端出口流出。实验中使用pH计监测各级结晶器中pH值。

|
| 图 2 头孢拉定连续结晶实验装置图 Fig.2 Equipment setup for continuous crystallization experiment of cefradine |
| |
称量去离子水、头孢拉定原料及抗氧化剂亚硫酸氢钠,滴加盐酸,配制一定pH值下的头孢拉定饱和溶液。向第一级结晶器中加入头孢拉定饱和溶液,并加入氨水至一定pH值后加入晶种,养晶,作为底液。启动结晶器搅拌及恒温槽并通入氮气,开启蠕动泵将头孢拉定饱和溶液均匀地滴入第1级结晶器中,当第1级结晶器中悬浮液液位到达右侧溢流口高度后会向第2级结晶器溢流,直至充满第2级结晶器和第3级结晶器,同时用氨水调节第2级结晶器和第3级结晶器内悬浮液pH值至等电点。当第3级结晶器出口有产品流出时,即为连续结晶操作开始。每隔1个停留时间接取出料悬浮液,进行抽滤、丙酮洗涤、真空干燥,获得头孢拉定续结晶产品。
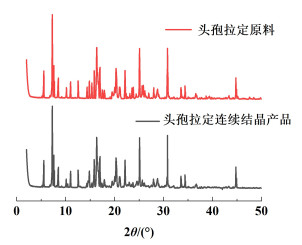
2 结果与讨论 2.1 头孢拉定连续结晶产品表征头孢拉定原料及连续结晶实验产品的PXRD图谱如图 3所示。
|
| 图 3 头孢拉定原料及连续结晶产品PXRD图 Fig.3 PXRD patterns of cefradine raw materials and continuous crystalline products |
| |
根据图 3,头孢拉定原料及连续结晶实验产品在图谱上衍射峰基本一致,说明实验得到的连续结晶产品是头孢拉定。
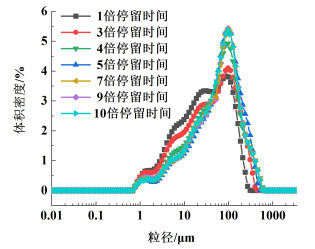
2.2 头孢拉定连续结晶实验稳定状态的探究对于连续结晶过程,通常在6倍停留时间以后可以达到连续结晶的稳定状态[17]。在头孢拉定连续结晶实验过程中,对不同停留时间下的产品取样,干燥后使用Mastersizer 3000激光粒度分析仪测定其粒度分布。Mastersizer 3000测量产品粒度分布时,选择乙醇作为分散剂,测量前设备提前润洗,在遮光度为8%~15%,转速为1 500 r·min-1时,进行测量。以停留时间为34 min的头孢拉定连续结晶实验为例,不同停留时间粒度分布图如图 4所示。
|
| 图 4 不同停留时间下头孢拉定连续结晶产品粒度分布图 Fig.4 Particle size distribution of cefradine continuous crystallization products under different residence times |
| |
从图 4中可以看出,在1倍停留时间时,头孢拉定产品颗粒不均匀,粒度分布图呈现双峰。这是由于连续结晶实验初期,各级结晶器pH值没有达到稳定状态。第1级结晶器中率先析出的晶体经过较长的生长时间流出,三级结晶器中析出的晶体生长时间较短。随着结晶过程的进行,不同级数连续结晶器内pH值逐渐趋于稳定。在第3倍停留时间时,连续结晶产品粒度分布图趋于单峰。此时,在二级结晶器中晶体大多析出后进入三级结晶器中,小颗粒晶体在三级结晶器中得到生长,使得连续结晶产品颗粒变大;同时在这一连续结晶器中析出的晶体变少,小颗粒晶体数目变少。因此此时样品粒度分布图中大颗粒晶体数量较大,呈现单峰。在4倍停留时间时,粒度分布图中可看出产品体积密度升高。在5倍停留时间时,连续结晶系统趋于稳定,产品粒度主要以大颗粒为主,此时晶体主要在第2级结晶器中成核,在三级结晶器中得到充分生长。在7倍停留时间与9倍停留时间时,连续结晶产品的粒度分布图差别变小。在10倍停留时间与9倍停留时间产品粒度分布图无明显差别,说明此时头孢拉定连续结晶实验达到稳定状态。因此10倍停留时间后取样,获得连续结晶产品。
2.3 养晶pH值的探究对第1级结晶器内养晶pH值进行探究,保持其他条件(温度293.15 K,原料液初始浓度7%、转速180 r·min-1、亚硫酸氢钠添加量2%、晶种添加量3%、养晶时间30 min)相同,研究不同养晶pH=2.65、2.75、2.85、2.95及3.05下头孢拉定析出的粒度分布的变化。图 5为不同养晶pH值下析出的头孢拉定晶体粒度分布图。

|
| 图 5 不同养晶pH值下析出的头孢拉定晶体粒度分布图 Fig.5 Crystal size distribution of cefradine precipitated at different crystallization point pH |
| |
实验结果表明,养晶pH值偏高时,随着氨水的不断加入,结晶体系pH值变化较大,容易产生局部过饱和度过高、爆发成核的现象。养晶pH值偏低时,溶液过饱和度较低,析出的头孢拉定晶体粒度分布较宽。综上所述选择养晶pH=2.85。
2.4 操作参数对头孢拉定连续结晶产品粒度分布及收率的影响采用单因素实验,调节各级结晶器以下操作参数相同,对头孢拉定连续结晶实验进行优化。其中,收率为产品与投料量的质量之比;停留时间为结晶器体积与原料流速之比。
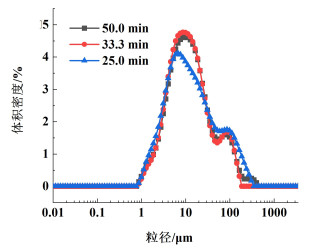
2.4.1 停留时间的影响保持其他条件(原料液初始浓度7%、养晶pH=2.85、结晶温度293.15 K、转速180 r·min-1、亚硫酸氢钠添加量2%、晶种添加量3%)相同,研究不同停留时间50.0、33.3及25.0 min对连续结晶产品的收率和粒度分布的影响。表 1为不同停留时间下头孢拉定连续结晶产品收率,图 6为不同停留时间下头孢拉定连续结晶产品粒度分布图。
| 停留时间/min | 收率/% |
| 50.0 | 49.05 |
| 33.3 | 48.84 |
| 25.0 | 47.11 |
|
| 图 6 不同停留时间下头孢拉定连续结晶产品粒度分布图 Fig.6 Particle size distribution of cefradine continuous crystallization products under different residence time |
| |
根据表 1,头孢拉定连续结晶产品的收率随停留时间的增加而增大,停留时间在50.0和33.3 min时头孢拉定连续结晶产品的收率差距不大,停留时间为25.0 min时收率降低。晶体析出需要一定时间,停留时间较短时,结晶不充分,剩余过饱和度较高,收率降低。根据图 6,当停留时间较长时,产品粒度分布更加不均匀,粒度分布图中有更加突出的双峰,这可能是由于较早成核的晶体在系统中停留时间较长,较大晶体颗粒占比增加。综上所述,停留时间选择33.3 min比较合适。
2.4.2 结晶温度的影响保持其他条件(停留时间33.3 min、原料液初始浓度7%、亚硫酸氢钠添加量2%、养晶pH=2.85、转速180 r·min-1、晶种添加量3%)相同,研究不同结晶温度288.15、293.15、298.15、303.15及308.15 K对头孢拉定连续结晶产品的收率和粒度分布的影响。表 2为不同结晶温度下头孢拉定连续结晶产品收率,图 7为不同结晶温度下头孢拉定连续结晶产品粒度分布图。
| 结晶温度/K | 收率/% |
| 288.15 | 56.68 |
| 293.15 | 56.62 |
| 298.15 | 56.44 |
| 303.15 | 56.05 |
| 308.15 | 55.55 |

|
| 图 7 不同结晶温度下头孢拉定连续结晶产品粒度分布图 Fig.7 Particle size distribution of cefradine continuous crystallization products at different crystallization temperature |
| |
根据表 2,温度改变时,头孢拉定连续结晶产品的收率没有太大影响。温度对头孢拉定的溶解度影响不大,所以温度的变化对产品收率无明显影响。随着结晶温度的升高,产品主粒度先减小后升高,可能是因为溶液介稳区宽度较窄,更容易成核,造成结晶产品粒度减小;温度较高时,晶体的生长速率加快,产品粒度变大。根据图 7,温度在一定范围内变大时,产品粒度分布更加不均匀。综上所述,结晶温度选择293.15 K比较合适。
2.4.3 晶种添加量的影响保持其他条件(停留时间33.3 min、原料液初始浓度7%、亚硫酸氢钠添加量2%、养晶pH=2.85、转速180 r·min-1、结晶温度293.15 K)相同,研究向一级结晶器中不添加晶种以及一次性添加晶种,晶种添加量分别为结晶底液中溶质质量的1%、3%和5%时,对头孢拉定连续结晶产品的收率和粒度分布的影响。表 3为不同晶种添加量下头孢拉定连续结晶产品收率,图 8为不同晶种添加量下头孢拉定连续结晶产品粒度分布图。
| 晶种添加量/% | 收率/% |
| 0 | 48.72 |
| 1 | 55.85 |
| 3 | 62.66 |
| 5 | 62.74 |

|
| 图 8 不同结晶添加量下头孢拉定连续结晶产品粒度分布图 Fig.8 Particle size distribution of continuous crystallization products of cefradine under different crystal addition amounts |
| |
根据表 3,在一定范围内,晶种添加量越多收率越高。对此可以做出以下解释:加入晶种,诱导晶体成核且进一步生长,从而提高收率。当晶种添加量为3%和5%时,收率相差较小。根据图 8,在一定范围内,晶种添加量越多,粒径大的晶体占比较大。在不添加晶种时,各级结晶器内晶体自发成核,小颗粒晶体数量大产品粒度分布出现双峰且2峰面积差距大。当添加晶种量逐渐增加时,晶种附于晶核上生长,此时粒径增加,产品粒度分布比较均匀。综上所述,晶种添加量选择3%比较合适。
2.4.4 原料液初始浓度的影响保持其他条件(停留时间33.3 min、搅拌速率180 r·min-1、亚硫酸氢钠添加量2%、养晶pH=2.85、晶种添加量为3%、结晶温度293.15 K)相同,研究原料液初始浓度5%、7%、9%及11%时对头孢拉定连续结晶产品的收率和粒度分布的影响。表 4为不同原料液初始浓度下头孢拉定连续结晶产品收率,图 9为不同原料液初始浓度下头孢拉定连续结晶产品粒度分布图。
| 原料液浓度/% | 收率/% |
| 5 | 43.41 |
| 7 | 57.56 |
| 9 | 68.35 |
| 11 | 76.53 |

|
| 图 9 不同原料液初始浓度下头孢拉定连续结晶产品粒度分布图 Fig.9 Particle size distribution of cefradine continuous crystallization products at different initial concentrations of feedstock solution |
| |
根据表 4,产品收率随结晶液初始浓度的加大而升高。根据图 9,当原料液浓度过低时,产品粒度分布不均匀。原料液浓度低时,溶液流动性好,搅拌造成小颗粒晶体数目大,小部分晶体生长,粒度分布图呈现双峰。综上所述,原料液初始浓度选择11%比较合适。
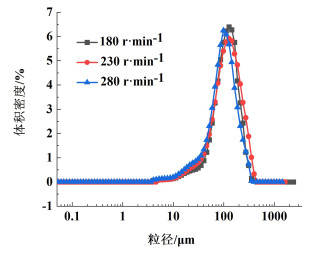
2.4.5 搅拌速率的影响保持其他条件(停留时间33.3 min、原料液初始浓度7%、亚硫酸氢钠添加量2%、养晶pH=2.85、晶种添加量为3%、结晶温度293.15 K)相同,研究不同转速180、230及280 r·min-1对头孢拉定连续结晶产品的收率和粒度分布的影响。表 5为不同搅拌速率下头孢拉定连续结晶产品收率,图 10为不同搅拌速率下头孢拉定连续结晶产品粒度分布图。
| 搅拌转速/(r·min-1) | 收率/% |
| 180 | 76.62 |
| 230 | 76.58 |
| 280 | 76.44 |
|
| 图 10 不同搅拌速率下头孢拉定连续结晶产品粒度分布图 Fig.10 Particle size distribution of continuous crystallization products of cefradine at different stirring rates |
| |
根据表 5,搅拌速率对收率基本没有影响。根据图 10,当转速为180 r·min-1时,峰最高最窄,产品粒度最均匀。当转速过快时,结晶器中的溶液受到的剪切力比较大,产品容易被打碎,形成细小的晶体,不易长大,所以粒度不均匀。综上所述,选择搅拌速率180 r·min-1比较合适。
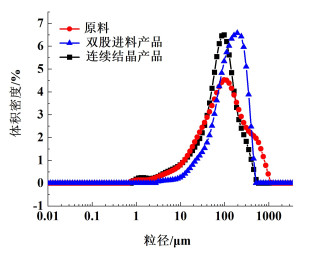
3 头孢拉定连续结晶工艺综合以上实验结果确定头孢拉定连续结晶优化工艺:结晶温度293.15 K,搅拌速率180 r·min-1,养晶pH=2.85,晶种添加量为3%,原料液初始浓度11%,停留时间为33.3 min,可以获得平均粒径为85.3 μm,收率为76.53%的头孢拉定连续结晶产品。蒋翠媛[15]优化后头孢拉定双股进料工艺收率最高达92.03%。连续结晶产品收率与之相比仍有差距。图 11为头孢拉定双股进料产品、连续结晶产品与原料的粒度分布图。从图 11中看出头孢拉定连续结晶产品粒度分布更窄,粒径较小。图 12为头孢拉定连续结晶产品与原料的显微镜图。从图 12中表明,连续结晶产品比原料晶体晶习更加完整。
|
| 图 11 头孢拉定双股进料产品、连续结晶产品及原料粒度分布图 Fig.11 The size distribution diagram of cefradine dual feed crystallization products、continuous crystallization products and raw materials |
| |

|
| 图 12 头孢拉定的显微镜图 Fig.12 Optical micrographs of cefradine |
| |
本研究成功构建用于头孢拉定连续结晶生产的实验装置。该连续结晶实验达到稳定状态需要10倍停留时间。采用单因素实验考察了头孢拉定连续结晶过程的影响因素,包括养晶pH值、停留时间、结晶温度、晶种添加量、原料液初始浓度及搅拌速率。其中,停留时间缩短,产品收率降低;晶种添加量增加时,粒度分布更均匀;原料液初始浓度对产品收率影响较大;合适的搅拌速率会使产品的粒度分布更加均匀。通过实验优化得到了晶习完整,粒度分布均匀的头孢拉定连续结晶产品。
| [1] |
郭永泰. 浅析头孢拉定的药理作用[J]. 海峡药学, 2004, 16(4): 120-121. GUO Yongtai. Analysis of pharmacological action of cefradine[J]. Strait Pharmaceutical Journal, 2004, 16(4): 120-121. (in Chinese) |
| [2] |
石焱, 弓小雪, 张洋, 等. 头孢拉定胶囊人体药代动力学和生物等效性[J]. 临床军医杂志, 2009, 37(6): 1097-1099. SHI Yan, GONG Xiaoxue, ZHANG Yang, et al. Pharmacokinetics and bioequivalence of cephradine capsule[J]. Clinical Journal of Medical Officers, 2009, 37(6): 1097-1099. (in Chinese) |
| [3] |
潘芳芳, 朱培曦, 黄巧巧, 等. 液相色谱-四极杆飞行时间质谱法分析头孢拉定中的主要杂质[J]. 药物分析杂志, 2013, 33(1): 133-137, 145. PAN Fangfang, ZHU Peixi, HUANG Qiaoqiao, et al. HPLC-Q-TOF-MS identification of major impurities in cefradine[J]. Chinese Journal of Pharmaceutical Analysis, 2013, 33(1): 133-137, 145. (in Chinese) |
| [4] |
刘宁宁. 头孢拉定的结晶工艺过程及影响结晶的因素探析[J]. 生物技术世界, 2015, 12(5): 100-100. LIU Ningning. Analysis on the crystallization process of cefradine and the factors affecting crystallization[J]. Biotech World, 2015, 12(5): 100-100. (in Chinese) |
| [5] |
褚睿智, 孟献梁, 张宝. 头孢拉定结晶工艺[J]. 化工进展, 2006, 25(10): 1211-1213. CHU Ruizhi, MENG Xianliang, ZHANG Bao. Crystallization process of cephradine[J]. Chemical Industry and Engineering Progress, 2006, 25(10): 1211-1213. DOI:10.3321/j.issn:1000-6613.2006.10.020 (in Chinese) |
| [6] |
田红玉, 聂飞, 周凝. 头孢拉定结晶工艺研究[J]. 煤炭与化工, 2019, 42(4): 141-143. TIAN Hongyu, NIE Fei, ZHOU Ning. Study on crystallization of cefradine[J]. Coal and Chemical Industry, 2019, 42(4): 141-143. (in Chinese) |
| [7] |
赵茜, 杜磊, 高大维. 加晶种提高头孢拉定反应结晶产品质量的研究[J]. 中国抗生素杂志, 2000, 25(4): 263-265. ZHAO Qian, DU Lei, GAO Dawei. Study on quality improvement of cephradine reactive crystallization product by ultrasonic seeding process[J]. Chinese Journal of Antibiotics, 2000, 25(4): 263-265. (in Chinese) |
| [8] |
倪行辉. 连续工艺在阿莫西林结晶中的应用[J]. 海峡药学, 2020, 32(4): 21-23. NI Xinghui. Application of continuous process in crystallization of amoxicillin[J]. Strait Pharmaceutical Journal, 2020, 32(4): 21-23. (in Chinese) |
| [9] |
谢非, 黄云海, 吴德慧, 等. 连续结晶器中十水草酸铈反应结晶动力学研究[J]. 化学工业与工程, 2022, 39(3): 42-48. XIE Fei, HUANG Yunhai, WU Dehui, et al. Kinetics of reaction crystallization of cerium oxalate decahydrate in continuous crystallizer[J]. Chemical Industry and Engineering, 2022, 39(3): 42-48. (in Chinese) |
| [10] |
SCHABER S D, GEROGIORGIS D I, RAMACHANDRAN R, et al. Economic analysis of integrated continuous and batch pharmaceutical manufacturing: A case study[J]. Industrial & Engineering Chemistry Research, 2011, 50(17): 10083-10092. |
| [11] |
刘宝树. 工业结晶原理与设备[C]//2018年镁化合物行业年会暨行业发展论坛论文集. 巩义, 2018: 158-164
|
| [12] |
SU Q, RIELLY C D, NAGY Z K. Simultaneous design and control framework for multi-segment multi-addition plug-flow crystallizer for anti-solvent crystallizations[C]//2015 American Control Conference (ACC). Chicago, IL, USA. IEEE: 4276-4281
|
| [13] |
ALVAREZ A J, SINGH A, MYERSON A S. Crystallization of cyclosporine in a multistage continuous MSMPR crystallizer[J]. Crystal Growth & Design, 2011, 11(10): 4392-4400. |
| [14] |
张军立, 龚俊波, 孙华, 等. 头孢氨苄连续结晶研究及应用[J]. 化工进展, 2019, 38(7): 3349-3354. ZHANG Junli, GONG Junbo, SUN Hua, et al. Study and application of the continuous crystallization process of cefalexin[J]. Chemical Industry and Engineering Progress, 2019, 38(7): 3349-3354. (in Chinese) |
| [15] |
蒋翠媛, 王平, 刘宝树, 等. 头孢拉定双股进料结晶新工艺[J]. 化学工业与工程, 2018, 35(3): 43-49. JIANG Cuiyuan, WANG Ping, LIU Baoshu, et al. The dual feed crystallization process of cephradine[J]. Chemical Industry and Engineering, 2018, 35(3): 43-49. (in Chinese) |
| [16] |
孙华. 洛伐他汀结晶过程研究[D]. 天津: 天津大学, 2006 SUN Hua. Study on the crystallization process of lovastatin[D]. Tianjin: Tianjin University, 2006 (in Chinese) |
| [17] |
ZHANG D, Xu S, Du S, et al. Progress of pharmaceutical continuous crystallization[J]. Engineering, 2017, 3(3): 354-364. |
 2023, Vol. 40
2023, Vol. 40





