水飞蓟宾是从水飞蓟种子中提取出来的主要水飞蓟素,属于黄酮木质素[1]。水飞蓟宾具有铁螯合特性,可保护肝脏;可抗氧化、抗肿瘤,还有调节炎症和细胞凋亡的作用。水飞蓟宾及其制剂对肝硬化、慢性肝炎和与酒精消费和环境毒素接触有关的肝病有非常显著的治疗作用;并且水飞蓟宾的安全指数很高,鲜有用药后的不良反应[2]。水飞蓟宾最近备受关注,因为其还有很多除了保护肝脏和抗氧化(自由基清除)等作用的其他可供选择的有益活性,主要包括抗癌和化学预防作用,以及低胆固醇、心脏保护和神经保护作用[3]。它的应用范围已扩大到除肝脏和胃肠道外的其他器官系统。例如治疗胰腺问题和平衡血糖,治疗肺部问题和肾脏疾病,治疗包括腺癌在内的各种前列腺疾病。此外,它在皮肤科和化妆品方面也有应用。
水飞蓟宾由2种非对映体化合物(水飞蓟宾A和水飞蓟宾B)按1∶1的比例组成。结晶性粉末状水飞蓟宾呈浅白灰色,无刺激性气味、味微苦涩,有引湿性。在丙酮、乙酸乙酯、甲醇和乙醇溶剂中有较大溶解度[4]。但是实验证实水飞蓟宾几乎不溶于水和脂质介质、人体服用后不能完全吸收,绝大部分药物以原型排出,致使水飞蓟宾的生物利用率低。物理化学稳定性好、高溶解度以及高生物利用度是一种特定活性药物成分(API)应具有的重要特性,而形成共晶是一种相对快速和简单的方法,并且可以提高药物的稳定性、溶解度、溶出率、生物利用度和机械性能等性能[5]。一方面,共晶不需要原料药具有电离官能团,药物共晶提供了更多的合成可能性。另一方面,特定原料药可以在没有辅料的情况下,通过选择适当的共晶生成剂使药物以稳定的晶型存在。
目前常用的共晶制备方法主要有:机械研磨法(干法研磨、液体辅助研磨以及聚合物辅助研磨等)、溶液结晶法(反应结晶、冷却结晶、蒸发结晶以及溶剂介导结晶等)、超临界流体技术、超声波合成、微波辅助合成等方法[6]。在实验室制备共晶时也可采用多种方法耦合的方式进行。
共晶配体的选择基于超分子合成子理论[7],可与羟基形成超分子合成子的官能团有羧基和酰胺。基于剑桥晶体数据库和分子结构选择水杨酸(SA)、丁香酸(SYRA)和水杨酰胺(SAL)作为共晶配体。采用辅助研磨法和溶剂蒸发法[8]成功制备出水飞蓟宾-水杨酸、水飞蓟宾-丁香酸和水飞蓟宾-水杨酰胺3种共晶,并对其进行了粉末X-射线衍射、傅里叶变换红外光耦、核磁共振[9]和综合热分析测定来确定共晶的形成[10, 11]。另外通过倒置式生物显微镜观察了原料药及共晶的形貌。通过测试样品在水中的溶解度发现,3种共晶的溶解度较水飞蓟宾呈现出明显的增加。
 |
水飞蓟宾(分析纯,天士力公司);水杨酸(分析纯,麦克林生化科技有限公司);水杨酰胺(质量分数99%,阿拉丁生物试剂有限公司);丁香酸(质量分数98%,阿拉丁生物试剂有限公司);无水甲醇、无水乙醇(分析纯,天津市化学试剂厂)。
KQ2200B型超声波清洗器;FA2204 B型电子天平;AV-400型核磁共振波谱仪;vertex 70型傅里叶变换红外光谱仪;D8 Discover粉末X射线衍射仪;Ix83型倒置式生物显微镜;HCT-3型综合热分析仪。
1.2 共晶制备 1.2.1 水飞蓟宾-水杨酸共晶制备首先,称量48.4 mg水飞蓟宾和27.6 mg水杨酸,量取20 mL甲醇;将固体和液体混合并采用超声溶解加速粉末在溶剂中的溶解速率;然后在50 ℃的条件下摇床震荡12 h;最后在室温下静置于通风橱内,7 d后获得浅红色的水飞蓟宾-水杨酸共晶粉末。
1.2.2 水飞蓟宾-丁香酸共晶制备首先,称量48.4 mg水飞蓟宾和39.7 mg丁香酸,量取20 mL甲醇;将固体和液体混合并采用超声溶解加速粉末在溶剂中的溶解速率;然后在50 ℃的条件下摇床震荡24 h;最后在室温下静置于通风橱内,5日后获得松散的水飞蓟宾-丁香酸共晶粉末。
1.2.3 水飞蓟宾-水杨酰胺共晶制备首先,称量48.4 mg水飞蓟宾和27.6 mg水杨酰胺,量取20 mL甲醇+乙醇(体积比为1∶1);其次,将固体和液体混合并采用超声溶解加速粉末在溶剂中的溶解速率;然后在50 ℃的条件下摇床震荡12 h;最后在室温下静置于通风橱内,3 d后获得浅红色水飞蓟宾-水杨酰胺共晶粉末。
1.3 共晶表征 1.3.1 粉末X-射线衍射测定粉末X-射线衍射采用德国布鲁克D8 Discover粉末X射线衍射仪,测试条件为石墨单色器,Cu_Kα系射线(λ=0.154180 nm)、40 kV的电压、40 mA的电流、扫描速度为6(°)·min-1,扫描步长为0.02°,2θ范围为5°~40°,在室温条件下测定。
1.3.2 傅里叶变换红外光耦测定傅里叶变换红外光耦数据记录在Bruker vertex 70傅里叶变换红外光谱仪上。以4 000~400 cm-1的扫描波数、4 cm-1的分辨率、KBr压片法的条件在室温下测定。
1.3.3 核磁共振波谱测定核磁共振波谱数据记录在瑞士布鲁克AV-400核磁共振波谱仪上。在共振频率为400 MHz,以DMSO-d6为溶剂的条件下进行测试。
1.3.4 综合热分析测定综合热分析(北京恒久HCT-3),测定条件:30~400 ℃的温度范围、升温速率10 ℃·min-1(水杨酸采用3 ℃·min-1)、氮气吹扫速度40 mL·min-1,样品测试量为2~10 mg。
1.3.5 倒置式生物显微镜测定晶体形貌由奥林巴斯Ix83倒置式生物显微镜测量:取一定量的样品放置于载玻片上,使用水等溶剂进行分散,室温下观察其晶体形貌。
1.3.6 溶解度测定采用分光光度法测定水飞蓟宾及成功制备的共晶在水中的溶解度。在25 ℃条件下测试。测试结果经绘图表明。
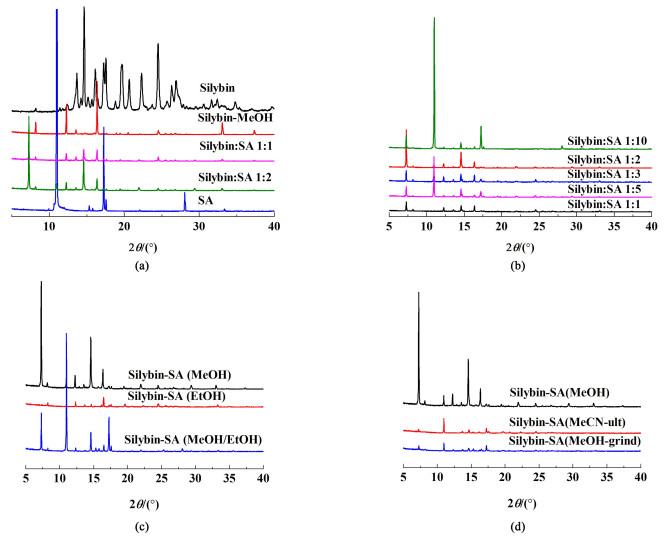
2 结果与讨论 2.1 共晶的PXRD表征 2.1.1 水飞蓟宾-水杨酸共晶PXRD图 1(a)为水飞蓟宾-水杨酸共晶的XRD,图 1(b)为不同的物质的量之比蒸发产物的XRD。图 1(a)中,水飞蓟宾-水杨酸共晶的XRD在衍射角7.3°、12.9°、21.9°和29.4°处出现新峰,16.1°、22.3°、23.7°、26.3°、26.9°、31.6°、32.4°和34.8°处水飞蓟宾的特征峰以及9.9°、15.3°、15.8°、22.1°、28.1°和33.4°处水杨酸的特征峰不再出现。以上特征峰的变化证明新晶相产生。因为水飞蓟宾分子中含有多个羟基和羰基,所以共晶的形成要通过原料药与配体不同的物质的量之比来实现。通过分析不同物质的量之比产物的XRD,水飞蓟宾和水杨酸的物质的量之比为1∶2时,7.3°处的新特征峰峰强最强,所以水飞蓟宾与水杨酸1∶2为最适宜物质的量之比。另外,分别使用甲醇、乙醇以及2者混合物作为溶剂。
|
| 图 1 XRD (a)水飞蓟宾-水杨酸;(b)不同物质的量之比;(c)其他溶剂;(d)其他方式 Fig.1 XRD (a) silybin-salicylic acid; (b) different molar ratios; (c) other solvents; (d) other means |
| |
由图 1(c)可得:11.1°和17.3°处水杨酸较强的特征峰,证明共晶以较低的纯度可在甲醇乙醇混合溶剂中产生,而纯乙醇中没有得到其共晶。图 1(d)是采用乙腈辅助超声和甲醇辅助研磨生成产物的XRD,均出现在7.3°处的特征峰,说明超声和湿法研磨2种共晶制备方法可用于水飞蓟宾-水杨酸共晶的制备。
2.1.2 水飞蓟宾-丁香酸共晶PXRD图 2(a)为水飞蓟宾-丁香酸共晶的XRD, 图 2(b)为不同溶剂蒸发产物的XRD。图 2(a)中水飞蓟宾-丁香酸共晶的XRD在5°左右、6.24°和9.91°处出现新峰。16.1°、22.3°、23.7°、26.3°、26.9°、31.6°、32.4°和34.8°处水飞蓟宾的特征峰以及16.23°、18.26°、21.5°、21.9°、24.0°~28.0°处丁香酸的特征峰不再出现或峰强变弱。以上特征峰的变化证明新晶相产生。同理,水飞蓟宾分子中含有多个羟基和羰基,采用与水杨酸相同的化学计量比进行共晶的合成。通过分析不同溶剂蒸发产物的XRD,发现水飞蓟宾-丁香酸共晶可以在甲醇溶剂、四氢呋喃溶剂以及甲醇四氢呋喃混合溶剂中分别形成。并且混合溶剂中共晶的晶型不如单一溶剂中完整。

|
| 图 2 XRD (a)水飞蓟宾-丁香酸;(b)其他溶剂 Fig.2 XRD (a) silybin-syringic acid; (b) other solvents |
| |
图 3(a)为水飞蓟宾-水杨酰胺共晶的XRD,图 3(b)为不同的物质的量之比蒸发产物的XRD。图 3(a)中水飞蓟宾-水杨酰胺共晶的XRD在5.9°、11.8°和23.8°处出现新峰,16.1°、22.3°、23.7°、26.3°、26.9°、31.6°、32.4°和34.8°处水飞蓟宾的特征峰以及32.4°处水杨酰胺的特征峰不再出现,8.45°和16.9°处水杨酰胺的特征峰峰强明显减弱。以上特征峰的变化充分证明新晶相产生。不同溶剂的XRD结果表明,水飞蓟宾-水杨酰胺共晶可在除甲醇乙腈混合溶剂的其他6种溶剂中形成,因为在5.9°和11.8°处出现新的特征峰。由于甲醇乙醇混合溶剂XRD的新特征峰峰强较强,水杨酰胺特征峰不明显,所以主要对其进行分析研究。

|
| 图 3 XRD (a)水飞蓟宾-水杨酰胺;(b)其他溶剂 Fig.3 XRD(a) silybin-salicylamide; (b) other solvents |
| |
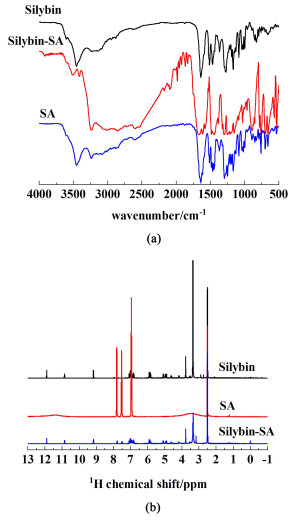
图 4(a)为水飞蓟宾-水杨酸共晶的红外光谱图。经分析图谱发现,共晶的红外图谱几乎是水飞蓟宾与水杨酸2单组分红外图谱的和。唯有水杨酸的CO特征吸收峰从1 612 cm-1长移到1 614 cm-1处。各个官能团的特征峰位置没有发生大变化是因为水飞蓟宾与水杨酸之间形成的氢键相互作用相对弱一些。
|
| 图 4 (a) 水飞蓟宾-水杨酸的红外图谱;(b)水飞蓟宾-水杨酸的核磁氢谱 Fig.4 (a) Infrared spectrum of silybin-salicylic acid; (b) nuclear magnetic hydrogen spectra of silybin-salicylic acid |
| |
图 4(b)是水飞蓟宾-水杨酸共晶的核磁氢谱图,分析图谱可知氢键是水飞蓟宾和水杨酸形成共晶的相互作用力,2者的物质的量之比为1∶2。δ7.80 (d, J=7.8 Hz, 1H), 7.52 (t, J=7.7 Hz, 1H), 6.94 (dd, J=15.1, 8.0 Hz, 2H),11.90 (s, 1H), 10.86 (s, 1H), 9.17 (s, 1H)是1H NMR化学位移(400 MHz, DMSO) 与氢原子的积分个数比。
2.2.2 水飞蓟宾-丁香酸共晶FT-IR及核磁表征结果图 5(a)为水飞蓟宾-丁香酸共晶的红外光谱图,由图 5(a)可见丁香酸中的CO双键的峰从1 699 cm-1略微长移到1 697 cm-1处,水飞蓟宾中的CO键的峰从1 639 cm-1处长移至1 633 cm-1处,水飞蓟宾中O—H的特征吸收峰从3 604 cm-1长移至3 600 cm-1处。即表明共晶红外图谱较水飞蓟宾和丁香酸出现移动。

|
| 图 5 (a) 水飞蓟宾-丁香酸的红外图谱;(b)水飞蓟宾-丁香酸的核磁氢谱 Fig.5 (a) Infrared spectrum of silybin-eugenic acid; (b) nuclear magnetic hydrogen spectrum of silybin-syringic acid |
| |
图 5(b)是水飞蓟宾-丁香酸共晶的核磁氢谱图,分析图谱可知氢键是水飞蓟宾和丁香酸形成共晶的相互作用力,2者的物质的量之比为1: 2。δ12.55 (s, 2H), 11.90 (s, 1H), 10.89 (s, 1H), 9.22 (d, J=22.3 Hz, 3H), 7.20 (s, 4H), 6.92 (dt, J=25.0, 18.4 Hz, 6H), 5.87 (dd, J=19.6, 11.2 Hz, 3H), 4.97 (dd, J=48.9, 19.4 Hz, 3H), 4.62 (s, 1H), 4.17 (s, 1H), 3.79 (d, J=9.2 Hz, 12H), 3.79 (d, J=9.2 Hz, 12H) 是1H NMR化学位移(400 MHz, DMSO) 与氢原子的积分个数比。表示水飞蓟宾位置5羟基氢由单体时的尖峰变为宽峰的特征峰是δ10.94(s, 1H)。丁香酸中的酚羟基氢对应的是δ12.55(s, 2H),其化学位移较小。核磁共振谱峰显著变宽是因为水飞蓟宾及丁香酸与小分子之间发生了强烈的氢键作用。
2.2.3 水飞蓟宾-水杨酰胺共晶FT-IR及核磁氢谱表征结果图 6(a)是水飞蓟宾-水杨酰胺共晶的红外光谱图。经分析图谱得知,从3 396和3 188 cm-1到3 400和3 190 cm-1处的轻微蓝移对应于水杨酰胺中氨基的N—H键特征吸收峰的变化。从3 604 cm-1到3 600 cm-1处的轻微红移对应于水飞蓟宾中O—H的特征吸收峰变化。此外,共晶红外图谱中CO键在1 600 cm-1处的峰强几乎没有,而与水飞蓟宾的CO键在1 639 cm-1处重合。

|
| 图 6 (a) 水飞蓟宾-水杨酰胺的红外图谱;(b)水飞蓟宾-水杨酰胺的核磁氢谱 Fig.6 (a) Infrared spectrum of silybin-salicylamide; (b) nuclear magnetic hydrogen spectra of silybin-salicylamide |
| |
图 6(b)是水飞蓟宾-水杨酰胺共晶的核磁氢谱。分析图谱可知氢键是水飞蓟宾和水杨酰胺形成共晶的相互作用力,并大致分析出2者的物质的量之比为1∶1。δ 13.07 (s, 1H), 11.91 (s, 1H), 10.94 (s, 1H), 9.19 (s, 1H), 8.42 (s, 1H), 7.96-7.81 (m, 2H), 7.41 (s, 1H), 7.10-6.79 (m, 8H), 5.88 (d, J=16.9 Hz, 3H), 4.97 (dd, J=48.2, 18.7 Hz, 3H), 4.62 (d, J=5.9 Hz, 1H), 4.17 (s, 1H), 3.78 (s, 3H), 3.52 (s, 1H)是1H NMR化学位移(400 MHz, DMSO)与氢原子的积分个数比。表示水飞蓟宾位置5羟基氢由单体时的尖峰变为宽峰的特征峰是δ10.94(s, 1H)。表示水杨酰胺中羟基氢由单体时的尖峰变为宽峰的特征峰位于δ13.07 (s, 1H)处,此峰出现了轻微化学位移。
由红外光谱和核磁共振氢谱联合分析,得出氢键是由水杨酰胺中的CO和N—H与水飞蓟宾5处的O—H和CO形成的结论。
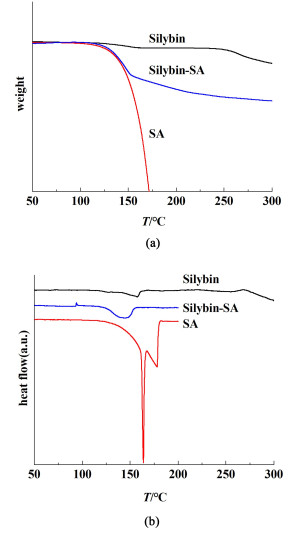
2.3 共晶综合热分析表征 2.3.1 水飞蓟宾-水杨酸共晶综合热分析表征结果图 7(a)和图 7(b)分别为水飞蓟宾-水杨酸共晶的热重和DSC图谱。综合分析2个图谱,水杨酸的熔点为163.8 ℃且共晶的熔点低于水飞蓟宾和水杨酸2单组分的熔点。水杨酸失量速率过快是因为其受热易分解。在熔点之前,水飞蓟宾失质量的是水,水杨酸则为自身小部分失质量,以致共晶也伴随小量失质量。图 7(b)中共晶在100 ℃附近有1处峰向上,经分析推测与一些水杨酸分解相关。
|
| 图 7 (a) 水飞蓟宾-水杨酸的热重;(b)水飞蓟宾-水杨酸的DSC图谱 Fig.7 (a) Thermal weight of silybin-salicylic acid; (b) DSC atlas of silybin-salicylic acid |
| |
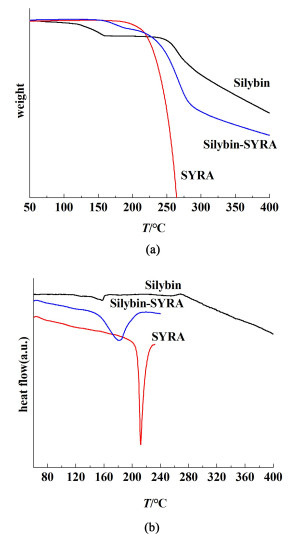
图 8(a)和8(b)分别为水飞蓟宾-丁香酸共晶的热重和DSC图谱。结合热重和DSC图谱分析,丁香酸在DSC图谱211.6 ℃处出现吸热峰,即说明211.6 ℃是丁香酸的熔点,此熔点与相关文献中说法一致。热重图中显示温度达到225 ℃以上丁香酸迅速失质量,即高温条件下丁香酸分解,此分解过程是吸热过程。水飞蓟宾-丁香酸共晶在DSC图谱181.3 ℃处出现吸热峰,即说明181.3 ℃是共晶的熔点,该熔点介于水飞蓟宾和丁香酸2单组分之间。共晶在高于181.3 ℃时开始缓慢失质量;当温度达到225 ℃左右时,共晶迅速失质量;最后共晶的失质量趋势同水飞蓟宾单组分的失质量速度。
|
| 图 8 (a) 水飞蓟宾-丁香酸的热重;(b)水飞蓟宾-丁香酸的DSC图谱 Fig.8 (a) Thermoweight of silybin-eugenic acid; (b) DSC atlas of silybin-eugenic acid |
| |
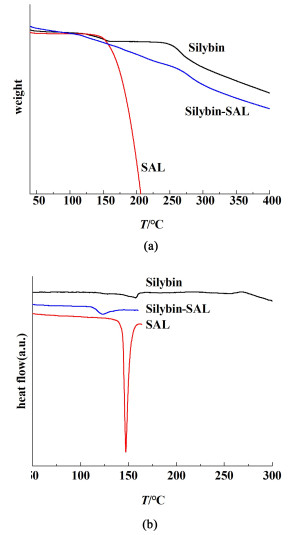
图 9(a)和图 9(b)分别是水飞蓟宾-水杨酰胺共晶的热重和DSC图谱。综合分析2个图谱,水杨酰胺的熔点为147.3 ℃且共晶的熔点低于水飞蓟宾和水杨酰胺2单组分的熔点。在熔点之前,水飞蓟宾失质量的是水,而水杨酰胺不存在失质量现象。当温度逐渐变高后,水杨酰胺的失质量率随之增加,最后水杨酰胺完全燃烧。由热重图可知,共晶随温度升高也有失质量的发生,此现象源于遗留溶剂的蒸发。共晶的吸热峰在123.3 ℃左右,且在水杨酰胺完全燃烧之前失质量率逐渐增加,随后共晶的失质量趋势同水飞蓟宾单组分的失质量速度。此过程也有水飞蓟宾的分解吸热峰。
|
| 图 9 (a) 水飞蓟宾-水杨酰胺的热重;(b)水飞蓟宾-水杨酰胺的DSC图谱 Fig.9 (a) Thermo weight of silybin-salicylamide; (b) DSC atlas of silybin-salicylamide |
| |
图 10(a)为水杨酸的晶体形貌,其呈针状结构。图 10(b)为水飞蓟宾-水杨酸共晶的晶体形貌,其呈表面光滑的长且宽的块状结构。其形貌与水飞蓟宾片状的晶体结构差异明显。且综合XRD、FT-IR、TG、DSC和核磁的表征结果确定共晶的成功制备。

|
| 图 10 显微镜照片(a)水杨酸;(b)水飞蓟宾-水杨酸 Fig.10 Microscopic images (a) salicylic acid; (b) silybin-salicylic acid |
| |
图 11(a)为丁香酸的晶体形貌,其呈细小针状结构。图 11(b)为水飞蓟宾-丁香酸共晶的晶体形貌,其呈细长条棍状结构,且多个棍状晶体结合在一起。综合XRD、FT-IR、TG、DSC和核磁的表征结果确定共晶的成功制备。

|
| 图 11 显微镜照片(a)丁香酸;(b)水飞蓟宾-丁香酸 Fig.11 Microscopic images (a)syringic acid; (b) silybin-syringic acid |
| |
图 12(a)为水杨酰胺的晶体形貌,其呈较短的棒状结构。图 12(b)为水飞蓟宾-水杨酰胺共晶的晶体形貌,其呈不规则片状,且比水飞蓟宾的片状结构更长更宽。综合XRD、FT-IR、TG、DSC和核磁的表征结果确定共晶的成功制备。

|
| 图 12 显微镜照片(a)水杨酰胺;(b)水飞蓟宾-水杨酰胺 Fig.12 Microscope photos. (a) salicylamide; (b) silybin salicylamide |
| |
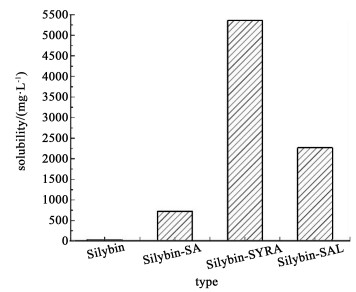
图 13由溶解度测定获得的数据绘图得。实验条件下,水飞蓟宾在水中的的溶解度为35.68 mg·L-1。
|
| 图 13 水飞蓟宾及共晶的溶解度 Fig.13 Solubility of silybin and eutectic |
| |
由图 13可见3种共晶在水中的溶解度显著提高,水飞蓟宾-丁香酸共晶在水中的溶解度是水飞蓟宾的百倍以上。结果表明,共晶可以提高水飞蓟宾的溶解度。
3 结论首次提出通过共晶提高水飞蓟宾的溶解度和改变水飞蓟宾的物化性质的新想法,研究了不同共晶方法和溶剂对共晶形成的影响。成功制备出水飞蓟宾-丁香酸、水飞蓟宾-水杨酸和水飞蓟宾-水杨酰胺3种共晶,共晶的晶体形貌与水飞蓟宾晶体形貌产生了显著的变化。3种共晶在水中的溶解度远大于水飞蓟宾,且水飞蓟宾-丁香酸共晶在水中的溶解度为水飞蓟宾的百倍以上。此外,可以通过形成共晶来改变水飞蓟宾非对映异构体的物化性质和旋光性,为水飞蓟宾A和水飞蓟宾B的分离提供了新思路和帮助。
| [1] |
BIEDERMANN D, VAVŘÍKOVÁ E, CVAK L, et al. Chemistry of silybin[J]. Nat Prod Rep, 2014, 31(9): 1138-1157. DOI:10.1039/C3NP70122K |
| [2] |
WANG X, LIN F, XU W, et al. Silybin B exerts protective effect on cisplatin-induced neurotoxicity by alleviating DNA damage and apoptosis[J]. Journal of Ethnopharmacology, 2022. DOI:10.1016/j.jep.2021.114938 |
| [3] |
KŘEN V, GAŽÁK R, KATEŘINA P. Chemoenzymatic preparative separation of silybins A and B[J]. Journal of Molecular Catalysis B: Enzymatic, 2009, 61(3/4): 247-251. |
| [4] |
DI COSTANZO A, ANGELICO R. Formulation strategies for enhancing the bioavailability of silymarin: The state of the art[J]. Molecules (Basel, Switzerland), 2019. DOI:10.3390/molecules2411255 |
| [5] |
ZHANG Z, LI D, LUO C, et al. Cocrystals of natural products: Improving the dissolution performance of flavonoids using betaine[J]. Crystal Growth & Design, 2019, 19(7): 3851-3859. |
| [6] |
NUGRAHANI I, UTAMI D, AYUNINGTYAS L, et al. New preparation method using microwave, kinetics, in vitro dissolution-diffusion, and anti-inflammatory study of diclofenac-proline co-crystal[J]. ChemistrySelect, 2019, 4(45): 13396-13403. DOI:10.1002/slct.201903342 |
| [7] |
RAJBONGSHI T, SARMAH K K, SARKAR A, et al. Preparation of pyrazinamide eutectics versus cocrystals based on supramolecular synthon variations[J]. Crystal Growth & Design, 2018, 18(11): 6640-6651. |
| [8] |
PARK B, YOON W, YUN J, et al. Emodin-nicotinamide (1∶2) cocrystal identified by thermal screening to improve emodin solubility[J]. International Journal of Pharmaceutics, 2019, 557: 26-35. DOI:10.1016/j.ijpharm.2018.12.027 |
| [9] |
PATEL J R, CARLTON R A, NEEDHAM T E, et al. Preparation, structural analysis, and properties of tenoxicam cocrystals[J]. International Journal of Pharmaceutics, 2012, 436(1/2): 685-706. |
| [10] |
WANG Y, XUE J, WANG Q, et al. Structural investigation of a 2∶1 co-crystal between diflunisal and isonicotinamide based on terahertz and Raman spectroscopy[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2019, 216: 98-104. DOI:10.1016/j.saa.2019.03.023 |
| [11] |
ZHANG Z, CAI Q, XUE J, et al. Co-crystal formation of antibiotic nitrofurantoin drug and melamine co-former based on a vibrational spectroscopic study[J]. Pharmaceutics, 2019. DOI:10.3390/pharmaceutics11020056 |
| [12] |
KŘEN V. Chirality matters: Biological activity of optically pure silybin and its congeners[J]. International Journal of Molecular Sciences, 2021. DOI:10.3390/ijms22157885 |
 2023, Vol. 40
2023, Vol. 40





