2. 天津大学化工学院, 天津 300072;
3. 四川农业大学园艺学院, 成都 611130;
4. 国药集团川抗制药有限公司, 成都 611730
2. Tianjin University, Tianjin 300072, China;
3. College of Horticulture, Sichuan Agricultural University, Chengdu 611130, China;
4. Sinopharm Chuankang Pharmaceutical Co. Ltd., Chengdu 611730, China
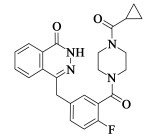
奥拉帕利(Olaparib),化学式C24H23FN4O3,化学名为4-[3-(4-环丙基甲酰基哌嗪基-1-羰基)-4-氟苄基]-2H-酞嗪-1-酮,商品名为Lynparza,由英国药企阿斯利康研发上市[1]。奥拉帕利是全球首个上市的聚腺苷二磷酸-核糖聚合酶(PARP,poly-ADP-ribose polymerase)抑制剂,靶向作用于有DNA修复缺陷的肿瘤,使其未修复的DNA损伤逐渐积累,导致肿瘤细胞死亡。2014年12月获得EMA和FDA批准上市,用于BRCA1/2基因缺陷相关的晚期卵巢癌的治疗,2016年1月又被美国FDA授予突破性疗法资格,在既往接受过一种基于紫杉烷的化疗及至少一种最新激素药物治疗的患者中,用于BRCA1/2或ATM基因突变转移性去势抵抗性前列腺癌(mCRPC)治疗[2-5]。
奥拉帕利化学结构如图 1,其氢键受体和供体位置较多,与不同溶剂作用中易出现多晶型现象[6]。Lynparza制剂端使用的原料晶型为无水晶型A[2],文献报道奥拉帕利还有无定型、无水晶型L、水合物晶型H、多种溶剂化合物晶型[1, 3-5, 7]及共晶[8, 9]等。针对奥拉帕利多晶型现象,现有文献主要集中在多晶型的制备和表征,鲜有对晶体结构、晶型相互转化关系进行深入研究。本工作研究了奥拉帕利异质同晶溶剂化物现象,并培养了奥拉帕利四氢呋喃溶剂化物的单晶,其晶体结构数据申请剑桥晶体数据库编号为2129899。通过单晶数据解析了奥拉帕利形成异质同晶溶剂化物的机理,并解释稳定晶型A在溶剂状态下向介稳晶型转变的原因。此外,还研究了奥拉帕利生产工艺相关晶型:无水物晶型A/L和水合物晶型H相互转化关系,为奥拉帕利工业化生产过程晶型控制提供指导。
|
| 图 1 奥拉帕利化合物结构 Fig.1 Molecular structure of olaparib |
| |
X’ Pert3 Power X射线粉末衍射仪(PANalytical公司);DSC2500差示扫描量热仪(TA公司);TGA1热重分析仪(METTLER TOLEDO公司)。
奥拉帕利粗品来自四川科伦药物研究院有限公司,粗品质量分数98.51%。所有有机试剂(成都市科隆试剂有限公司)均为分析纯。纯化水为实验室用去离子水。
1.2 奥拉帕利多晶型的制备 1.2.1 奥拉帕利无定型的制备取奥拉帕利10 g,加入到100 mL二氯甲烷-乙醇(体积比为9∶1)的混合溶剂中,加热到回流溶解,趁热过滤,滤液在旋转蒸发仪上于50 ℃快速减压蒸除溶剂,得到奥拉帕利无定型(9.35 g,收率93.5%)。
1.2.2 奥拉帕利溶剂化物或水合物的制备奥拉帕利无定型在二氯甲烷、乙醇、四氢呋喃和乙腈等多种有机溶剂中的饱和溶液悬浮打浆均可获得对应的溶剂化物。
奥拉帕利无定型在纯化水的饱和液中悬浮打浆可制备得到奥拉帕利水合物晶型H。
1.2.3 奥拉帕利晶型A的制备取奥拉帕利水合物晶型H样品15 g,溶解于225 mL的75%乙醇-水溶液中,以0.05 ℃·min-1的速度降温至10 ℃,抽滤干燥即可得到晶型A。
1.2.4 奥拉帕利晶型L的制备晶型A奥拉帕利在乙醇溶液中,配置成混悬溶液,在室温下悬浮转晶24 h以上即可得到晶型L。
1.3 晶型的表征方法X射线粉末衍射[XRD](X’ Pert3 Power X射线衍射分析仪),测试方法:Cu_Kα石墨单色器,射线管工作电压40 kV,工作电流40 mA,扫描范围3.5°~40.0°,步长0.013 1°,透射式连续扫描方式扫描。
差示扫描量热法[DSC](METTLER TOLEDO),测试方法:精密称取上述晶型样品3~5 mg,均匀铺于铝坩埚中,加盖,以空坩埚作空白对照。在N2保护下升温扫描,温度范围35~200 ℃,升温速率10 ℃·min-1。
热重分析法[TGA](METTLER TOLEDO TGA1热重分析仪),测试方法:精密称取上述晶型样品3~5 mg,均匀铺于瓷坩埚中,以空坩埚作空白对照。在氮气保护下升温检测,温度范围35~500 ℃,升温速率10 ℃·min-1。
变温XRD(X’ Pert3 Power X射线衍射分析仪),测试方法:Cu_Kα为0.154 06 nm,单色辐射,40 kV 40 mA激发,反射模式,室温测试XRD后,逐步由室温25 ℃快速升温至200 ℃恒温40 min后测试其XRD图谱。
动态水分吸附仪DVS(Surface Measurement Systems Intrinsic):温度25 ℃;保护气体N2;dm/dt≤0.005,最大平衡时间120 min;相对湿度范围0~90%。
X-射线单晶衍射XRSD(Rigaku X射线单晶衍射仪):Mo靶检测(波长λ=0.71073 nm),角度收集范围为2.78°~27.23°,使用SHELXS软件进行晶体结构解析。
1.4 THF溶剂化物单晶培养及检测THF单晶培养方法:奥拉帕利THF的饱和溶液,加入THF稀释1倍,密封后,针头扎约6~10个小针孔,放置室温环境下缓慢挥发长出单晶。
1.5 悬浮-溶剂介导转晶实验方法配制不同浓度的乙醇-水溶剂,加入奥拉帕利晶型A至其不再溶解。称量晶型A与晶型H配制质量比为1∶1的混合物或晶型A与晶型L质量比为1∶1的混合物,在不同比例的乙醇-水或乙腈-水溶剂中悬浮3天后,取样采用XRD对固相进行定性分析。
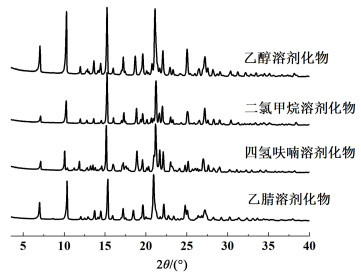
2 实验结果与讨论 2.1 溶剂化物的表征与分析图 2是奥拉帕利二氯甲烷溶剂化物、THF溶剂化物、乙醇溶剂化物和乙腈溶剂化物的XRD图谱,几种溶剂化物的XRD图谱非常相似,仅存在非常细微的区别。图 3列出了THF溶剂化物的DSC图谱,其他溶剂化物的DSC图谱与THF溶剂化物图谱类似,具体脱溶剂温度及失质量列于表 1,根据TGA失质量及溶剂种类,换算可得不同溶剂化物的化学计量比均为0.5。晶型表征结果表明,奥拉帕利的不同溶剂化物,具有高度相似的晶体结构,Xu等[10-13]称之为异质同晶溶剂化物现象(Isostructure solvates)。
|
| 图 2 奥拉帕利不同溶剂化物的XRD图谱 Fig.2 XRD patterns of Olaparib solvates |
| |

|
| 图 3 奥拉帕利THF溶剂合物的DSC分析图 Fig.3 DSC profile of Olaparib oxolane solvate |
| |
| 溶剂化物的种类 | DSC(peak/℃) | TGA/% | 化学计量比 | |
| 脱溶剂峰 | 熔化峰 | |||
| THF溶剂化物 | 171.3 | 212.3 | 7.80 | 0.5 |
| 二氯甲烷溶剂化物 | 169.9 | 211.7 | 8.28 | 0.5 |
| 乙醇溶剂化物 | 158.6 | 210.6 | 5.62 | 0.5 |
| 乙腈溶剂化物 | 165.7 | 211.5 | 4.80 | 0.5 |
奥拉帕利溶剂化物脱溶剂峰较尖锐、脱溶剂温度较高,且脱完溶剂后均有吸热转晶峰,转晶后的晶体熔化峰与无水物晶型A的熔化峰一致。溶剂化物研究中常将溶剂化物分为3种类型:通道型溶剂化物、独立位点型溶剂化物和络合型溶剂化物[14]。独立位点型溶剂化物热流/热重曲线的形态特点有[14-16]:(a)DSC图谱脱溶剂峰“较尖锐”;(b)TGA图谱失重台阶“较陡”;(c)脱溶剂温度点与溶剂分子沸点关系不大。奥拉帕利不同溶剂化物的热流/热重曲线符合独立位点溶剂化物的特征。
培养不同溶剂化物的单晶,获得四氢呋喃溶剂化物的单晶并成功解析得到晶体结构数据。四氢呋喃溶剂化物晶体属于单斜晶系(monoclinic),晶胞尺寸a=1.03555 nm;b=0.91697 nm;c=2.45770 nm。奥拉帕利四氢呋喃溶剂化物单晶数据申请剑桥晶体数据库CDCC编号为2129899。
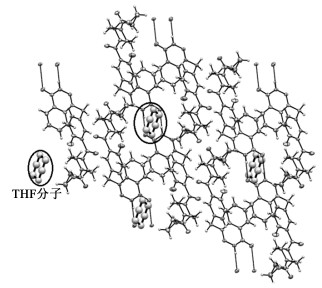
奥拉帕利THF溶剂化物单晶截面图如图 4所示,将THF分子用球棍模型标识,可以直观观察到,THF溶剂化物分子位于奥拉帕利化合物分子形成的“口袋中”。从THF单晶结构分析,奥利帕利形成异质同晶溶剂化物机理与上述分子晶体“口袋”有关:奥拉帕利分子堆积方式不受溶剂分子种类的影响,在形成不同溶剂化物的过程中,不同溶剂分子作为“客体分子”填充入已形成的“口袋”中[11, 13]。
|
| 图 4 四氢呋喃溶剂化物单晶截面图: THF分子以球-棍模型标注 Fig.4 Part of the crystal structure for THF solvate: THF solvent molecular are shown in ball-wire model |
| |
THF溶剂化物单晶结构中,奥拉帕利化合物分子与THF溶剂分子通过氢键相互作用,而不同的THF溶剂分子之间不存在直接作用,该微观结构特点符合独立位点型溶剂化物的定义[14],即从单晶结构解析结果表明,奥拉帕利溶剂化物晶型属于独立位点型溶剂化物。
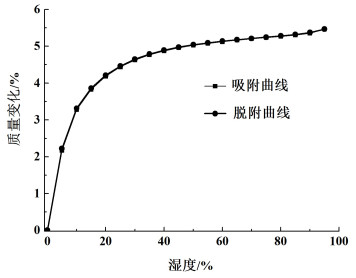
2.2 水合物晶型H的表征和分析晶型H是水合物晶型。其XRD图谱列于图 5,DSC/TGA结果列于图 6和图 7。晶型H在6.4°、7.4°和8.3°有明显特征峰,与图 2中有机溶剂化物晶型的XRD特征峰明显不同。热分析曲线表明晶型H在40 ℃即开始脱去4.5%的结晶水,脱水峰“平坦”,且动态水分吸附仪DVS(图 8所示)吸附和脱附曲线无滞后性,符合通道型结晶水的特征[14-16]。

|
| 图 5 奥拉帕利水合物晶型H及无水物晶型A/L的XRD图谱 Fig.5 XRD patterns of Olaparib hydrate Form H and anhydrous Form A/Form L |
| |

|
| 图 6 奥拉帕利水合物晶型H的DSC图谱 Fig.6 DSC profile of Olaparib hydrate Form H |
| |

|
| 图 7 奥拉帕利水合物晶型H的TGA图谱 Fig.7 TGA profile of Olaparib hydrate Form H |
| |
|
| 图 8 奥拉帕利水合物晶型H的DVS图谱 Fig.8 DVS pattern of Olaparib hydrate Form H |
| |
无水物晶型A与晶型L的XRD图谱如图 5所示。晶型L的变温XRD图谱结果(图 9)表明,晶型L在200 ℃恒温40 min后,晶型已完全转变为晶型A。
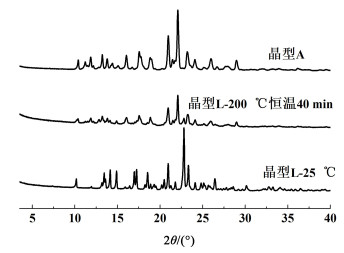
|
| 图 9 晶型L变温XRD图谱 Fig.9 Variable-temperature X-ray diffraction profiles of Form L |
| |
DSC结果(图 10)表明,晶型A在212.2 ℃处有尖锐的熔化峰;晶型L的DSC有2个尖锐的吸热峰和1个放热峰,第1个吸热峰在200 ℃左右,紧接着是放热峰,第2个吸热峰与晶型A熔化峰重合,也出现在212 ℃附近。变温XRD数据表明在200 ℃时晶型L会转晶为晶型A。因此,晶型L热分析曲线上,第1个吸热峰为晶型L的熔化峰,接着熔融液体重结晶转化为晶型A放热,第2个吸热峰为晶型A的熔化峰。根据晶型热力学稳定性规则判断[17, 18],无水物晶型L为热力学介稳晶型,无水物晶型A为热力学稳定晶型。
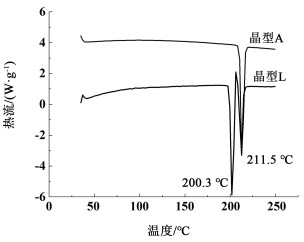
|
| 图 10 奥拉帕利无水物晶型A和晶型L的DSC图谱 Fig.10 DSC profiles of anhydrous Form A and From L |
| |
奥拉帕利无水物晶型A和水合物晶型H在乙醇-水体系中,可以相互转晶。表 2列出了乙醇-水体系中,不同水体积比和不同温度下转化晶型的种类。研究结果表明,温度和水体积比均会影响转晶方向:高温60 ℃时,水体积比≥80%,无水物晶型A趋向转化为水合物晶型H;水体积比≤70%,水合物晶型H趋向于转化为晶型A。较低温25 ℃时,水体积比≥60%,无水物晶型A趋向转化为水合物晶型H;水体积比≤50%,水合物晶型H趋向与转化为晶型A。在水体积比为60%和70%时,低温25 ℃生成晶型H,高温60 ℃则生成晶型A,表明低温更有利于水合物的生成,与文献[19, 20]报道一致。
| 晶型种类 | φ(水)/% | 转晶晶型 | |
| 25 ℃ | 60 ℃ | ||
| A+H (质量比1∶1) 乙醇-水体系 |
95 | H | H |
| 90 | H | H | |
| 85 | H | H | |
| 80 | H | H | |
| 70 | H | A | |
| 60 | H | A | |
| 50 | A | A | |
| 40 | A | A | |
| 25 | A | A | |
| 20 | A | A | |
| 10 | A | A | |
| 5 | A | A | |
| 纯乙醇 | A | A | |
理论上,无水物晶型A和晶型L溶剂介导转晶中,介稳晶型L会优先溶解,稳定晶型A会逐步生长,一定条件下悬浮足够时间,晶型L会完全转变为晶型A[21-23]。
表 3列出了晶型A+晶型L在乙醇-水体系和乙腈-水体系中,溶剂悬浮介导转晶的方向。在有机溶剂乙醇\乙腈中,以及水体积比较低的乙醇-水(水体积比≤25%)体系\乙腈(水体积比≤50%),热力学稳定晶型A向介稳晶型L转化。库多斯公司所有权的专利文献中[1],也提到晶型A在常用有机溶剂中浆化是制备晶型L的一种方法,这似乎与介稳晶型终会转变为稳定晶型的趋势相悖[17, 18]。
| A+L (质量比1∶1)乙醇-水体系 |
A+L (质量比1∶1)乙腈-水体系 |
|||
| φ(乙醇)/% | 转晶方向 | φ(乙腈)/% | 转晶方向 | |
| 75 | A→L | 50 | A→L | |
| 83 | A→L | 60 | A→L | |
| 90 | A→L | 70 | A→L | |
| 100 | A→L | 80 | A→L | |
| 90 | A→L | |||
| 100 | A→L | |||
分析原因,“反常”的转晶方向可能与异质同晶溶剂化物现象有关[24, 25]:有机溶剂分子(如乙醇\乙腈)较容易进入晶型A的晶格“口袋”,形成对应的溶剂化物,而溶剂化物在溶剂介导的作用下转晶形成晶型L。本文作者在研究中,离线取样分析XRD,并未监测到溶剂化物晶型,后续可借助在线设备监测转晶过程,进一步明确稳定晶型A向介稳晶型L转晶的机理。
3 结论奥拉帕利化合物分子氢键受体和供体位置较多,存在多晶型和溶剂化物晶型。表征及分析奥拉帕利二氯甲烷溶剂化物、THF溶剂化物、乙醇溶剂化物和乙腈溶剂化物可得,上述奥拉帕利溶剂化物属于独立位点型的异质同晶溶剂化物。培养并解析了THF溶剂化物的单晶结构,单晶数据表明THF分子位于奥拉帕利化合物分子形成的“口袋中”,奥拉帕利分子堆积方式受THF分子的影响较小。奥利帕尼形成异质同晶溶剂化物机理与上述分子晶体“口袋”有关。
奥拉帕利相变过程监测和研究结果表明,奥拉帕利无水晶型A与水合物晶型H在乙醇-水体系的相转变方向受温度和水体积比的影响,且低温更有利于水合物晶型的生成。
通过变温XRD研究和热力学相互稳定性规则分析,奥拉帕尼无水晶型A为热力学稳定晶型,晶型L为热力学介稳晶型。而常用有机溶剂中,溶剂介导转晶的方向均为:稳定晶型A转晶为介稳晶型L。推测“反常”转晶过程为:有机分子首先进入晶型A的晶格“口袋”,形成对应的溶剂化物,而溶剂化物在溶剂介导的作用下转晶形成晶型L。
| [1] |
凯瑟琳·安妮·奎格利, 以斯拉·约翰·斯蒂尔, 伦纳德·杰西·池亚尔. 4-[3-(4-环丙烷羰基-哌嗪-1-羰基)-4-氟-苄基]-2H-酞嗪-1-酮: CN101821242[P]. 2010-09-01
|
| [2] |
陈本川. 治疗晚期卵巢癌新药: 奥拉帕尼(olaparib)[J]. 医药导报, 2015, 34(6): 846-849. CHEN Benchuan. Olaparib, a new drug for the treatment of advanced ovarian cancer[J]. Herald of Medicine, 2015, 34(6): 846-849. DOI:10.3870/yydb.2015.06.043 (in Chinese) |
| [3] |
朱社凤. 一种奥拉帕利组合物胶囊: CN107375232A[P]. 2017-11-24
|
| [4] |
刘振腾, 孙逸威, 李华, 等. 一种奥拉帕利化合物的合成方法: CN107325055A[P]. 2017-11-07
|
| [5] |
章微华, 蔡鸿飞, 金远锋. 一种奥拉帕利的重结晶方法: CN107304187A[P]. 2017-10-31
|
| [6] |
赵绍磊, 王灵宇, 吴送姑. 药物多晶型的研究进展[J]. 化学工业与工程, 2018, 35(3): 12-21. ZHAO Shaolei, WANG Lingyu, WU Songgu. Progress in the research of pharmaceutical polymorph[J]. Chemical Industry and Engineering, 2018, 35(3): 12-21. DOI:10.3969/j.issn.1006-7906.2018.03.003 (in Chinese) |
| [7] |
朱社凤. 一种治疗卵巢癌的药物奥拉帕利的制备方法: CN107382873A[P]. 2017-11-24
|
| [8] |
陈敏华, 张炎锋, 刘凯, 等. 奥拉帕利与尿素的共晶及其制备方法: CN105753789A[P]. 2016-07-13
|
| [9] |
陈嘉媚, 高璐, 戴霞林. 一种奥拉帕利与富马酸共晶晶型α及其制备方法与应用: CN202110925622[P]. 2021-10-09
|
| [10] |
BĒRZI A, REKIS T, ACTI A. Comparison and rationalization of droperidol isostructural solvate stability: An experimental and computational study[J]. Crystal Growth & Design, 2014, 14(7): 3639-3648. |
| [11] |
XU W, GONG N, YANG S, et al. Isostructurality among solvates of cabazitaxel: X-ray structures and new solvates preparation[J]. Journal of Pharmaceutical Sciences, 2015, 104(4): 1256-1262. DOI:10.1002/jps.24374 |
| [12] |
YANG D, GONG N, ZHANG L, et al. Isostructurality among 5 solvatomorphs of betulin: X-ray structure and characterization[J]. Journal of Pharmaceutical Sciences, 2016, 105(6): 1867-1873. DOI:10.1016/j.xphs.2016.03.015 |
| [13] |
GALLAGHER J F, MOCILAC P. Pockets and channels in tennimide solvate structures: Influence of solvent on crystal packing behaviour[J]. Journal of Molecular Structure, 2021. DOI:10.1016/j.molstruc.2021.130149 |
| [14] |
冉媛媛. 克林霉素磷酸酯溶剂化物转化研究[D]. 天津: 天津大学, 2014 RAN Yuanyuan. Study on the transformation of solvates of clindamycin phosphate[D]. Tianjin: Tianjin University, 2014 (in Chinese) |
| [15] |
BURNS D H, CARPER W R. Anion recognition in a model ion channel: Effects of solvation on chloride binding to a porphyrin-metacyclophane[J]. Journal of Molecular Structure: THEOCHEM, 2004, 711(1/2/3): 149-157. |
| [16] |
TOMASI J, MENNUCCI B, CAMMI R. Quantum mechanical continuum solvation models[J]. Chemical Reviews, 2005, 105(8): 2999-3094. DOI:10.1021/cr9904009 |
| [17] |
倪维骅. 药物多晶型的研究方法[J]. 医药工业, 1981, 12(9): 33-39, 5, 50. NI Weihua. Research methods of drug polymorphism[J]. Chinese Journal of Pharmaceuticals, 1981, 12(9): 33-39, 5, 50. (in Chinese) |
| [18] |
GIRON D. Thermal analysis and calorimetric methods in the characterisation of polymorphs and solvates[J]. Thermochimica Acta, 1995, 248: 1-59. DOI:10.1016/0040-6031(94)01953-E |
| [19] |
LABUZA T, ALTUNAKAR B. Water activity prediction and moisture sorption isotherms[J]. Water Activity in Foods: Fundamentals and Applications, 2020, 161-205. |
| [20] |
WANG X, WU S, DONG W, et al. In situ monitoring of the solvent-mediated transformation of cefadroxil DMF solvate into monohydrate[J]. Organic Process Research & Development, 2013, 17(9): 1110-1116. |
| [21] |
刘雅. L-组氨酸伴随多晶型及晶型转化过程研究[D]. 天津: 天津大学, 2018 LIU Ya. A study on concomitant polymorphism and solution-mediated phase transformation of L-histidine in antisolvent crystallization[D]. Tianjin: Tianjin University, 2018 (in Chinese) |
| [22] |
HERMAN C, HAUT B, DOUIEB S, et al. Use of in Situ Raman, FBRM, and ATR-FTIR probes for the understanding of the solvent-mediated polymorphic transformation of Ⅱ-Ⅰ etiracetam in methanol[J]. Organic Process Research & Development, 2012, 16(1): 49-56. |
| [23] |
O'MAHONY M A, MAHER A, CROKER D M, et al. Examining solution and solid state composition for the solution-mediated polymorphic transformation of carbamazepine and piracetam[J]. Crystal Growth & Design, 2012, 12(4): 1925-1932. |
| [24] |
GU C, YOUNG V J, GRANT D J W. Polymorph screening: Influence of solvents on the rate of solvent-mediated polymorphic transformation[J]. Journal of Pharmaceutical Sciences, 2001, 90(11): 1878-1890. |
| [25] |
CARDEW P T, DAVEY R J. The kinetics of solvent-mediated phase transformations[J]. Proceedings of the Royal Society of London A Mathematical and Physical Sciences, 1985, 398(1815): 415-428. |
 2023, Vol. 40
2023, Vol. 40





