离子液体(Ionic liquid, IL),一种完全由阴阳离子构成的有机盐,因其在室温条件下呈液态而得名,组成离子液体的阴阳离子具有不对称性和低电荷密度[1, 2]。科学家对离子液体的深入探究发现与传统溶剂相比,离子液体更加环保和安全,目前被公认为是一类“绿色”溶剂[3, 4]。离子液体特殊的结构决定了其具有一些独特的物理和化学性质,比如极低的蒸汽压、挥发性小、良好的热稳定性和化学稳定性、优异的润滑性能,较好的溶解能力等。而这些独特的物化性质也决定了离子液体在众多生产领域都有潜在的应用价值[5-8]。例如,由于离子液体对很多物质都具有较好的溶解能力,并且与众多有机溶剂都不互溶,因此在萃取分离中有着广泛的应用[9, 10]。很多研究已表明在燃油产品的脱硫脱氮方面,离子液体可用作性能良好的脱硫剂[11];在对煤焦油中酚类物质的提取方面,离子液体也展现了强于传统萃取剂的分离能力[12]。与此同时,近年来已有一些研究发现离子液体可作为添加剂用于改善蛋白质的结晶过程,提高晶体质量,缩短结晶时间和调控晶体的晶型,这无疑为解决蛋白质结晶学领域的难题提供了可能性[13, 14]。
溶菌酶(Lysozyme)是一种碱性蛋白质,又名胞壁质酶(Muramidase)或N-乙酰胞壁质聚糖水解酶(N-acetylmuramide glycanohydrlase),易溶于水,难溶于有机溶剂[15, 16]。溶菌酶主要通过作用于细菌细胞壁中N-乙酰胞壁酸和N-乙酰氨基葡糖之间的β-1, 4-糖苷键来破坏细菌细胞壁的结构,从而使得细菌溶解破裂,起到抗菌消炎的作用[17, 18]。1922年,英国的细菌学家Fleming首次在人的唾液和眼泪中发现了这种能够杀死细菌的酶并将其命名为溶菌酶,之后科学家们发现该酶广泛存在于动物、植物以及微生物细胞中,其中尤以蛋清中含量最高[19, 20]。目前,溶菌酶已广泛应用于食品防腐,基因工程以及细胞工程等领域[21]。鸡蛋清溶菌酶因其易于结晶且价格便宜,所以常作为模型蛋白应用于蛋白质结晶方面的研究[22]。
本研究选取了4种亲水性离子液体,分别为1-丁基-3-甲基咪唑四氟硼酸盐([C4mim]BF4)、1-丁基-3-甲基咪唑氯盐([C4mim]Cl)、1-丁基-3-甲基咪唑溴盐([C4mim]Br)和1,3-二甲基咪唑碘化物([dmim]I),并以鸡蛋清溶菌酶为模型蛋白,根据前期实验研究结果,选取5.01为结晶环境的pH值,25和5 ℃分别为降温结晶的起始和终点温度,并确定降温时间为4 h,固定离子液体的添加浓度为3%,采用冷却结晶法制备晶体,利用浊度法测定酶活性,考察了这4种离子液体对溶菌酶晶体形态和活性的影响,为深入研究离子液体在蛋白质结晶领域的应用提供理论依据。
1 实验 1.1 实验材料与试剂本研究所用的4种离子液体均购自上海成捷化学有限公司,其化学结构信息如表 1所示。实验中用到的其它化学试剂如表 2所示。
| 离子液体名称 | 简写 | 结构式 | 相对分子质量 |
| 1-丁基-3-甲基咪唑四氟硼酸盐 | [C4mim]BF4 | 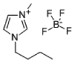 |
226.02 |
| 1-丁基-3-甲基咪唑氯盐 | [C4mim]Cl | 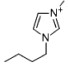 |
174.67 |
| 1-丁基-3-甲基咪唑溴盐 | [C4mim]Br | 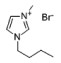 |
219.12 |
| 1, 3-二甲基咪唑碘化物 | [dmim]I |  |
224.04 |
| 名称 | w/% | 等级 | 来源 |
| 溶菌酶 | >99 | 20 000 U·mg-1 | 上海源叶生物有限公司 |
| 氯化钠 | >99.8 | AR | 天津市科密欧化学试剂有限公司 |
| 磷酸二氢钾 | >99 | AR | 天津市科密欧化学试剂有限公司 |
| 磷酸氢二钾 | >99 | AR | 天津市科密欧化学试剂有限公司 |
| 溶壁微球菌 | BR | 上海源叶生物有限公司 | |
| 牛肉膏 | AR | 天津江天化工有限公司 | |
| 蛋白胨 | AR | 天津江天化工有限公司 | |
| 琼脂 | AR | 天津江天化工有限公司 |
CK-3006程序降温恒温槽,宁波新芝生物科技股份有限公司;EMS-4B磁力搅拌器,天津市欧诺仪器仪表有限公司;FD-1C-50冷冻干燥机,北京博医康实验仪器有限公司;UV-1800紫外分光光度计,上海元析仪器有限公司;CX31显微镜,奥林巴斯(中国)有限公司。
1.3 实验方法 1.3.1 溶菌酶晶体制备本研究中溶菌酶晶体的制备采用冷却结晶法,结晶过程使用的仪器设备主要由结晶器,控温系统和搅拌系统3部分组成。图像采集系统由显微镜、高分辨相机以及计算机3部分组成,结晶过程的图像采集工作是通过安装在高配置计算机上的图像软件实现的。
晶体制备实验步骤如下:(1)配制0.1 mol·L-1磷酸盐缓冲溶液,该磷酸盐缓冲溶液pH值为5.01,后续溶菌酶晶体的制备均以该磷酸盐缓冲溶液作为基础溶液;(2)准确移取一定体积的上述磷酸盐缓冲溶液并转移至50 mL带有夹层的结晶器中,加入一定质量的NaCl,使其浓度为5%(质量分数),然后分别加入不同种类的离子液体([C4mim]BF4、[C4mim]Cl、[C4mim]Br和[dmim]I),控制其浓度为3%(质量/体积);(3)将恒温水浴温度保持25 ℃ 30 min,向结晶器中加入过量溶菌酶,开启磁力搅拌器搅拌30 min,此时,溶菌酶在结晶器中达到溶解平衡;(4)将上述溶菌酶悬浊液转移到预热至25 ℃的砂芯漏斗过滤,将滤液转移到结晶器中,即得到溶菌酶饱和溶液。设置温控系统的降温程序,开始冷却结晶操作;(5)在降温结晶过程中,在冷却温度降低到20、15、10和5 ℃时,分别吸取少许结晶母液于显微镜载玻片上,观察晶体的形貌;(6)待冷却结晶过程结束维持30 min后,快速将结晶器中的结晶母液转移至5 ℃的低温离心机离心管中,12 000 r·min-1下离心15 min,取沉淀,冷冻干燥制得溶菌酶晶体;(7)对于不同种类的离子液体,设置不同的冷却结晶程序,重复以上操作步骤,最终得到添加不同离子液体下的溶菌酶晶体。
1.3.2 溶菌酶晶体活性测定由于溶菌酶可以破坏细菌的细胞壁,进而导致细菌悬浮液的浊度降低,本研究以溶壁微球菌为溶菌酶作用的底物细菌,利用紫外可见分光光度计测定底物悬浮液在450 nm处的吸光度,根据吸光度值的变化,计算溶菌酶晶体的活性。
1.3.2.1 菌体的活化培养(1) 准确量取4 mL液体培养基并加入适量菌粉,维持37 ℃,200 r·min-1于摇床上培养20~40 h。
(2) 采用平板划线法,挑选生长状况良好的菌液接种到固体培养基,并在28 ℃下恒温培养48 h。
(3) 恒温培养48 h后,选取固体培养基中大小适中的单菌落,并将其转移至液体培养基中,在37 ℃,200 r·min-1于摇床上继续培养20~40 h。
(4) 将上一步得到的含有菌液的液体培养基低温离心20 min,离心期间维持温度4 ℃,离心转速4 200 r·min-1,离心结束取沉淀,并用无菌水洗涤菌体沉淀,再离心,重复3次离心操作。
(5) 对步骤(4)处理得到的菌体预冻,并在-50 ℃条件下冷冻干燥20 h,将充分干燥的菌体粉于25 ℃下保存。
1.3.2.2 底物悬浮液的制备(1) 移取一定体积的0.1 mol·L-1,pH 6.20的磷酸盐缓冲溶液,加入0.2 g的活化菌粉,搅拌得到均一的悬浮液。
(2) 调节紫外可见分光光度计波长为450 nm,测定上述悬浮液吸光度(OD)值,测定过程中,通过0.1 mol·L-1,pH 6.20的磷酸盐缓冲溶液稀释悬浮液,使OD值介于0.5~0.6之间。
1.3.2.3 酶活力的测定(1) 移取一定体积的0.1 mol·L-1,pH 6.20的磷酸盐缓冲溶液,加入适量的经过冷却结晶制备得到的溶菌酶晶体,将其配制成浓度为50 μg·mL-1的酶液。
(2) 控制恒温水浴25 ℃,维持酶液和底物悬浮液在该温度下15~20 min,取3 mL底物悬浮液于比色皿中,测定吸光度值OD值,调零。
(3) 加入0.2 mL酶液于比色皿中快速混合,并开始计时,分别测定20 s和80 s时的OD450值,操作重复3次,取平均值。
1.3.2.4 酶活力的计算定义在25 ℃,pH值为6.20的特定条件下,紫外分光光度计450 nm处,吸光度值每分钟下降0.001为1个酶活力单位,通过公式(1)计算每mg溶菌酶的活力u。
| $ u=\frac{\Delta \mathrm{OD}_{450}}{0.001 m_{\text {样品 }}} $ | (1) |
式(1)中:u为溶菌酶的活力,U·mg-1;ΔOD450为时间为80 s与20 s时测定的酶解液在分光光度计上读出的吸光度值的差值;m样品为加入的溶菌酶的质量,mg。
2 结果与讨论 2.1 冷却结晶实验结果 2.1.1 结晶条件的确定 2.1.1.1 溶液pH值的确定四方晶形是蛋清溶菌酶最常见的晶形,制备该晶体形貌的晶体一般是在乙酸/乙酸钠(HAc-NaAc)缓冲溶液体系中,在酸性溶液环境,NaCl通常考虑作为降低溶菌酶溶解度的盐析剂。一般认为,缓冲溶液的pH值、温度、盐析剂的浓度等都会影响晶体的生长,进而最终影响晶体的质量。Russell等[23]探究了溶液pH值、结晶温度及结晶母液过饱和度等对溶菌酶结晶过程的影响,发现了结晶过程缓冲溶液pH值对溶菌酶结晶过程的影响最为显著,其原因可能是由于溶菌酶是两性大分子物质,溶液体系的pH值可改变溶菌酶表面的净电荷数量,进而影响其溶解度,进一步对溶菌酶的结晶过程产生影响。姬燕培等[24]研究了在其他条件不变的情况下,通过改变pH值考察溶菌酶的结晶情况,发现了在pH值为4.6和5.0条件下制备得到的溶菌酶晶体的质量较高。结合本课题组以前的研究数据[25],本研究选择以0.1 mol·L-1,pH=5.01的缓冲溶液作为结晶基础母液进行后续的冷却结晶制备溶菌酶晶体。
2.1.1.2 冷却结晶起始和终点温度的确定通过课题组前期的研究结果,我们考察了添加离子液体条件下溶菌酶的溶解度曲线,并且发现在5~25 ℃之间溶菌酶的溶解度随温度变化显著,同时为了避免过高温度对溶菌酶活性产生负面影响,本研究确定选择25和5 ℃作为降温程序的起始和终点温度,通过降温操作产生过饱和度,从而实现溶菌酶从母液中结晶析出。
2.1.1.3 降温曲线的确定冷却结晶是通过将溶液温度降低,产生一定的过饱和度,当跨过介稳区宽度时,就会从溶液中析出晶体。降温速率决定了过饱和度产生的快慢,进而间接影响析出晶体的质量。降温速率过大,溶液较大的过饱和度快速形成,对于溶菌酶等生物大分子,容易形成无定形沉淀或由于爆发成核形成大量微小晶体。而当降温速率过小时,由于产生过饱和度变化太小,而无法形成能够达到临界晶核尺寸大小的晶核,最终导致晶体无法生长。所以选取合适的冷却结晶降温速率曲线对于溶菌酶结晶非常重要。本研究中降温程序的计算方式如式(2)~式(5)所示,通过计算,可以设计一个降温速率曲线,使得溶菌酶在结晶过程中溶解度随时间匀速下降。
| $ X=f(T) $ | (2) |
| $ t=g(T) $ | (3) |
| $ X=X_0-a t $ | (4) |
| $ g(T)=\frac{\left[f\left(T_0\right)-f(T)\right]}{a} $ | (5) |
以式(2)表示溶解度曲线,式(3)表述降温程序,式(4)表述溶解度随时间匀速下降,式(5)为降温程序,通过将式(2)和式(3)代入式(4)得到。T表示温度,X表示溶解度,X0表示初始溶解度,t表示时间。
本研究中设置了t=2、3、4和5 h 4个不同的降温时间来考察溶菌酶的结晶情况。结合课题组前期的研究中测得的溶菌酶在pH=5.01,浓度为0.1 mol·L-1磷酸盐缓冲液中的溶解度数据曲线[26],结合上述方程,计算得到的程序降温曲线如图 1所示。
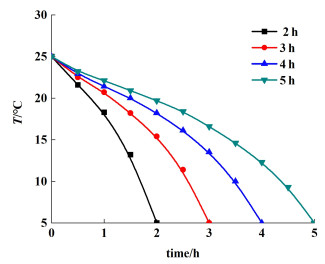
|
| 图 1 t=2、3、4和5 h下的降温曲线图 Fig.1 The cooling curves at t=2, 3, 4 and 5 h |
| |
本研究中,在冷却结晶实验阶段,研究了降温时间分别为2、3、4和5 h条件下溶菌酶的冷却结晶过程,发现降温时间为4 h时,溶菌酶晶体颗粒度较大,晶形完整。固定添加离子液体的浓度为3%,为了探究不同离子液体对溶菌酶晶体形貌的影响,利用显微镜摄取20、15、10以及5 ℃时溶菌酶晶体的形貌,结果如图 2所示。
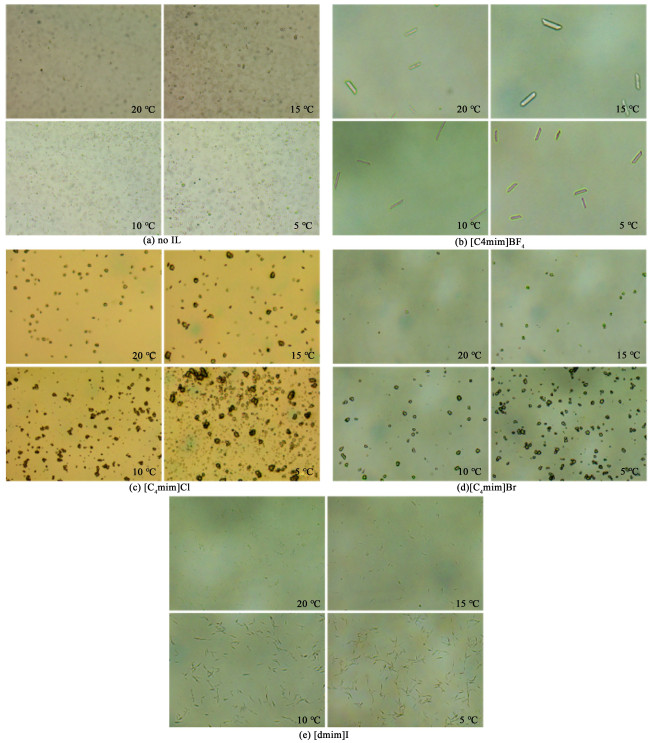
|
| 图 2 设置降温时间为4 h,添加3%不同种类的离子液体时在结晶过程中观察到的溶菌酶晶体形貌,所有图像均在放大10倍显微镜下拍摄 Fig.2 The lysozyme crystals observed during the crystallization process with 3% of different kinds of ionic liquids added when the cooling time was set to 4 h, all images were taken under a microscope with a 10×objective |
| |
由图 2可见,我们发现,与无离子液体添加相比,离子液体能够改善溶菌酶晶体的形态和大小。不添加离子液体时,溶液中形成了大量的细小微晶和不规则的晶体,而添加3%[C4mim]BF4后,溶液中晶体呈现规则的棒状晶体,其原因可能为该结晶条件更有利于溶菌酶晶体某一晶面的生长,从而使这一晶面快速生长,而其它晶面生长速度相对较慢,最终形成棒状晶体形貌。添加3%[C4mim]Cl后,溶菌酶晶体为块状晶体形貌,但与不添加离子液体的情况相比,晶体更容易从溶液中析出,且晶体的尺度也得到改善。添加3%[C4mim]Br后,对溶菌酶的结晶过程及晶体形貌及粒度的影响并不明显。添加3%[dmim]I时,溶菌酶晶体呈针状晶体,我们之前的研究发现离子液体[dmim]I的加入会降低溶菌酶在缓冲溶液中的溶解度。因此,我们推测,[dmim]I的添加增大了溶菌酶结晶过程中溶液的过饱和度,并且可能改变了溶菌酶分子组装形式,影响溶菌酶的晶型,最终形成与前面3种离子液体完全不同的针状晶体。
2.2 离子液体对溶菌酶晶体活性的影响为了探析添加不同离子液体对制备得到的溶菌酶晶体活性的影响,本研究将添加不同离子液体结晶得到的溶菌酶晶体溶解配制成50 μg·mL-1的溶液,采用比浊法,以溶壁微球菌为酶解底物,测定不同条件下制备得到的溶菌酶的活性。以降温结晶时间为横坐标,酶活性为纵坐标,得到添加不同离子液体条件下溶菌酶晶体活性变化的曲线图,结果如图 3、图 4、图 5和图 6所示。

|
| 图 3 添加不同浓度[C4mim]BF4以及设置不同降温时间条件下溶菌酶晶体的活性 Fig.3 The activity of lysozyme crystals under the conditions of adding different concentrations of [C4mim]BF4 and setting different cooling time |
| |

|
| 图 4 添加不同浓度[C4mim]Cl以及设置不同降温时间条件下溶菌酶晶体的活性 Fig.4 The activity of lysozyme crystals under the conditions of adding different concentrations of [C4mim]Cl and setting different cooling times |
| |
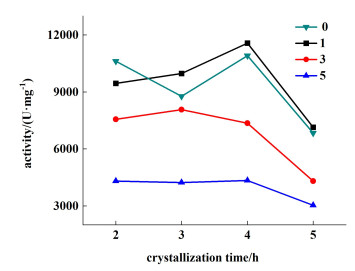
|
| 图 5 添加不同浓度[C4mim]Br以及设置不同降温时间条件下溶菌酶晶体的活性 Fig.5 The activity of lysozyme crystals under the conditions of adding different concentrations of [C4mim]Br and setting different cooling times |
| |
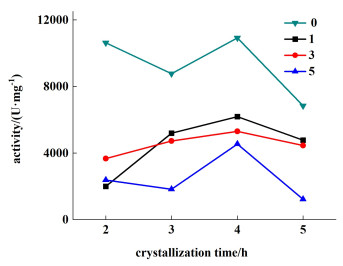
|
| 图 6 添加不同浓度[dmim]I以及设置不同降温时间条件下溶菌酶晶体的活性 Fig.6 The activity of lysozyme crystals under the conditions of adding different concentrations of [dmim]I and setting different cooling times |
| |
由图 3可见,添加离子液体[C4mim]BF4后,溶菌酶晶体的活性明显降低,值得注意的是,当[C4mim]BF4的添加浓度为1%时,溶菌酶晶体的活性的下降程度最大。固定[C4mim]BF4的添加浓度不变,比较不同降温时间条件下得到的溶菌酶晶体的活性发现,当添加1%[C4mim]BF4时,溶菌酶冷却结晶时间为2 h时,得到的溶菌酶晶体的活性最大;添加3%离子液体[C4mim]BF4时,溶菌酶冷却结晶时间为4 h时,得到的溶菌酶晶体活性最大,而添加5%离子液体[C4mim]BF4时,溶菌酶冷却结晶时间为3 h时得到的溶菌酶晶体的活性最大。
由图 4可见,添加离子液体[C4mim]Cl对溶菌酶晶体活性的影响不同于添加离子液体[C4mim]BF4。与不添加离子液体相比,添加1%[C4mim]Cl后,溶菌酶晶体的活性显著提高,然而随着[C4mim]Cl添加浓度的增大,溶菌酶晶体的活性产生下降趋势。
由图 5可见,当添加的离子液体[C4mim]Br的浓度为1%时,结晶制得的溶菌酶晶体的活性有轻微的增加,但是随着离子液体[C4mim]Br添加浓度的增加,溶菌酶晶体的活性反而降低。
如图 6所示,离子液体[dmim]I的添加使得溶菌酶晶体的活性显著降低,并且随着添加浓度的增大,酶活性的下降程度增大。一般认为,溶菌酶等生物大分子的活性与其空间三维结构,特别是与晶体活性中心结构域组成及组装形式密切相关,该结果也说明,离子液体[dmim]I的添加改变了溶菌酶晶体三维空间组装形式,进而改变活性中心结构域,最终影响到溶菌酶晶体的活性。
3 结论对分别添加4种亲水性离子液体条件下冷却结晶得到的溶菌酶晶体的形态和活性进行了研究,离子液体对溶菌酶晶体形态的影响显著。与不添加离子液体相比,[C4mim]Cl和[C4mim]Br未改变晶体形态,均为块状晶体,而添加[C4mim]BF4条件下得到棒状溶菌酶晶体,添加[dmim]I得到针状溶菌酶晶体。离子液体的添加影响了溶菌酶的晶体生长,最终影响了溶菌酶的晶体形态。[C4mim]BF4和[dmim]I的作用下,溶菌酶晶体的活性明显下降,而添加1%的[C4mim]Cl和[C4mim]Br则能促进晶体活性的提升。该研究结果为离子液体在结晶领域的应用提供理论指导,特别是通过控制结晶过程来调控生物大分子晶体形态及晶体活性。离子液体对溶菌酶晶体活性的影响机理有待进行更为深入的探究。
| [1] |
ZHAO R, WANG X, LI F, et al. Ionic liquid/ionic liquid dispersive liquid-liquid microextraction[J]. Journal of Separation Science, 2011, 34(7): 830-836. DOI:10.1002/jssc.201000802 |
| [2] |
TARIQ M, FREIRE M G, SARAMAGO B, et al. Surface tension of ionic liquids and ionic liquid solutions[J]. Chemical Society Reviews, 2012, 41(2): 829-868. DOI:10.1039/C1CS15146K |
| [3] |
张娜娜, 李圆圆, 贾文, 等. 几种离子液体的制备及性能表征[J]. 辽宁化工, 2021, 50(12): 1781-1784. ZHANG Nana, LI Yuanyuan, JIA Wen, et al. Preparation and characterization of several ionic liquids[J]. Liaoning Chemical Industry, 2021, 50(12): 1781-1784. DOI:10.3969/j.issn.1004-0935.2021.12.010 (in Chinese) |
| [4] |
杨帆. 离子液体对生物大分子结构稳定性影响的分子模拟研究[D]. 济南: 山东大学, 2021 YANG Fan. The molecular simulation of the effects of ionic liquids on the structural stability of biological macromolecules[D]. Jinan: Shandong University, 2021 (in Chinese) |
| [5] |
MANDAL P, MOLLA A R. Study of protein structures under the influence of imidazolium based ionic liquids[J]. Asian Journal of Chemistry, 2022, 34(7): 1633-1638. DOI:10.14233/ajchem.2022.23735 |
| [6] |
王月. 离子液体萃取体系及共价有机框架材料在放射性元素分离中的应用[D]. 北京: 北京大学, 2021 WANG Yue. Application of ionic liquid extraction systems and covalent organic framework materials in the separation of radioactive elements[D]. Beijing: Peking University, 2021 (in Chinese) |
| [7] |
王键吉, 张锁江, 韩布兴. 前言: 离子液体前沿专刊[J]. 中国科学: 化学, 2021, 51(10): 1311-1312. WANG Jianji, ZHANG Suojiang, HAN Buxing. Preface: Special issue on the frontiers of ionic liquids[J]. Scientia Sinica Chimica), 2021, 51(10): 1311-1312. (in Chinese) |
| [8] |
李诗文, 柳鑫. 烷基咪唑型离子液体在食品领域的应用及安全性研究进展[J]. 食品科学, 2022. LI Shiwen, LIU Xin. Application of alkyl imidazole ionic liquids in food field and progress on its safety research[J]. Food Science, 2022. DOI:10.7506/spkx1002-6630-20220331-384(inChinese) (in Chinese) |
| [9] |
初正帅, 彭效明, 蔡青蔓, 等. 离子液体及其双水相体系在萃取分离桑叶多糖中的应用[J]. 食品研究与开发, 2021, 42(8): 113-118. CHU Zhengshuai, PENG Xiaoming, CAI Qingman, et al. Application of ionic liquids and their two-aqueous phase systems in extraction and separation of polysaccharides from mulberry leaves[J]. Food Research and Development, 2021, 42(8): 113-118. (in Chinese) |
| [10] |
殷梦凡, 唐政, 张睿, 等. 离子液体液液萃取分离正辛烷/邻二甲苯[J]. 化工学报, 2021, 72(12): 6282-6290. YIN Mengfan, TANG Zheng, ZHANG Rui, et al. Separation of n-octane and o-xylene by liquid-liquid extraction with ionic liquids[J]. CIESC Journal, 2021, 72(12): 6282-6290. (in Chinese) |
| [11] |
李艳秋, 马川兰, 郭志芳. 咪唑类离子液体的合成及应用研究进展[J]. 农产品加工, 2022(14): 85-88, 93. LI Yanqiu, MA Chuanlan, GUO Zhifang. Progress on the synthesis and application of imidazoles ionic liquids[J]. Farm Products Processing, 2022(14): 85-88, 93. (in Chinese) |
| [12] |
李艳, 高美娟, 杜松山. 离子液体萃取分离煤焦油中酚类化合物的研究进展[J]. 化工设计通讯, 2021, 47(12): 93-95. LI Yan, GAO Meijuan, DU Songshan. Progress in separation of phenolic compounds from coal tar by ionic liquid extraction[J]. Chemical Engineering Design Communications, 2021, 47(12): 93-95. DOI:10.3969/j.issn.1003-6490.2021.12.049 (in Chinese) |
| [13] |
赵晶, 游其华, 沈金海, 等. 离子液体在结晶及多晶型转化领域的应用[J]. 广州化工, 2017, 45(18): 16-18, 38. ZHAO Jing, YOU Qihua, SHEN Jinhai, et al. Application and development of ionic liquids in crystallization and polymorphic transformation[J]. Guangzhou Chemical Industry, 2017, 45(18): 16-18, 38. DOI:10.3969/j.issn.1001-9677.2017.18.008 (in Chinese) |
| [14] |
徐乐慧, 洪鸣凰, 赵文杰, 等. 生物大分子结晶技术研究进展[J]. 中国医药工业杂志, 2011, 42(7): 554-559. XU Lehui, HONG Minghuang, ZHAO Wenjie, et al. Progress in research of technologies for crystallization of biological macromolecules[J]. Chinese Journal of Pharmaceuticals, 2011, 42(7): 554-559. DOI:10.3969/j.issn.1001-8255.2011.07.020 (in Chinese) |
| [15] |
林晨. 溶菌酶蛋白质结晶过程中成核的研究[D]. 广州: 华南理工大学, 2017 LIN Chen. Study on nucleation of lysozyme crystallization[D]. Guangzhou: South China University of Technology, 2017 (in Chinese) |
| [16] |
宋娟. 溶菌酶的分离方法及进展[J]. 河南化工, 2017, 34(7): 16-18. SONG Juan. Separation methods and progress of lysozyme[J]. Henan Chemical Industry, 2017, 34(7): 16-18. (in Chinese) |
| [17] |
黄敏, 孔明航, 王丽明. 鸡蛋清中溶菌酶的提取与抑菌作用[J]. 中国食品添加剂, 2010(3): 154-157. HUANG Min, KONG Minghang, WANG Liming. The extraction and antibacterial effect of lysozyme from hen-egg white[J]. China Food Additives, 2010(3): 154-157. (in Chinese) |
| [18] |
吴连春, 张秀玲. 溶菌酶的研究与应用[J]. 科技传播, 2011, 3(13): 109-110. WU Lianchun, ZHANG Xiuling. The research and application of lysozyme[J]. Public Communication of Science & Technology, 2011, 3(13): 109-110. (in Chinese) |
| [19] |
BYRNE N, ANGELL C A. The solubility of hen lysozyme in ethylammonium nitrate/H2O mixtures and a novel approach to protein crystallization[J]. Molecules (Basel, Switzerland), 2010, 15(2): 793-803. |
| [20] |
陈姗姗. 基因重组溶菌酶的制备及其酶学性质的研究[D]. 山东烟台: 烟台大学, 2020 CHEN Shanshan. Preparation of genetic recombinant lysozyme and study on its enzymatic properties[D]. Shandong Yantai: Yantai University, 2020 (in Chinese) |
| [21] |
张彦青, 张丽, 刘娜, 等. 日落黄与溶菌酶作用机制的光谱法研究[J]. 中国食品添加剂, 2021, 32(10): 119-126. ZHANG Yanqing, ZHANG Li, LIU Na, et al. Spectroscopic study on the interaction mechanism between sunset yellow and lysozyme[J]. China Food Additives, 2021, 32(10): 119-126. (in Chinese) |
| [22] |
HEKMAT D, HEBEL D, SCHMID H, et al. Crystallization of lysozyme: From vapor diffusion experiments to batch crystallization in agitated ml-scale vessels[J]. Process Biochemistry, 2007, 42(12): 1649-1654. |
| [23] |
JUDGE R A, JACOBS R S, FRAZIER T, et al. The effect of temperature and solution pH on the nucleation of tetragonal lysozyme crystals[J]. Biophysical Journal, 1999, 77(3): 1585-1593. |
| [24] |
姬燕培. 亲水性离子液体1, 3-二丁基咪唑氯代盐在溶菌酶结晶中的应用研究[D]. 沈阳: 东北大学, 2010 JI Yanpei. Investigations on the application of hydrophilic ionic Liquid1, 3-butyl-imidazole chloride to lysozyme crystallization[D]. Shenyang: Northeastern University, 2010 (in Chinese) |
| [25] |
姜萍萍. 离子液体诱导溶菌酶结晶及机理研究[D]. 天津: 天津大学, 2010 JIANG Pingping. Study on lysozyme crystallization induced by ionic liquids and its mechanism[D]. Tianjin: Tianjin University, 2010 (in Chinese) |
| [26] |
方文质. 离子液体对溶菌酶溶液结构影响的研究[D]. 天津: 天津大学, 2015 FANG Wenzhi. Study on the effect of ionic liquids on the solution structure of lysozyme[D]. Tianjin: Tianjin University, 2015 (in Chinese) |
 2023, Vol. 40
2023, Vol. 40