偶氮染料是合成染料中种类最多的一类,占染料种类的60%以上[1]。这些化合物的合成工艺简单、成本低廉、染色性能好,因此在纺织、食品、化妆品、制药等行业都有着广泛的应用[2]。偶氮染料至少含有一个偶氮基团(—N=N—),且偶氮基团常与芳香环以及助色团相连[3]。由于染料废水具有酸度高、色度高、毒性强等特点[4-6],对环境的危害极大,所以如何有效处理染料废水一直是人们密切关注的话题。
随着染料生产技术的发展,处理染料废水的难度也在不断增大。传统的染料废水处理方法已难以满足不易降解染料废水的处理要求[7]。近年来,基于硫酸根自由基(SO4- ·)的高级氧化技术引起了研究人员的广泛关注[8]。与传统的高级氧化方法生成的羟基自由基相比,硫酸根自由基有以下特点:(1)较高的氧化还原电位。在某些活化方法下,硫酸根自由基的氧化还原电位(2.5~3.1 V)甚至比羟基自由基(2.8 V)更高。(2)半衰期更长。硫酸根自由基的半衰期为30~40 μs,而羟基自由基的半衰期仅为10-3 μs。(3)硫酸根自由基氧化有机污染物的能力可能比羟基自由基更有效,如阿特拉津、硫唑嘌呤等物质[9-12]。活化过硫酸盐的方法有很多,如紫外线(UV)、热、过渡金属离子、活性炭等[13]。Fe2+/SPS工艺因其所需活化能低,传质效率高,环境友好以及成本低廉而受到人们的青睐[14]。
微反应器是指内部结构的特征尺寸在亚毫米尺寸的流体设备,具有传质传热效率高,实验条件可控,操作安全,易于放大等优点[15]。根据在微流体混合过程中有无外部能量的辅助促进,可将微反应器分为主动式和被动式的微反应器[16]。声化学微反应器是一种典型的主动式微反应器。它将声空化效应和微反应器的优势相结合,能够实现传质和反应过程的高效强化[17]。Zhao等[18]的研究表明超声强度、超声频率、液体黏度等对超声空化有着直接的影响。Thangavadivel等[19]发现流速、溶液温度和超声功率对微反应器的效率有显著影响。
研究人员大都在宏尺度的反应釜或者玻璃器皿中进行废水处理实验,而利用声化学微反应器进行相关试验的报道很少。本研究自行设计了一个新型的声化学微反应器系统,并以偶氮染料亚甲基蓝(MB)为模拟污染物,研究Fe2+/SPS体系在声化学微反应器中降解污染物的效果。本研究的内容是:(1)比较静置系统、磁力搅拌系统、毛细管微反应器系统和声化学微反应器系统中亚甲基蓝和硫酸亚铁混合液pH值、硫酸亚铁浓度和过硫酸钠浓度对亚甲基蓝降解率的影响;(2)研究流道结构和流速对亚甲基蓝降解率的影响。
1 实验材料和方法 1.1 声化学微反应器设计图 1 (a)为声化学微反应器示意图。该声化学微反应器以水为介质,通过超声波换能器将超声能量传递到毛细管中,以增强毛细管中溶液的混合效果。换能器安装管为高300 mm,内径100 mm,外径106 mm的不锈钢管。频率28 kHz,功率100 W的超声波换能器发射端切割为圆弧形,切割后超声频率变为33 kHz。超声波换能器上下对称地粘贴在换能器安装管上。换能器安装管两侧焊有开口槽,开口槽内部焊接有毛细管支撑座。开口槽底端装有不锈钢球阀,可用来排出开口槽中的水。整个装置由支座支撑,水温控制在25(±2) ℃。

|
| 图 1 (a) 声化学微反应器示意图;(b)实验装置图 Fig.1 Schematic diagram of (a)sonochemical microreactor; (b) experimental device |
| |
图 1 (b)为实验装置图。该实验装置由声化学微反应器、双通道注射泵、超声波发生器和收集装置组成。双通道注射泵以选定的流量泵送MB和FeSO4混合液与SPS溶液并在T型接头处汇合并进入外径为1.6 mm,内径为0.8 mm的毛细管中。开启超声波发生器,毛细管中溶液的混合效果可能会发生改变。反应溶液在毛细管内的停留时间可通过改变溶液流速(即注射泵的流量)来调整。集液瓶中盛有5 mL 30%的甲醇溶液。为了便于计算,只将注射泵泵送结束前的5 mL液体泵入集液瓶,其余液体作为润洗泵入废液瓶。
分别将毛细管绑在直线形、矩形波形、三角波形和半圆波形的不锈钢支架上,从而实现了上述4种毛细管流道结构,如图 2所示。

|
| 图 2 流道结构示意图 Fig.2 Schematic diagram of channel structure |
| |
试验所用试剂如表 1所示,所有试剂均为分析纯,使用前并未提纯。
| 试剂 | 化学式 | 生产厂家 |
| 过硫酸钠 | Na2S2O8 | 国药集团 |
| 七水合硫酸亚铁 | FeSO4·7H2O | 国药集团 |
| 甲醇 | CH3OH | 国药集团 |
| 亚甲基蓝 | C16H18ClN3S | 北联精细 |
| 氢氧化钠 | NaOH | 国药集团 |
| 浓硫酸 | H2SO4 | 国药集团 |
MB和FeSO4混合液的配制:将100 mL一定浓度的FeSO4溶液和100 mL 0.2 mmol ·L-1 MB溶液1∶1混合,并使用0.1 mol ·L-1NaOH和0.1 mol ·L-1 H2SO4调整溶液pH值。
本试验中所述的溶液浓度均为溶液混合之前的浓度,反应开始后溶液pH值也不再调整。
试验所用仪器如表 2所示,其中包括仪器型号及生产厂家。
| 仪器名称 | 仪器型号 | 生产厂家 |
| 声化学微反应器 | SCM2021-1 | 江南大学自制 |
| 超声波发生器 | KMD-K3 | 科美达超声波 |
| 双通道注射泵 | WH-SP-02 | 汶颢微流控 |
| 紫外可见光分光度计 | UV1800 | 日本岛津 |
| 精密电子天平 | FA1204 | 鄞州华丰电子 |
| 实验室pH计 | EL20 | 梅特勒-托利多 |
| 恒温磁力搅拌器 | DF-101S | 予华仪器 |
本实验使用Fe2+活化过硫酸钠产生SO4- ·,其具体反应方程式如式(1)所示:
| $ \mathrm{Fe}^{2+}+\mathrm{S}_2 \mathrm{O}_8^{2-} \longrightarrow \mathrm{Fe}^{3+}+\mathrm{SO}_4^{2-}+\mathrm{SO}_4^{-} \cdot $ | (1) |
并且SO4-·能与水反应生成羟基自由基(·OH),反应如式(2)所示[20]:
| $ \mathrm{SO}_4^{-} \cdot+\mathrm{H}_2 \mathrm{O} \longrightarrow \mathrm{HSO}_4^{-}+\cdot \;\mathrm{OH} $ | (2) |
使用SO4- ·降解污染物的一般机理如图 3所示。硫酸根自由基通过不饱和键加成、夺氢或电子转移等方式来降解污染物。降解过程中还会发生羟化反应及苯环侧链的氧化反应。对于含有芳香族化合物(如亚甲基蓝),SO4-·和·OH将进一步破坏芳香环形成小分子物质,生成水、二氧化碳和无机离子。

|
| 图 3 污染物降解机理 Fig.3 Mechanism of pollutant degradation |
| |
分别在静置系统、磁力搅拌系统、毛细管微反应器系统和声化学微反应器系统中研究MB和FeSO4混合液pH值、FeSO4浓度和SPS浓度对MB降解率的影响。流道结构和流速对MB降解率的影响的试验在声化学微反应器系统和毛细管微反应器系统中进行。静置系统和磁力搅拌系统的所有实验均在恒温磁力搅拌器中进行。试验所用亚甲基蓝浓度始终保持为0.2 mmol ·L-1,溶液在管道内的停留时间均为60 s。
静置系统:静置系统是指从反应开始到加入猝灭剂期间不使用任何方式搅拌溶液的系统。将5 mL SPS溶液倒入盛有5 mL MB和FeSO4混合液的烧杯,倒入的瞬间开始计时,一定时间后倒入10 mL甲醇溶液并同时将转速调整为300 r ·min-1以加速终止氧化反应。
磁力搅拌系统:磁力搅拌系统是指从反应开始到反应猝灭始终使用搅拌转子以一定的速度搅拌溶液的系统。与静置系统不同的是,该系统试验期间磁力搅拌转子始终处于转动状态。
声化学微反应器系统:声化学微反应器系统是指反应溶液在三通接头处汇合进入毛细管,并使用超声强化毛细管内部反应溶液混合的反应系统。先使用注射器1吸取5 mL SPS溶液并使用注射器2吸取5 mL MB和FeSO4混合液,再打开注射泵,反应溶液以一定的流速进入并润洗毛细管道。同时开启超声波发生器,将输出功率调整为100%。当注射进度为50%时将毛细管插入装有5 mL甲醇溶液的玻璃瓶中直至注射进度到100%。实验结束后先将毛细管内的液体排出,再吸取去离子水清洗毛细管。清洗结束后,多次吸取空气排出毛细管内剩余的去离子水直至没有明显的水珠被排出。
为了便于比较有超声和无超声条件下MB的降解规律,我们将超声波发生器处于未开启状态的声化学微反应器系统称为毛细管微反应器系统。
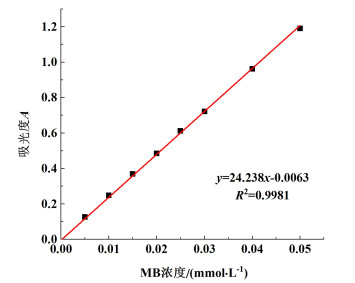
1.4 分析方法MB浓度通过分光光度法确定。配制理论浓度为0.005、0.010、0.015、0.020、0.025、0.030、0.040、0.050 mmol ·L-1的MB溶液,使用紫外可见分光光度计UV1800于最大吸收波长664 nm处测定溶液吸光度并绘制MB标准曲线,如图 4所示。降解效果采用降解率η如式(3)所示:
| $ \eta=\frac{n_0-n_{\mathrm{t}}}{n_0} \times 100 \% $ | (3) |
|
| 图 4 MB溶液标准曲线 Fig.4 Standard curve of MB solution |
| |
式(3)中:n0为降解前MB的物质的量,mmol;nt为降解后MB的物质的量,mmol。
2 结果与讨论 2.1 MB与FeSO4混合液pH值对MB降解率的影响MB与FeSO4混合液pH值对MB降解率的影响如图 5所示,设定FeSO4浓度为1.0 mmol ·L-1,SPS浓度为1.0 mmol ·L-1,毛细管长度为4.3 m,流速为7.16 cm ·s-1,流道结构为半圆波形。

|
| 图 5 MB与FeSO4混合液的pH值对MB降解率的影响 Fig.5 Effect of pH of MB and FeSO4 mixture on MB degradation rate |
| |
调节MB与FeSO4混合液pH值为1、2、3、4、5、6,探究混合液pH值对MB降解率的影响。MB降解率随着MB与FeSO4混合液pH值的增加先升高后降低。当MB与FeSO4混合液pH值为3时MB降解率最高。pH值过低时,Fe2+在水中极易形成[Fe(H2O)6]2+水合物[21],而当pH值逐步升高时,Fe2+易水解形成沉淀[式(4)][22]。当水溶液中可溶性Fe2+减少后,SO4- ·的产率也会降低,导致MB降解率也随之降低。当MB与FeSO4混合液pH值从1增加至6,声化学微反应器系统中MB的降解效果均优于其他3种反应系统。当MB与FeSO4混合液pH值为3时声化学微反应器系统中MB降解率为73.87%,比毛细管微反应器系统、磁力搅拌反应系统、静置反应系统分别高出2.31%、5.29%、7.45%。可以看出声化学微反应器系统和毛细管微反应器系统能够更为有效降解MB的原因在于MB与FeSO4混合液与SPS溶液被连续均匀地泵入微流道,提升了Fe2+的利用率。当流体在毛细管内流动时主要受黏性力影响而呈层流状态。而在超声作用下,高速振动的液体带动毛细管快速振动,强化了毛细管内流体的混合。因此,声化学微反应器系统在降解MB时有更好的效果。
| $ \mathrm{Fe}^{2+}+\mathrm{H}_2 \mathrm{O} \longrightarrow \mathrm{Fe}(\mathrm{OH})^{+}+\mathrm{H}^{+} $ | (4) |
FeSO4浓度对MB降解率的影响如图 6所示,设定SPS浓度为1.0 mmol ·L-1,MB与FeSO4混合液pH值为3,毛细管长度为4.3 m,流速为7.16 cm ·s-1,流道结构为半圆波形。

|
| 图 6 FeSO4浓度对MB降解率的影响 Fig.6 Effect of FeSO4 concentration on MB degradation rate |
| |
调节FeSO4浓度为0.2、0.6、1.0、1.4、1.8、3.0、5.0 mmol ·L-1,探究FeSO4浓度对MB降解率的影响。从图 6可以看出MB降解率随着FeSO4的增加先升高后降低。当FeSO4浓度从0.2 mmol ·L-1增加到1.4 mmol ·L-1,可活化SPS的Fe2+增多,MB降解率逐渐上升。当FeSO4浓度从1.4 mmol ·L-1增加到5.0 mmol ·L-1时,MB降解率下降,这是因为溶液中过量的Fe2+与SO4- ·产生反应消耗了部分SO4- ·[式(5)][23],从而降低了MB的降解率。当FeSO4浓度为1.4 mmol ·L-1时,声化学微反应器系统中MB降解率为75.51%,比毛细管微反应器系统、磁力搅拌系统、静置系统分别高出1.50%、5.39%和8.53%。声化学微反应器系统仍具有明显优势的原因可能是溶液添加方式与超声的共同作用。磁力搅拌系统和静置系统溶液的添加方式为向MB与FeSO4混合液中一次添加等量的SPS溶液。而声化学微反应器中溶液的添加方式为MB与FeSO4混合液和SPS溶液同时均匀地泵入毛细管,这样可以保证不会出现局部浓度过高而对MB有效降解产生影响。声化学微反应器中微流道和超声振子引起的振动均能强化管道内溶液混合。
| $ \mathrm{Fe}^{2+}+\mathrm{SO}_4{ }^{-} \cdot \longrightarrow \mathrm{Fe}^{3+}+\mathrm{SO}_4{ }^{2-} $ | (5) |
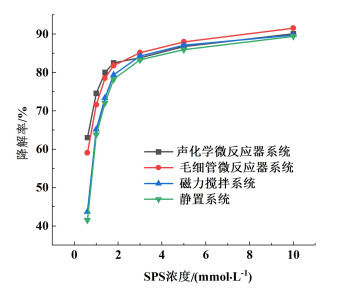
SPS浓度对MB降解率的影响如图 7所示,设定FeSO4浓度为1.4 mmol ·L-1,MB与FeSO4混合液pH值为3,毛细管长度为4.3 m,流速为7.16 cm ·s-1,流道结构为半圆波形。
|
| 图 7 SPS浓度对MB降解率的影响 Fig.7 Effect of SPS concentration on MB degradation rate |
| |
调节SPS浓度为0.6、1.0、1.4、1.8、3.0、5.0、10.0 mmol ·L-1,探究SPS浓度对MB降解率的影响。可以看出,在4种反应系统中,随着SPS浓度的增加,MB降解率先快速升高后趋于平缓。当SPS浓度从0.6 mmol ·L-1增加到1.8 mmol ·L-1时,SO4- ·的产量也随之增加,MB降解率快速上升。继续增加SPS浓度,MB降解率提升较为缓慢。提升SPS浓度虽然有益于MB降解,但添加过量的SPS并不会对MB降解产生明显的帮助。这是因为SPS过量时,SO4- ·的产率过快,不仅SO4- ·相互猝灭,而且过量的S2O82-也会与SO4- ·产生反应[式(6)~式(7)][24]。当SPS浓度为1.8 mmol ·L-1时,声化学微反应器系统中MB降解率为82.46%,比毛细管微反应器系统、磁力搅拌系统、静置系统分别高出0.66%、3.14%和4.29%;当过硫酸钠浓度为3.0~10.0 mmol ·L-1,声化学微反应器系统中MB降解率始终比毛细管微反应器系统低,与磁力搅拌系统和静置系统中MB降解率相差保持在1%以内。SPS浓度过高时声化学微反应器系统降解MB的性能反而变差,原因可能是氧化剂浓度过高时,MB会在超声的作用下开始聚集,阻碍了MB的降解[25, 26]。
| $ \mathrm{SO}_4^{-} \cdot+\mathrm{SO}_4^{-} \cdot \longrightarrow 2 \mathrm{SO}_4^{2-} $ | (6) |
| $ \mathrm{S}_2 \mathrm{O}_8^{2-}+\mathrm{SO}_4^{-}· \rightarrow \mathrm{SO}_4^{2-}+\mathrm{S}_2 \mathrm{O}_8^{-}· $ | (7) |
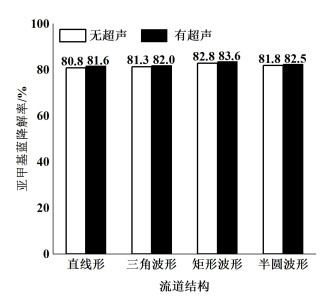
流道结构对MB降解率的影响如图 8所示,设定FeSO4浓度为1.4 mmol ·L-1,SPS浓度为1.8 mmol ·L-1,MB和FeSO4混合液的pH值为3,流速为7.16 cm ·s-1。
|
| 图 8 流道结构对MB降解率的影响 Fig.8 Effect of channel structure on MB degradation rate |
| |
流道结构调整为直线形、三角波形、矩形波形和半圆波形,毛细管长度均为4.3 m,探究流道结构MB降解率的影响。由于低雷诺数下微流道内的流体混合效果差,因此常通过变换微流道结构来改变流体流动方向的方式提高混合效果,即通过微流道结构周期性的变化引起流体流动方向的不断改变,形成局部的二次流与湍流,增强流体扰动。直线形流道结构的降解效果最差,这是因为汇入毛细管内的MB与FeSO4混合液和SPS溶液主要以分子扩散的方式进行混合,混合效果差,影响降解效率。当改变流道结构后,溶液在三角波形、半圆波形、矩形波形流道中混合效果相较于直线形均得到提升,流体在微流道拐角结构处(三角波形尖角处、半圆波形圆弧处、矩形波形顶点处)不断受到挤压、冲击、阻挡,引起流体流动方向的发生变化,从而形成更多的二次流,增强了流体扰动与对流扩散作用[27],提升了溶液混合效果,因此3种微流道结构中MB的降解效果均有提升,其中又由于在矩形波形流道中,流体流动方向变化的角度最大,次数最多,因此矩形波形微流道的降解效果最好。相较于无超声条件,在有超声作用时MB降解率有较小的提升,这主要得益于超声振子引起的振动引入液体流动和涡流,强化了流道内溶液的混合。
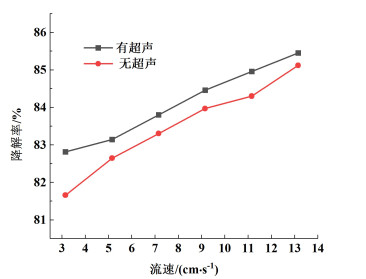
2.5 流速对MB降解率的影响流速对MB降解率的影响如图 9所示,设定FeSO4浓度为1.4 mmol ·L-1,SPS浓度为1.8 mmol ·L-1,MB和FeSO4混合液的pH值为3,流道结构为矩形波形。
|
| 图 9 流速对MB降解率的影响 Fig.9 Effect of flow rate of solution on MB degradation rate |
| |
通过改变毛细管长度的方式保证不同流速下溶液在管道内的停留时间一致。改变3种溶液混合后的流速,使其分别为3.16、5.16、7.16、9.16、11.16、13.16 cm ·s-1,对应毛细管长度分别为1.9、3.1、4.3、5.5、6.7、7.9 m,探究流速对MB降解率的影响。由图 9可以看出,流速越大,MB降解率越高,并且MB降解率基本上呈线性趋势升高。由于注射泵的流速越大,毛细管内液体流速增加,雷诺数增大[28]。微流道内浓度的变化主要在流体流过流道的拐角结构时发生。当流体经过拐角结构后,流体流线发生周期性的拉伸、折叠,且相交处出现回流现象。随着雷诺数的增大,流体初始能量增加,在微流道拐角结构处,流体受到更强的阻挡、冲击等干扰作用,更易于产生二次流及涡旋等流动现象[29],部分流体流动状态由稳定的层流变为无序的湍流,增强了流体在各个方向上的扰动,强化了流体的混合过程,使得MB和FeSO4混合液与SPS溶液混合地更加充分,有利于氧化降解反应的进行。相比于无超声条件,毛细管内的反应溶液在超声作用下被进一步混合,从而MB降解率也在提高,当流速为13.16 cm ·s-1时,MB降解率可达85.45%。
3 结论(1) MB降解率受MB与FeSO4混合液pH值、FeSO4浓度和SPS浓度的影响较为显著。当MB与FeSO4混合液pH值为3,FeSO4浓度为1.4 mmol ·L-1,SPS控制为1.8 mmol ·L-1时,在静置系统、磁力搅拌系统、毛细管微反应器系统和声化学微反应器系统中MB降解效果均为最好。
(2) 相比于直线形、三角波形和半圆波形流道结构,矩形波形流道结构更有利于溶液的混合。
(3) 当SPS浓度过高时,亚甲基蓝在超声作用下容易发生聚集,不利于亚甲基蓝的降解。
(4) 当反应溶液在毛细管内的停留时间相同时,大流速时有利于反应溶液的高效混合。
| [1] |
BENKHAYA S, M'RABET S, EL HARFI A. Classifications, properties, recent synthesis and applications of azo dyes[J]. Heliyon, 2020. DOI:10.1016/j.heliyon.2020.e03271 |
| [2] |
ALSANTALI R I, RAJA Q A, ALZAHRANI A Y A, et al. Miscellaneous azo dyes: A comprehensive review on recent advancements in biological and industrial applications[J]. Dyes and Pigments, 2022. DOI:10.1016/j.dyepig.2021.110050 |
| [3] |
CAI M, SU J, LIAN G, et al. Sono-advanced Fenton decolorization of azo dye Orange G: Analysis of synergistic effect and mechanisms[J]. Ultrasonics Sonochemistry, 2016, 31: 193-200. DOI:10.1016/j.ultsonch.2015.12.017 |
| [4] |
KODAVATIGANTI S, BHAT A P, GOGATE P R. Intensified degradation of Acid Violet 7 dye using ultrasound combined with hydrogen peroxide, Fenton, and persulfate[J]. Separation and Purification Technology, 2021. DOI:10.1016/j.seppur.2021.119673 |
| [5] |
LIN X, MA Y, WAN J, et al. Efficient degradation of Orange G with persulfate activated by recyclable FeMoO4[J]. Chemosphere, 2019, 214: 642-650. DOI:10.1016/j.chemosphere.2018.09.124 |
| [6] |
DAILIN D J, NORDIN N Z, TAN L, et al. State of the art bioremediation of textile dye in wastewater: A Review[J]. Bioscience Research, 2022, 19(2): 914-924. |
| [7] |
NIU C, WANG Y, ZHANG X, et al. Decolorization of an azo dye Orange G in microbial fuel cells using Fe(Ⅱ)-EDTA catalyzed persulfate[J]. Bioresource Technology, 2012, 126: 101-106. DOI:10.1016/j.biortech.2012.09.001 |
| [8] |
蔺艺莹, 宋宝东. Fe(Ⅱ)/亚硫酸盐体系活化溶解氧降解苯胺[J]. 化学工业与工程, 2020, 37(4): 1-6. LIN Yiying, SONG Baodong. Degradation of aniline by dissolved oxygen catalyzed by Fe (Ⅱ)/sulfite system[J]. Chemical Industry and Engineering, 2020, 37(4): 1-6. DOI:10.13353/j.issn.1004.9533.20200107 (in Chinese) |
| [9] |
LIU N, DING F, WENG C, et al. Effective degradation of primary color direct azo dyes using Fe0 aggregates-activated persulfate process[J]. Journal of Environmental Management, 2018, 206: 565-576. |
| [10] |
ZHU J, LIN Y, ZHANG T, et al. Modelling of iohexol degradation in a Fe(Ⅱ)-activated persulfate system[J]. Chemical Engineering Journal, 2019, 367: 86-93. DOI:10.1016/j.cej.2019.02.120 |
| [11] |
KHAN J A, HE X, SHAH N, et al. Kinetic and mechanism investigation on the photochemical degradation of atrazine with activated H2O2, S2O82- and HSO5-[J]. Chemical Engineering Journal, 2014, 252: 393-403. DOI:10.1016/j.cej.2014.04.104 |
| [12] |
ZHANG Y, ZHANG J, XIAO Y, et al. Kinetic and mechanistic investigation of azathioprine degradation in water by UV, UV/H2O2 and UV/persulfate[J]. Chemical Engineering Journal, 2016, 302: 526-534. DOI:10.1016/j.cej.2016.05.085 |
| [13] |
TIAN K, HU L, LI L, et al. Recent advances in persulfate-based advanced oxidation processes for organic wastewater treatment[J]. Chinese Chemical Letters, 2022, 33(10): 4461-4477. DOI:10.1016/j.cclet.2021.12.042 |
| [14] |
YAN Z, GU Y, WANG X, et al. Degradation of aniline by ferrous ions activated persulfate: Impacts, mechanisms, and by-products[J]. Chemosphere, 2021. DOI:10.1016/j.chemosphere.2020.129237 |
| [15] |
董正亚, 陈光文, 赵帅南, 等. 声化学微反应器: 超声和微反应器协同强化[J]. 化工学报, 2018, 69(1): 102-115. DONG Zhengya, CHEN Guangwen, ZHAO Shuainan, et al. Sonochemical microreactor—Synergistic intensification of ultrasound and microreactor[J]. CIESC Journal, 2018, 69(1): 102-115. (in Chinese) |
| [16] |
BAYAREH M, ASHANI M N, USEFIAN A. Active and passive micromixers: A comprehensive review[J]. Chemical Engineering and Processing-Process Intensification, 2020, 10. DOI:10.1016/j.cep.2019.107771 |
| [17] |
DONG Z, YAO C, ZHANG X, et al. A high-power ultrasonic microreactor and its application in gas-liquid mass transfer intensification[J]. Lab on a Chip, 2015, 15(4): 1145-1152. DOI:10.1039/C4LC01431F |
| [18] |
ZHAO S, YAO C, DONG Z, et al. Role of ultrasonic oscillation in chemical processes in microreactors: A mesoscale issue[J]. Particuology, 2020, 48: 88-99. DOI:10.1016/j.partic.2018.08.009 |
| [19] |
THANGAVADIVEL K, KONAGAYA M, OKITSU K, et al. Ultrasound-assisted degradation of methyl orange in a micro reactor[J]. Journal of Environmental Chemical Engineering, 2014, 2(3): 1841-1845. DOI:10.1016/j.jece.2014.08.004 |
| [20] |
RAYAROTH M P, ARAVINDAKUMAR C T, SHAH N S, et al. Advanced oxidation processes (AOPs) based wastewater treatment-unexpected nitration side reactions-a serious environmental issue: A review[J]. Chemical Engineering Journal, 2022. DOI:10.1016/j.cej.2021.133002 |
| [21] |
XU X, ZHAO Z, LI X, et al. Chemical oxidative degradation of methyl tert-butyl ether in aqueous solution by Fenton's reagent[J]. Chemosphere, 2004, 55(1): 73-79. DOI:10.1016/j.chemosphere.2003.11.017 |
| [22] |
XU X, LI X. Degradation of azo dye Orange G in aqueous solutions by persulfate with ferrous ion[J]. Separation and Purification Technology, 2010, 72(1): 105-111. DOI:10.1016/j.seppur.2010.01.012 |
| [23] |
HAN D, WAN J, MA Y, et al. New insights into the role of organic chelating agents in Fe(Ⅱ) activated persulfate processes[J]. Chemical Engineering Journal, 2015, 269: 425-433. DOI:10.1016/j.cej.2015.01.106 |
| [24] |
SHANG W, DONG Z, LI M, et al. Degradation of diatrizoate in water by Fe(Ⅱ)-activated persulfate oxidation[J]. Chemical Engineering Journal, 2019, 361: 1333-1344. DOI:10.1016/j.cej.2018.12.139 |
| [25] |
陈昱冉. 超声驻波场中疏水颗粒稳态声团聚机理[D]. 江苏徐州: 中国矿业大学, 2020 CHEN Yuran. The mechanism of the stable acoustic aggregation of hydrophobic particles in ultrasonics standing waves field[D]. Jiangsu Xuzhou: China University of Mining and Technology, 2020 (in Chinese) |
| [26] |
王凯, 齐广宇, 蒋章妹, 等. 亚甲基蓝溶液中分子二聚现象的压致增强研究[J]. 高等学校化学学报, 2014, 35(11): 2431-2434. WANG Kai, QI Guangyu, JIANG Zhangmei, et al. High pressure-enhanced dimeric aggregation in methylene blue solution†[J]. Chemical Journal of Chinese Universities, 2014, 35(11): 2431-2434. (in Chinese) |
| [27] |
刘赵淼, 赵晟, 王文凯, 等. 几何构型对平面混沌式微混合器混合性能的影响[J]. 分析化学, 2019, 47(9): 1321-1331. LIU Zhaomiao, ZHAO Sheng, WANG Wenkai, et al. Influence of geometric configuration on mixing performance of planar chaotic micro-mixer[J]. Chinese Journal of Analytical Chemistry, 2019, 47(9): 1321-1331. (in Chinese) |
| [28] |
梁洁. 基于波形微混合器的黄芩素电化学检测技术研究[D]. 江苏无锡: 江南大学, 2021 LIANG Jie. Research on electrochemical detection technology based on wavy micromixers for the determination of baicalein[D]. Jiangsu Wuxi: Jiangnan University, 2021 (in Chinese) |
| [29] |
谢耀聪. 基于微流控芯片和电化学技术的茶多酚检测方法研究[D]. 江苏无锡: 江南大学, 2020 XIE Yaocong. Research on the detection method of tea polyphenols based on microfluidic chip and electrochemical technology[D]. Jiangsu Wuxi: Jiangnan University, 2020 (in Chinese) |
 2022, Vol. 39
2022, Vol. 39





