2. 枣庄学院化学化工与材料科学学院, 山东 枣庄 277160
2. College of Chemistry Chemical Engineering and Materials Science, Zaozhuang University, Shandong Zaozhuang 277160, China
利用分子间相互作用,构筑基元能够组装形成多种新材料[1],盘状液晶材料就属于这样一类自组装体系[2]。Chandrasekha等[3]在1977年首次发现带有增溶侧链的π共轭分子苯六酚-1, 2, 3, 4, 5, 6-六戊酸酯可以组装形成热致柱状液晶相[4]。近年来,在Ringsdorf等[5]关于具有光导性质的苯并菲类液晶材料等工作的推动下,研究人员对此类液晶材料进行了深入的研究,并报道了大量具有柱状液晶相的功能分子。这些分子大多由盘状的刚性π共轭核心结构和周边的柔性侧链,如烷基链等构成。在液晶相中,分子的刚性共轭核心通过π-π堆积作用自组装成柱状结构并被无序的侧链所分隔[6]。基于卟啉[7]、酞菁[8]、苯并菲[9, 10]、苝二酰亚胺[11]和六苯并蔻[12]等化合物的盘状液晶性质已被广泛研究。2017年Würthner等[13]报道了一种含有氢键的苝二酰亚胺分子,该分子通过氢键和π-π堆积作用自组装成一维J-聚集体,随后J-聚集体又自组装成六方柱状液晶相。此类液晶材料由于相邻分子间存在较大的π轨道作用,能够使电荷或激子沿柱状结构的轴向快速迁移,从而具有较好的光电性质,可用于有机光伏器件和场效应晶体管等领域[14, 17]。
近年来,氮杂氟硼二吡咯(Aza-BODIPY)类功能染料由于其在近红外区具有光吸收和发射特性,已被广泛应用于荧光探针[18, 19]、传感器[20, 21]和细胞成像[22, 23]。尽管Aza-BODIPY染料近年来备受关注,但是基于此类染料的液晶性质仍未见报道。本研究设计合成了一种带有疏水扇结构的Aza-BODIPY染料1,差示扫描量热法(DSC)、偏光显微镜(POM)和小角X射线衍射(SAXD)证实了该分子能自组装形成柱状液晶相。
1 实验部分 1.1 材料与方法实验中使用的化学品和试剂均来自天津大学化学品管理平台,有机溶剂(分析纯或色谱纯)来自天津江天化学试剂有限公司,其中部分溶剂需要经预处理后使用,柱层析法所用的硅胶均为300~400目,文中涉及的柱层析方法均为常压柱层析法。液晶薄膜制备:取2.00 mg染料1固体样品于石英片上,再加盖一块石英片于上方,然后将其置于热台上加热至液态(230 ℃),再缓慢冷却(5 ℃ ·min-1)至室温用于测试。
研究中使用Bruker AVANCE III HD(400 MHz)核磁共振波谱仪进行1H NMR和13C NMR测试,以四甲基硅烷作为内标。质谱使用布鲁克道尔顿公司的Autoflex tof/tof III型质谱仪进行测试。紫外-可见光谱测试采用可控温式的Agilent Varian Cary 300型紫外-可见分光光度计。荧光发射光谱采用Edinburgh Instruments FLS 980稳态/瞬态荧光光谱仪进行测试,荧光光谱进行了校正。荧光量子产率通过相对法测试,以锌酞菁(N, N-二甲基甲酰胺中,Φ=0.3)为标准物。使用瑞士PerkinElmer公司的DSC Q8000量热仪进行差示扫描量热(DSC)测试。以装有Linkam THMS 600热台和温度控制器的Olympus BX-51偏光显微镜进行观测,获得了2个正交偏振片下液晶相的光学织构。小角X射线衍射测试使用了日本理学的Smartlab衍射仪(Cu_Kα)。
1.2 合成路线如图 2所示,以化合物6为起始原料制备了具有3条十二烷基疏水链的前体化合物2。研究中首先将6与C12H25Br通过亲核取代反应合成有十二烷基疏水链的化合物5,化合物5通过KOH水解并酸化,得到化合物4,之后化合物4在二氯亚砜作用下生成酰氯3,酰氯3与3-叠氮-1-丙胺在三乙胺条件下反应得到化合物2。最后化合物2与化合物7 [18]在碘化亚铜作用下通过“click”反应得到目标化合物Aza-BODIPY染料1。具体实验方法及化合物表征如下。
|
| 图 1 Aza-BODIPY 1的合成路线、反应试剂和条件: (a) C12H25Br,K2CO3, DMF, 80 ℃, 12 h, 98%(质量分数,下同); (b) KOH, V(THF) ∶V(H2O)=1 ∶1, 75 ℃, 95%; (c) 无水DCM, SOCl2, N2保护, rt, 4 h, 78%; (d) C2H5)3N, CH2Cl2, rt, 12 h, 3-叠氮-1-丙胺, 68%; (e) V(DCM) ∶V(CH3CN)=1 ∶1, CuI, DIEA, 50 ℃, 5 h, 40% Fig.1 The synthetic route for Aza-BODIPY 1, reagents and conditions: (a) C12H25Br, K2CO3, DMF, 80 ℃, 12 h, 98%; (b) KOH, V(THF) ∶V(H2O)=1 ∶1, 75 ℃, 95%; (c) Anhydrous CH2Cl2, SOCl2, N2 protection, rt, 4 h, 78%; (d) C2H5)3N, CH2Cl2, rt, 12 h, 3-azidobutane-1-amine, 68%; (e) V(DCM) ∶V(CH3CN)=1 ∶1, CuI, DIEA, 50 ℃, 5 h, 40% |
| |

|
| 图 2 (a) 染料化合物1在二氯甲烷溶液中(cT=1.0×10-6 mol ·L-1)的紫外-可见吸收光谱(黑色)及荧光光谱(红色);(b)染料化合物1的荧光衰减曲线 Fig.2 (a) UV/Vis absorption spectra (black) of compounds 1 and fluorescence spectra (red) in CH2Cl2 at a concentration of 1.0×10-6 mol ·L-1; (b) Fluorescence decay of dye 1 |
| |
化合物3 ~ 5均利用文献中报道的方法合成[24],所得产物的核磁共振氢谱与文献中给出的数据一致。
化合物5:1H NMR (400 MHz, CDCl3) δ 7.25 (s, 2H), 4.01 (td, J=6.5 Hz, 2.1 Hz, 6H), 3.89 (s, 3H), 1.81 (s, 6H), 1.47 (s, 6H), 1.28 (d, J=15.0 Hz, 54H), 0.88 (t, J =6.8 Hz, 9H)。
化合物4:1H NMR (400 MHz, CDCl3) δ 7.32 (s, 2H), 4.02 (t, J=6.8 Hz, 6H), 1.91~1.68 (m, 6H), 1.54~1.42 (m, 6H), 1.28 (d, J =14.1 Hz, 54H), 0.88 (t, J=6.8 Hz, 9H)。
化合物3:1H NMR (400 MHz, CDCl3) δ 7.32 (s, 2H), 4.02 (t, J=6.7 Hz, 6H), 1.82 (s, 6H), 1.55~1.42 (m, 6H), 1.26 (s, 54H), 0.88 (t, J =6.8 Hz, 9H)。
化合物2:在冰浴条件下,将3-叠氮-1-丙胺(0.50 g, 4.38 mmol)和三乙胺(0.59 g, 5.84 mmol)溶于二氯甲烷(20 mL),再将化合物3 (3.0 g, 4.38 mmol)的二氯甲烷(10 mL)溶液逐滴加到冰浴体系中,恢复至室温反应12 h。用TLC监测反应完毕,用二氯甲烷萃取,加水洗涤3次,有机层加入无水硫酸镁干燥,抽滤,浓缩,浓缩液使用洗脱剂V(石油醚) ∶V(乙酸乙酯)=10 ∶1进行柱色谱分离纯化,得到白色粉末的固体产物2 (2.30 g, 68%)。1H NMR (400 MHz, CDCl3) δ 6.97 (s, 2H), 6.66~6.53 (m, 1H), 3.96 (t, J=6.1 Hz, 6H), 3.50 (d, J=6.1 Hz, 2H), 3.42 (t, J=6.4 Hz, 2H), 1.89 (dd, J=13.0, 6.4 Hz, 2H), 1.83~1.69 (m, 6H), 1.52~1.40 (m, 6H), 1.26 (s, 48H), 0.88 (t, J=6.5 Hz, 9H).13C NMR (101 MHz, CDCl3) δ 167.58, 153.10, 141.19, 129.29, 105.63, 73.49, 69.31, 49.62, 37.87, 31.94, 30.33, 29.75, 29.74, 29.72, 29.67, 29.66, 29.60, 29.42, 29.38, 28.80, 26.10, 22.70, 14.10。
化合物1:在100 mL的圆底烧瓶中加入7(341 mg, 0.35 mmol),用二氯甲烷和乙腈的混合溶剂(体积比为1 ∶1)40 mL溶解,称取化合物2(780 mg, 1.05 mmol)加入体系中,再加入碘化亚铜(267 mg, 1.4 mmol)和N, N-二异丙基乙胺(DIEA)(400 mg, 3.5 mmol),50 ℃下回流5 h。用TLC监测反应结束后,旋蒸除去体系中的溶剂,浓缩液通过柱色谱分离纯化,洗脱剂为V(甲醇) ∶V(二氯甲烷)=1 ∶40,浓缩后用二氯甲烷和甲醇重结晶,最终得到蓝黑色固体1 (352 mg, 40%)。1H NMR (400 MHz, CDCl3) δ 8.02 (dd, J=16.3, 8.7 Hz, 8H), 7.73 (s, 2H), 7.04 (d, J=8.7 Hz, 4H), 6.98 (d, J=8.7 Hz, 4H), 6.94 (s, 4H), 6.89 (s, 2H), 6.58 (t, J=5.8 Hz, 2H), 5.28 (s, 4H), 4.48 (t, J=6.3 Hz, 4H), 4.04 (d, J=6.6 Hz, 4H), 3.97 (t, J=6.4 Hz, 12H), 3.42 (d, J=6.0 Hz, 4H), 2.30~2.15 (m, 4H), 1.92~1.67 (m, 16H), 1.26 (d, J=9.5 Hz, 144H), 0.87 (t, J=5.5 Hz, 24H)。13C NMR (101 MHz, CDCl3) δ 167.74, 160.46, 160.15, 153.12, 144.02, 131.42, 130.78, 128.97, 123.32, 114.94, 114.68, 105.63, 73.52, 69.35, 68.22, 62.06, 48.06, 37.14, 31.94, 30.35, 29.76, 29.72, 29.68, 29.62, 29.45, 29.40, 29.38, 26.11, 22.69, 14.11。MS MALDI-TOF):calculated for C154H242BF2N11O12, [M+Na]+=2509.872 m/z, found 2510.597 m/z, [M+K]+=2525.872 m/z, found 2526.583 m/z。
2 结果与讨论 2.1 Aza-BODIPY染料1在二氯甲烷溶液中的光谱性质图 2(a)为Aza-BODIPY化合物1在二氯甲烷中的紫外-可见吸收光谱及其荧光发射光谱。在紫外-可见吸收光谱中可以观测到化合物1在600~700 nm范围内分布的S0-S1吸收带,化合物1的最大吸收波长为693 nm,摩尔吸收系数为1.40×105 L ·mol-1 ·cm-1,荧光发射光谱与紫外/可见吸收光谱呈镜像关系,其最大发射波长为724 nm,Stokes位移是31 nm。时间分辨荧光光谱的测试结果如图 2b所示,荧光衰减曲线符合双指数衰减拟合,其中短寿命为2.25 ns,权重为93.15%,该寿命值与文献中已报道的Aza-BODIPY染料的荧光寿命一致[23]。另外,还观察到了11.96 ns的长寿命组分,其权重为6.85%,我们推测此组分可能源自染料1在激发过程中形成的激基缔合物等物种,一般此类物种具有较长的激发态寿命[25]。通过加权平均可得染料1在二氯甲烷中的荧光寿命为2.92 ns。通过相对法测得1的量子产率为0.36。
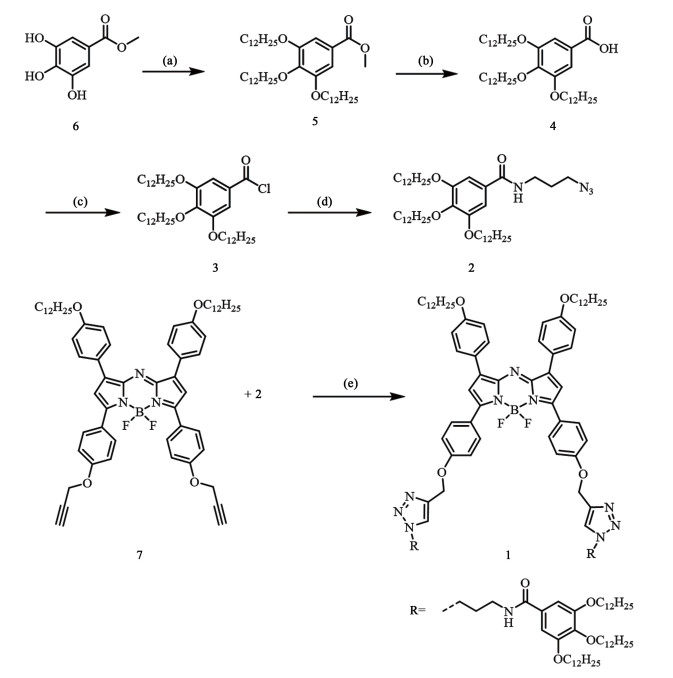
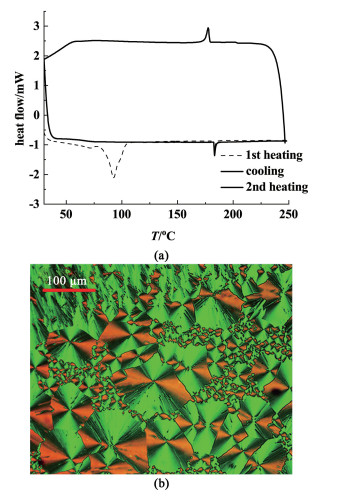
2.2 Aza-BODIPY染料1的液晶性质染料1的DSC曲线如图 3(a)所示,第1次加热过程中,在92.7 ℃有1个ΔH为42.37 J ·g-1的吸热峰,继续加热到183 ℃,出现第2个吸热峰,所对应的ΔH为2.13 J ·g-1。第1次冷却过程中,仅在177.5 ℃出现1个ΔH为1.84 J ·g-1的放热峰,直至降到室温。第2次加热过程中也仅在183 ℃出现1个吸热峰,ΔH为2.00 J ·g-1。结合这些相变过程以及相变过程ΔH值,我们推测,在92.7 ℃的大焓变吸热峰对应的相变过程为固体转化为液晶相,180 ℃左右的吸热及放热峰为液晶相与液相之间的转变。同样地,在冷却过程中,没有液晶相转变为固体的重结晶过程发生,表明液晶相向固体的转变过程为动力学控制。在偏光显微镜下,Aza-BODIPY染料1的液晶相呈现典型的扇形织构[图 3(b)]。
|
| 图 3 (a) Aza-BODIPY染料1的DSC曲线;(b)从各向同性相冷却样品得到Aza-BODIPY染料1在2个正交偏振器之间的光学织构 Fig.3 (a) Differential scanning calorimetry profile of Aza-BODIPY 1; (b) optical texture of dye 1 between two crossed polarizers obtained by cooling the sample from isotropic phase |
| |
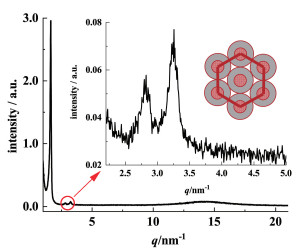
将样品从220 ℃冷却到室温后,进行了小角X射线衍射的测试。衍射图谱显示(图 4),在小角区可观察到3个布拉格衍射峰,其中在q1=1.63 nm-1时出现了1个高强度的尖锐衍射峰,所对应的d1=3.86 nm,此外,在q2=2.82 nm-1及q3=3.26 nm-1时观测到2个较弱的衍射峰,分别对应d2=2.21 nm及d3=1.93 nm,且
|
| (中间的小圆部分代表染料分子刚性的共轭结构,外面灰色填充部分表示两端的烷基链) 图 4 从220 ℃冷却至室温的Aza-BODIPY染料1的X射线衍射图;插图:六方柱状液晶结构的示意图 Fig.4 X-ray diffraction pattern for a sample of Aza-BODIPY 1 cooling from 220 ℃ to RT; Inset: Schematic representation of the structure of the hexagonal columnar LC phase(the small circle in the middle representing the rigid π-conjugated core, the outer gray filling indicating the hydrocarbon chains at both ends) |
| |
为了进一步探究染料1所形成液晶相的结构及其应用,我们对液晶薄膜的吸收和发射光谱性质进行了测试。如图 5所示,液晶薄膜在600~800 nm的波长范围内有1个较宽的吸收峰,其最大吸收位于726 nm,相比染料1在二氯甲烷溶液中单体的吸收光谱红移了33 nm,这表明染料分子通过自组装成J-聚集体的结构而进一步形成柱状液晶。同时,液晶薄膜的荧光发射光谱相比染料1的单体分子也发生显著红移,其最大发射波长为801 nm,Stokes位移是75 nm。因此,染料1可作为近红外发光液晶材料。此外,由盘状分子通过π-π有序堆积形成的柱状相液晶通常具有较好的电荷载流子传输性质[26, 27],因而我们推测染料1在有机光电器件领域具有一定的应用潜力。

|
| 图 5 Aza-BODIPY染料1液晶薄膜的紫外-可见吸收光谱(黑色)与荧光发射光谱(红色) Fig.5 UV/Vis absorption spectra (black) and fluorescence emission spectra (red) of Aza-BODIPY dye 1 in liquid crystal film |
| |
利用“click”反应成功合成了一个具有疏水扇单元的Aza-BODIPY染料1。该分子在溶液中具有近红外吸收和发光性质。DSC测试表明,染料1在加热或冷却过程中具有固相-液晶相以及液晶相-液相的相转变,在偏光显微镜下可以观察到其液晶相的扇形织构。小角X射线衍射的研究证实了Aza-BODIPY染料1具有液晶性质,且液晶相为六方柱状液晶结构。染料1的液晶薄膜具有近红外吸收和发光性质,与单体分子相比,液晶薄膜的吸收和发射光谱发生显著红移,表明分子在液晶相中形成了J-聚集体结构。该研究对基于Aza-BODIPY类染料的盘状液晶的分子设计具有一定的启发意义。
| [1] |
WHITESIDES G M, GRZYBOWSKI B. Self-assembly at all scales[J]. Science, 2002, 295(5564): 2418-2421. DOI:10.1126/science.1070821 |
| [2] |
CHANDRASEKHAR S, PRASAD S K. Recent develop-ments in discotic liquid crystals[J]. Contemporary Physics, 1999, 40(4): 237-2345. DOI:10.1080/001075199181431 |
| [3] |
CHANDRASEKHAR S, SADASHIVA B, SURESH K. Liquid crystals of disc-like molecules[J]. Pramana, 1977, 9(5): 471-480. DOI:10.1007/BF02846252 |
| [4] |
(a) TSCHIERSKE C. Non-conventional liquid crystals-the importance of micro-segregation for self-organisation[J]. Journal of Materials Chemistry, 1998, 8(7): 1485-1508. (b) O'NEILL M, KELLY S M. Liquid crystals for charge transport, luminescence and photonics[J]. Advanced Mate-rials, 2003, 15(14): 1135-1146
|
| [5] |
ADAM D, SCHUHMACHER P, SIMMERER J, et al. Fast photoconduction in the highly ordered columnar phase of a discotic liquid crystal[J]. Nature, 1994, 371(6493): 141-143. DOI:10.1038/371141a0 |
| [6] |
BUSHEY M L, NGUYEN T Q, ZHANG W, et al. Using hydrogen bonds to direct the assembly of crowded aromat-ics[J]. Angewandte Chemie International Edition, 2004, 43(41): 5446-5453. DOI:10.1002/anie.200301678 |
| [7] |
(a) SHEARMAN G C, YAHIOGLU G, KIRSTEIN J, et al. Synthesis and phase behaviour of beta-octaalkyl porphyrins[J]. Journal of Materials Chemistry, 2009, 19(5): 598-604. (b) SEGADE A, LOPEZ-CALAHORRA F, VELASCO D. Multiple interactions in the self-association of porphyrin discotic mesogens[J]. Journal of Physical Chemistry B, 2008, 112(25): 7395-7402
|
| [8] |
(a) VAN NOSTRUM C F, PICKEN S J, SCHOUTEN A J, et al. Synthesis and supramolecular chemistry of novel liq-uid-crystalline crown ether-substituted phthalocyanines- toward molecular wires and molecular ionoelectronics[J]. Journal of the American Chemical Society, 1995, 117(40): 9957-9965. (b) SMOLENYAK P, PETERSON R, NE-BESNY K, et al. Highly ordered thin films of octa substi-tuted phthalocyanines[J]. Journal of the American Chemical Society, 1999, 121(37): 8628-8636
|
| [9] |
KUMAR S. Recent developments in the chemistry of tri-phenylene-based discotic liquid crystals[J]. Liquid Crystals, 2004, 31(8): 1037-1059. DOI:10.1080/02678290410001724746 |
| [10] |
(a) MULLER G R J, MEINERS C, ENKELMANN V, et al. Liquid crystalline perylene-3, 4-dicarboximide derivatives with high thermal and photochemical stability[J]. Journal of Materials Chemistry, 1998, 8(1): 61-64. (b) BALA-KRISHNAN K, DATAR A, NADDO T, et al. Effect of side-chain substituents on self-assembly of perylene diimide molecules: Morphology control[J]. Journal of the American Chemical Society, 2006, 128(22): 7390-7398
|
| [11] |
GÖRL D, SOBERATS B, HERBST S, et al. Perylene bisimide hydrogels and lyotropic liquid crystals with tem-perature-responsive color change[J]. Chemical Science, 2016, 7(11): 6786-6790. DOI:10.1039/C6SC02249A |
| [12] |
WU J, PISULA W, MULLEN K. Graphenes as potential material for electronics[J]. Chemical Reviews, 2007, 107(3): 718-747. DOI:10.1021/cr068010r |
| [13] |
HERBST S, SOBERATS B, LEOWANAWAT P, et al. A columnar liquid-crystal phase formed by hydrogen-bonded perylene bisimide j-aggregates[J]. Angewandte Chemie International Edition, 2017, 56(8): 2162-2165. DOI:10.1002/anie.201612047 |
| [14] |
KUMAR S. Discotic liquid crystals for solar cells[J]. Current Science, 2002, 82(3): 256-257. |
| [15] |
LENG S, WEX B, CHAN L, et al. Phase transitions and structures of novel pyrenes potentially useful in photo-voltaic applications[J]. Journal of Physical Chemistry B, 2009, 113(16): 5403-5411. DOI:10.1021/jp810653z |
| [16] |
SCHMIDT-MENDE L, FECHTENKOTTER A, MUL-LEN K, et al. Self-organized discotic liquid crystals for high-efficiency organic photovoltaics[J]. Science, 2001, 293(5532): 1119-1122. DOI:10.1126/science.293.5532.1119 |
| [17] |
LI J, CHANG J, TAN H, et al. Disc-like 7, 14-dicyano-ovalene-3, 4:10, 11-bis(dicarboximide) as a solution-processible n-type semiconductor for air stable field-effect transistors[J]. Chemical Science, 2012, 3(3): 846-850. DOI:10.1039/C1SC00739D |
| [18] |
CHEN Z, LIU Y, WAGNER W, et al. Near-IR absorbing J-aggregate of an amphiphilic BF2-Azadipyrromethene dye by kinetic cooperative self-assembly[J]. Angewandte Chemie International Edition, 2017, 56(21): 5729-5733. DOI:10.1002/anie.201701788 |
| [19] |
LIU P, GAO F, ZHOU L, et al. Tetrathienyl-functionalized red- and NIR-absorbing BODIPY dyes appending various peripheral substituents[J]. Organic & Biomolecular Chemistry, 2017, 15(6): 1393-1399. |
| [20] |
YANG L, FAN G, REN X, et al. Aqueous self-assembly of a charged BODIPY amphiphile via nucleation-growth mechanism[J]. Physical Chemistry Chemical Physics, 2015, 17(14): 9167-9172. DOI:10.1039/C5CP00207A |
| [21] |
ZHANG Y, LIU P, PAN H, et al. Alignment of supramo-lecular J-aggregates based on uracil-functionalized BOD-IPY dye for polarized photoluminescence[J]. Chemical Communications, 2020, 56(80): 12069-12072. DOI:10.1039/D0CC04929H |
| [22] |
FAN G, LIN Y, YANG L, et al. Co-self-assembled nanoaggregates of BODIPY amphiphiles for dual colour imaging of live cells[J]. Chemical Communications, 2015, 51(62): 12447-12450. DOI:10.1039/C5CC04757A |
| [23] |
ZHU L, XIE W, ZHAO L, et al. Tetraphenylethylene- and fluorene-functionalized near-infrared aza-BODIPY dyes for living cell imaging[J]. Royal Society of Chemistry advances, 2017, 7(88): 55839-55845. |
| [24] |
TAKAHASHI R, NUNOKAWA T, SHIBUYA T, et al. Synthesis and solid-state polymerization of butadiyne derivatives with trialkoxyphenylurethane groups[J]. Bulletin of the Chemical Society of Japan, 2012, 85(2): 236-244. DOI:10.1246/bcsj.20110219 |
| [25] |
ALAMIRY M A, BENNISTON A C, COPLEY G, et al. Intramolecular excimer formation for covalently linked boron dipyrromethene dyes[J]. Journal of Physical Chemistry A, 2011, 115(44): 12111-12119. DOI:10.1021/jp2070419 |
| [26] |
ADAM D, SCHUHMACHER P, SIMMERER J, et al. Fast photo-conduction in the highly ordered columnar phase of a discotic liquid crystal[J]. Nature, 1994, 371(6493): 141-143. DOI:10.1038/371141a0 |
| [27] |
DEHM V, CHEN Z, BAUMEISTER U, et al. Helical growth of semiconducting columnar dye assemblies based on chiral perylene bisimides[J]. Organic Letters, 2007, 9(6): 1085-1088. DOI:10.1021/ol0700963 |
 2022, Vol. 39
2022, Vol. 39





