2. 系统生物工程教育部重点实验室 合成生物学前沿科学中心, 天津 300072
2. Frontier Science Center for Synthetic Biology and Key Laboratory of Systems Bioengineering (Ministry of Education), Tianjin 300072, China
嗜盐微生物(Halophiles)是六大极端微生物的一种[1],其正常的生长需要较高的盐浓度来维持。相比于其他常见底盘微生物,嗜盐菌的高耐盐特性使其在培养过程中不易染菌,可以进行不严格的灭菌发酵[2],下游提取胞内PHB产物时,加入适量清水即可实现细胞破壁,在节约能耗的同时,也简化了发酵工艺。但嗜盐微生物的遗传背景不清晰、基因编辑难度大制约了其发展。自新疆艾丁湖分离纯化得到的嗜盐菌TD01(Halomonas sp.TD01),最适生长温度37 ℃,最适生长盐浓度为60 g·L-1 NaCl,最高可耐受250 g·L-1 NaCl,是1株中度嗜盐菌并可天然生产聚3-羟基丁酸酯(poly-3-hydroxybutyrate,PHB)[3]。CRISPR/Cas9基因编辑系统[4]、组成型启动子库PPorin[5]、诱导型表达系统[6]等基因编辑手段在Halomonas sp.TD01中的成功应用,为其作为下一代工业生物技术的底盘细胞打下坚实基础。
聚羟基脂肪酸酯(Polyhydroxyalkanoates,PHA)是一类由含羟基脂肪酸单体聚合而成的生物大分子聚合物,无毒无害可再生,具有生物相容性、可降解性和良好的物化特性[7],在生物塑料[8]、药物缓释载体、植入性材料[9]等领域拥有广泛前景[10]。聚3-羟基丁酸酯由3-羟基丁酸聚合而成,是结构最简单,研究最清楚的PHA。
乙酸作为一种二元弱酸,不仅常作为生物发酵时产生的副产物,还广泛存在于各种纤维素水解液中[11]。乙酸钠的价格比葡萄糖每吨低150美元左右[12],研究表明,利用廉价的乙酸盐代替葡萄糖进行如异丙醇[13]、乙醇酸[14]等高附加值产品的生产是具有一定潜力的。但高浓度的乙酸根和盐离子会抑制菌体生长,降低产量和产率,因此提高工程菌株对乙酸盐的耐受和利用效率至关重要。
本研究测试发现Halomonas sp.TD1.0具有天然耐受高浓度乙酸钠的优势,并可利用乙酸高效合成PHB。随后我们通过过表达枯草芽孢杆菌来源的乙酰辅酶A合成酶(ACS)进一步提高了菌株的乙酸利用速度和PHB产量,并初步研究了ACS的表达对TD1.0利用葡萄糖和乙酸钠混合碳源进行代谢的影响。
1 实验部分 1.1 菌株和质粒菌株和质粒见表 1。
| 菌种和质粒 | 特征 | 来源 |
| Halomonas sp.TD01 | wild-type | [15] |
| TD1.0 | TD01, MmP1 expression system in chromosome | [15] |
| E.coli DH5α | Plasmid construction | 实验室 |
| E.coli S17-1 | pir, recA, thi-1, pro, hsdR, RP4-2-Tc: : Mu-Km: : Tn7 | 实验室 |
| TD-PN59 | TD1.0, pN59-M-ACS | 本研究 |
| TD-PN85 | TD1.0, pN85-M-ACS | 本研究 |
| pN59-M-ACS | pSEVA341, pRO1600/C-olE1 ori,oriT,CmR,PMmp1,acs | 本研究 |
| pN85-M-ACS | pSEVA321,RK2,oriT,CmR,PMmp1,acs | 本研究 |
LB培养基:5 g·L-1酵母抽提物,10 g·L-1胰蛋白胨,10 g·L-1氯化钠,pH=7.0。需要时额外添30 μg·mL-1相应抗生素。固体培养基添加2%的琼脂。
20LB培养基:LB培养基的基础上把氯化钠浓度提到20 g·L-1。
60LB培养基:LB培养基的基础上把氯化钠浓度提到60 g·L-1,pH值调至9.0。
60MMG发酵培养基:60 g·L-1 NaCl,1 g·L-1酵母抽提物,20 g·L-1葡萄糖或27.3 g·L-1 NaAC,9.85 g·L-1 Na2HPO4·12H2O,1.5 g·L-1 KH2PO4,1 g·L-1 NH4Cl,0.4 g·L-1 MgSO4·7H2O,0.05 g·L-1 Fe(Ⅲ)-NH4-Citrate,0.02 g·L-1 CaCl2·2H2O,0.1 mg·L-1 ZnSO4·7H2O,0.03 mg·L-1 MnCl2·4H2O,0.3 mg·L-1 H3BO3,0.2 mg·L-1 CoCl2·6H2O,0.01 mg·L-1 CuSO4·5H2O,0.02 mg·L-1 NiCl2·6H2O,0.03 mg·L-1 NaMoO4·2H2O。
1.3 引物设计引物设计见表 2。
| 引物名称 | 引物序列 |
| ACS-PN59-M-F | ACTAGAGAAAGAGGAGAAATACTAGATGAACCTGAAAGCCCTGCCTGCCA |
| ACS-PN59-M-R | TCGCCAGGGTTTTCCCAGTCACGACTTAATCTTCCATGGTAGACAGA |
| ACS-PN85-M-F | ACTAGAGAAAGAGGAGAAATACTAGATGAACCTGAAAGCCCTGCCTGCCA |
| ACS-PN85-M-R | TCGCCAGGGTTTTCCCAGTCACGACTTAATCTTCCATGGTAGACAGA |
| PN59-M-ACS-F | CTGTCTACCATGGAAGATTAAGTCGTGACTGGGAAAACCCTG |
| PN59-M-ACS-R | GGCAGGGCTTTCAGGTTCATCTAGTATTTCTCCTCTTTCTCTAGTATTA |
| PN85-M-ACS-F | TGATCTGTCTACCATGGAAGATTAAGTCGTGACTGGGAAAACCCTGGCG |
| PN85-M-ACS-R | TGGCAGGCAGGGCTTTCAGGTTCATCTAGTATTTCTCCTCTTTCTCTAGTATTAAAC |
一般高拷贝表达质粒的构建:将枯草芽孢杆菌属来源的acs基因序列,根据嗜盐单胞菌的密码子偏爱性进行优化,并由苏州金唯智生物科技有限公司进行基因合成,合成的acs基因连接至pU17获得pU17-acs。以pU17-acs为模板,采用引物ACS-PN59-M-F和ACS-PN59-M-R,PCR扩增得到acs片段(引物2端分别带有与质粒骨架有互补的25 bp序列)。以携带诱导型启动子PMmp1的高拷贝质粒pN59-pSEVA341[16]为模板,采用引物PN59-M-ACS-F和PN59-M-ACS-R,PCR扩增得到质粒骨架(2端有25bp与ACS互补的序列)。将得到的目标片段和质粒骨架,采用Gibson组装试剂盒(NEB公司),进行无缝融合。诱导型低拷贝穿梭质粒pN85-pSEVA321[17]以同样的方法进行构建,基因acs的扩增引物采用ACS-PN85-M-F和ACS-PN85-M-R,质粒pN85-pSEVA341的扩增引物采用PN85-M-ACS-F和PN85-M-ACS-R。
1.5 接合转化的方法E.coli DH5α的化转和E.coli S17-1的电转方法参照Ma等[17]方法。接合转化方法同Ye等[18]。最终接合菌体用无抗60LB重悬菌体后涂布到加有30 μg·mL-1氯霉素抗性的60LB平板上,37 ℃培养48 h,获的单菌落进行菌落PCR验证得到正确的转化菌株。
1.6 提取总蛋白取适量菌液,离心去上清,洗涤2次,100 ℃煮10 min,离心取上清,进行SDS-PAGE分析。
1.7 摇瓶发酵将菌株在60LB平板上划线,37 ℃培养24 h,挑取单菌落接种至60LB,37 ℃,220 r·min-1下培养12 h,连续活化2次。最后将二级活化种子液接种到60 MMG(Glu/NaAC)发酵培养基(50 mL/500 mL锥形瓶)中,接种量为0.25(OD600),需要时添加30 μg·mL-1氯霉素抗性,和1 mmol·L-1诱导物IPTG(OD600为0.4~0.6时添加),在37 ℃,220 r·min-1条件下进行发酵培养。
1.8 发酵液分析与产物测定细胞OD600值使用紫外可见分光光度计测定。葡萄糖和乙酸钠浓度使用高效液相色谱仪进行检测,色谱柱型号HPX87H-安捷伦,流动相为5 mmol·L-1 H2SO4,流速0.5 mL·min-1,柱温60 ℃,检测器为示差RID检测器。
细胞干质量测量:取适量发酵菌体,离心去上清,-80 ℃超低温冰箱内冷冻12 h,采用德国CHRIST公司的冷冻干燥机冻干12 h,精密电子天平测量细胞干质量。
PHB产物分析:称取20 mg左右干菌体和适量PHB标品,置于耐高温封闭性好的酯化管中,加入1.5 mL酯化液(485 mL甲醇,15 mL浓硫酸,0.25 g苯甲酸)和1.5 mL三氯甲烷,100 ℃酯化4 h。向酯化后的体系中加入1 mL双蒸水,震荡混匀,静置分层,取下层有机相用于气相色谱的检测。色谱条件为:N2载气,H2燃烧气体,流速30 mL·min-1,空气400 mL·min-1,柱子为安捷伦HP-5,气相程序:进样口温度240 ℃,检测器温度250 ℃,初始温度80 ℃,维持1.5 min,30 ℃·min-1升温至140 ℃,40 ℃·min-1升温至240 ℃,维持2 min。
2 结果与讨论 2.1 TD1.0对乙酸钠的利用和耐受性测试为表征嗜盐单胞菌TD1.0对乙酸钠的利用和耐受能力,60 MMG为基础培养基,以25、50、75、100 g·L-1的乙酸钠代替葡萄糖为碳源进行生长测试。菌株在不同浓度乙酸钠为碳源条件下的生长曲线见图 1。
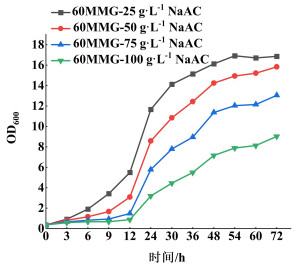
|
| 图 1 NaAC耐受测试 Fig.1 Tolerance of NaAC |
| |
由图 1可知,TD1.0在高浓度乙酸钠(25~100 g·L-1)的碳源下均可以生长,其中在25 g·L-1乙酸钠为碳源下长势最好,最高生物量达到了16.8(OD600)。但随着乙酸钠浓度的提高,菌株生长受到了抑制,浓度越高,抑制程度越明显。在生长前期(12 h内),100 g·L-1乙酸钠条件下,培养12 h OD600仅从0.25长到0.87,而此时以25 g·L-1乙酸钠为碳源的菌株OD600已经达到了5.48。培养72 h,TD1.0在100 g·L-1 NaAC中最大OD600为9.1,相比于在25 g·L-1乙酸钠实验组,其生长抑制率达到45.8%,而大多数微生物在乙酸盐浓度超过0.5 g·L-1时,其生长就会受到严重抑制[19]。以上结果表明嗜盐单胞菌TD1.0具有天然的利用和耐受高浓度乙酸钠的生理优势,为后续开发嗜盐单胞菌利用廉价的乙酸盐代替葡萄糖生产相关化学品具有巨大潜力。
2.2 过表达ACS对乙酸利用和PHB合成的影响在嗜盐菌中,以葡萄糖和乙酸钠为碳源合成PHB的途径如图 2所示。葡萄糖经过糖酵解途径转化为乙酰辅酶A,乙酸钠经过乙酰-CoA合成酶(ACS)得到乙酰辅酶A,其中一部分乙酰-CoA进入TCA循环,另一部分在乙酰-CoA乙酰基转移酶(PhaA)的作用下生成乙酰乙酰-CoA,继而在3-羟基丁酰-CoA脱氢酶(PhaB)的作用下生成3-羟基丁酰-CoA,最终在聚羟基脂肪酸酯合成酶(PhaC)的作用下生成聚3-羟基脂肪酸酯(PHB)。
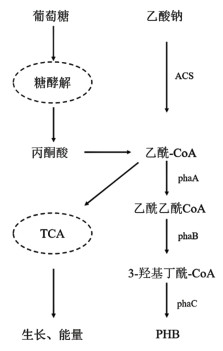
|
| 图 2 PHB的生产途径 Fig.2 Biosynthesis pathway of PHB |
| |
为进一步强化嗜盐单胞菌利用乙酸钠的优势,本实验构建了以高拷贝acs表达载体pN59-M-ACS和低拷贝acs表达载体pN85-M-ACS。通过接合转化将2种质粒分别导入TD1.0后得到菌株TD-PN59和TD-PN85,SDS-PAGE分析的ACS蛋白表达见图 3,TD-PN59和TD-PN85中ACS蛋白(65 kDa)均可正常表达,且高拷贝表达菌株TD-PN59的ACS蛋白条带较TD-PN85更为明显,表明表达载体拷贝数越高,ACS的表达量就越多。
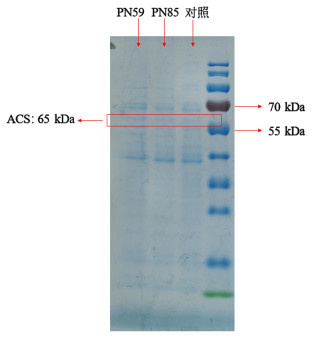
|
| 图 3 菌株TD-PN59和TD-PN85胞内ACS的PAGE检测 Fig.3 ACS expression in strain TD-PN59 and TD-PN85 |
| |
进一步对TD-PN59和TD-PN85进行乙酸钠为单一碳源摇瓶生长测试,其中乙酸钠浓度为27.3 g·L-1为碳源,对照组以20 g·L-1葡萄糖(碳物质的量等价于27.3 g·L-1乙酸钠)为单一碳源。以TD1.0为对照菌株,以初始OD600=0.25进行接种,其中TD-PN59和TD-PN85菌株在OD600长至0.4~0.6时添加1 mmol·L-1的IPTG诱导ACS表达。37 ℃,200 r·min-1培养,间隔取样测定碳源剩余量、生物量(OD600)(图 4)和胞内PHB产量(图 5)。
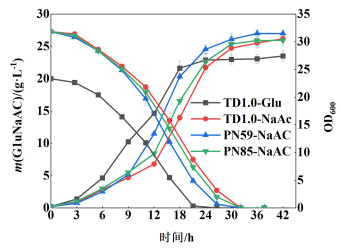
|
| 图 4 导入不同拷贝数ACS菌株的生长情况 Fig.4 Growing status of different strains |
| |

|
| 图 5 导入不同拷贝数ACS菌株的CDW和PHB产量 Fig.5 CDW and PHB content of different strains |
| |
由图 4和图 5可知,TD1.0菌株以葡萄糖为碳源时,前期生长阶段(< 12 h), 生长迅速,优于乙酸钠,最高OD600为26;以乙酸钠为碳源虽前期生长速度慢于葡萄糖,但培养12 h后,乙酸钠利用加快,最大值达到30.57(OD600),优于葡萄糖为碳源的生长(图 4)。代谢葡萄糖的对照组pH值从最初的9.0降到了6.3,代谢乙酸钠的实验组pH值仍维持在9.0左右,这说明代谢葡萄糖会产生大量的酸性代谢副产物,对菌株生长产生抑制作用[20],而代谢乙酸钠时能维持碱性环境从而有利于细胞在发酵后期的生长。TD1.0以葡萄糖为碳源在42 h达到最大细胞干质量(CDW),为9.87 g·L-1,PHB产量为6.12 g·L-1,PHB胞内产物占比0.62 g/g(PHB/干菌体)。以乙酸钠为碳源时,TD1.0可在36 h内完全消耗完乙酸钠,并在48 h时达到9.6 g·L-1的最大细胞干质量,PHB产量和胞内质量分数分别为5.86 g·L-1和61%。
含高拷贝质粒pN59-M-ACS的菌株TD-PN59约30 h消耗完乙酸钠,并在36 h时达到31.5的最大细胞OD600值,发酵过程中的最大和平均乙酸盐利用速率为1.47 (9~12 h)和0.91 g·L-1·h-1,比TD1.0分别提高37.4%[1.07 g·L-1·h-1(9~12 h)]和19.7%(0.76 g·L-1·h-1)。菌株TD-PN59的细胞干质量也有轻微提升,发酵42 h时达到9.98 g·L-1,PHB的产量和胞内含量分别为6.49 g·L-1和65%,PHB产量相比于TD1.0利用乙酸钠为碳源提高(5.86 g·L-1)了约11%,比TD1.0利用葡萄糖为碳源(6.12 g·L-1)提高了约6%。含低拷贝质粒pN85-M-ACS的菌株TD-PN85在42 h时达到最大细胞OD600值(30.24),其最大乙酸钠利用速率为1.20 g·L-1·h-1(9~12 h),相比于野生型提高了12%,但平均乙酸钠利用速率未见明显提升。TD-PN85利用乙酸钠时的PHB产量为6.01 g·L-1,此时细胞干质量为9.7 g·L-1,PHB含量为62%。
20 g·L-1的葡萄糖和27.3 g·L-1的乙酸钠含有相同的碳摩尔数(约0.667 mol·L-1)。当菌株TD1.0以葡萄糖为底物时,其合成PHB的碳摩尔转化率为42.7% C-mol;以乙酸钠为底物时的PHB碳摩尔转化率为40.9% C-mol;工程菌TD-PN59以乙酸钠为底物时合成PHB的碳摩尔转化率为45.3% C-mol,相比于TD1.0利用葡萄糖或乙酸钠时分别提升了6.1%和10.8%。
上述结果表明,以廉价乙酸盐替代葡萄糖进行发酵生产PHB是可行的,并且通过过表达ACS,不仅可以提高TD1.0的乙酸钠利用速率,还可提高细胞干质量和PHB的产量。葡萄糖需要经过整个EMP途径代谢后才能转化为PHB的前体物乙酰辅酶A,而乙酸进入细胞后仅需一步反应就可转化为乙酰辅酶A(图 2),因此以乙酸为碳源合成PHB时在乙酰辅酶A供应方面具有独特的优势。除了过表达ACS之外,在后续的工作中还可以通过激活乙醛酸循环[21]和实验室适应性进化[22]等策略提进一步提高乙酸盐的利用效率。
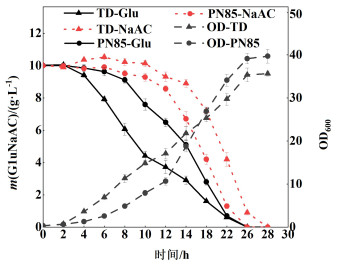
2.3 葡萄糖与乙酸钠混合碳源发酵随后考察了ACS表达对菌株代谢葡萄糖和乙酸钠混合碳源(60 MMG,10 g·L-1葡萄糖和10 g·L-1乙酸钠)的影响,结果如图 6所示。
|
| 图 6 混合碳源条件下菌株碳源消耗和生长曲线 Fig.6 OD600 and the consistence of Glu/NaAC |
| |
TD1.0在代谢葡萄糖和乙酸钠混合碳源时表现出明显的代谢物阻遏效应[23],即先利用葡萄糖后利用乙酸钠的特征,由于生长前期只快速利用葡萄糖而造成代谢溢流现象,生成了乙酸副产物而使得培养基中乙酸钠含量略有上升(最高至10.52 g·L-1),待葡萄糖浓度较低(< 4 g·L-1)时,逐渐开始利用乙酸钠,最终在28 h时完全消耗完2种碳源。与野生型TD1.0相比,过表达ACS的菌株TD-PN85在生长前期葡萄糖利用较缓,但却具有明显的葡萄糖和乙酸钠共利用的特征,且没有发现培养基中因利用葡萄糖而导致乙酸增加的现象,说明表达ACS后导致乙酸利用效率提升而快速消耗掉葡萄糖产生的乙酸,最终在培养26 h时能够完全消耗完2种碳源,最大细胞OD为39.68,高于TD1.0(35.62)。在整个发酵过程中,TD-PN85菌株双碳源共利用的最大速率为1.63 g·L-1·h-1(12~14 h),比TD1.0(1.08 g·L-1·h-1,6~8 h)提高了约51%。同样地,我们也进行了TD-PN59的混合碳源生长实验,但因为拷贝数过高,给菌株带来了巨大的代谢负担,延缓了菌株生长,葡萄糖和乙酸利用速率均大幅降低。
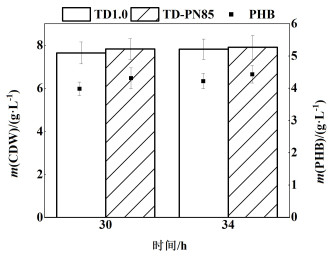
由图 7可知,菌株TD-PN85的CDW和PHB产量均略高于对照菌株TD1.0。在34 h时,对照菌株TD1.0利用混糖取得最大CDW为7.82 g·L-1,PHB产量为4.22 g·L-1,含量为54%。菌株TD-PN85同样在34 h时取得最大CDW为7.91 g·L-1,PHB产量为4.43 g·L-1,含量为56%,相比于对照菌株均稍有提升。与单一碳源相比,2个菌株在利用葡萄糖/乙酸钠混合碳源时的PHB碳摩尔转化率均显著下降(约为35% C-mol),这很可能是因为等量配比的葡萄糖和乙酸钠造成了比较显著的代谢模式转换,从而影响到PHB的合成效率,后续研究中需要进一步优化2种碳源的比例或添加方式以提高PHB的合成。
|
| 图 7 混合碳源条件下菌株CDW和PHB产量 Fig.7 CDW and PHB from Glu/NaAC |
| |
实验表明,在嗜盐菌TD1.0中,采用质粒pN85-M-ACS过表达ACS可以有效缓解葡萄糖代谢物阻遏效应,促进葡萄糖和乙酸钠的共利用,但PHB产量并没有得到显著提高。
3 结论1) 嗜盐单胞菌Halomonas sp.TD1.0可耐受高浓度乙酸钠,乙酸钠浓度从25 g·L-1提高至100 g·L-1时对其生长抑制程度只有45.8%,其乙酸钠耐受性显著优于大肠杆菌等普通模式菌株,并可利用乙酸钠为单一碳源高效合成PHB。
2) 在嗜盐单胞菌TD1.0中表达异源乙酰辅酶A合成酶后的工程菌TD-PN59的乙酸盐平均利用速度提高了19.7%,并且其细胞干质量、PHB产量和PHB胞内质量分数分别达到9.98 g·L-1,6.49 g·L-1和65%,分别比同样培养条件下的野生型菌株提高了3.2%,10.8%, 和7.3%。
3) 低拷贝量表达acs可以显著缓解葡萄糖对乙酸钠的分解代谢物阻遏效应实现葡萄糖和乙酸钠的共利用。
| [1] |
周璟, 盛红梅, 安黎哲. 极端微生物的多样性及应用[J]. 冰川冻土, 2007, 29(2): 286-291. ZHOU Jing, SHENG Hongmei, AN Lizhe. Diversity of extremophilic miroorganisms and their applications[J]. Journal of Glaciology and Geocryology, 2007, 29(2): 286-291. DOI:10.3969/j.issn.1000-0240.2007.02.017 (in Chinese) |
| [2] |
FU X, TAN D, AIBAIDULA G, et al. Development of Halomonas TD01 as a host for open production of chemicals[J]. Metabolic Engineering, 2014, 23: 78-91. DOI:10.1016/j.ymben.2014.02.006 |
| [3] |
TAN D, XUE Y, AIBAIDULA G, et al. Unsterile and continuous production of polyhydroxybutyrate by Halomonas TD01[J]. Bioresource Technology, 2011, 102(17): 8130-8136. DOI:10.1016/j.biortech.2011.05.068 |
| [4] |
QIN Q, LING C, ZHAO Y, et al. CRISPR/Cas9 editing genome of extremophile halomonas spp[J]. Metabolic Engineering, 2018, 47: 219-229. DOI:10.1016/j.ymben.2018.03.018 |
| [5] |
YIN J, FU X, WU Q, et al. Development of an enhanced chromosomal expression system based on porin synthesis operon for halophile Halomonas sp[J]. Applied Microbiology and Biotechnology, 2014, 98(21): 8987-8997. DOI:10.1007/s00253-014-5959-1 |
| [6] |
SHEN R, NING Z, LAN Y, et al. Manipulation of polyhydroxyalkanoate granular sizes in halomonas bluephagenesis[J]. Metabolic Engineering, 2019, 54: 117-126. DOI:10.1016/j.ymben.2019.03.011 |
| [7] |
袁恺, 周卫强, 彭超, 等. 微生物发酵法生产聚羟基脂肪酸酯的研究进展[J]. 生物工程学报, 2021, 37(2): 384-394. YUAN Kai, ZHOU Weiqiang, PENG Chao, et al. Engineering progress in microbial production of polyhydroxyalkanoates[J]. Chinese Journal of Biotechnology, 2021, 37(2): 384-394. (in Chinese) |
| [8] |
OSO M S D, MAURICIO-IGLESIAS M, HOSPIDO A. Evaluation and optimization of the environmental performance of PHA downstream processing[J]. Chemical Engineering Journal, 2021. DOI:10.1016/j.cej.2020.127687 |
| [9] |
DIAS F, LEZCANO M F, ÁLVAREZ G, et al. Polyhydroxybutyrate (PHB) tubular scaffolds for nerve regeneration[J]. The FASEB Journal, 2021. DOI:10.1096/fasebj.2021.35.S1.01856 |
| [10] |
杜鹤童, 赵倚晴, 陈金春, 等. 基于嗜盐微生物合成生物学的下一代工业生物技术[J]. 生命科学, 2019, 31(4): 385-390. DU Hetong, ZHAO Yiqing, CHEN Jinchun, et al. Next generation industrial biotechnology based on synthetic biology of halophiles[J]. Chinese Bulletin of Life Sciences, 2019, 31(4): 385-390. (in Chinese) |
| [11] |
李书廷, 洪坤强, 汪保卫, 等. 大肠杆菌乙酸耐受性菌株的构建及其耐受机制研究进展[J]. 微生物学通报, 2020, 47(12): 4250-4259. LI Shuting, HONG Kunqiang, WANG Baowei, et al. Advances in construction of acetic acid tolerance Escherichia coli[J]. Microbiology China, 2020, 47(12): 4250-4259. (in Chinese) |
| [12] |
LIM H G, LEE J H, NOH M H, et al. Rediscovering acetate metabolism: Its potential sources and utilization for biobased transformation into value-added chemicals[J]. Journal of Agricultural and Food Chemistry, 2018, 66(16): 3998-4006. DOI:10.1021/acs.jafc.8b00458 |
| [13] |
YANG H, ZHANG C, LAI N, et al. Efficient isopropanol biosynthesis by engineered Escherichia coli using biologically produced acetate from syngas fermentation[J]. Bioresource Technology, 2020. DOI:10.1016/j.biortech.2019.122337 |
| [14] |
LI W, CHEN J, LIU C, et al. Microbial production of glycolate from acetate by metabolically engineered escherichia coli[J]. Journal of Biotechnology, 2019, 291: 41-45. DOI:10.1016/j.jbiotec.2018.12.012 |
| [15] |
ZHAO H, ZHANG H, CHEN X, et al. Novel T7-like expression systems used for halomonas[J]. Metabolic Engineering, 2017, 39: 128-140. DOI:10.1016/j.ymben.2016.11.007 |
| [16] |
CHEN X, YIN J, YE J, et al. Engineering halomonas bluephagenesis TD01 for non-sterile production of poly(3-hydroxybutyrate-co-4-hydroxybutyrate)[J]. Bioresource Technology, 2017, 244: 534-541. DOI:10.1016/j.biortech.2017.07.149 |
| [17] |
MA H, ZHAO Y, HUANG W, et al. Rational flux-tuning of halomonas bluephagenesis for co-production of bioplastic PHB and ectoine[J]. Nature Communications, 2020. DOI:10.1038/s41467-020-17223-3 |
| [18] |
YE J, HU D, CHE X, et al. Engineering of Halomonas bluephagenesis for low cost production of poly(3-hydroxybutyrate-co-4-hydroxybutyrate) from glucose[J]. Metabolic Engineering, 2018, 47: 143-152. DOI:10.1016/j.ymben.2018.03.013 |
| [19] |
KIEFER D, MERKEL M, LILGE L, et al. From acetate to bio-based products: Underexploited potential for industrial biotechnology[J]. Trends in Biotechnology, 2021, 39(4): 397-411. DOI:10.1016/j.tibtech.2020.09.004 |
| [20] |
刘冬冬. 强化葡萄糖代谢途径提高L-赖氨酸发酵水平的研究[D]. 江苏无锡: 江南大学, 2017 LIU Dongdong. Increasing the fermentation level of L-lysine via enhancing glucose metabolism pathways[D]. Jiangsu Wuxi: Jiangnan University, 2017 (in Chinese) |
| [21] |
LI Y, HUANG B, WU H, et al. Production of succinate from acetate by metabolically engineered escherichia coli[J]. ACS Synthetic Biology, 2016, 5(11): 1299-1307. DOI:10.1021/acssynbio.6b00052 |
| [22] |
FERNÁNDEZ-SANDOVAL M T, HUERTA-BERISTAIN G, TRUJILLO-MARTINEZ B, et al. Laboratory metabolic evolution improves acetate tolerance and growth on acetate of ethanologenic Escherichia coli under non-aerated conditions in glucose-mineral medium[J]. Applied Microbiology and Biotechnology, 2012, 96(5): 1291-1300. DOI:10.1007/s00253-012-4177-y |
| [23] |
马婉晴, 章珍, 刘悦琳, 等. 大肠杆菌分解代谢产物阻遏效应研究进展[J]. 遗传, 2010, 32(6): 571-576. MA Wanqing, ZHANG Zhen, LIU Yuelin, et al. Advances in mechanism of Escherichia coli carbon catabolite repression[J]. Hereditas, 2010, 32(6): 571-576. (in Chinese) |
 2022, Vol. 39
2022, Vol. 39





