2. 安徽工业大学冶金减排与资源综合利用教育部重点实验室, 安徽 马鞍山 243002;
3. 安徽欣创节能环保科技股份有限公司, 安徽 马鞍山 243071
2. Key Laboratory of Metallurgical Emission Reduction & Resources Recycling, Ministry of Education, Anhui University of Technology, Anhui Maanshan 243002, China;
3. Anhui Xinchuang Energy Saving & Environmental Protection Science & Technology Co. Ltd., Anhui Maanshan 243071, China
随着现代科学技术的进步,人们在追求快速发展的同时也越来越注重环境问题。砷(As)是自然界中一种广泛存在的类金属,含As矿物的冶炼过程和用砷化合物作为原料的生产过程中会产生含As的废水、废气和废渣,长期接触超标的含As污染物会导致各种慢性健康问题[1]。在自然水体中,溶解的砷主要以亚砷酸盐As(Ⅲ)、砷酸盐As(Ⅴ)或甲基化的砷化合物形式存在。而地下水(pH值一般在6.5~8.5之间)往往呈现厌氧状态,As主要是以中性的H3AsO3分子的形式存在,难以和吸附剂形成静电吸附或者络合物的形态而去除[2, 3]。在常规的吸附处理方法中,往往是通过在一定条件下将As(Ⅲ)氧化成As(Ⅴ),利用As(Ⅴ)在水中的电负性将其吸附去除。
水体中As常用的处理方法有化学沉淀法[4]、膜分离法[5]、离子交换法[6]等,这些方法虽然操作简单,但会产生大量的废渣和有毒物质,易造成二次污染,在排放之前需要进一步的处理,从而提高了工业处理的成本。吸附法具有成本低、效率高、操作简单、适用性广以及再生处理方便等优点,从而在处理含As废水领域备受青睐。近年来,随着除As技术的不断进步和快速发展,人们尝试了各种以生物质基材料为主制备的吸附剂,例如:藻类、细菌、真菌等微生物,纤维素、壳聚糖、海藻酸钠等从生物中提取的天然多糖,或者是树皮、秸秆、果皮等农林废弃物等。生物质基吸附剂与其他类型吸附剂相比(如表 1所示),有很多的优势。生物质基材料表面含有丰富的羧基、氨基、羟基等的活性官能团,对水溶液中的多种离子都表现出较好的吸附性能,并且天然的生物高分子或其衍生物乃至一些生物质废弃物作为生物质基原料,不仅成本低廉,来源广泛,种类繁多,而且减少了废弃物可能造成的污染[7]。制备性能优异、附加值高的生物质基吸附剂是绿色、经济、可持续的除砷途径,因此受到众多研究者的广泛关注[8]。
| 吸附剂类型 | 优点 | 缺点 |
| 矿物质 | 孔隙结构丰富,稳定性良好,无毒无害 | 天然矿物吸附效果一般,大部分需要改性处理才能有较好的吸附效果 |
| 碳基材料 | 比表面积大,结构稳定 | 价格昂贵,再生效率低 |
| 金属氧化物 | 具有较多的表面电荷,热稳定性好 | 再生性较差,反应过程不可逆 |
| 工业废弃物 | 来源广泛,价格低廉,工艺简单,以废治废 | 成分复杂,受自身浸出性影响,再生性差 |
| 生物质基材料 | 成本低,效率高、种类繁多、对环境友好 | 多数吸附剂贮存困难 |
本论文介绍As在水溶液中存在形式和含As(Ⅲ)废水的氧化处理方法,概括经过物理改性或化学改性后生物质基吸附剂的除As效果及应用,然后根据吸附剂与吸附质之间的作用类型,分析了生物质基吸附剂在除As过程中的吸附机理,另外,探讨了生物质基吸附剂在处理含As废水方面的潜在应用。
1 砷溶液的化学分析As在水溶液中的离子存在形态不同会影响到除As方法的选择。As具有多种价态,在自然水体通常以As(Ⅲ)和As(Ⅴ)的形式存在。由于水体的pH不同,导致As(Ⅲ)和As(Ⅴ)均有不同存在形式。其中As(Ⅲ)主要以亚砷酸(H3AsO3)、亚砷酸根(H2AsO3-、HAsO32-、AsO33-)等形式存在,As(Ⅴ)主要以砷酸(H3AsO4)和砷酸根(H2AsO4-、HAsO42-、AsO43-)等形式存在[9, 10]。
1.1 As(Ⅲ)溶液的化学分析As(Ⅲ)在溶液体系中的解离平衡方程及平衡常数如下:
| ${{\text{H}}_{3}}\text{As}{{\text{O}}_{3}}\rightleftharpoons {{\text{H}}^{+}}+{{\text{H}}_{2}}\text{AsO}_{3}^{-}, {{K}_{1}}=4.0\times {{10}^{-10}}$ | (1) |
| ${{\text{H}}_{2}}\text{AsO}_{3}^{-}\rightleftharpoons {{\text{H}}^{+}}+\text{HAsO}_{3}^{2-}, {{K}_{2}}=7.0\times {{10}^{-13}}$ | (2) |
| $\text{HAsO}_{3}^{2-}\rightleftharpoons {{\text{H}}^{+}}+\text{AsO}_{3}^{3-}, {{K}_{3}}=4.0\times {{10}^{-14}}$ | (3) |
根据公式(1)~(3)计算得出浓度500 mg·L-1的As(Ⅲ)在不同pH值条件下的存在形态(如图 1所示)。

|
| 图 1 500 mg·L-1的As(Ⅲ)在溶液中离子形态的平衡分布图 Fig.1 Equilibrium distribution of As(Ⅲ) species in aqueous with a total As(Ⅲ) concentration of 500 mg·L-1 |
| |
从图 1可以看出,在酸性溶液中,As(Ⅲ)主要以H3AsO3的形式存在;当pH值达到7左右时,H3AsO3去质子化解离出1个H+,溶液中开始出现H2AsO3-,当pH值达到10.7左右时,H2AsO3-的组分比例达到最大,接近于93.1%,此时,H2AsO3-离子开始解离出H+出现HAsO32-,溶液中H3AsO3存在比例不断减小,当pH值接近12时完全消失,随着H3AsO3的消失,AsO33-被解离出来。
1.2 As(Ⅴ)溶液的化学分析As(Ⅴ)在溶液体系中存在的解离平方程及平衡常数如式(4)~(6):
| ${{\text{H}}_{3}}\text{As}{{\text{O}}_{4}}\rightleftharpoons {{\text{H}}^{+}}+{{\text{H}}_{4}}\text{AsO}_{4}^{-}, {{K}_{1}}=6.3\times {{10}^{-7}}$ | (4) |
| ${{\text{H}}_{2}}\text{AsO}_{4}^{-}\rightleftharpoons {{\text{H}}^{+}}+\text{HAsO}_{4}^{2-}, {{K}_{2}}=2.0\times {{10}^{-7}}$ | (5) |
| $\text{HAsO}_{4}^{2-}\rightleftharpoons {{\text{H}}^{+}}+\text{AsO}_{4}^{3-}, {{K}_{3}}=3.2\times {{10}^{-13}}$ | (6) |
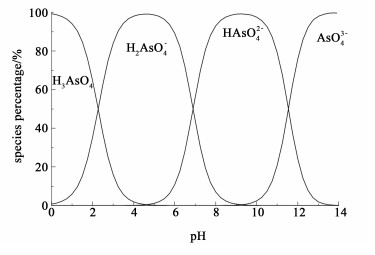
根据公式(4)~(6)计算得出浓度500 mg·L-1的As(Ⅴ)在不同pH值条件下的存在形态(如图 2所示)。
|
| 图 2 500 mg·L-1的As(Ⅴ)在溶液中离子形态的平衡分布图 Fig.2 Equilibrium distribution of As(Ⅴ) species in aqueous with a total As(Ⅴ) concentration of 500 mg·L-1 |
| |
从图 2可以看出,H3AsO4的组分比例随pH值的增大而不断减小,在pH值在4.5左右时趋于0,H3AsO4去质子化解离出的H2AsO4-组分比例随pH值增大呈现先增大后减小的变化趋势,当pH值在4.5左右时达到最大值98.4%,当pH值在9左右时H2AsO4-的组分比例趋于0,此时HAsO42-的比例达到最大值99.9%,直到pH值在10左右时HAsO42-的组分比例逐渐减小,AsO43-被解离出来。
不同pH值条件下As的存在形式有所不同,所表现出来的化学性质也大相径庭[11]。根据一些研究发现[12, 13],当溶液pH<9时,As(Ⅲ)主要以溶解性H3AsO3分子的形式存在,其吸附机理主要依靠络合作用,在生物质基吸附剂表面形成络合物,当溶液pH>9时,As(Ⅲ)主要以As的阴离子形式存在,此时理想的吸附条件是与吸附剂表面带正电的官能团发生静电吸引作用,但是碱性溶液中会存在大量的OH-离子,会与溶液中As的阴离子存在竞争关系。此外,在此pH值条件下,大多数吸附剂的表面呈电负性,会发生与As(Ⅲ)的静电排斥,不利于吸附。当溶液pH>4时,As(Ⅴ)主要以阴离子的形式存在,在酸性溶液中,生物质基材料表面官能团会发生质子化,使其整体带正电荷,从而与溶液中的砷阴离子产生静电吸引。当废水中同时存在As(Ⅲ)和As(Ⅴ)时,pH值处于4~9之间,吸附效果表现最佳[12-14]。虽然科研工作者对含As废水的处理做了大量的研究和试验,但是依然存在着很多问题,如工艺成本高、操作流程复杂、易造成二次污染等。因此,研究出高效的处理含As废水方法和材料具有重大的现实意义。
2 含砷As(Ⅲ)废水的处理方法As(Ⅲ)和As(Ⅴ)都可以在自然水体中发生吸附,但是吸附行为和吸附效果却不一样。在自然水体中,As(Ⅲ)比As(Ⅴ)具有更强的毒性和迁移能力。此外,As(Ⅲ)在水体中大部分以中性分子(H3AsO3)的形式存在,不易被吸附[15]。因此,利用化学沉淀、吸附法等传统技术直接处理含As(Ⅲ)废水的效果不明显,效率也不高。根据目前一些研究成果,还没有更有效的吸附材料和除As方法可以达到直接去除As(Ⅲ)的效果。因此,将As(Ⅲ)氧化为As(Ⅴ)已成为了处理含As(Ⅲ)废水的关键步骤,这样不仅可以达到将砷离子从废水中去除的目的,还可以降低As(Ⅲ)的二次污染[16]。目前,较为常见的As(Ⅲ)氧化技术主要有化学氧化和生物质基氧化。
2.1 化学氧化化学氧化就是向待处理废水中加入化学氧化剂,将As(Ⅲ)预氧化成As(Ⅴ),常用的化学氧化剂有MnO2、KMnO4、H2O2、·OH和O3等,由于不同氧化剂有着不同的氧化还原电位和氧化反应机制,因此,其对As(Ⅲ)的氧化速率和氧化程度也不相同[17]。
Yin等[18]制备了一种新型的水合氧化锆和二氧化锰包覆改性活性炭。通过XPS的表征结果分析发现,MnO2作为预氧化剂,先将As(Ⅲ)氧化成As(Ⅴ),再被改性活性炭吸附,提高了改性吸附剂去除As(Ⅲ)的能力。王雨等[19]研究发现,H2O2和KMnO4对As(Ⅲ)都有氧化能力,在一定范围内,随着投加量的增加,氧化能力不断增加。Yuan等[20]研究发现铁可以以不同的氧化物形式存在于生物炭上,如Fe2O3、Fe3O4或FeOOH,这有助于As(Ⅲ)氧化成As(Ⅴ),从而有效地从水中去除。
羟基自由基(·OH)是由1个氢原子和1个氧原子结合而成,从分子式上看是氢氧根离子(OH-)失去1个电子,这种组成成分使得它拥有极强的氧化能力。Lu等[21]研究发现在可见光照射下,会产生大量的·OH和超氧化物自由基,As(Ⅲ)氧化性能明显加快。杨智临等[22]研究了含铁矿物体系中·OH对As(Ⅲ)氧化及去除的影响。实验结果表明,·OH是As(Ⅲ)发生氧化反应的直接氧化剂,同时,·OH对除As效率产生了一定的促进作用。
臭氧(O3)自身具有强氧化性,能够将As(Ⅲ)氧化成As(Ⅴ),在一定条件下,它又可以通过水解产生·OH间接氧化As(Ⅲ),因此,O3被广泛应用于处理含砷废水。Khuntia等[23]在研究臭氧气泡氧化As(Ⅲ)性能发现,氧化速率随着臭氧投加量的增加而增加,并且O3和·OH都参与了氧化过程。
近年来,各种高级氧化技术(超声、电化学等)已成为氧化As(Ⅲ)的研究热点。Anahita[24]等利用电化学方法对氧化铈纳米颗粒上As的氧化还原过程进行考察。研究发现,在pH<4和电压0.8 V的条件下,As(Ⅲ)能够被氧化成As(Ⅴ)。Li等[25]采用超声-电化学组合氧化技术处理含砷酸性废水。研究结果表明,在电解过程中加入超声波可以提高As(Ⅲ)的氧化效率。当电解时间为120 min时,As(Ⅲ)的氧化率比简单电解的氧化率高25.49%,并且超声功率的增加可以促进As(Ⅲ)的氧化。
2.2 生物质基氧化生物质基氧化法是通过某些有生命的植物、微生物、无生命的生物源性物质对As(Ⅲ)氧化后与其它方法共同作用达到除砷效果的。
壳聚糖、海藻酸钠、纤维素等生物质材料表面存在的官能团(如羰基、酚羟基、半醌型自由基等)可作为受电子体,在As(Ⅲ)氧化成As(Ⅴ)的过程中发挥重要作用[26, 27]。Dong等[28]利用显微和光谱方法,报道了半醌型自由基直接附着在生物炭释放的溶解有机物上,引发As(Ⅲ)氧化成As(Ⅴ)。Zhong等[29]研究了生物炭基材料上的氧化还原活性官能团在As(Ⅲ)向As(Ⅴ)转化中的氧化作用。研究发现,在酸性和中性条件下,酚羟基和半醌型持久自由基激活O2而产生的羟基和H2O2使得As(Ⅲ)氧化为As(Ⅴ)。相反,碱性条件下,主要是羰基(C=O)起作用。通过FTIR和XPS表征发现,代表C=O峰的相对强度和相对面积显著降低,表明C=O接受了来自As(Ⅲ)的电子。
细菌、真菌及微藻类植物等微生物可依靠生物体自身的化学结构及成分特性来氧化As(Ⅲ)。Zhang等[30]发现一些细菌可以在无氧条件下将As(Ⅲ)氧化成As(Ⅴ),无氧条件下用硝酸盐作为电子接受体是氧化As(Ⅲ)的重要环节。张玉聪等[31]运用生物氧化柱作为除As(Ⅲ)的预处理,研究发现随着砷氧化菌在氧化柱中逐渐富集,As(Ⅲ)的氧化能力逐渐提高,As(Ⅲ)浓度迅速下降。微生物可以除去常规方法很难除去的As(Ⅲ),操作简便,对环境友好,但是它们生存条件苛刻,一定程度上限制了微生物基在氧化As(Ⅲ)领域的应用。
生物质基氧化法具有一般物化法无法比拟的优势,不仅价格低廉,能耗低,而且不需要添加任何化学药剂,无二次污染,目前被认为最具有发展前景的氧化As(Ⅲ)的一种方法。
3 生物质基吸附剂对砷的吸附特性近年来,生物质基材料因其环境友好而受到越来越多的关注,各种生物质基材料被广泛地用于处理含As废水,目前,常见的生物质基吸附材料主要有如生物炭[32]、木质素[33]、壳聚糖[34]和纤维素[35]等,其除As原理主要是利用吸附材料表面的羟基、羧基、氨基等官能团,通过物理化学作用将As吸附到材料表面,最后达到除As效果[36]。虽然生物质基吸附材料拥有诸多优势,但单一的生物质基吸附材料也存在一些不可忽视的限制,例如:(1)淀粉、壳聚糖和海藻酸钠等材料在水中都具有一定的溶解度,不能直接作为吸附剂;(2)生物质基材料表面官能团的数量丰富,但种类相对单一,对目标污染物的选择性和吸附能力有限。因此,对生物质基材料进行改性,可以有效的避开材料原本的缺点,提高材料稳定性、增加材料的活性位点以及活性基团等,从而提高材料的吸附能力[37]。
3.1 物理改性物理改性主要是通过掺杂、冷冻干燥、静电纺丝等技术手段对生物质基材料进行改性,改变所制备的生物质基吸附剂的内部结构,增加比表面积,提高稳定性等特点,从而提高生物质基吸附剂的对溶液中As的吸附容量。
Zhou等[38]在研究未改性生物炭除As(Ⅴ)效果时,发现生物炭对As(Ⅴ)最大吸附容量仅有17.5 mg·g-1。进一步考察发现,未改性生物炭的表面光滑,表面仅富含碳、氧元素,对As(Ⅴ)的吸附效果不佳,除As(Ⅴ)效果有限。他们进一步研究,将生物炭置于磁性明胶溶液中进行物理改性,制成微球(MG-CSB)。改性后材料的比表面积增大,并且具有很强的磁性易在水体分离。此外,明胶增强了原始生物炭的理化性质,显著提高了吸附剂表面含氧官能团的含量。根据Langmuir等温模型的拟合测定,MG-CSB对As(Ⅴ)吸附容量最大达到45.8 mg·g-1。改性后吸附剂显著提高了对水溶液中的As(Ⅴ)的去除能力。Mondal等[39]通过高温蒸汽法用绿豆壳改性生物炭(SAC-MBH)。通过SEM表征发现,改性后生物炭的比表面积增大,孔隙数量增加,且非均匀结构有利于将As(Ⅴ)吸附于活性炭表面内。研究结果表明,在吸收剂用量为0.75 g,pH=3.0,温度为308 K的条件下,As的最大去除率达到98.75%。在吸附过程中,吸附剂表面官能团(如羧基、羟基、硫酸盐和氨基)起着很大的作用。
壳聚糖本身可作为一种吸附剂,吸附一些重金属离子,国内外许多学者通过化学改性得到各种各样的壳聚糖衍生物,与未改性的壳聚糖相比,溶解性能、使用范围以及鳌合能力都得到加强。Chen等[40]用分批法和柱法研究了壳聚糖脱As(Ⅴ)效果,考察了各种实验因素对除As(Ⅴ) 效果的影响。研究结果发现,壳聚糖对As(Ⅴ)的仅达到1.9 mg·g-1较低的吸附容量。Lobo等[41]以壳聚糖和硝酸铁溶液为原料,通过离子凝胶法合成了功能性壳聚糖铁微球(F-ICM),通过与未改性的壳聚糖微球对比发现,改性后材料的机械性能和稳定性能得到了明显的提高。根据Langmuir等温模型的拟合测定,F-ICM对As(Ⅴ)的最大吸附量为120.77 mg·g-1。改性后的材料提高了对砷酸盐的选择性,PO43-、NO3-和CO32-存在对材料吸附容量的影响不大,并且材料经过4次循环使用后仍然能获得较好的吸附性能。
物理改性的成本低、改性时间短、改性过程中产生的副产物对环境影响不大,但是物理改性后的材料长时间放置,吸附性能和稳定性会降低,并且在循环利用时需要通过过滤或离心等技术来实现分离回收,所以限制了其在工业应用上的发展。
3.2 化学改性化学改性是指通过嵌段共聚,接枝和交联等化学方法,将功能基团和其他链节引入生物质基吸附材料的分子链中,或者通过化学键的形式与化合物进行复合,使得生物质基吸附材料的分子链和表面的化学结构发生改变,从而改变材料的各项性能。
海藻酸钠是一种阴离子生物聚合物,受到Hssain等[42]的注意用于去除As。他们研究了海藻酸钠微球的除As(Ⅴ)性能。研究发现,海藻酸钠微球在20 ℃条件下达到39.4 mg·g-1较低吸附容量。为了进一步提高海藻酸钠的吸附容量,他们对海藻酸钠进行化学改性,合成了活性炭-海藻酸钠复合微球,改性后的吸附剂孔隙结构明显增加,在30 ℃条件下最大吸附量达到66.7 mg·g-1。Bajpai等[43]以三聚磷酸酯(TPP)和氯化钙作为交联剂,通过油包水微乳液交联法制备出壳聚糖-海藻盐纳米颗粒(CANPs),提高了材料对As(Ⅴ)的吸附性能。通过FTIR表征结果发现,藻酸酸钠带负电荷的羧基通过静电相互作用与壳聚糖带正电荷的铵基结合并形成小尺寸纳米颗粒。根据Langmuir等温模型的拟合测定,CANPs对As(Ⅴ)的最大吸附量为337.83 mg·g-1,当pH=4.2时,CANPs的吸附效果最佳,对As(Ⅴ)的吸附作用主要是依靠壳聚糖上阳离子的静电吸引作用。
Liu等[44]从水竹壳中提取的纤维素,研究其除As(Ⅲ)效果。研究结果发现,单一纤维素为棒状结构,表面相对光滑,吸附As(Ⅲ)效率往往受到限制。他们通过水热法将羟基氧化铁(FeOOH)和氧化铜(CuO)负载到纤维素上制成纳米复合材料(FeOOH/CuO@WBC)。实验结果表明,当pH=3.5时,FeOOH/CuO@WBC对As(Ⅲ)最大吸附量为76.1 mg·g-1。研究发现,CuO负载在纤维素表面后,纤维素表面变得粗糙,当CuO@WBC浸入铁离子溶液中时,铁离子由于良好的亲水性而附着在其表面,并在热液反应过程中逐渐成为FeOOH,在FeOOH/CuO@WBC与As(Ⅲ)接触时,CuO将部分As(Ⅲ)氧化为As(Ⅴ),氧化的砷酸根离子与铁羟基发生接触,并与羟基置换反应。整个吸附过程中,纤维素(WBC)、CuO和FeOOH的协同作用大大提高了除As(Ⅲ)效率。Xi等[45]利用铁离子作为交联剂,通过共沉淀法将纤维素纳米晶与聚乙烯亚胺合成含纤维素纳米晶的高性能吸附剂[CNC-PEI-Fe(Ⅲ)],铁离子将2种分散的聚合物连接在一起,并诱导出大量的O—Fe—O键,提供了更多的吸附活性位点,As(Ⅲ)与吸附剂在表面发生络合反应,形成Fe—O—As络合物,改性后的吸附剂增加了对As(Ⅲ)的吸附性能,改性后吸附剂有较宽的孔径,提高了材料的吸附效果。研究结果表明,CNC-PEI-Fe(Ⅲ)对As(Ⅲ)/As(Ⅴ)的最大吸附容量分别为142.42/78.71 mg·g-1。合成后的含铁吸附剂适用于较宽的pH值范围,这为纳米纤维素在As污染治理中提供新的应用。
Huang等[46]以水铁矿(Fh)作为改性剂,将其负载到生物炭上合成一种新型吸附材料(FhBC)。改性后材料表面具有丰富的活性位点,结合生物炭多骨架结构的特点,提高了材料的除As(Ⅴ)效果。由于固相中的一部分Fe—O以Fe(Ⅱ)—O的形式存在,使得改性后材料在较宽的pH值范围内具有高氧化能力,在吸附的过程中,改性吸附剂中的生物炭作为电子供体,将Fe(Ⅲ)还原为Fe(Ⅱ),Fe(Ⅱ)与溶解在水中的O2进一步反应,生成一系列自由基,将溶液中As(Ⅲ)氧化为As(Ⅴ)在进行吸附。实验结果表明,FhBC对As(Ⅲ)、As(Ⅴ)的最大吸附率分别能达到99.53%和99.00%,改性后的吸附剂显著提高了对As(Ⅲ)、As(Ⅴ)的吸附性能。
化学改性主要分为接枝、交联和复合改性。接枝是以生物质基材料为载体,通过引入适当的支链或功能性侧基,使生物质基吸附材料表面产生较多的活性基团,从而提高生物质基材料对目标离子的选择性和吸附容量;交联是指在交联剂的作用下,通过化学键将聚合物的分子链连接在一起形成网状结构的过程,交联后吸附材料的力学性能、抗腐蚀性以及耐溶剂性等都有很大的提高;复合通过与一些性能稳定、官能团丰富的材料混合制备成复合材料,提高材料结构的稳定性。化学改性的种类繁多,效果显著,但是同时化学改性反应过程较长,制备工艺复杂,生产成本高[47]。目前,很多研究利用改性生物质基复合材料吸附溶液中As(如表 2所示)。
| Adsorbent | Arsenic species | Adsorption capacity/(mg·g-1) | Conditions | Reference | ||
| Temperature/℃ | Dosage/(g·L-1) | pH | ||||
| CANPs | As(Ⅴ) | 337.83 | 30 | 0.03 | 4.2 | [43] |
| FeOOH/CuO@WBC | As(Ⅲ) | 76.1 | 20 | 50 | 3.5 | [44] |
| CNC-PEI-Fe(Ⅲ) | As(Ⅲ)/As(Ⅴ) | 149.42/78.71 | 25 | 0.02 | 4 | [45] |
| CGO-Gd | As(Ⅴ) | 252.12/128.2 | 25 | 0.1/0.3 | 6 | [48] |
| Fe-NN/BFs | As(Ⅲ)/As(Ⅴ) | 70.22/93.94 | 25 | 1 | 7.0 | [49] |
| PEI-coffee | As(Ⅲ)/As(Ⅴ) | 13.2/46.1 | 40 | 1 | 5.1 | [50] |
| cellulose@nZVI | As(Ⅲ) | 92.95 | 25 | 8 | 1.0 | [51] |
| MBC800-0.6300 | As(Ⅲ) | 22.94 | 25 | 0.02 | 6 | [52] |
| CAFB | As(Ⅴ) | 15.80 | 25 | 1 | 4 | [53] |
| CAZ-SM | As(Ⅴ) | 1.25 | 25 | 1 | 7.5 | [54] |
| GA | As(Ⅴ) | 14.95 | 25 | 1 | 6.5 | [55] |
| ZrIOx-AC | As(Ⅴ) | 3.9 | 25 | 2 | 7 | [56] |
| Mn-F400 | As(Ⅴ) | 4.96 | 25 | 0.83 | 7 | [57] |
| CMGO | As(Ⅲ) | 45 | 25 | 5 | 7.3 | [58] |
| Ce-CNB | As(Ⅲ) | 57.5 | 25 | 0.2 | 8 | [59] |
| MAC | As(Ⅴ) | 42.95 | 25 | 1.5 | 3 | [60] |
由于生物质基材料结构复杂,对目标污染物的吸附机理与吸附剂本身的性质和所处的吸附环境有关。为此,探讨吸附剂与吸附质之间的作用机理,对指导实际废水处理具有重要的意义。根据生物质基吸附剂和吸附质之间相互作用力(范德华力和化学键力)的不同,吸附机理可以分为离子交换、络合作用、静电吸引和氧化还原[27, 61-63]。
4.1 离子交换离子交换是带有可交换离子的不溶性固体与溶液中带有同种电荷的离子之间置换离子的过程。利用生物质基吸附剂除As过程中,吸附剂表面官能团上离子(与As电荷属性相同)和溶液中不同形态的As进行交换,使As代替原来的离子附着在吸附剂的表面,从而使得生物质基材料上的阴阳离子达到平衡。
Arcibar等[64]在利用铁离子改性活性炭吸附As(Ⅴ)的研究中发现,改性后的吸附剂增大了离子交换的容量。在pH=7条件下,砷酸盐分子的羟基配体能够取代位于活性炭表面的羟基氧化纳米粒子,进行离子交换,形成单齿和双齿复合物,附着在吸附剂的表面。此外,吸附剂表面的正电荷会与As(Ⅴ)产生静电吸附作用,但是,这一机制的吸附效果不明显。
Merodio等[65]在改性活性炭吸附As(Ⅴ)的实验中发现,As离子的吸附机理包括静电吸引和羟基在改性吸附剂中的离子交换作用。根据FTIR对吸附剂表面官能团的定性分析,也证明在对As(Ⅴ)吸附过程中改性吸附剂上羟基的键起主要作用。
4.2 表面络合络合作用是指被吸附的离子与带相反电荷的离子或官能团结合而形成的络合物。利用生物质基吸附剂除As时,溶液中含As离子被当作中心离子,生物吸附剂的表面官能团(如羟基、羧基等)与配体相似提供自由电子,与中心离子发生相互作用形成配位键,在吸附过程中,吸附剂表面的多种官能团参与水体中游离的多种阴离子或阳离子发生络合反应。
Sherlala等[58]制备了壳聚糖-氧化石墨烯纳米复合材料用于研究As(Ⅲ)吸附性能。研究发现纳米复合材料表面零电荷点约为6.8,另一方面,pH<9.2时,As(Ⅲ)主要以中性形式(H3AsO3)存在,在这种情况下,静电吸附作用是不可行的,进一步研究发现,吸附主要通过纳米复合材料的表面官能团(—NH2、—OH和—OH2)和H3AsO3之间通过表面络合来进行的,表面复合物的形成遵循单齿键或双齿复合物。通过对表面复合物的动力学模型和平衡等温线模型的分析也证实了这一机制。
Zhang等[59]在用铈改性壳聚糖吸附As(Ⅲ)实验中发现,pH值在2~8范围内,吸附容量随pH值的升高逐渐增加,pH>8时,吸附容量随pH值的增加而降低。通过对pH=8时的吸附过程分析可知,此时As(Ⅲ)与纳米生物吸附剂上的羟基发生络合反应,形成单齿和双齿络合物。另外,吸附剂表面的Ce(Ⅳ)将部分As(Ⅲ)氧化成As(Ⅴ),然后吸附在吸附剂表面。因此,铈改性壳聚糖对As(Ⅲ)的吸附是通过2种同时发生的机制进行:表面羟基的络合作用和氧化还原作用。
4.3 静电吸引静电吸引主要是生物质基吸附剂中一些活性基团发生变化后,使生物质基材料整体带正电荷,与溶液中的As离子产生了静电吸引作用,从而达到除As的目的。这种吸附能力高度依赖溶液中的pH值和吸附剂表面的电性,在pH值过低的情况下,溶液中的As主要以化合物的形式存在,难以和吸附剂形成静电吸附。在pH值过高的情况下,溶液中会存在大量的OH-存在,会与As阴离子共同竞争吸附剂上的吸附位点,As与吸附剂之间的静电吸引效果会受到一定的影响。
Choi等[48]通过水热共沉淀法制备了一种壳聚糖-石墨烯氧化物(CGO-Gd)纳米复合材料,研究其吸附As(Ⅴ)的实验中发现,pH值在3~7范围内,CGO-Gd表面的官能团质子化,形成带正电荷的表面性能,如GO-OH2+,Gd-OH3+,和GO-COHOH2+,它们通过静电吸引和表面络合作用吸附带负电荷的As(Ⅴ)。而在pH值在8~12范围内时,负电荷浓度增大,静电吸引作用逐渐减弱,As(Ⅴ)的显著吸附是由于As(Ⅴ)与表面官能团的表面络合作用。
Wang等[66]以铁锰离子处理松材生物炭(FMM)或铁锰离子共沉淀于松材生物炭(FMB)作为原料,制备了生物炭负载双金属吸附剂。研究结果表明,FMM和FMB对As(Ⅴ)的吸附随着溶液pH值(3~9)的增加而降低,在实验的pH值的条件下,由于生物炭表面官能团发生质子化而带正电,对含砷阴离子产生了静电吸引作用,说明静电相互作用是As与生物炭之间主要的吸附机理。
4.4 氧化还原氧化还原属于化学吸附,有些生物质基吸附剂具备一些氧化能力,将一些低价态的离子在被吸附的同时,也出现氧化现象。利用生物质基吸附剂处理含As废水时[主要是As(Ⅲ)],吸附剂的表面官能团起到电子受体作用,将As(Ⅲ)氧化成As(Ⅴ),最后达到除As的效果。
Dong等[28]研究了半醌型自由基附着在有机物上然后直接从生物炭中释放出来进行除As实验,研究发现,改性吸附剂触发As(Ⅲ)氧化成As(Ⅴ)。其他研究也证明了,氧化还原会影响水溶液中As的去除[67, 68]。
Wang等[69]利用δ-MnO2改性活性炭制备一种新型吸附剂,并对As(Ⅲ)和As(Ⅴ)的吸附性能进行了研究。研究结果发现,为了提高改性吸附剂对As(Ⅲ)的吸附容量,约93.3%的As(Ⅲ)被氧化成As(Ⅴ),氧化后的As(Ⅴ)与吸附剂表面上的羟基官能团发生离子交换反应,最后达到除As的目的。
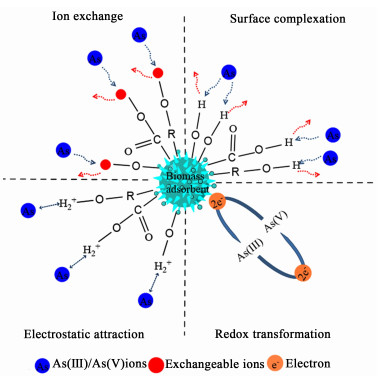
图 3总结概括了生物质基吸附剂对水中As的离子交换、络合作用、静电吸引和氧化还原4种吸附机理。在实际应用过程中,这4个机理有时并不是单独发生的,往往存在着多种吸附机理共同参与,只是以一种吸附机理为主,从而提高生物质基吸附剂对As的吸附性能,这与吸附剂表面的官能团、溶液pH值等因素也有较大的关系。吸附机理的研究非常重要,它可以反映生物质基吸附剂与As的吸附过程,解释吸附剂提高吸附容量和选择性的原理,这样更有助于我们更好的理解吸附过程。
|
| 图 3 生物质基吸附剂去除废水中砷的主要机理 Fig.3 Principal mechanisms of removal arsenic from wastewater by biomass adsorbent |
| |
由于生物质基吸附剂的组成和结构复杂,水体中As存在的形态具有多样性,利用生物质基吸附剂处理含As废水时缺乏统一的标准和理论指导,且生物质基吸附剂的改性机理和吸附机理的过程比较复杂,研究难度较大。迄今为止,生物质基吸附剂在废水处理中的应用仍面临一系列挑战。针对生物质基吸附法在研究和应用中存在的问题,应该从以下3个方面加强研究:
(1) 加强生物质基吸附剂处理As(Ⅲ)废水能力。生物质基吸附剂自身氧化As(Ⅲ)的能力有限,化学药剂预氧化易产生二次污染,可以开发新型简单、高效、稳定的生物质基吸附剂氧化/吸附协同除As(Ⅲ)体系。光催化技术是一种对环境友好的高氧化技术,无需添加其他氧化剂,产生的羟基自由基氧化性强、无选择性,再配合使用生物质基吸附法达到除As的效果,并且理论上光催化剂可以重复使用,节约成本。
(2) 深入生物质基吸附剂的改性研究。生物质基材料种类繁多,表面性能也千差万别,而目前针对生物质基材料的改性方法比较单一,存在一定的盲目性和试探性。有必要对生物质基材料改性进行深入系统的研究,建立和完善统一的理论体系,指导适合不同需求和目的的改性方法,制备出不同性质和用途的吸附剂。
(3) 拓展生物质基材料的吸附应用。生物质基吸附剂具有良好的除As效果,应用前景广阔,但目前大部分生物质基吸附剂仍集中在实验室试验阶段,实际应用进程缓慢。应尽快形成高效、经济的除As工艺,从理论上优化生物质基材料的吸附效果,系统地解释生物质基材料的作用机理。加强生物质基材料的研究与生物除As技术的开发,研发新设备,满足工程上的需要,为工业应用奠定坚实的基础。
| [1] |
MOHAMMED ABDUL K S, JAYASINGHE S S, CHANDANA E P S, et al. Arsenic and human health effects: A review[J]. Environmental Toxicology and Pharmacology, 2015, 40(3): 828-846. DOI:10.1016/j.etap.2015.09.016 |
| [2] |
ZHU H, JIA Y, WU X, et al. Removal of arsenic from water by supported nano zero-valent iron on activated carbon[J]. Journal of Hazardous Materials, 2009, 172(2/3): 1591-1596. |
| [3] |
HOPENHAYN C. Arsenic in drinking water: Impact on human health[J]. Elements, 2006, 2(2): 103-107. DOI:10.2113/gselements.2.2.103 |
| [4] |
FEISTEL U, OTTER P, KUNZ S, et al. Field tests of a small pilot plant for the removal of arsenic in groundwater using coagulation and filtering[J]. Journal of Water Process Engineering, 2016, 14: 77-85. DOI:10.1016/j.jwpe.2016.10.006 |
| [5] |
SABBATINI P, YRAZU F, ROSSI F, et al. Fabrication and characterization of iron oxide ceramic membranes for arsenic removal[J]. Water Research, 2010, 44(19): 5702-5712. DOI:10.1016/j.watres.2010.05.059 |
| [6] |
ORTEGA A, OLIVA I, CONTRERAS K E, et al. Arsenic removal from water by hybrid electro-regenerated anion exchange resin/electrodialysis process[J]. Separation and Purification Technology, 2017, 184: 319-326. DOI:10.1016/j.seppur.2017.04.050 |
| [7] |
曾辉平, 吕赛赛, 杨航, 等. 铁锰泥除砷颗粒吸附剂对As(Ⅴ)的吸附去除[J]. 环境科学, 2018, 39(1): 170-178. ZENG Huiping, LV Saisai, YANG Hang, et al. Arsenic(Ⅴ) removal by granular adsorbents made from backwashing residuals from biofilters for iron and manganese removal[J]. Environmental Science, 2018, 39(1): 170-178. (in Chinese) |
| [8] |
HOCAOGLU S M, WAKUI Y, SUZUKI T M. Separation of arsenic(Ⅴ) by composite adsorbents of metal oxide nanoparticles immobilized on silica flakes and use of adsorbent coated alumina tubes as an alternative method[J]. Journal of Water Process Engineering, 2019, 27: 134-142. DOI:10.1016/j.jwpe.2018.11.014 |
| [9] |
白艳, 王志, 樊智锋, 等. 壳聚糖絮凝-超滤法去除水中微量砷[J]. 膜科学与技术, 2008, 28(3): 87-94. BAI Yan, WANG Zhi, FAN Zhifeng, et al. Removal of trace arsenic from water by chitosan flocculation-ultrafiltration[J]. Membrane Science and Technology, 2008, 28(3): 87-94. DOI:10.3969/j.issn.1007-8924.2008.03.018 (in Chinese) |
| [10] |
IQBAL J, KIM H J, YANG J, et al. Removal of arsenic from groundwater by micellar-enhanced ultrafiltration (MEUF)[J]. Chemosphere, 2007, 66(5): 970-976. DOI:10.1016/j.chemosphere.2006.06.005 |
| [11] |
QIAO J, JIANG Z, SUN B, et al. Arsenate and arsenite removal by FeCl3: Effects of pH, As/Fe ratio, initial As concentration and co-existing solutes[J]. Separation and Purification Technology, 2012, 92: 106-114. DOI:10.1016/j.seppur.2012.03.023 |
| [12] |
张明月, 曾辉平, 吕育锋, 等. 高铁盐与亚铁盐混凝除As(Ⅲ)性能的对比研究[J]. 中国环境科学, 2017, 37(5): 1798-1804. ZHANG Mingyue, ZENG Huiping, LV Yufeng, et al. Comparison of arsenite removal processes by ferric salts and ferrous salts[J]. China Environmental Science, 2017, 37(5): 1798-1804. DOI:10.3969/j.issn.1000-6923.2017.05.024 (in Chinese) |
| [13] |
AMEN R, BASHIR H, BIBI I, et al. A critical review on arsenic removal from water using biochar-based sorbents: The significance of modification and redox reactions[J]. Chemical Engineering Journal, 2020. DOI:10.1016/j.cej.2020.125195 |
| [14] |
邓天天, 施卓, 侯宇梦, 等. 基于纳米凹凸棒@CTS(壳聚糖)的砷离子印迹聚合物吸附特性[J]. 环境化学, 2018, 37(7): 1628-1637. DENG Tiantian, SHI Zhuo, HOU Yumeng, et al. Adsorption of arsenic imprinted polymer based on nano-attapulgite@CTS[J]. Environmental Chemistry, 2018, 37(7): 1628-1637. (in Chinese) |
| [15] |
WANG C, LUO H, ZHANG Z, et al. Removal of As(Ⅲ) and As(Ⅴ) from aqueous solutions using nanoscale zero valent iron-reduced graphite oxide modified composites[J]. Journal of Hazardous Materials, 2014, 268: 124-131. DOI:10.1016/j.jhazmat.2014.01.009 |
| [16] |
YUE C, PENG B, TIAN W, et al. Complete stabilization of severely As-contaminated soil by a simple H2O2 pre-oxidation method combined with non-toxic TMT-15 and FeCl3 ·6H2O[J]. International Journal of Minerals, Metallurgy, and Materials, 2019, 26(9): 1105-1112. DOI:10.1007/s12613-019-1819-4 |
| [17] |
江波. 水体中剧毒性Cr(Ⅵ)和As(Ⅲ)的处理方法及其反应机理研究[D]. 山东东营: 中国石油大学(华东), 2015 JIANG Bo. Remediation of toxic Cr(Ⅵ) and/or as(Ⅲ)-bearing wastewaters and investigation of their reaction mechanisms[D]. Shandong Dongying: China University of Petroleum (Huadong), 2015 (in Chinese) |
| [18] |
YIN Y, ZHOU T, LUO H, et al. Adsorption of arsenic by activated charcoal coated zirconium-manganese nanocomposite: Performance and mechanism[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2019, 575: 318-328. |
| [19] |
王雨. 过氧化氢-二氧化锰体系去除水体中三价砷的效能研究[D]. 哈尔滨: 哈尔滨工业大学, 2020 WANG Yu. Study on the removal efficiency of trivalent arsenic in water by hydrogen peroxide-manganese dioxide system[D]. Harbin: Harbin Institute of Technology, 2020 (in Chinese)] |
| [20] |
YUAN Y, BOLAN N, PRÉVOTEAU A, et al. Applications of biochar in redox-mediated reactions[J]. Bioresource Technology, 2017, 246: 271-281. DOI:10.1016/j.biortech.2017.06.154 |
| [21] |
LU H, LIU X, LIU F, et al. Visible-light photocatalysis accelerates as(Ⅲ) release and oxidation from arsenic-containing sludge[J]. Applied Catalysis B: Environmental, 2019, 250: 1-9. DOI:10.1016/j.apcatb.2019.03.020 |
| [22] |
杨智临. 铁基材料产羟基自由基特征与除砷机制[D]. 北京: 中国地质大学(北京), 2020 YANG Zhilin. Hydroxyl radical production and arsenic removal by iron-bearing materials[D]. Beijing: China University of Geosciences, 2020 (in Chinese) |
| [23] |
KHUNTIA S, MAJUMDER S K, GHOSH P. Oxidation of As(Ⅲ) to As(Ⅴ) using ozone microbubbles[J]. Chemosphere, 2014, 97: 120-124. DOI:10.1016/j.chemosphere.2013.10.046 |
| [24] |
KARIMI A, ANDREESCU S, ANDREESCU D. Single-particle investigation of environmental redox processes of arsenic on cerium oxide nanoparticles by collision electrochemistry[J]. ACS Applied Materials & Interfaces, 2019, 11(27): 24725-24734. |
| [25] |
LI L, YANG Z, YU Z, et al. Study on the oxidation process of as(Ⅲ) in acidic wastewater containing arsenic by electrolysis and ultrasonic coupling[J]. Nature Environment and Pollution Technology, 2018, 17(4): 1419-1425. |
| [26] |
Wang S, Gao B, Li Y, et al. Manganese oxide-modified biochars: Preparation, characterization, and sorption of arsenate and lead[J]. Bioresource technology, 2015, 181: 13-17. DOI:10.1016/j.biortech.2015.01.044 |
| [27] |
NIAZI N K, BIBI I, SHAHID M, et al. Arsenic removal by perilla leaf biochar in aqueous solutions and groundwater: An integrated spectroscopic and microscopic examination[J]. Environmental Pollution, 2018, 232: 31-41. DOI:10.1016/j.envpol.2017.09.051 |
| [28] |
DONG X L, MA L Q, GRESS J, et al. Enhanced Cr(Ⅵ) reduction and As(Ⅲ) oxidation in ice phase: Important role of dissolved organic matter from biochar[J]. Journal of Hazardous Materials, 2014, 267: 62-70. DOI:10.1016/j.jhazmat.2013.12.027 |
| [29] |
ZHONG D, JIANG Y, ZHAO Z, et al. pH dependence of arsenic oxidation by rice-husk-derived biochar: Roles of redox-active moieties[J]. Environmental Science & Technology, 2019, 53(15): 9034-9044. |
| [30] |
ZHANG J, ZHOU W, LIU B, et al. Anaerobic arsenite oxidation by an autotrophic arsenite-oxidizing bacterium from an arsenic-contaminated paddy soil[J]. Environmental Science & Technology, 2015, 49(10): 5956-5964. |
| [31] |
张玉聪, 迟媛媛, 万俊锋, 等. 生物氧化法作为离子交换除砷技术预处理的可行性研究[J]. 应用化工, 2019, 48(12): 2827-2829. ZHANG Yucong, CHI Yuanyuan, WAN Junfeng, et al. Feasibility study of biological oxidation as pretreatment for arsenic removal by ion exchange technology[J]. Applied Chemical Industry, 2019, 48(12): 2827-2829. (in Chinese) |
| [32] |
SIDDIQ O M, TAWABINI B S, SOUPIOS P, et al. Removal of arsenic from contaminated groundwater using biochar: A technical review[J]. International Journal of Environmental Science and Technology, 2022, 19(1): 651-664. DOI:10.1007/s13762-020-03116-x |
| [33] |
耿静. 木质素基重捕剂处理含砷酸性废水研究[J]. 无机盐工业, 2019, 51(12): 65-70. GENG Jing. Study on treatment of arsenic-containing acidic wastewater with lignin-based recapture agent[J]. Inorganic Chemicals Industry, 2019, 51(12): 65-70. DOI:10.11962/1006-4990.2019-0341 (in Chinese) |
| [34] |
WANG X, LIU Y, ZHENG J. Removal of As(Ⅲ) and As(Ⅴ) from water by chitosan and chitosan derivatives: A review[J]. Environmental Science and Pollution Research, 2016, 23(14): 13789-13801. DOI:10.1007/s11356-016-6602-8 |
| [35] |
张琪, 王鼎, 潘远凤, 等. 球磨载铝纤维素对水中砷离子的吸附性能研究[J]. 广东化工, 2019, 46(23): 2-10. ZHANG Qi, WANG Ding, PAN Yuanfeng, et al. Adsorption characteristics of arsenic ions on ball mill-prepared Al oxide/cellulose adsorbents in aqueous system[J]. Guangdong Chemical Industry, 2019, 46(23): 2-10. (in Chinese) |
| [36] |
LATA S, SAMADDER S R. Removal of arsenic from water using nano adsorbents and challenges: A review[J]. Journal of Environmental Management, 2016, 166: 387-406. DOI:10.1016/j.jenvman.2015.10.039 |
| [37] |
郝林林. 改性生物质材料制备及对水中砷吸附性能与处理工艺研究[D]. 哈尔滨: 哈尔滨工业大学, 2017 HAO Linlin. Study on preparation of the modified biomass materials and the adsorption performance of arsenic and its treatment technology[D]. Harbin: Harbin Institute of Technology, 2017 (in Chinese) |
| [38] |
ZHOU Z, LIU Y, LIU S, et al. Sorption performance and mechanisms of arsenic(Ⅴ) removal by magnetic gelatin-modified biochar[J]. Chemical Engineering Journal, 2017, 314: 223-231. DOI:10.1016/j.cej.2016.12.113 |
| [39] |
MONDAL S, AIKAT K, HALDER G. Biosorptive uptake of arsenic(Ⅴ) by steam activated carbon from mung bean husk: Equilibrium, kinetics, thermodynamics and modeling[J]. Applied Water Science, 2017, 7(8): 4479-4495. DOI:10.1007/s13201-017-0596-3 |
| [40] |
CHEN C, CHUNG Y. Arsenic removal using a biopolymer chitosan sorbent[J]. Journal of Environmental Science and Health, Part A, 2006, 41(4): 645-658. DOI:10.1080/10934520600575044 |
| [41] |
LOBO C, CASTELLARI J, COLMAN LERNER J, et al. Functional iron chitosan microspheres synthesized by ionotropic gelation for the removal of arsenic (Ⅴ) from water[J]. International Journal of Biological Macromolecules, 2020, 164: 1575-1583. DOI:10.1016/j.ijbiomac.2020.07.253 |
| [42] |
HASSAN A F, ABDEL-MOHSEN A M, ELHADIDY H. Adsorption of arsenic by activated carbon, calcium alginate and their composite beads[J]. International Journal of Biological Macromolecules, 2014, 68: 125-130. DOI:10.1016/j.ijbiomac.2014.04.006 |
| [43] |
BAJPAI A K. Facile preparation of ionotropically crosslinked chitosan-alginate nanosorbents by water-in-oil (W/O) microemulsion technique: Optimization and study of arsenic (Ⅴ) removal[J]. Journal of Water Process Engineering, 2019. DOI:10.1016/j.jwpe.2019.100920 |
| [44] |
LIU H, LI P, QIU F, et al. Controllable preparation of FeOOH/CuO@WBC composite based on water bamboo cellulose applied for enhanced arsenic removal[J]. Food and Bioproducts Processing, 2020, 123: 177-187. DOI:10.1016/j.fbp.2020.06.018 |
| [45] |
XI C, WANG R, RAO P, et al. The fabrication and arsenic removal performance of cellulose nanocrystal-containing absorbents based on the "bridge joint" effect of iron ions[J]. Carbohydrate Polymers, 2020. DOI:10.1016/j.carbpol.2020.116129 |
| [46] |
HUANG Y, GAO M, DENG Y, et al. Efficient oxidation and adsorption of As(Ⅲ) and As(Ⅴ) in water using a Fenton-like reagent, (ferrihydrite)-loaded biochar[J]. Science of the Total Environment, 2020. DOI:10.1016/j.scitotenv.2020.136957 |
| [47] |
许江城, 康得军, 杨天学, 等. 改性吸附材料处理水体中砷的研究进展[J]. 水处理技术, 2020, 46(10): 6-11. XU Jiangcheng, KANG Dejun, YANG Tianxue, et al. Research progress in the treatment of arsenic in water by modified adsorbent[J]. Technology of Water Treatment, 2020, 46(10): 6-11. (in Chinese) |
| [48] |
CHOI J S, LINGAMDINNE L P, YANG J K, et al. Fabrication of chitosan/graphene oxide-gadolinium nanorods as a novel nanocomposite for arsenic removal from aqueous solutions[J]. Journal of Molecular Liquids, 2020. DOI:10.1016/j.molliq.2020.114410 |
| [49] |
WEI Y, WEI S, LIU C, et al. Efficient removal of arsenic from groundwater using iron oxide nanoneedle array-decorated biochar fibers with high Fe utilization and fast adsorption kinetics[J]. Water Research, 2019. DOI:10.1016/j.watres.2019.115107 |
| [50] |
HAO L, WANG N, WANG C, et al. Arsenic removal from water and river water by the combined adsorption-UF membrane process[J]. Chemosphere, 2018, 202: 768-776. DOI:10.1016/j.chemosphere.2018.03.159 |
| [51] |
ZHOU S, WANG D, SUN H, et al. Synthesis, characterization, and adsorptive properties of magnetic cellulose nanocomposites for arsenic removal[J]. Water, Air, & Soil Pollution, 2014, 225(5): 1-13. |
| [52] |
KHAN Z H, GAO M, QIU W, et al. The sorbed mechanisms of engineering magnetic biochar composites on arsenic in aqueous solution[J]. Environmental Science and Pollution Research International, 2020, 27(33): 41361-41371. DOI:10.1007/s11356-020-10082-x |
| [53] |
曾辉平, 王繁烁, 于亚萍, 等. 壳聚糖海藻酸钠铁锰泥吸附剂制备与除As(Ⅴ)研究[J]. 中国环境科学, 2020, 40(3): 1146-1155. ZENG Huiping, WANG Fanshuo, YU Yaping, et al. Preparation of chitosan-alginate adsorbent contained Fe-Mn sludge and its potential for As(Ⅴ) removal[J]. China Environmental Science, 2020, 40(3): 1146-1155. DOI:10.3969/j.issn.1000-6923.2020.03.026 (in Chinese) |
| [54] |
VITELA-RODRIGUEZ A V, RANGEL-MENDEZ J R. Arsenic removal by modified activated carbons with iron hydro(oxide) nanoparticles[J]. Journal of Environmental Management, 2013, 114: 225-231. DOI:10.1016/j.jenvman.2012.10.004 |
| [55] |
ZENG H, YU Y, WANG F, et al. Arsenic(Ⅴ) removal by granular adsorbents made from water treatment residuals materials and chitosan[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2020. DOI:10.1016/j.colsurfa.2019.124036 |
| [56] |
VELAZQUEZ-JIMENEZ L H, ARCIBAR-OROZCO J A, RANGEL-MENDEZ J R. Overview of As(Ⅴ) adsorption on Zr-functionalized activated carbon for aqueous streams remediation[J]. Journal of Environmental Management, 2018, 212: 121-130. DOI:10.1016/j.jenvman.2018.01.072 |
| [57] |
NIETO-DELGADO C, GUTIÉRREZ-MARTÍNEZ J, RANGEL-MÉNDEZ J R. Modified activated carbon with interconnected fibrils of iron-oxyhydroxides using Mn2+ as morphology regulator, for a superior arsenic removal from water[J]. Journal of Environmental Sciences, 2019, 76: 403-414. DOI:10.1016/j.jes.2018.06.002 |
| [58] |
SHERLALA A I A, RAMAN A A A, BELLO M M, et al. Adsorption of arsenic using chitosan magnetic graphene oxide nanocomposite[J]. Journal of Environmental Management, 2019, 246: 547-556. DOI:10.1016/j.jenvman.2019.05.117 |
| [59] |
ZHANG L, ZHU T, LIU X, et al. Simultaneous oxidation and adsorption of As(Ⅲ) from water by cerium modified chitosan ultrafine nanobiosorbent[J]. Journal of Hazardous Materials, 2016, 308: 1-10. DOI:10.1016/j.jhazmat.2016.01.015 |
| [60] |
RAHMAN H L, ERDEM H, SAHIN M, et al. Iron-incorporated activated carbon synthesis from biomass mixture for enhanced arsenic adsorption[J]. Water, Air, & Soil Pollution, 2019, 231(1): 1-17. |
| [61] |
NAVARATHNA C M, KARUNANAYAKE A G, GUNATILAKE S R, et al. Removal of Arsenic(Ⅲ) from water using magnetite precipitated onto Douglas fir biochar[J]. Journal of Environmental Management, 2019. DOI:10.1016/j.jenvman.2019.109429 |
| [62] |
SATTAR M S, SHAKOOR M B, ALI S, et al. Comparative efficiency of peanut shell and peanut shell biochar for removal of arsenic from water[J]. Environmental Science and Pollution Research International, 2019, 26(18): 18624-18635. DOI:10.1007/s11356-019-05185-z |
| [63] |
VITHANAGE M, HERATH I, JOSEPH S, et al. Interaction of arsenic with biochar in soil and water: A critical review[J]. Carbon, 2017, 113: 219-230. DOI:10.1016/j.carbon.2016.11.032 |
| [64] |
ARCIBAR-OROZCO J A, JOSUE D B, RIOS-HURTADO J C, et al. Influence of iron content, surface area and charge distribution in the arsenic removal by activated carbons[J]. Chemical Engineering Journal, 2014, 249: 201-209. DOI:10.1016/j.cej.2014.03.096 |
| [65] |
MERODIO-MORALES E E, REYNEL-ÁVILA H E, MENDOZA-CASTILLO D I, et al. Lanthanum- and cerium-based functionalization of chars and activated carbons for the adsorption of fluoride and arsenic ions[J]. International Journal of Environmental Science and Technology, 2020, 17(1): 115-128. DOI:10.1007/s13762-019-02437-w |
| [66] |
WANG S, GAO B, LI Y, et al. Sorption of arsenate onto magnetic iron-manganese (Fe-Mn) biochar composites[J]. RSC Advances, 2015, 5(83): 67971-67978. DOI:10.1039/C5RA12137J |
| [67] |
VEGA-HERNANDEZ S, WEIJMA J, BUISMAN C J N. Particle size control of biogenic scorodite during the GAC-catalysed As(Ⅲ) oxidation for efficient arsenic removal in acid wastewaters[J]. Water Resources and Industry, 2020. DOI:10.1016/j.wri.2020.100128 |
| [68] |
VEGA-HERNANDEZ S, WEIJMA J, BUISMAN C J N. Immobilization of arsenic as scorodite by a thermoacidophilic mixed culture via As(Ⅲ)-catalyzed oxidation with activated carbon[J]. Journal of Hazardous Materials, 2019, 368: 221-227. DOI:10.1016/j.jhazmat.2019.01.051 |
| [69] |
WANG Y, LIU H, WANG S, et al. Simultaneous removal and oxidation of arsenic from water by δ-MnO2 modified activated carbon[J]. Journal of Environmental Sciences, 2020, 94: 147-160. DOI:10.1016/j.jes.2020.03.006 |
 2022, Vol. 39
2022, Vol. 39





