聚氯乙烯(Polyvinyl Chloride,PVC)是五大通用塑料之一,氯乙烯单体是生产聚氯乙烯的主要原料,具有不饱和双键结构,可以与多种单体发生共聚,最终被加工成各种管材、薄膜、建材等实用化工产品[1, 2]。其生产工艺主要有乙烯氧氯法、平衡氧氯法和电石乙炔法[3]。我国工业生产氯乙烯采用以煤炭为原料的乙炔法,目前所用的HgCl2易挥发,危害生态环境和人类健康,因此,亟需开发一种新型的非汞催化剂[4]。
20世纪60~90年代,Smith、Hutchings及Shinoda等[5-8]通过实验,将催化剂活性与金属离子电子亲和势相关联,验证了AuCl3催化剂的初始催化活性远高于HgCl2和PdCl2。与此同时,他们发现AuCl3催化剂在反应过程中失活较快,催化稳定性较差。
Xu等[9]通过DFT计算,探讨了Au催化体系引入离子液体后,催化反应的路径和机理。李小年课题组[10]采用负载的方式制备了Au-IL/AC催化剂,在温度180 ℃、乙炔空速370 h-1、HCl与C2H2气速比为1.2时,乙炔转化率可达72%。Zhao等[11]制备了Au-Cu-IL/AC催化剂,在170 ℃、乙炔空速740 h-1、HCl与C2H2气速比为1.2时,乙炔转化率可达76.7%,明显高于Au-IL/AC。
近年来,金属钌(Ru)因具有高活性、低价格和环境友好的特点,有望成为无汞催化体系的核心。张金利课题组[12]制备了1%Ru@15%TPPB/AC(质量比,下同)催化剂,在温度为170 ℃、乙炔空速为360 h-1的条件下在48 h内,乙炔转化率可达99.7%。
2018年,李航等[13]以氯化胆碱为配体,制备了0.2%Ru-10%ChCl/AC(wt)催化剂,在温度170 ℃、乙炔空速900 h-1的条件下,反应进行25 h,乙炔转化率可达87.5%,氯乙烯选择性超过99.3%,表征分析ChCl的加入使反应过程中高价态的Run+含量增多。
与气固相反应相比,气液相反应具有温度均一、传质优异的特点。不易挥发,溶解能力强的离子液体脱颖而出。Hu等[14]将金属纳米粒子(NPs)束缚在阴离子表面活性离子液体(ASC-ILs)中,得到NPs/ASC-ILs催化剂。在温度180 ℃,浓度为0.038 mol·L-1时,Pd-NPs/[P4444][C17COO]具有最佳催化效果,乙炔转化率可达93%。随后,为了降低体系黏度,该小组[15]加入正十四烷作为稀释剂,得到两相体系的催化剂,在由下而上的气流带动下,NPs@IL液滴成为独立的微反应器单元。
Zhou等[16]采用1-烷基-3-甲基咪唑类无金属离子液体催化剂,研究了阴、阳离子种类对催化性能的影响。当使用[Bmim]Br时,反应初期溴乙烯是主要的反应产物,随着反应继续,溴乙烯逐渐减少而氯乙烯成为主要产物,证明离子液体的阴离子参与反应,经理论模拟得出液相催化体系中N杂环类离子液体的阴离子以Cl-离子为最适宜。
2019年,任雁飞等[17]制得N-甲基吡咯烷酮盐酸盐,与CuCl合成制备得到氯亚铜酸离子液体应用于乙炔氢氯化液相反应,在温度180 ℃、乙炔空速50 h-1、HCl/C2H2气速比为1.2的条件下,乙炔转化率达到86%。
基于上述研究指导,本研究制备了N-甲基吡咯烷酮盐酸盐([Hnmpo]Cl)为液相乙炔氢氯化催化反应溶剂,以Ru为催化活性中心,制备了氯钌酸离子液体,测试了催化性能,随后加入Sn构成双金属催化体系,在最优反应条件下评价了催化性能,并针对积碳、稳定性以及活性组分价态变化做了表征分析和理论计算,研究了影响其稳定性的因素,从分子角度揭示了HCl和C2H2在离子液体上的吸附行为,并提出了循环催化反应机理。
1 实验部分 1.1 试剂与仪器三氯化钌(RuCl3),氯化亚锡(SnCl2),1-丁基-3甲基咪唑氯盐([Bmim]Cl),1-己基-3甲基咪唑氯盐([Hmim]Cl),四丁基氯化磷([P4444]Cl),四丁基氯化铵([N4444]Cl),皆为分析纯,上海迈瑞尔化学品有限公司; N-甲基吡咯烷酮(NMP),分析纯,上海阿拉丁生化科技股份有限公司; 无水乙醇(C2H5OH),乙酸乙酯(C2H5OOCCH3),蒸馏水(H2O),氢氧化钠(NaOH),分析纯,天津市元立化工技术有限公司; 高纯氮气(N2),体积分数为99.999%,高纯氢气(H2),体积分数为99.999%,天津环宇气体有限责任公司; 氯化氢(HCl),体积分数为99.9%,乙炔(C2H2),体积分数为99.9%,东祥特种气体有限公司。
质量流量计,S4932/MT,北京堀场汇博隆精密仪器有限公司; 色谱工作站,Vostro 270-R 586,戴尔(中国)有限公司; 气相色谱仪,3420 A,北京北分瑞利分析仪器有限公司。
1.2 离子液体催化剂的制备 1.2.1 [Hnmpo]Cl的制备将100 mL(物质的量1.037 mol)的N-甲基吡咯烷酮(NMP)加入烧瓶中,搅拌加热到60 ℃,持续通入纯净氮气排净空气,1 h后升温至120 ℃,用质量流量计控制氯化氢流速为21.5 mL·min-1,设置NaOH溶液为尾气吸收,持续20 h之后停止通气,将体系密闭120 ℃恒温搅拌12 h。将瓶中液体用乙酸乙酯洗涤抽滤共3次,以除去未反应的原料,得到白色晶体,在60 ℃下真空干燥12 h,即可得[Hnmpo]Cl。
测量制得[Hnmpo]Cl的1H NMR以确定其纯度。N-甲基吡咯烷酮盐酸盐[Hnmpo]Cl:1H NMR (400 MHz, DMSO-d6,δ ppm) 1.83~1.97 (m, 2H, NCH2), 2.18 (t, 2H, CH2), 2.69 (d, 3H, NCH3), 3.30 (td, 2H, COCH2), 13.20 (s, 1H, NH)。
1.2.2 离子液体催化剂的制备在氮气的保护下,将[Hnmpo]Cl置于烧瓶中,在120 ℃下把RuCl3一次性加入到烧瓶中,恒温混合搅拌24 h,即可得到[Hnmpo]Cl-RuCl3 IL。
RuCl3-SnCl2/[Hnmpo]Cl IL的制备方法与之相同。使用x, y表示离子液体的组成,x=n(RuCl3)/V(IL),y=n(SnCl2)/V(IL),单位为mol·L-1,表示为xRuCl3-ySnCl2/[Hnmpo]Cl IL。
1.3 催化剂催化活性的评价使用如图 1所示的装置测试了离子液体对乙炔氢氯化反应的催化性能。
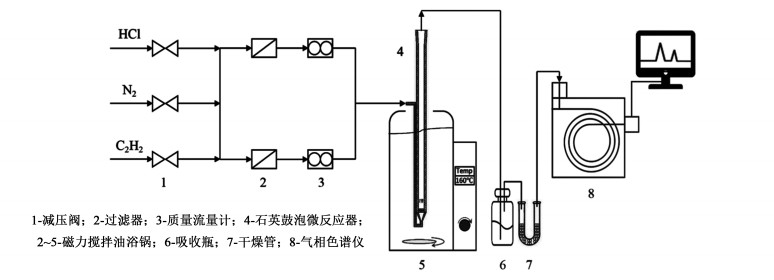
|
| 图 1 催化活性评价装置 Fig.1 Experimental setup for catalyst testing |
| |
反应气体氯化氢和乙炔分别由无水氯化钙和变色硅胶干燥,然后通过过滤器,由经皂膜流量计校正过的质量流量计控制流量,混合后进入反应管。反应管内装有12 mL离子液体,并在反应前使用氮气吹扫除去水和空气,然后通入氯化氢30 min,随后再将乙炔通过反应管。一般操作条件下,氯化氢气态流量为11.5 mL·min-1,乙炔气态流量为10 mL·min-1,HCl/C2H2气速比为1.15,此时的乙炔空速为50 h-1。气体在管内反应之后,管口上方出气首先经过装有氢氧化钠溶液的尾气吸收瓶以除去未反应的氯化氢,气流随后通过装有无水氯化钙颗粒的U型管脱水,最后经过四通阀进入到气相色谱仪进行在线分析检测。气相色谱仪使用氢火焰离子化检测器,色谱柱为2 m × Φ 4 mm的GDX-301填充柱,色谱柱温度是100 ℃,气化室温度是120 ℃,检测器温度是150 ℃,使用高纯氮气为载气,氮气、氢气和空气的气速分别为30、30和300 mL·min-1。
1.4 计算方法通过气相色谱结果,使用面积归一法计算乙炔转化率(X)和氯乙烯选择性(S),考虑到反应后氯化氢被氢氧化钠溶液吸收,在反应过程中体系的体积可以认为是恒定的,计算方程式如式(1)和(2):
| $ \begin{gathered} X=\left(1-\varphi_{\mathrm{A}}\right) \times 100 \% \end{gathered} $ | (1) |
| $ S=\frac{\varphi_{\mathrm{VCM}}}{1-\varphi_{\mathrm{A}}} \times 100 \% $ | (2) |
(1) 和(2)中:φA为产物中剩余乙炔体积分数; φVCM为氯乙烯体积分数。
2 结果与讨论 2.1 工艺条件 2.1.1 阳离子种类的影响结合之前的研究考虑到以不同氮杂环、磷受体为阳离子的盐酸盐均可与金属氯化物形成具有高催化活性的离子液体催化剂,出于对HCl分子活化机理的考虑,统一选择阳离子的盐酸盐即[Bmim]Cl、[Hmim]Cl、[P4444]Cl、[N4444]Cl和[Hnmpo]Cl分别与0.007 5 mol·L-1的RuCl3制备成离子液体催化剂,在乙炔空速为40 h-1、温度为160 ℃、HCl/C2H2气速比为1.15的条件下测试了RuCl3摩尔浓度均为0.007 5 mol·L-1的离子液体的催化性能。评价结果见图 2。
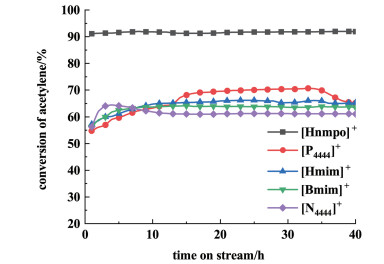
|
| 图 2 阳离子种类对催化性能的影响 Fig.2 Effect of types of cation rings on catalytic performance |
| |
从图 2中可以看到1-烷基-3甲基咪唑氯盐、季膦盐和季铵盐分别与RuCl3混合形成的离子液体催化剂的催化性能相差不大,乙炔转化率不超过70.5%。[Hnmpo]Cl-RuCl3的催化性能表现最佳,反应25 h乙炔转化率为91.3%,而且40 h内转化率无下降趋势,可以认为[Hnmpo]Cl在以Ru为活性中心的离子液体体系种有极其重要的作用。
2.1.2 筛选反应条件随后,考察了离子液体中RuCl3摩尔浓度、乙炔空速、反应温度和反应气体气速比对反应活性的影响,命名[Hnmpo]Cl-xRuCl3 IL,x代表RuCl3的摩尔浓度,单位为mol·L-1,筛选结果见图 3。
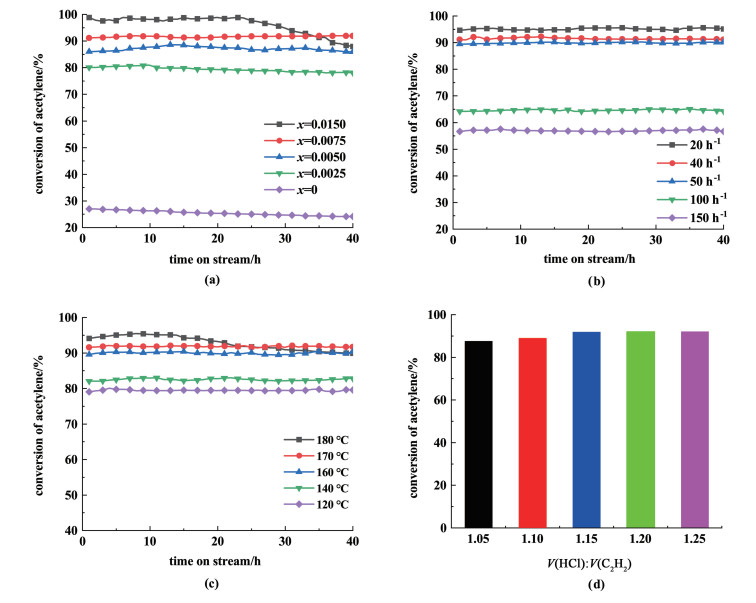
|
| 图 3 [Hnmpo]Cl-xRuCl3 IL在不同条件下的催化活性(a)Ru摩尔浓度的影响; (b)乙炔空速的影响; (c)反应温度的影响; (d)HCl与C2H2气速比的影响 Fig.3 Catalytic activity of [Hnmpo]Cl-xRuCl3 IL under different conditions by the influence of (a) Ru molar concentration; (b)space velocity of acetylene; (c)reaction temperature; (d)the ratio of HCl/C2H2 |
| |
筛选出最适宜反应条件为RuCl3摩尔浓度0.007 5 mol·L-1、反应温度170 ℃、50 h-1的乙炔空速以及HCl/C2H2气速比为1.15。
在此条件下对[Hnmpo]Cl-xRuCl3 IL的寿命进行了测试,结果见图 4(c),乙炔转化率在140 h内可保持在89.6%以上,为了进一步提升催化稳定性,考虑对离子液体改性处理。
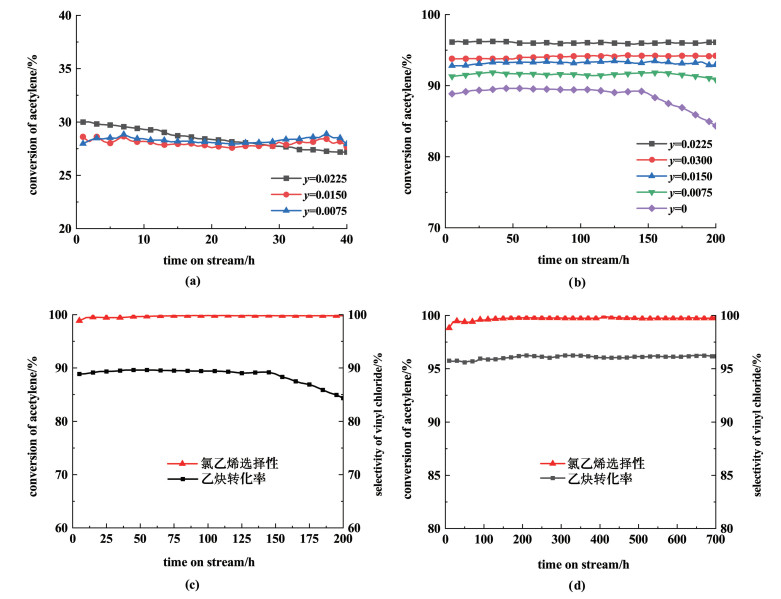
|
| 图 4 (a)[Hnmpo]Cl-ySnCl2 IL的催化活性; (b)金属摩尔的影响; (c)复配前的寿命; (d)复配后的寿命 Fig.4 (a)Catalytic activity of [Hnmpo]Cl-ySnCl2 IL; (b)catalytic performance as a function of the ratio of Ru and Sn; (c)life before compounding; (d)life after compounding |
| |
结合之前的研究[17]发现,体系内较多的HCl不仅可以防止[Hnmpo]Cl的分解,还可以有效避免Ru因吸附过多的C2H2而被还原,从增强对HCl的吸附出发,考虑到SnCl2在液态环境中与HCl有较强的结合能力,因此加入SnCl2构成双金属催化体系以增强对HCl的吸附能力,相关反应见式(3)。
| $ \mathrm{SnCl}_{2}+2 \mathrm{HCl} \rightarrow \mathrm{SnCl}_{4}^{2-}+2 \mathrm{H}^{+} $ | (3) |
首先使用SnCl2与[Hnmpo]Cl混合制备了[Hnmpo]Cl-ySnCl2 IL,y代表SnCl2的摩尔浓度,单位为mol·L-1,在反应温度170 ℃、乙炔空速50 h-1、HCl/C2H2气速比为1.15的条件下考察了SnCl2单组分的催化活性,结果见图 4(a)。可以看出,在相同的反应条件下,[Hnmpo]Cl-ySnCl2 IL的催化性能与纯[Hnmpo]Cl的催化性能相差无几,可以证明Sn物种对催化活性没有贡献。
随后制备了n(Ru)∶n(Sn)分别为1∶1,1∶2,1∶3和1∶4的xRuCl3-ySnCl2/[Hnmpo]Cl离子液体催化剂(x=0.007 5 mol·L-1),测试了其催化性能,结果见图 4(b),可以看出,不加入SnCl2时,反应140 h之后乙炔转化率开始逐渐下降,当Ru/Sn物质的量之比为1∶3,反应200 h之内,乙炔转化率最高可达96.1%,且稳定性良好,所以继续对其进行寿命测试,结果见图 4(d),可以看出,优化后的双金属催化剂在反应700 h内,乙炔转化率保持在96.1%,氯乙烯选择性保持在99.7%,表现出了极强的稳定性。
2.2 离子液体的表征为了探究影响催化反应活性和催化稳定性的因素,对单金属离子液体和双金属离子液体做了一系列表征分析(2.2节中所有离子液体催化剂,x=0.007 5, y=0.022 5, 单位均为mol·L-1)。
2.2.1 离子液体的阴、阳离子结构为了确认阴、阳离子的具体形态,分别研究了[Hnmpo]Cl-xRuCl3在正负离子模式下的高分辨质谱(ESI-MS),结果见图 5。
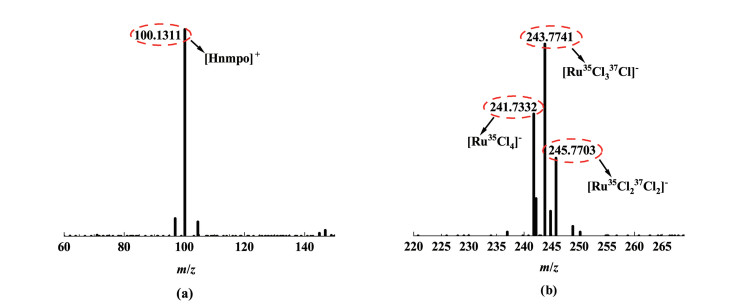
|
| 图 5 [Hnmpo]Cl-xRuCl3 IL的电喷雾质谱图(a)正离子模式; (b)负离子模式 Fig.5 ESI-MS spectra of [Hnmpo]Cl-xRuCl3 IL (a)positive ion mode; (b)negative ion mode |
| |
从图 5(a)可以看出,[Hnmpo]Cl-xRuCl3 IL中存在N-甲基吡咯烷酮的阳离子[Hnmpo]+,其中,正离子模式分子离子峰的质荷比m/z为100.131 1,理论质荷比为100.131 0,表征结果与理论值是一致的。图 5(b)显示[Hnmpo]Cl-xRuCl3 IL中存在RuCl4-离子,其中,负离子模式分子离子峰的质荷比m/z分别为241.733 2、243.774 1和245.770 3,分别对应3种不同同位素组合下的RuCl4-(44102Ru1735Cl4-、44102Ru1737Cl1735Cl3-和44102Ru1735Cl21737Cl2-)。RuCl4-的理论质荷比为242.884 8,表征结果与理论值是一致的。
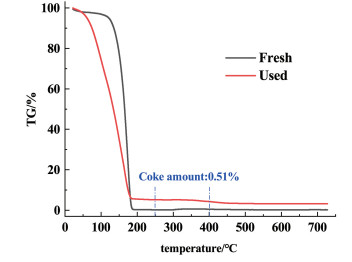
2.2.2 离子液体的积碳量由乙炔、氯乙烯或反应中生成的低聚物聚合所引起的积碳,是乙炔氢氯化反应中固体催化剂失活的常见原因之一。为了测量反应过程中生成的焦炭含量,在空气气氛下使用TGA对反应前后的[Hnmpo]Cl-xRuCl3 IL进行了测试。图 6显示了新鲜的和在温度170 ℃、50 h-1乙炔空速下反应48 h后的离子液体的TGA结果。
|
| 图 6 新鲜和反应后的[Hnmpo]Cl-xRuCl3 IL在空气氛围下的TGA曲线 Fig.6 TGA curves of the fresh and used [Hnmpo]Cl-xRuCl3 IL in air atmosphere |
| |
反应中生成的焦炭所引起的失量主要在250~400 ℃温度范围内[18]。可以计算出,反应过程中积碳量仅为0.51%,可以认为[Hnmpo]Cl-xRuCl3 IL在液相体系催化乙炔氢氯化反应能够较好抑制积碳生成,展现出均相体系的最明显优势。
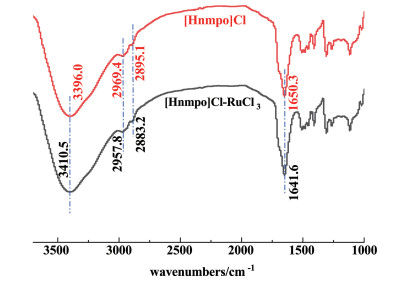
2.2.3 离子液体的分子间作用力研究了[Hnmpo]Cl和[Hnmpo]Cl-xRuCl3 IL的FTIR谱,结果见图 7。
|
| 图 7 [Hnmpo]Cl-xRuCl3 IL和[Hnmpo]Cl的FTIR谱图 Fig.7 FTIR spectra of [Hnmpo]Cl-xRuCl3 IL and [Hnmpo]Cl |
| |
从图 7中可以看出,[Hnmpo]Cl与RuCl3形成[Hnmpo]Cl-xRuCl3 IL之后,位于3 396.0 cm-1处的N—H伸缩振动峰向更高的波数移动了14.5 cm-1,烷基C—H伸缩振动峰都发生红移至更低的波数,C=O伸缩振动峰从1 650.3 cm-1红移至1 641.6 cm-1。这些特征峰的变化都表明了[Hnmpo]Cl-xRuCl3 IL中的NMP阳离子与含Ru阴离子之间确实存在较强的相互作用力,可能主要归结于C—H…Cl氢键作用力。
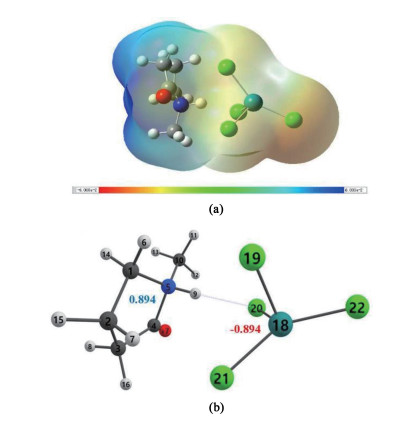
为了从分子与化学键的角度揭示离子液体的阴、阳离子的作用方式,我们计算了[Hnmpo]Cl-xRuCl3 IL的静电势(Electrostatic potential)、自然布局分析(Natural population analysis, NPA)以及HCl分子的吸附结构。所有理论计算结果如图 8和图 9所示。
|
| 图 8 新鲜[Hnmpo]Cl-xRuCl3 IL的(a)静电势; (b)分子间氢键, IL+与IL-的NPA电荷分别用蓝色(正电)和红色(负电)数字表示 Fig.8 (a)Electrostatic potential and (b)intermolecular hydrogen-bonding of fresh [Hnmpo]Cl-xRuCl3 IL with IL+ and IL- NPA charges represented in blue(e+) and red(e-) |
| |
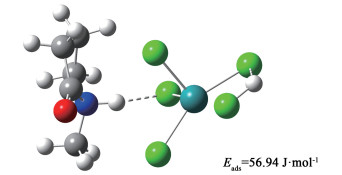
|
| 图 9 HCl分子吸附在[Hnmpo]Cl-xRuCl3 IL上的结构 Fig.9 Structure of [Hnmpo]Cl-xRuCl3 IL adsorbing HCl |
| |
图 8(a)显示,[Hnmpo]Cl-xRuCl3 IL形成了2个明确的带电基团,RuCl3与[Hnmpo]Cl结合后,由于Cl原子的配位作用,形成了极性更大的RuCl4-阴离子,成为体系里的负电荷中心,在催化反应中提供亲核位点,同时,亲电位点Ru被这些亲核配体环绕,这将更有利于Ru对C2H2分子的吸附作用。
此外,图 8(b)说明2个带电基团并不是传统意义上溶液内的阴、阳离子,正、负电基团将一部分电荷离域,贡献给分子间作用力,表现为[Hnmpo]+与RuCl4-之间的H…Cl氢键,即电荷辅助氢键(Charge-assisted hedrogen bond, CAHB)[24],并且CAHB的键合强度相当于共价键,这说明H…Cl增强了离子液体的热稳定性。
2.2.4 离子液体的热稳定性对新鲜的[Hnmpo]Cl-xRuCl3 IL作了热重-红外光谱联用分析(TG-IR),研究其分解温度及对应分解产物,结果见图 10和图 11。
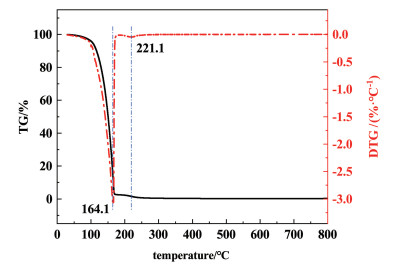
|
| 图 10 新鲜[Hnmpo]Cl-xRuCl3 IL在氮气气氛下的TGA-DTG曲线 Fig.10 TGA-DTG curves of fresh [Hnmpo]Cl-xRuCl3 IL in N2 atmosphere |
| |
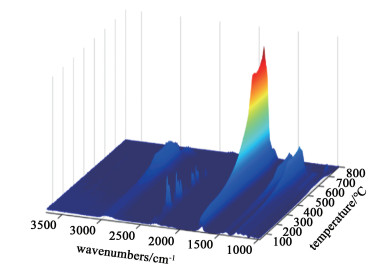
|
| 图 11 [Hnmpo]Cl-xRuCl3 IL在TGA升温过程中得到的同步三维FTIR谱图 Fig.11 3D FTIR spectra of [Hnmpo]Cl-xRuCl3 IL with TGA heating |
| |
结合图 10的2条曲线可以看出,离子液体在升温过程中有2个不同的失量过程。首先是100~164.1 ℃,对应于占离子液体绝大比重的游离[Hnmpo]Cl受热分解挥发,164~288 ℃的失量过程则主要是与极低浓度的RuCl3结合形成离子液体的极少部分[Hnmpo]Cl的分解挥发。这2个过程分界明显,证明[Hnmpo]Cl-xRuCl3 IL中确实存在与计算结果相符的分子间氢键。
从图 11可以清晰地看出不同温度下的特征峰位置完全一致,处于3 010.1~2 807.6 cm-1内的宽峰对应HCl分子的H—Cl伸缩振动,1 736.1 cm-1处的强峰则因NMP分子的C=O伸缩振动引起[25],1 308.2~1 389.2 cm-1的2处峰可归因于NMP分子的C—N伸缩振动,说明分解产物只有NMP和HCl分子,证明离子液体在持续通入HCl的环境下是热稳定的。
使用ICP-OES测量了新鲜和反应36 h之后的xRuCl3-ySnCl2/[Hnmpo]Cl IL中Ru元素含量,结果如表 1所示,可以看出,反应前后离子液体中的Ru含量与标准值都非常接近,证明活性物种在反应过程中并无损失。
| Sample | The content of Ru/% | |
| Nominal | Actual | |
| Fresh | 0.0432 4 | 0.0432 2 |
| Used | 0.0431 9 | 0.0432 1 |
通过XPS测量新鲜和反应后的双金属离子液体,得到的全谱图和表面化学元素组成分别显示于表 2和图 12中。
| Sample | Fresh | Used | |
| The surface atomic composition of IL (atom%) | C 1s | 61.99 | 78.67 |
| N 1s | 8.62 | 3.90 | |
| O 1s | 16.77 | 14.63 | |
| Cl 2p | 10.39 | 1.81 | |
| Sn 3d | 1.62 | 0.71 | |
| Ru 3p | 0.61 | 0.28 | |
| Ru/N | 0.071 | 0.072 | |
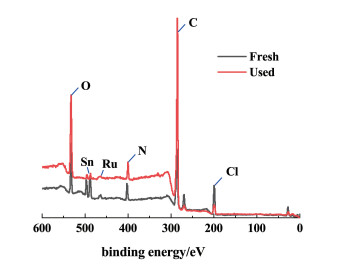
|
| 图 12 新鲜和反应后xRuCl3-ySnCl2/[Hnmpo]Cl IL的XPS全谱图 Fig.12 XPS sweep scan of the fresh and the used xRuCl3-ySnCl2/[Hnmpo]Cl IL |
| |
如图 12所示,反应前后的XPS全谱图曲线基本相同。由表 2可以得到,反应前后Ru/N原子比分别为0.071和0.072,基本没有变化,结合ICP-OES中Ru含量的数据,证明xRuCl3-ySnCl2/[Hnmpo]Cl IL在反应过程中可以保持稳定,活性组分与[Hnmpo]Cl几乎无损失。
2.2.5 离子液体中的Ru物种价态乙炔氢氯化反应过程中金属活性组分发生价态变化也是催化剂失活的主要原因之一[19, 20],因此使用XPS表征分析了新鲜和反应后的xRuCl3-ySnCl2/[Hnmpo]Cl IL中Ru的价态变化。
首先,在XPS分析中选用Ru 3p轨道来分析,这是由于Ru 3d轨道的结合能与C 1s轨道的结合能会发生重合而对分析造成干扰[21]。因此,为了得到清晰的卷积结果,采用信号较强的Ru 3p3/2。图 13与表 3分别为Ru 3p3/2峰的去卷积谱图和Ru物种的相对含量。
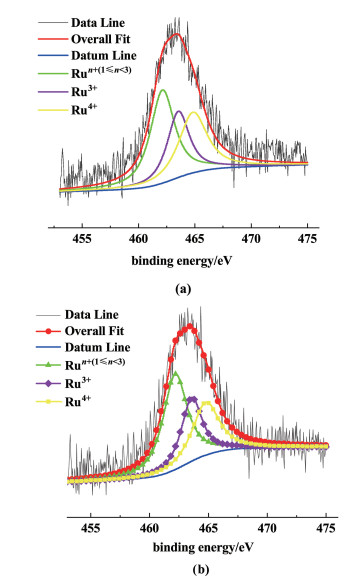
|
| 图 13 新鲜和反应后xRuCl3-ySnCl2/[Hnmpo]Cl IL的Ru 3p3/2 XPS图谱(a)fresh; (b)used Fig.13 Deconvolution profiles of Ru 3p3/2 XPS spectrum of the fresh and used xRuCl3-ySnCl2/ [Hnmpo]Cl IL (a)fresh; (b)used |
| |
| Status | Area/% | |||
| Run+(1≤n < 3) | Ru3+ | Ru4+ | ||
| xRu | Fresh | 35.17 | 31.01 | 33.82 |
| Used | 43.83 | 26.26 | 29.91 | |
| xRu-ySn | Fresh | 41.85 | 26.74 | 31.41 |
| Used | 45.95 | 26.05 | 28.00 | |
从图 13可以看出,反应前后离子液体催化剂样品的Ru含3个价态,结合文献报道[12, 21, 22],液态催化剂中Ru物种主要存在3种类型,其分别为:Run+(1≤n < 3)[462.3(±0.3) eV]、Ru3+[463.5(±0.3) eV]、Ru4+[464.8(±0.2) eV]。
表 3显示,xRuCl3-ySnCl2/[Hnmpo]Cl IL在反应过程中,高价态的Ru物种Ru3+和Ru4+被还原成低价Run+的比例大大减小,据文献报道[21, 22],高价态Ru含量是活性与稳定性的决定性因素,说明Sn的加入有效抑制了高价态Ru的还原,延长了催化剂寿命。
2.2.6 Sn金属复配的影响采用UV-Vis检测离子液体中可能存在的配合物。
图 14为新鲜和反应36 h后,离子液体的紫外可见吸收光谱。可以发现,反应前后2种离子液体在222 nm左右都出现了强吸收峰,这对应于N-甲基吡咯烷酮[26]和Ru3+与[Hnmpo]Cl形成的配合物[27, 28]。除了新鲜的[Hnmpo]Cl-RuCl3 IL,其它3条曲线都在264 nm附近出现了1个很弱的吸收峰,更明显的是,新鲜的xRuCl3-ySnCl2/[Hnmpo]Cl IL在264 nm附近同样存在吸收峰,说明在反应前,SnCl2的加入就可以使Ru形成新配合物。
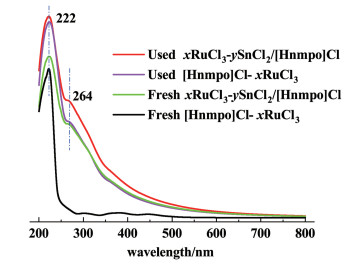
|
| 图 14 新鲜和反应后[Hnmpo]Cl-xSnCl2 IL和xRuCl3-ySnCl2/[Hnmpo]Cl IL的UV-Vis曲线 Fig.14 UV-Vis spectra of the [Hnmpo]Cl-xSnCl2 IL and xRuCl3-ySnCl2/[Hnmpo]Cl IL |
| |
为了研究加入Sn组分后,对离子液体阴、阳离子基团带电量和分子间作用力的影响,计算了新鲜xRuCl3-ySnCl2/[Hnmpo]Cl IL的静电势和自然布局分析(NPA),结果如图 15所示。
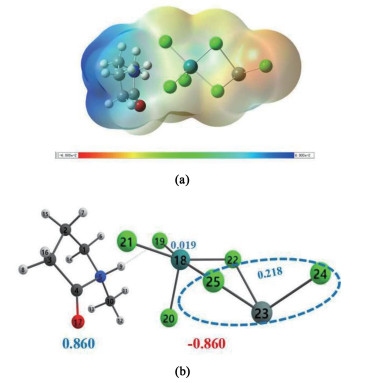
|
| 图 15 新鲜xRuCl3-ySnCl2/[Hnmpo]Cl IL的(a)静电势; (b)分子间氢键, IL+与IL-的NPA电荷分别用蓝色(正电) 和红色(负电)数字表示 Fig.15 (a)Electrostatic potential and (b)intermolecular hydrogen-bonding of fresh xRuCl3-ySnCl2/[Hnmpo]Cl IL with IL+and IL- NPA charges represented in blue(e+) and red(e-) |
| |
图 15(a)显示,SnCl2的引入给Ru提供了新的Cl原子配位,形成[RuCl3-(Cl)2-SnCl]-阴离子。图 15(b)显示,双金属离子液体的NPA电荷更小,说明H…Cl更强,分子间共价作用力更大使体系更稳定。
2.2.7 气体分子在离子液体上的吸附行为随后,我们计算了2种离子液体吸附HCl和C2H2时的吸附能以及相应结构的分子轨道能量。
HCl和C2H2在[Hnmpo]Cl-xRuCl3上的吸附能ΔE分别为-56.85和-82.76 kJ·mol-1,证明离子液体对HCl和C2H2有很强的吸附能力,与较高的催化活性相符。加入SnCl2后,主要增强了离子液体对HCl的吸附能力,提升了HCl占据催化剂表面活性位点的竞争力,揭示了催化稳定性得到显著提升的内在规律。
| IL catalyst | ΔE/(kJ·mol-1) | |
| HCl | C2H2 | |
| [Hnmpo]Cl-xRuCl3 | -56.85 | -82.76 |
| xRuCl3-ySnCl2/[Hnmpo]Cl | -70.64 | -86.94 |
前线轨道是化学反应中最活跃的轨道,能量差代表电子跃迁的难易程度。吸附过程中电子从离子液体向HCl转移形成氢键,因此HOMO能量越高表示越易吸附活化HCl,而C2H2通常作为给电子体与金属原子络合形成π键被吸附,因此LUMO能量越低表示越易接受电子吸附和活化C2H2。
表 5显示,xRuCl3-ySnCl2/[Hnmpo]Cl IL的HOMO能量比[Hnmpo]Cl-xRuCl3 IL显著升高,证明离子液体吸附HCl的能力得到增强。xRuCl3-ySnCl2/[Hnmpo]Cl_C2H2拥有更高的HOMO能量,说明其在先吸附C2H2后继续吸附HCl分子的能力更强,提高了HCl的吸附竞争力。另外,计算出2种IL_C2H2的LUMO-HOMO能级差分别为2.729和3.431 eV,分子内电子跃迁所需的能量显著增大,同结构的LUMO-HOMO能级差代表了其发生二聚的能力,数值越小表示越容易发生,因此[Hnmpo]Cl-xRuCl3_C2H2更容易发生二聚,双金属离子液体的能级差较之显著增大,因此催化活性和稳定性都有所提升,与上述关于吸附能的判断一致。
| Structure | HOMO/eV | LUMO/eV |
| [Hnmpo]Cl-xRuCl3 | -6.734 | -3.862 |
| [Hnmpo]Cl-xRuCl3_HCl | -6.358 | -3.550 |
| [Hnmpo]Cl-xRuCl3_C2H2 | -6.424 | -3.695 |
| xRuCl3-ySnCl2/[Hnmpo]Cl | -6.439 | -3.787 |
| xRuCl3-ySnCl2/[Hnmpo]Cl_HCl | -6.377 | -3.567 |
| xRuCl3-ySnCl2/[Hnmpo]Cl_C2H2 | -6.230 | -2.799 |
将[Hnmpo][RuCl3-(Cl)2-SnCl]作为催化组分模型进行了DFT计算,主要包括原子行为,电荷转移和能量变化,优化为循环,催化反应机理如图 16所示。
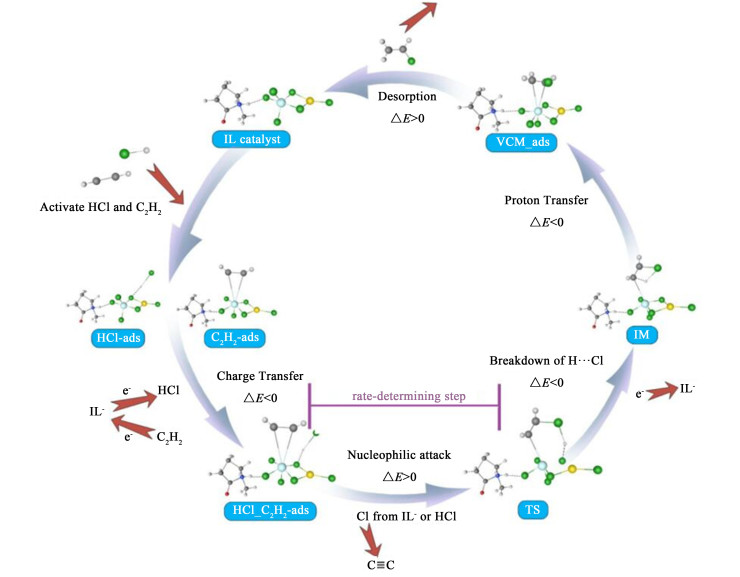
|
| 图 16 理论计算xRuCl3-ySnCl2/[Hnmpo]Cl IL循环催化机理模型 Fig.16 Cyclic catalytic mechanism model of the xRuCl3-ySnCl2/[Hnmpo]Cl IL |
| |
首先,活性位点受到HCl和C2H2的进攻,HCl与IL-形成氢键Cl…H—Cl被吸附,本身分子内的H—Cl键被拉长活化,C2H2与Ru络合形成π键被吸附,同时暴露出空轨道而被活化,单吸附的结构继续吸附另一种分子,最终都形成共吸附的HCl_C2H2-ads,此过程e-从IL-转移至HCl,从C2H2转移至IL-。随后,Cl原子从IL-中挣脱,形成游离的Cl…H…Cl,因对称性所致,电子均匀排布,因此对C原子发生亲核加成的Cl原子可以来源于IL-或HCl,此步骤涉及Ru—Cl—Sn共价键的弱化断裂,需大幅吸热,故为整个循环中的速率控制步骤,与相关文献报道一致[17]。加成后电子向π键离域,H…Cl极度弱化并断裂,Cl重新与IL-配位形成共价键,此步骤电子回到IL-,获得电子的π电子云密度升高,引发质子转移形成C—H键,催化过程基本完成,生成吸附态的VCM-ads,最后吸收极少热量完成C2H3Cl脱附,电子向IL-转移,Ru物种的价态升高,活性位点重生,至此旧循环完成且新循环开始。
3 结论1)[Hnmpo]Cl-xRuCl3 IL在筛选的最佳反应条件下表现出良好的催化性能。结合ESI-MS、TGA、FTIR、ICP-OES、XPS表征和理论计算,确认了阴、阳离子的存在形式,且存在较强的相互作用力,反应前后活性组分几乎无损失,证明离子液体在反应条件下可以保持稳定。
2) 加入SnCl2复配得到更稳定的xRuCl3-ySnCl2/[Hnmpo]Cl IL催化剂,在反应700 h内,乙炔转化率大于96.1%,氯乙烯选择性超过99.5%。ICP-OES和XPS表征显示活性物种Ru在反应前后几乎无损失,Sn的加入有效抑制了反应中高价态Ru的还原,从而抑制了催化剂失活,极大的提升了催化稳定性。
3) 对HCl和C2H2的吸附行为进行DFT计算后,发现xRuCl3-ySnCl2/[Hnmpo]Cl IL吸附HCl和C2H2的能力更强,并且其吸附C2H2的结构LUMO-HOMO能极差较大,不易发生二聚反应。随后计算了[Hnmpo][RuCl3-(Cl)2-SnCl]模型催化反应机理,分析了原子行为、电荷转移和能量变化。
| [1] |
ZHONG J, XU Y, LIU Z. Heterogeneous non-mercury catalysts for acetylene hydrochlorination: Progress, challenges, and opportunities[J]. Green Chemistry, 2018, 20(11): 2412-2427. DOI:10.1039/C8GC00768C |
| [2] |
张凌毓, 吴刚强, 郎中敏. 氯乙烯工业发展现状[J]. 内蒙古石油化工, 2012, 38(6): 1-3. ZHANG Lingyu, WU Gangqiang, LANG Zhongmin. Vinyl Chloride Industry development status[J]. Inner Mongolia Petrochemical Industry, 2012, 38(6): 1-3. (in Chinese) |
| [3] |
SCHOBERT H. Production of acetylene and acetylene-based chemicals from coal[J]. Chemical Reviews, 2014, 114(3): 1743-1760. DOI:10.1021/cr400276u |
| [4] |
ZHAO J, YUE Y, SHENG G, et al. Supported ionic liquid-palladium catalyst for the highly effective hydrochlorination of acetylene[J]. Chemical Engineering Journal, 2019, 360: 38-46. DOI:10.1016/j.cej.2018.11.179 |
| [5] |
SMITH D M, WALSH P M, SLAGER T L. Studies of silica-supported metal chloride catalysts for the vapor-phase hydrochlorination of acetylene[J]. Journal of Catalysis, 1968, 11(2): 113-130. DOI:10.1016/0021-9517(68)90018-3 |
| [6] |
SHINODA K. The vapor-phase hydrochlorination of acetylene over metal chlorides supported on activated carbon[J]. Chemistry Letters, 1975, 4(3): 219-220. DOI:10.1246/cl.1975.219 |
| [7] |
HUTCHINGS G J, GRADY D T. Effect of drying conditions on carbon supported mercuric chloride catalysts[J]. Applied Catalysis, 1985, 16(3): 411-415. DOI:10.1016/S0166-9834(00)84403-6 |
| [8] |
NKOSI B, COVILLE N J, HUTCHINGS G J. Vapour phase hydrochlorination of acetylene with group Ⅷ and IB metal chloride catalysts[J]. Applied Catalysis, 1988, 43(1): 33-39. DOI:10.1016/S0166-9834(00)80898-2 |
| [9] |
XU H, MENG S, LUO G. Ionic liquids-coordinated Au catalysts for acetylene hydrochlorination: DFT approach towards reaction mechanism and adsorption energy[J]. Catalysis Science & Technology, 2018, 8(4): 1176-1182. |
| [10] |
ZHAO J, GU S, XU X, et al. Supported ionic-liquid-phase-stabilized Au(iii) catalyst for acetylene hydrochlorination[J]. Catalysis Science & Technology, 2016, 6(9): 3263-3270. |
| [11] |
ZHAO J, YU Y, XU X, et al. Stabilizing Au(Ⅲ) in supported-ionic-liquid-phase (SILP) catalyst using CuCl2 via a redox mechanism[J]. Applied Catalysis B: Environmental, 2017, 206: 175-183. DOI:10.1016/j.apcatb.2017.01.026 |
| [12] |
SHANG S, ZHAO W, WANG Y, et al. Highly efficient Ru@IL/AC to substitute mercuric catalyst for acetylene hydrochlorination[J]. ACS Catalysis, 2017, 7(5): 3510-3520. DOI:10.1021/acscatal.7b00057 |
| [13] |
LI H, WU B, WANG J, et al. Efficient and stable Ru(Ⅲ)-choline chloride catalyst system with low Ru content for non-mercury acetylene hydrochlorination[J]. Chinese Journal of Catalysis, 2018, 39(11): 1770-1781. DOI:10.1016/S1872-2067(18)63121-3 |
| [14] |
HU J, YANG Q, YANG L, et al. Confining noble metal (Pd, Au, Pt) nanoparticles in surfactant ionic liquids: Active non-mercury catalysts for hydrochlorination of acetylene[J]. ACS Catalysis, 2015, 5(11): 6724-6731. DOI:10.1021/acscatal.5b01690 |
| [15] |
YANG L, YANG Q, HU J, et al. Metal nanoparticles in ionic liquid-cosolvent biphasic systems as active catalysts for acetylene hydrochlorination[J]. AIChE Journal, 2018, 64(7): 2536-2544. DOI:10.1002/aic.16103 |
| [16] |
ZHOU X, XU S, LIU Y, et al. Mechanistic study on metal-free acetylene hydrochlorination catalyzed by imidazolium-based ionic liquids[J]. Molecular Catalysis, 2018, 461: 73-79. DOI:10.1016/j.mcat.2018.04.027 |
| [17] |
REN Y, WU B, WANG F, et al. Chlorocuprate(i) ionic liquid as an efficient and stable Cu-based catalyst for hydrochlorination of acetylene[J]. Catalysis Science & Technology, 2019, 9(11): 2868-2878. |
| [18] |
LI H, WU B, WANG F, et al. Achieving efficient and low content Ru-based catalyst for acetylene hydrochlorination based on N, N'-dimethylpropyleneurea[J]. ChemCatChem, 2018, 10(18): 4090-4099. DOI:10.1002/cctc.201801000 |
| [19] |
NKOSI B, COVILLE N J, HUTCHINGS G J, et al. Hydrochlorination of acetylene using gold catalysts: A study of catalyst deactivation[J]. Journal of Catalysis, 1991, 128(2): 366-377. DOI:10.1016/0021-9517(91)90295-F |
| [20] |
MALTA G, KONDRAT S A, FREAKLEY S J, et al. Deactivation of a single-site gold-on-carbon acetylene hydrochlorination catalyst: An X-ray absorption and inelastic neutron scattering study[J]. ACS Catalysis, 2018, 8(9): 8493-8505. DOI:10.1021/acscatal.8b02232 |
| [21] |
PU Y, ZHANG J, YU L, et al. Active ruthenium species in acetylene hydrochlorination[J]. Applied Catalysis A: General, 2014, 488: 28-36. DOI:10.1016/j.apcata.2014.09.037 |
| [22] |
ZHANG H, LI W, JIN Y, et al. Ru-Co(Ⅲ)-Cu(Ⅱ)/SAC catalyst for acetylene hydrochlorination[J]. Applied Catalysis B: Environmental, 2016, 189: 56-64. DOI:10.1016/j.apcatb.2016.02.030 |
| [23] |
XU H, ZHOU K, SI J, et al. A ligand coordination approach for high reaction stability of an Au-Cu bimetallic carbon-based catalyst in the acetylene hydrochlorination process[J]. Catalysis Science & Technology, 2016, 6(5): 1357-1366. |
| [24] |
王朋, 肖迪, 梁妮, 等. 电荷辅助氢键的形成机制及环境效应研究进展[J]. 材料导报, 2019, 33(5): 812-818. WANG Peng, XIAO Di, LIANG Ni, et al. Advances in formation mechanism and environmental effects of charge-assisted hydrogen bonds[J]. Materials Reports, 2019, 33(5): 812-818. (in Chinese) |
| [25] |
AMBROZINI B, CERVINI P, CAVALHEIRO É T G. Thermal behavior of the β-blocker propranolol[J]. Journal of Thermal Analysis and Calorimetry, 2016, 123(2): 1013-1017. DOI:10.1007/s10973-015-5118-7 |
| [26] |
YAU H, BAYAZIT M K, STEINKE J H G, et al. Sonochemical degradation of N-methylpyrrolidone and its influence on single walled carbon nanotube dispersion[J]. Chemical Communications (Cambridge, England), 2015, 51(93): 16621-16624. DOI:10.1039/C5CC06526G |
| [27] |
CHATTERJEE D, BAJAJ H C, DAS A. Synthesis, kinetics, and physicochemical studies of a new mixed-valent heterobinuclear cyano-bridged ruthenium(Ⅲ)-iron(Ⅱ) complex[J]. Inorganic Chemistry, 1993, 32(19): 4049-4052. DOI:10.1021/ic00071a013 |
| [28] |
DE KLERK-ENGLES B, FRUHAUF H W, VRIEZE K, et al. Kinetic and thermodynamic products in the reaction of poly(dichlorodicarbonylruthenium) with pyridinecarbaldimine ligands and the crystal structure of trans-Cl2Ru(CO)2(N-(pyrid-2-ylmethoxymethyl)(3-isopropoxypropyl)amine)[J]. Inorganic Chemistry, 1993, 32(24): 5528-5535. DOI:10.1021/ic00076a020 |
 2022, Vol. 39
2022, Vol. 39





