2. 化学工程联合国家重点实验室, 天津 300350
2. State Key Laboratory of Chemical Engineering, Tianjin 300350, China
对苯醌是生产对苯二酚及染料中间体的重要原料,同时也作为阻聚剂、抗氧化剂以及橡胶防老剂被广泛应用于高分子及橡胶工业[1]。目前,工业上合成对苯醌主要采用苯胺氧化法[2],即利用软锰矿作为氧化剂将苯胺氧化为对苯醌。然而该工艺需要加入过量的MnO2以及稀硫酸,在反应过程中产生大量废渣,引发严重的环境污染问题。此外,稀硫酸会持续性腐蚀设备,增加额外的设备费用。为了克服传统苯胺氧化法的缺陷,苯酚氧化法[3]、对苯二酚氧化法[4]和苯电氧化法[5]等多种新型氧化方法被陆续开发。苯酚氧化法通常采用金属离子配合物作为催化剂,该催化剂制备条件复杂,且稳定性差。对苯二酚氧化法虽然反应简单,对苯醌收率高,但其原料价格昂贵,不适合大规模工业化生产。电氧化法虽然反应条件温和,产品纯度高,但反应时间过长,后续分离成本高。出于经济和生态方面的考虑,苯直接氧化法被认为是生产对苯醌最具潜力的方法[6, 7],开发用于苯一步氧化生成对苯醌的高选择性、高活性绿色催化剂具有重要意义。
金属有机框架材料(MOFs)是一种通过配位键将金属离子与有机分子桥联所构成的新型多孔材料。MOFs材料孔隙率高,易于功能化修饰、结构高度可控,因此受到广泛关注[8-10]。利用MOFs含有的不饱和金属位点及结构缺陷,或者将其作为载体封装纳米金属颗粒,可使其应用于催化领域。研究表明,MOFs能够在相对温和的条件下激活氧化剂H2O2,并在苯氧化反应中表现出优异的催化活性[11-13]。然而,在苯氧化过程中,对苯醌的选择性受到了极大的限制。因此,寻找合适的MOFs是提高对苯醌选择性的关键。研究表明,Cu是氧化苯制苯酚、氢醌、对苯二酚和对苯醌的有效催化剂[14, 15]。当以Cu作为活性中心时,只需稍微调整反应条件,即可提升对苯醌的选择性,同时保持较高的收率,这对于其他金属是很难办到的[16]。因此,含有不饱和铜路易斯活性位点的HKUST-1是催化苯氧化制对苯醌的有效催化剂。
本研究通过溶剂热法成功合成HKUST-1,使用XRD、SEM、FTIR、BET、XPS和TG等表征手段确证催化剂结构参数及热稳定性。将催化剂用于苯直接氧化生成对苯醌反应测试其催化性能,考察反应时间、反应温度、催化剂用量、氧化剂用量以及反应溶剂等因素对对苯醌选择性和收率的影响,对催化剂的循环使用性能进行了研究。
1 实验部分 1.1 实验试剂三水合硝酸铜[Cu(NO)3 ·3H2O, AR]、1, 3, 5-苯三甲酸(H3BTC, 质量分数≥ 98.0%)、乙腈(C2H3N, AR)、无水乙醇(C2H6O, AR)、N, N-二甲基甲酰胺(DMF, AR)、无水甲醇(CH3OH, H2O≤10-4)、苯(C6H6, AR)、丙酮(C3H6O, AR)和乙酸(CH3COOH, AR)购自上海阿拉丁生化科技有限公司。过氧化氢(H2O2, 质量分数为30%)购自天津市江天化工股份有限公司。去离子水购自天津市永清源蒸馏水经营部。
1.2 催化剂的制备采用溶剂热法制备HKUST-1催化剂,首先称量2.07 g Cu(NO3)2 ·3H2O (8.57 mmol)和1.00 g 1, 3, 5-苯三甲酸(4.76 mmol),并分别溶解在22.5 mL 1∶1∶1 (体积比)的去离子水/DMF/乙醇混合溶剂中,超声处理,直到溶质充分溶解。然后将上述溶液混合并继续超声直至得到均一的蓝色混合溶液。将上述混合溶液转移至100 mL带有聚四氟乙烯内衬的水热反应釜中,并在100 ℃下反应15 h,反应完成后自然冷却至室温并抽滤。最后将产物在甲醇中浸渍48 h,置换孔道中的DMF,每8 h更换1次溶剂。待浸渍完成后放入真空干燥箱中在160 ℃下干燥24 h,即得催化剂HKUST-1。
1.3 催化剂的表征采用德国布鲁克AXS公司D8-FOCUS X射线衍射仪(XRD)对催化剂进行晶相结构分析,2θ扫描范围5°~50°,扫描速率8(°) ·min-1。采用日本日立公司S-4800场发射扫描电子显微镜(SEM)对制备的催化剂进行表面形貌的分析。采用港东公司的FTIR-650傅里叶变换红外光谱仪(FTIR)对催化剂进行红外表征。利用美国麦克仪器公司ASAP 2020型分析仪并通过BET法测定催化剂的总比表面积,通过BJH模型获得样品的孔径分布。采用德国耐驰公司的F5热重分析仪(TG)对催化剂进行热稳定性分析。采用美国赛默飞世尔公司的ESCALAB 250Xi型X射线光电子能谱仪(XPS)表征催化剂活性金属元素及价态分布。
1.4 活性测试称取一定量的催化剂,在160 ℃下真空干燥1 h (脱除H2O,得到开放的Cu2+活性位点)。随后加入20 mL乙腈及2 mL苯混合均匀并转移到带有低温冷却循环装置的玻璃反应器中,待达到预定温度后,注入氧化剂H2O2。反应完成后,放入冰浴中淬灭反应,离心后取上层清液,利用安捷伦7890A气相色谱仪进行产物分析,检测器为氢火焰检测器,色谱柱为DB-5ht (30 m×0.32 mm×0.25 μm) 毛细管。苯反应转化率(X)、对苯醌选择性(S)和收率(Y)的公式如式(1)~(3)。
| $ X=1-\frac{n_ {\rm{tB}}}{n_{{\rm{0B}}}}×100\% $ | (1) |
| $ S=\frac{n_ {\rm{tBQ}}}{n_{{\rm{0B}}}-n_{{\rm{tB}}}}×100\% $ | (2) |
| $ Y=\frac{n_ {\rm{tBQ}}}{n_{{\rm{0B}}}}×100\% $ | (3) |
式(1)~(3)中:ntB为反应后苯的剩余量;n0B为苯初始量;ntBQ为反应中生成的对苯醌的量。
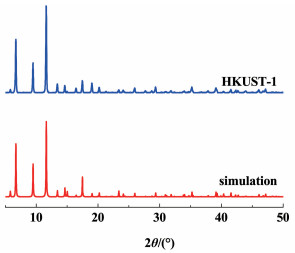
2 结果与讨论 2.1 HKUST-1催化剂的物化性质表征图 1为HKUST-1催化剂的XRD谱图。
|
| 图 1 催化剂的XRD谱图 Fig.1 XRD pattern of catalyst |
| |
从图 1中可以看出,HKUST-1催化剂主要的出峰位置在2θ=5.8°, 6.6°, 9.5°, 11.7°, 13.5°, 14.6°, 16.5°, 17.5°, 19.3°, 26.0°和29.4°处,分别对应(111), (200), (220), (222), (400), (331), (422), (511), (440), (731)和(751)晶面,结果与CCDC单晶衍射模拟计算数据及文献报道一致[17, 18]。同时,没有观察到属于CuO (JCPDS: 05-0667)和Cu2O (JCPDS: 48-1548)的特征峰,说明制备的催化剂结晶度较高,晶形和纯度较好。SEM结果显示(图 2),所制备的催化剂呈现规则的八面体形貌,并且大小均一,平均晶粒尺寸约为10~20 μm。

|
| 图 2 催化剂的SEM图 Fig.2 The SEM image of catalyst |
| |
为了进一步确定催化剂的结构,对其进行了红外表征,结果如图 3所示。

|
| 图 3 催化剂的红外谱图 Fig.3 FTIR spectra of catalyst |
| |
从图 3中可以看出,在3 500~3 200 cm-1处有较宽的吸收峰,其归属于O—H键的伸缩振动特征峰[19, 20],说明有配位水存在于HKUST-1催化剂中。1 620和1 554 cm-1归属于C O的反对称伸缩振动峰[21],1 440和1 366 cm-1归属于C O的对称伸缩振动峰[21],1 106和933 cm-1归属于苯环中C—H键的面内和面外摇摆振动峰[22],这些都是催化剂中BTC的特征峰。727 cm-1归属于Cu与BTC配位的Cu—O键的伸缩振动峰[23]。
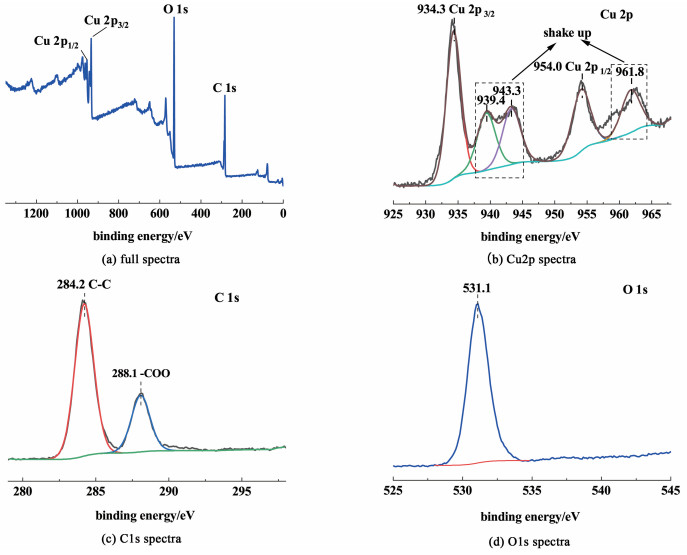
图 4为HKUST-1催化剂的XPS能谱图。
|
| 图 4 催化剂的XPS谱图 Fig.4 XPS spectra of catalyst |
| |
从全谱图可以看出催化剂表面含有C、O和Cu 3种元素。图 4(b)为催化剂Cu2p轨道的XPS谱图,其中,结合能为934.3和954.0 eV的特征峰归属为Cu2p1/2和Cu2p3/2,结合能为939.4、943.3和961.8 eV的特征峰归属其卫星峰,这些都是Cu2+的特征峰[24],表明催化剂中心Cu组分是以+2价形式存在的。此外,催化剂Cu2p轨道的XPS谱图没有归属Cu+的特征峰,说明制备的催化剂比较纯净,没有Cu2O杂质,与XRD结果一致。图 4(d)为O1s轨道的XPS谱图,结合能为531.1 eV的特征峰归属于HKUST-1中的晶格氧O2-。
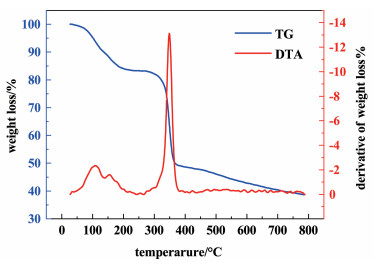
为探究催化剂的热稳定性,对其进行热重分析。
由图 5可知,催化剂存在2个较为明显的失量过程,初始阶段的质量损失与水或者其他溶剂分子的蒸发有关[25],该阶段一直持续到214 ℃。随着温度逐步升高,HKUST-1在214~293 ℃的温度区间内展现出了良好的热稳定性。当温度超过293 ℃后,HKUST-1的质量突然降低,这主要是由于有机骨架发生了分解,此时晶体结构坍塌[26, 27]。综上所述,制备的HKUST-1催化剂具有良好的热稳定性,能够在反应体系中稳定存在。
|
| 图 5 催化剂的热重分析曲线 Fig.5 The TG analysis curve of catalyst |
| |
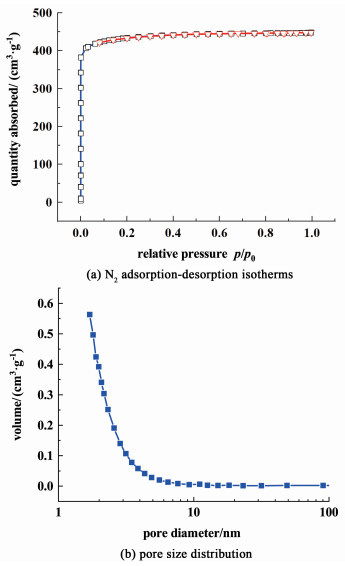
图 6和表 1分别为催化剂的氮气物理吸附-脱附曲线及孔结构参数。
|
| 图 6 催化剂的N2吸附-脱附等温线和孔径分布 Fig.6 The N2 adsorption-desorption isotherms and pore size distribution curve of catalyst |
| |
| 样品 | BET表面积/(m2·g-1) | 孔体积/(cm3·g-1) | 平均孔径/nm | |||||
| 总和 | 微孔 | 介孔 | 总和 | 微孔 | 介孔 | |||
| HKUST-1 | 1 309.12 | 1 118.21 | 190.91 | 0.693 5 | 0.587 7 | 0.105 8 | 2.29 | |
由图 6(a)可知,催化剂在低相对压力区快速达到吸附平衡,同时在高相对压力区没有明显的回滞环出现。根据国际纯粹与应用化学联合会(IUPAC)提出的气体吸附等温线的分类标准可知,该样品属于典型的Ⅰ型等温吸附线型,说明该催化剂主要以微孔为主[28]。催化剂的比表面积及孔隙特征如表 1所示,其BET比表面积为1 309.12 m2 ·g-1,总孔容及微孔孔容分别为0.693 5和0.587 7 cm3 ·g-1,平均孔径约为2.29 nm。以上数据表明合成的催化剂具有较大的比表面积,能够提供大量的活性位点,使其具有较高的催化活性。
2.2 性能评价 2.2.1 HKUST-1催化苯氧化生成对苯醌性能评价HKUST-1及其前驱体作为催化剂催化苯氧化制对苯醌实验结果如表 2所示。结果表明,在无催化剂或者无氧化剂的条件下(表 2,序号4和序号5),无对苯醌生成。当以前驱体均苯三酸作为催化剂时(表 2,序号3),也没对苯醌生成。以硝酸铜作为催化剂时(表 2,序号2),有一定量的对苯醌生成,说明硝酸铜作为路易斯酸可以促进反应,结合XPS结果可知Cu2+是苯氧化制对苯醌反应的活性中心。尽管硝酸铜具有良好的催化活性,但将其从均相催化反应体系中分离并回收是极其困难的。
| 序号 | 催化剂 | 选择性/% | 收率/% | 转化率/% |
| 1 | HKUST-1 | 64.61 | 11.96 | 18.51 |
| 2 | Cu(NO3)2·3H2O | 39.34 | 6.48 | 16.47 |
| 3 | H3BTC | |||
| 4a | ||||
| 5b | HKUST-1 | |||
| 注:反应条件:T=60 ℃,t=80 min,m(catalyst)=0.15 g,n(benzene) ∶n(H2O2)=1 ∶4。a不添加催化剂,b不添加氧化剂。 | ||||
在化工生产中,应该优先选择较为温和的反应条件,所以首先尝试了在较低的温度下进行反应。从图 7(a)可以看出,该反应并不能在室温下进行。随着反应温度的升高,开始有对苯醌生成,其收率先增大后减小,并在60 ℃时达到峰值,而对苯醌的选择性随温度升高持续降低。温度较低时,虽然选择性较高,但此时底物的转化率较低,导致产物的收率不高。温度较高时,苯氧化反应副产物增多且对苯醌易被深度氧化,导致选择性下降,产物收率降低。另一方面,高温会使H2O2在反应体系中快速无效分解,导致H2O2有效利用率降低。此外,当温度高于70 ℃时,反应体系极不稳定,甚至发生爆沸,与很多文献报道一致[29, 30]。综上所述,60 ℃是比较适宜的反应温度。此外,在考察反应温度的影响时,也考察了反应时间的影响,结果如图 7(b)所示。实验结果表明,80 min是最适宜的反应时间,延长反应时间,对苯醌收率下降。苯氧化超过80 min后,大部分生成的自由基倾向于氧化生成的对苯醌分子,而不是进攻苯分子[31],对苯醌被深度氧化。

|
| 图 7 反应温度及时间对苯氧化的影响 Fig.7 Effect of reaction temperature and time |
| |
在此温度和反应时间下,我们进一步考察了催化剂用量对反应的影响,结果如图 8(a)所示。由图 8(a)可知,对苯醌的收率随催化剂用量的增加表现出先增加后减小的趋势,并且在0.15 g时达到最大值。随着催化剂用量增加,活性位点数量增多,继续提高催化剂的用量,在该反应体系下,并不能明显地优化反应,反而会使氧化剂无效分解,降低产能,类似的现象也出现在其他以H2O2作为氧化剂的苯氧化反应中[32, 33]。随后对H2O2的用量进行优化,由图 8(b)可以看出,在一定范围内,随着H2O2用量的增加,对苯醌的收率明显提高。当氧化剂与底物的物质的量之比超过4∶1时,对苯醌的收率有所下降,这可能是由于过量的氧化剂使对苯醌发生深度氧化。此外,大量的过氧化氢存在,会与羟基自由基反应生成过氧化氢自由基,使其无效分解,不利于氧化剂的利用[34]。
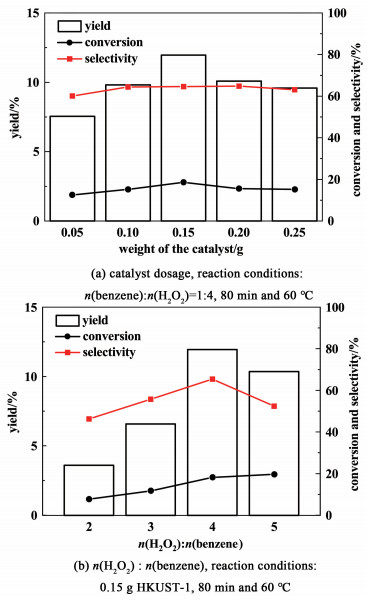
|
| 图 8 催化剂及氧化剂用量对苯氧化反应的影响 Fig.8 Effect of catalyst dosage and molar ratio of H2O2 and benznen |
| |
| 序号 | 溶剂 | 选择性/% | 收率/% | 转化率/% |
| 1 | 乙腈 | 64.61 | 11.96 | 18.51 |
| 2 | 甲醇 | 3.25 | 0.10 | 3.08 |
| 3 | 丙酮 | 3.47 | 0.06 | 1.73 |
| 4 | 醋酸 | 16.28 | 2.74 | 16.83 |
| 5 | 乙醇 | 4.07 | 0.08 | 1.97 |
| 注:反应条件:T=60 ℃,t=80 min,m(HKUST-1)=0.15 g,n(benzene)∶n(H2O2)=1∶4。 | ||||
溶剂筛选试验表明,乙腈是本反应的最佳溶剂。反应在甲醇、乙醇、丙酮以及醋酸溶液中进行时,对苯醌的选择性和收率均远远低于乙腈。
2.2.2 催化剂循环性能评价考察了HKUST-1催化剂在该反应体系下的稳定性。反应完成后,将催化剂过滤分离,并经乙腈和甲醇洗涤后在160 ℃下真空干燥24 h,再次用于苯氧化反应。由图 9(a)可以看出,HKUST-1的催化活性在重复循环4次后并没有明显下降,相较于第1次催化活性仍能保持在90%以上。HKUST-1各轮催化后的XRD谱图如图 9(b)所示。重复使用后,催化剂的晶相结构并没有发生明显变化,说明HKUST-1催化剂在该反应体系下有较高的稳定性,可重复利用。

|
| 图 9 (a) 催化剂的循环使用性能;(b) 催化剂循环使用后的XRD谱图 Fig.9 (a) Recycling performance of the catalyst; (b) XRD pattern after the catalyst is recycled |
| |
1) 通过溶剂热法成功制备了HKUST-1催化剂。该催化剂具有较高的比表面积,提供了大量的Cu2+活性位点,使其表现出优异的催化活性。此外,该催化剂还有良好的热稳定性,能够在苯氧化反应体系中稳定存在。
2) 在苯氧化制对苯醌反应中,当反应温度为60 ℃、反应时间为80 min、过氧化氢与底物的物质的量之比为4∶1、催化剂用量为0.15 g、溶剂为乙腈时,对苯醌的收率最高,达到11.96%,此时,对苯醌的选择性为64.61%。催化剂HKUST-1可以循环使用4次,而且没有明显的活性损失。
| [1] |
隋玲玲, 李森, 张迪. 对苯醌合成方法的研究进展[J]. 辽宁化工, 2012, 41(11): 1190-1193. SUI Lingling, LI Sen, ZHANG Di. Research progress in synthetic methods of p-benzoquinone[J]. Liaoning Chemical Industry, 2012, 41(11): 1190-1193. DOI:10.3969/j.issn.1004-0935.2012.11.029 (in Chinese) |
| [2] |
时克勤. 一种回收软锰矿粉在对苯醌生产工艺中循环使用的方法: CN101081809A[P]. 2007-12-05
|
| [3] |
REILLY E L. Oxidation of monohydroxy aryl compounds to 1, 4-quinones: US3987068[P]. 1976-10-19
|
| [4] |
RADEL R J, SULLIVAN J M, HATFIELD J D. Catalytic oxidation of hydroquinone to quinone using molecular oxygen[J]. Industrial & Engineering Chemistry Product Research and Development, 1982, 21(4): 566-570. |
| [5] |
LI X, LI X, TANG S, et al. High selectivity of benzene electrochemical oxidation to p-benzoquinone on modified PbO2 electrode[J]. Applied Surface Science, 2014, 311: 357-361. DOI:10.1016/j.apsusc.2014.05.068 |
| [6] |
XU J, JIANG Q, CHEN T, et al. Vanadia supported on mesoporous carbon nitride as a highly efficient catalyst for hydroxylation of benzene to phenol[J]. Catalysis Science & Technology, 2015, 5(3): 1504-1513. |
| [7] |
BORAH P, MA X, NGUYEN K T, et al. A vanadyl complex grafted to periodic mesoporous organosilica: A green catalyst for selective hydroxylation of benzene to phenol[J]. Angewandte Chemie International Edition, 2012, 51(31): 7756-7761. DOI:10.1002/anie.201203275 |
| [8] |
FURUKAWA H, CORDOVA K E, O'KEEFFE M, et al. The chemistry and applications of metal-organic frameworks[J]. Science, 2013. DOI:10.1126/science.1230444 |
| [9] |
ZHU Q, XU Q. Metal-organic framework composites[J]. Chemical Society Reviews, 2014, 43(16): 5468-5512. DOI:10.1039/C3CS60472A |
| [10] |
WANG S, MCGUIRK C M, D'AQUINO A, et al. Metal-organic framework nanoparticles[J]. Advanced Materials, 2018. DOI:10.1002/adma.201800202 |
| [11] |
LIU Y, LIU B, ZHOU Q, et al. Morphology effect of metal-organic framework HKUST-1 as a catalyst on benzene oxidation[J]. Chemical Research in Chinese Universities, 2017, 33(6): 971-978. DOI:10.1007/s40242-017-6468-4 |
| [12] |
MARX S, KLEIST W, BAIKER A. Synthesis, structural properties, and catalytic behavior of Cu-BTC and mixed-linker Cu-BTC-PyDC in the oxidation of benzene derivatives[J]. Journal of Catalysis, 2011, 281(1): 76-87. DOI:10.1016/j.jcat.2011.04.004 |
| [13] |
LIU Y, ZHANG T, WU W, et al. Water-mediated promotion of direct oxidation of benzene over the metal-organic framework HKUST-1[J]. RSC Advances, 2015, 5(69): 56020-56027. DOI:10.1039/C5RA05595D |
| [14] |
PARIDA K M, RATH D. Structural properties and catalytic oxidation of benzene to phenol over CuO-impregnated mesoporous silica[J]. Applied Catalysis A: General, 2007, 321(2): 101-108. DOI:10.1016/j.apcata.2007.01.054 |
| [15] |
KUBACKA A, WANG Z, SULIKOWSKI B, et al. Hydroxylation/oxidation of benzene over Cu-ZSM-5 systems: Optimization of the one-step route to phenol[J]. Journal of Catalysis, 2007, 250(1): 184-189. DOI:10.1016/j.jcat.2007.05.017 |
| [16] |
WANNA W, RAMU R, JANMANCHI D, et al. An efficient and recyclable copper nano-catalyst for the selective oxidation of benzene to p-benzoquinone (p-BQ) using H2O2(aq) in CH3CN[J]. Journal of Catalysis, 2019, 370: 332-346. DOI:10.1016/j.jcat.2019.01.005 |
| [17] |
CHEN Y, MU X, LESTER E, et al. High efficiency synthesis of HKUST-1 under mild conditions with high BET surface area and CO2 uptake capacity[J]. Progress in Natural Science: Materials International, 2018, 28(5): 584-589. DOI:10.1016/j.pnsc.2018.08.002 |
| [18] |
VEHRENBERG J, VEPSÄLÄINEN M, MACEDO D S, et al. Steady-state electrochemical synthesis of HKUST-1 with polarity reversal[J]. Microporous and Mesoporous Materials, 2020. DOI:10.1016/j.micromeso.2020.110218 |
| [19] |
ZHAO Y, DING H, ZHONG Q. Synthesis and characterization of MOF-aminated graphite oxide composites for CO2 capture[J]. Applied Surface Science, 2013, 284: 138-144. DOI:10.1016/j.apsusc.2013.07.068 |
| [20] |
MOHAMMADNEJAD M, FAKHREFATEMI M. Synthesis of magnetic HKUST-1 metal-organic framework for efficient removal of mefenamic acid from water[J]. Journal of Molecular Structure, 2021. DOI:10.1016/j.molstruc.2020.129041 |
| [21] |
BHORIA N, BASINA G, POKHREL J, et al. Functionalization effects on HKUST-1 and HKUST-1/graphene oxide hybrid adsorbents for hydrogen sulfide removal[J]. Journal of Hazardous Materials, 2020. DOI:10.1016/j.jhazmat.2020.122565 |
| [22] |
BORFECCHIA E, MAURELLI S, GIANOLIO D, et al. Insights into adsorption of NH3 on HKUST-1 metal-organic framework: A multitechnique approach[J]. The Journal of Physical Chemistry C, 2012, 116(37): 19839-19850. DOI:10.1021/jp305756k |
| [23] |
AZHAR M R, ABID H R, SUN H, et al. One-pot synthesis of binary metal organic frameworks (HKUST-1 and UiO-66) for enhanced adsorptive removal of water contaminants[J]. Journal of Colloid and Interface Science, 2017, 490: 685-694. DOI:10.1016/j.jcis.2016.11.100 |
| [24] |
SUN C, ZHU J, LV Y, et al. Dispersion, reduction and catalytic performance of CuO supported on ZrO2-doped TiO2 for NO removal by CO[J]. Applied Catalysis B: Environmental, 2011, 103(1/2): 206-220. |
| [25] |
WANG F, GUO H, CHAI Y, et al. The controlled regulation of morphology and size of HKUST-1 by "coordination modulation method"[J]. Microporous and Mesoporous Materials, 2013, 173: 181-188. DOI:10.1016/j.micromeso.2013.02.023 |
| [26] |
VRTOVEC N, MAZAJ M, BUSCARINO G, et al. Structural and CO2 capture properties of ethylenediamine-modified HKUST-1 metal-organic framework[J]. Crystal Growth & Design, 2020, 20(8): 5455-5465. |
| [27] |
QIU W, WANG Y, LI C, et al. Effect of activation temperature on catalytic performance of CuBTC for CO oxidation[J]. Chinese Journal of Catalysis, 2012, 33(4/5/6): 986-992. |
| [28] |
GÖLTNER C G, SMARSLY B, BERTON B, et al. On the microporous nature of mesoporous molecular sieves[J]. Chemistry of Materials, 2001, 13(5): 1617-1624. DOI:10.1021/cm0010755 |
| [29] |
MISHRA S, BAL R, DEY R K. Heterogeneous recyclable copper oxide supported on activated red mud as an efficient and stable catalyst for the one pot hydroxylation of benzene to phenol[J]. Molecular Catalysis, 2021. DOI:10.1016/j.mcat.2020.111310 |
| [30] |
XU J, CHEN Y, HONG Y, et al. Direct catalytic hydroxylation of benzene to phenol catalyzed by vanadia supported on exfoliated graphitic carbon nitride[J]. Applied Catalysis A: General, 2018, 549: 31-39. DOI:10.1016/j.apcata.2017.09.015 |
| [31] |
ELMETWALLY A E, ESHAQ G, YEHIA F Z, et al. Iron oxychloride as an efficient catalyst for selective hydroxylation of benzene to phenol[J]. ACS Catalysis, 2018, 8(11): 10668-10675. DOI:10.1021/acscatal.8b03590 |
| [32] |
DING G, WANG W, JIANG T, et al. Highly selective synthesis of phenol from benzene over a vanadium-doped graphitic carbon nitride catalyst[J]. ChemCatChem, 2013, 5(1): 192-200. DOI:10.1002/cctc.201200502 |
| [33] |
XUE B, CHEN Y, HONG Y, et al. Facile synthesis of Fe-containing graphitic carbon nitride materials and their catalytic application in direct hydroxylation of benzene to phenol[J]. Chinese Journal of Catalysis, 2018, 39(7): 1263-1271. DOI:10.1016/S1872-2067(18)63063-3 |
| [34] |
YEHIA F, ESHAQ G, ELMETWALLY A E. Enhancement of the working pH range for degradation of p-nitrophenol using Fe2+-aspartate and Fe2+-glutamate complexes as modified Fenton reagents[J]. Egyptian Journal of Petroleum, 2016, 25(2): 239-245. DOI:10.1016/j.ejpe.2015.05.015 |
 2022, Vol. 39
2022, Vol. 39





