2. 人因工程国防科技重点实验室, 北京 100094
2. National Key Laboratory for Human Factors Engineering, Beijing 100094, China
对化石能源的过度依赖,引发了能源可持续性与环境污染的双重危机[1-2]。氢具有清洁、能量密度高等优点,是未来最有潜力的能源载体,将在解决能源危机与全球变暖问题中发挥重要作用[3]。目前,工业制氢最主要的方式是甲烷蒸气重整和煤气化,但这2种制氢方式仍旧依赖化石能源[3, 4]。而电解水制氢技术可以利用太阳能、风能等可再生能源,被普遍认为是未来大规模可持续发展的制氢路径[5]。
在电解水的过程中,析氧反应涉及4电子转移过程,动力学迟缓[6, 7]。虽然Ir和Ru等贵金属具有较高的OER催化活性[8],但是较低的储量与昂贵的价格限制了它们的大规模应用。碱性电解水可以使用非贵金属催化剂,从而大大降低制氢的成本[5]。但是在工业电解水过程中,析氧反应由于过电位较大,能耗仍较高[9]。近年来,研究人员为制备高性能的非贵金属催化剂作出了诸多努力,并取得了一定进展。过渡金属的二元、三元合金催化剂,如硼氢化钠还原混合镍、铁盐溶液制备得到的无定形Ni2Fe1[10],以金属有机骨架为前驱体热退火得到密排六方结构的NiFe@NC[11],湿化学法得到的W0.5Co0.4Fe0.1/NF[12]等均表现出较高的OER催化活性。采用高温溶剂热法、电沉积法等方法制备的NiFe/Ni/Ni[13]、NiFe-LDH/CNT[14]、Ni1-xFexOOH[15]、中空α-Ni(OH)2纳米球[16]和Co1-xFex(OH)2[17]等过渡金属氢氧化物催化剂也表现出优异的OER催化活性。在空气氛围下热退火得到的过渡金属氧化物催化剂如Fe掺杂的NiOx纳米管[18]、NiyCo1-yOx薄膜[19]和rGO@CoNiOx[20]纳米片等表现出良好的OER催化活性。此外,过渡金属硫化物催化剂如NiCoFeS/NF[21]、NiFeS/NF[22]和NiS-Ni3S2/NF[23]等以及过渡金属磷化物催化剂如Ni0.69Co0.31-P[24]和Ni-P[25]等也均表现出良好的OER催化活性。在众多OER催化剂中,镍铁基催化剂的催化活性较高[26, 27]。有研究指出镍与铁存在协同效应促进了析氧反应[26]。许多非贵金属催化剂制备需要长时间的高压、水热反应,制备方法繁琐,不利于放大。而且许多纳米催化剂颗粒需要黏接剂,虽然表现出较高的催化活性,但在长时间气泡冲刷的工业水电解环境下难以保持稳定。因此,寻求更理想的水电解非贵金属催化剂仍然是巨大挑战。
本研究报道采用一种简便、易放大的方法制备出高活性、高稳定性的OER催化剂。以商用镍网为基底,通过电沉积法一步制备出多孔镍铁合金催化剂电极,无需黏接剂。电极制备过程中,金属离子Ni2+、Fe2+沉积和氢气析气同时发生。催化剂的多级孔结构是在电极上强烈析气的条件下逐步形成的。由于电极制备环境与其工作环境类似,从而能够较好的适应析氧反应所需的离子传递和气泡释放条件,表现出优异的OER催化活性。电流密度为10 mA·cm-2时,电极的过电位为210 mV,塔菲尔斜率为35 mV·dec-1。在工业生产水电解条件下,电流密度为200和500 mA·cm-2时,电极的过电位仅为250和340 mV。水电解连续运行250 h,电极性能无明显衰减,表现出了优异的稳定性。
1 实验部分 1.1 实验材料六水合氯化镍(NiCl2·6H2O)、氯化铵(NH4Cl)、浓硫酸(H2SO4)、氢氧化钾(KOH)、异丙醇(C3H8O)和无水乙醇(C2H6O)均为分析纯,购自天津市科密欧化学试剂有限公司。四水合氯化亚铁(FeCl2·4H2O)为分析纯,购自上海源叶生物科技有限公司。200目镍网(N6)购自康威金属丝网制品有限公司。杜邦Nafion溶液(D520)、河森铱黑(Ir)购自上海河森电气有限公司。去离子水(≥3 MΩ·cm)购自天津市永清源蒸馏水经营部。
1.2 样品制备多孔镍铁合金电极采用电沉积方法制备。根据合金电极中镍铁的比例及制备过程中电镀电流、时间的不同,将其命名为NixFe1-x-t-i。以制备Ni0.85Fe0.15-180-3为例:用0.5 mol·L-1的硫酸、无水乙醇和去离子水依次对镍网(1 cm×1.5 cm)进行超声清洗15 min后备用。将5.34 g NH4Cl、2.37 g NiCl2·6H2O、0.50 g FeCl2·4H2O溶于50 mL去离子水中配制成电镀液。以清洗过的镍网为阴极、Pt片(3 cm×3 cm)为阳极,在3 A·cm-2的电流密度下电镀180 s,得到Ni0.85Fe0.15-180-3,最后将制备好的电极用去离子水冲洗干净,并在60 ℃下真空干燥。改变电镀时间和电镀电流密度即可得到不同电镀条件下制备的多孔镍铁合金电极。
依同样方法,改变电镀液中FeCl2·4H2O的量即可得到不同镍铁比的多孔镍铁合金电极。为对比用,取5.00 mg铱黑,加入400 μL去离子水、600 μL异丙醇、15 μL杜邦Nafion溶液配制成催化剂墨水,超声分散1 h,并将其均匀地滴涂于准备好的镍网上,得到Ir/Ni电极。
1.3 样品表征与电化学性能测试采用X射线衍射仪(XRD, D8 Focus, Bruker)对催化剂电极的晶体结构进行表征,所需粉末样品系对整体催化剂超声1 h后收集得到。采用场发射扫描电子显微镜(SEM, S-4800, Hitachi)对制备的催化剂电极进行形貌分析,并用X射线能谱分析仪(EDS, EDAX, AMETEK)进行元素分析。采用激光共聚焦拉曼光谱仪(Confocal Raman Microscopy, LabRAM HR Evolution, HORIBA)采集样品的拉曼光谱。
电化学性能测试采用电化学工作站(PARSTAT 2273, AMETEK)连接的三电极体系。以制备的样品作为工作电极,汞/氧化汞电极(Hg/HgO 1.00 mol·L-1 KOH)为参比电极,Pt片(3 cm×3 cm)为辅助电极。本研究所报道的电位均转化为相对于可逆氢电极(Reversible Hydrogen Electrode, RHE)的电位,转换公式为:ERHE=EHg/HgO+0.098+0.059pH。在1.00 mol·L-1 KOH溶液中,对电极进行10圈循环伏安活化,活化电位区间为1.0~2.0 V,扫描速率为50 mV·s-1。待活化过程结束后,使用线性扫描伏安法(Linear Sweep Voltammetry, LSV)对电极的OER催化活性进行考察,线性扫描区间为1.2~1.8 V扫描速率为5 mV·s-1,并计算相应的塔菲尔斜率。交流阻抗谱的测试频率为100 kHz~0.1 Hz,偏置电位为1.50 V,振幅为10 mV。电化学活性面积(Electrochemical Active Surface Area, ECSA)通过循环伏安测试[23]并计算出双电层电容(double-layer capacitance,Cdl)来确定。在60 ℃、30% KOH的工业水电解条件下以200和500 mA·cm-2的恒定电流密度来测试样品的稳定性,通过盐桥连接的汞/氧化汞参比电极(Hg/HgO 1.00 mol·L-1 KOH)记录工作电极电位随时间的变化。
2 结果与讨论图 1为空白镍网和不同镍铁比电极的XRD谱图与扫描电镜图。空白镍网在44.5°、51.9°和74.6°的3个强衍射峰分别代表面心立方晶体Ni的(111)、(200)和(220)晶面。不同镍铁比例的合金粉末与空白镍网具有相似的衍射峰。随Fe含量增加,衍射峰左移,符合Vegard定理[28]。
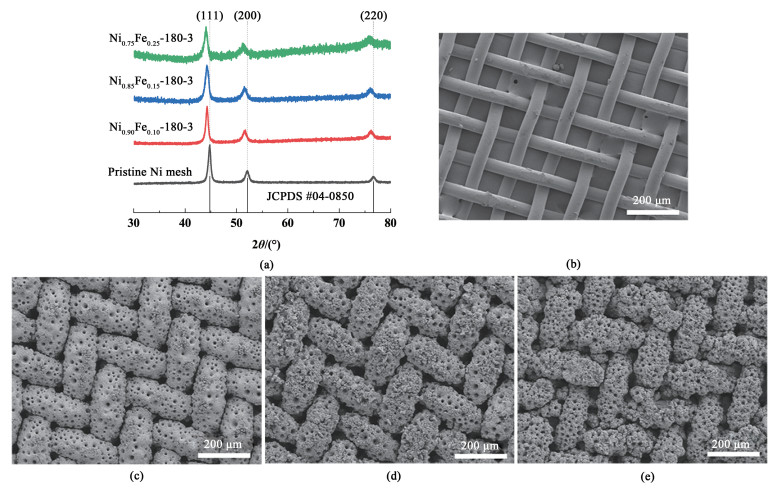
|
| 图 1 (a) 各电极的XRD图谱及(b) 空白镍网;(c) Ni0.9Fe0.1-180-3;(d) Ni0.85Fe0.15-180-3;(e) Ni0.75Fe0.25-180-3的扫描电镜图 Fig.1 (a) XRD patterns and SEM images of (b) Pristine Ni mesh; (c) Ni0.9Fe0.1-180-3; (d) Ni0.85Fe0.15-180-3; (e) Ni0.75Fe0.25-180-3 |
| |
商用镍网表面光滑,比表面积较小[图 1(b)]。以此为基底,经一步电沉积制备的多孔镍铁合金电极表面粗糙,且含有丰富的孔结构,比表面积显著增大,如图 1(c)~图 1(e)所示。且由图 1可知,Fe的含量对镍铁合金电极的形貌无显著影响。
在电镀过程中,镍网基底上发生Ni2+、Fe2+还原反应的同时还发生析氢反应:
| $ 2{\rm{NH}}_4^ + + 2{{\rm{e}}^ - } = 2{\rm{N}}{{\rm{H}}_3} + {{\rm{H}}_2} \uparrow $ | (1) |
电极在剧烈析气的条件下形成丰富的孔结构[图 1(c)~图 1(d)]。在电镀过程中,Ni2+、Fe2+与H2气泡自动沿阻力最小的路径传质,此条件下构筑出的多级孔结构成为用于OER反应时液相中传质与气泡释放的适宜传递通道。
电镀的时间和电流密度会影响电极的结构和性能。图 2为不同电镀时间及电流密度下制备的电极的扫描电镜图、极化曲线及双电层电容曲线。电镀时间短,镍铁的沉积量较少,无法形成丰富的结构[图 2(a)]。电镀时间过长则会导致镀层太厚,使部分孔结构消失[图 2(c)],从而导致比表面积减小。电镀电流密度较小时,氢气析出量较少,电极无法形成多级结构[图 2(d)]。此外,由极化曲线可知,电极的结构影响其性能,在3 A·cm-2的电流密度下电镀180 s制备得到的Ni0.85Fe0.15-180-3具有最好的OER性能[图 2(e)]。电极的双电层电容Cdl通过循环伏安法测定,结果如图 3(f)所示。由于电化学活性面积ECSA与双电层电容Cdl正相关,可知Ni0.85Fe0.15-180-3具有较大的反应活性面积。因此,3 A·cm-2的电流密度下电镀180 s制备的多孔镍铁合金电极所具有的丰富结构使其表现出优异的性能。
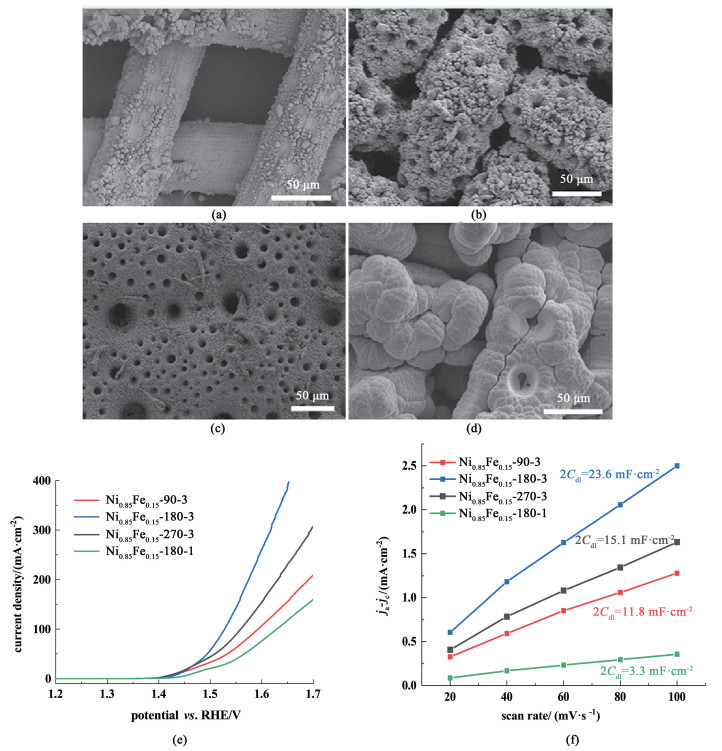
|
| 图 2 (a) Ni0.85Fe0.15-90-3;(b) Ni0.85Fe0.15-180-3;(c) Ni0.85Fe0.15-270-3;(d) Ni0.85Fe0.15-180-1的扫描电镜图及它们的(e) 极化曲线; (f) 双电层电容曲线 Fig.2 SEM images of (a) Ni0.85Fe0.15-90-3; (b) Ni0.85Fe0.15-180-3; (c) Ni0.85Fe0.15-270-3; (d) Ni0.85Fe0.15-180-1 and (e) polarization curves of different electrodes; (f) Cdl of different electrodes |
| |
基于此,后续讨论中的电极制备条件均为3 A·cm-2的电流密度下电镀180 s。
在多孔镍铁合金的制备过程中,Ni2+和Fe2+不断沉积并沿电场线方向形成镍铁合金枝晶状阵列[图 3(a)]。孔壁由枝晶排列构成,枝晶直径约300~500 nm[图 3(c)]。枝晶阵列与镍网基底直接相连,为电子传递提供了通路。Ni元素和Fe元素均匀地分布在电极上[图 3(e)和图 3(f)]。

|
| 图 3 (a) Ni0.85Fe0.15-180-3的断面电镜图;(b)~(d) Ni0.85Fe0.15-180-3不同放大倍数的电镜图;(e)~(f) Ni、Fe的元素分布图 Fig.3 (a) SEM image of Ni0.85Fe0.15-180-3 in cross-section view; (b)~(d) SEM images of Ni0.85Fe0.15-180-3; (e)~(f) EDX mapping images of Ni and Fe elements |
| |
在不同镍铁比例的合金电极中,Ni0.85Fe0.15-180-3具有最好的催化活性。由图 4(a)可知,Ni0.85Fe0.15-180-3起始电位最小(1.40 V),并且在10 mA·cm-2的电流密度下过电位仅为210 mV,远小于Ir所需的过电位(300 mV)。另外,Ni0.85Fe0.15-180-3的Tafel斜率也最小,仅为35 mV·dec-1[图 4(b)],说明Ni0.85Fe0.15-180-3具有较快的析氧反应动力学。
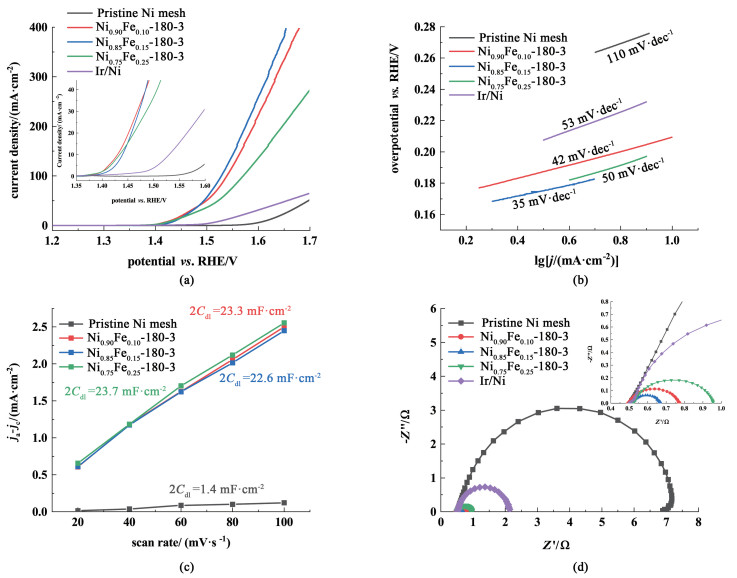
|
| 图 4 不同镍铁比电极的(a) 极化曲线;(b) Tafel曲线;(c) 双电层电容曲线;(d) Nyquist曲线 Fig.4 (a) Polarization curves of different electrodes; (b) Corresponding Tafel plots; (c) Cdl of different electrodes; (d) Nyquist plots of different electrodes |
| |
相比于表面光滑平整的镍网基底,多孔镍铁合金电极具有丰富的结构,显著地提高了电极的比表面积。通过循环伏安法测定电极的双电层电容Cdl,结果如图 4(c)所示。多孔镍铁合金电极具有较大的电化学活性面积,约为空白镍网的16倍。电化学活性面积的增大提高了电极的催化性能。
交流阻抗谱测量显示[图 4(d)],各镍铁电极都表现出较小的串联电阻0.55(±0.05) Ω,说明溶液电阻较小且电极具有良好的导电性。每个电极的Nyquist曲线在高频区都呈现1个明显的半圆,且没有Warburg阻抗,说明各电极在反应过程中传质速率很快[29]。不同电极的电子转移电阻Rct(半圆弧的半径)有明显区别。其中Ni0.85Fe0.15-180-3的Rct最小,因此拥有最快的催化反应动力学。
不同比例的多孔镍铁合金电极具有相似的结构[图 1(c)~图 1(e)]与电化学活性面积[图 4(c)],但表现出不同的催化活性[图 4(a)]。这说明是Fe含量影响了多孔镍铁合金电极的本征催化活性。当Fe摩尔分数达到15%时,多孔镍铁合金电极的催化活性最高[图 4(a)]。在反应条件下(电极电位为1.5 V),Ni0.85Fe0.15-180-3的原位拉曼光谱(图 5)在475和555 cm-1处有2个较强的峰,为NixFe1-xOOH的特征峰[30],说明在碱性OER条件下,镍铁合金表面形成NixFe1-xOOH相,与文献报道结果一致。此相中的Fe作为活性位点催化OER,降低反应过电位[15]。催化活性位点数量最初随着合金中Fe含量增加而增加,电极的催化活性变好。但当Fe含量过高时,会形成不含Ni或含Ni极少的FeOOH新相,导致催化活性转差[15]。
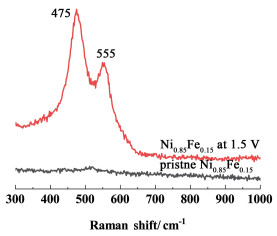
|
| 图 5 在1 mol·L-1 KOH溶液中Ni0.85Fe0.15-180-3的拉曼光谱图 Fig.5 The Raman spectra of Ni0.85Fe0.15-180-3 in 1 mol·L-1 KOH |
| |
图 6中将Ni0.85Fe0.15-180-3与文献[10-14, 16, 31-37]报道的镍铁基催化剂的性能进行了对比,对比测试环境均为室温,1 mol·L-1 KOH溶液。由图 6可知,Ni0.85Fe0.15-180-3在作比较的各镍铁催化剂中10 mA·cm-2电流密度下过电位较低,同时也具有较低的Tafel斜率。Ni0.85Fe0.15-180-3优异的OER催化活性应当与其特殊的结构密切相关。Ni0.85Fe0.15-180-3具有适宜的多级孔结构和适当的镍铁比例,使其在多种不同方法制备的镍铁基催化剂中表现突出。
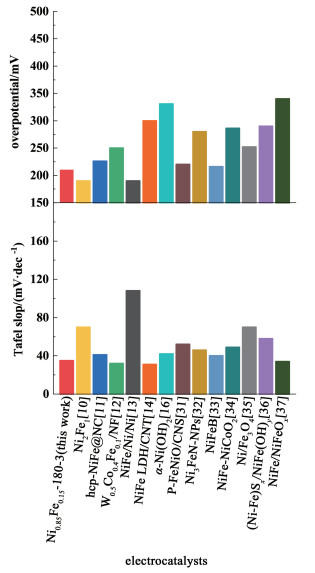
|
| 图 6 Ni0.85Fe0.15-180-3与其它镍铁基OER催化剂在电流密度为10 mA·cm-2时的过电位和Tafel斜率对比 Fig.6 A comparison of Ni0.85Fe0.15-180-3 in this work with previous Ni-Fe based catalysts in terms of the overpotential at 10 mA·cm-2 and Tafel slope in OER |
| |
工业水电解条件下对Ni0.85Fe0.15-180-3电极的稳定性测试结果示于图 7。在电流密度为200和500 mA·cm-2时,Ni0.85Fe0.15-180-3的电极电位仅为1.48和1.57 V。稳定性测试共计进行了250 h,在测试期间,电极运行较为稳定。对电极电位随时间变化进行线性拟合,得到200 mA·cm-2的电流密度下电极性能衰减速率约为130 μV·h-1,500 mA·cm-2的电流密度下电极性能的衰减速率约为370 μV·h-1。但可以注意到电位的升高并非线性变化,而是逐渐趋稳的。例如,在200 mA·cm-2的电流密度下运行到190 h后的二十多个小时之内电位已经稳定在1.48 V不再变化。可见Ni0.85Fe0.15-180-3电极在工业水电解条件下具有较高的稳定性。
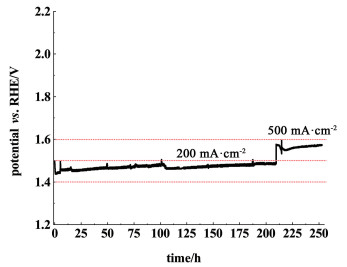
|
| 图 7 60℃、30% KOH溶液中不同电流密度下Ni0.85Fe0.15-180-3的计时电位曲线 Fig.7 The chronopotentiometric curve of Ni0.85Fe0.15-180-3 in 30% KOH at 60 ℃ |
| |
以镍网为基底,通过一步电沉积制备了多孔镍铁合金电极。该电极具有丰富的孔结构和较高的比表面积,其OER催化活性超过了许多前人报道的镍铁基催化剂。Fe含量对多孔镍铁合金电极的本征催化活性有影响,当Fe摩尔分数达到15%时,催化活性最高。Ni0.85Fe0.15-180-3在工业水电解条件下有较高的稳定性,运行250 h性能无明显衰减。一步电沉积制备的廉价、高活性与稳定性镍铁合金电极在碱性水电解制氢中具有广阔的前景。强析气条件下形成的多级孔结构电极的成功制备也为其它析气电极结构优化提供了新的思路。
| [1] |
ABE J O, POPOOLA A P I, AJENIFUJA E, et al. Hydrogen energy, economy and storage: Review and recommendation[J]. International Journal of Hydrogen Energy, 2019, 44(29): 15072-15086. DOI:10.1016/j.ijhydene.2019.04.068 |
| [2] |
DAWOOD F, ANDA M, SHAFIULLAH G M. Hydrogen production for energy: An overview[J]. International Journal of Hydrogen Energy, 2020, 45(7): 3847-3869. DOI:10.1016/j.ijhydene.2019.12.059 |
| [3] |
常进法, 肖瑶, 罗兆艳, 等. 水电解制氢非贵金属催化剂的研究进展[J]. 物理化学学报, 2016, 32(7): 1556-1592. CHANG Jinfa, XIAO Yao, LUO Zhaoyan, et al. Recent progress of non-noble metal catalysts in water electrolysis for hydrogen production[J]. Acta Physico-Chimica Sinica, 2016, 32(7): 1556-1592. (in Chinese) |
| [4] |
ZOU X, ZHANG Y. Noble metal-free hydrogen evolution catalysts for water splitting[J]. Chemical Society Reviews, 2015, 44(15): 5148-5180. DOI:10.1039/C4CS00448E |
| [5] |
URSUA A, GANDIA L M, SANCHIS P. Hydrogen production from water electrolysis: Current status and future trends[J]. Proceedings of the IEEE, 2012, 100(2): 410-426. DOI:10.1109/JPROC.2011.2156750 |
| [6] |
XU B, ZHANG Y, PI Y, et al. Research progress of nickel-based metal-organic frameworks and their derivatives for oxygen evolution catalysis[J]. Acta Physico Chimica Sinica, 2020. DOI:10.3866/PKU.WHXB202009074 |
| [7] |
XUAN C, WANG J, ZHU J, et al. Recent progress of metal organic frameworks-based nanomaterials for electrocatalysis[J]. Acta Physico-Chimica Sin, 2017, 33(1): 149-164. DOI:10.3866/PKU.WHXB201609143 |
| [8] |
MCCRORY C C, JUNG S, FERRER I M, et al. Benchmarking hydrogen evolving reaction and oxygen evolving reaction electrocatalysts for solar water splitting devices[J]. Journal of the American Chemical Society, 2015, 137(13): 4347-4357. DOI:10.1021/ja510442p |
| [9] |
ZENG K, ZHANG D. Recent progress in alkaline water electrolysis for hydrogen production and applications[J]. Progress in Energy and Combustion Science, 2010, 36(3): 307-326. DOI:10.1016/j.pecs.2009.11.002 |
| [10] |
FU S, SONG J, ZHU C, et al. Ultrafine and highly disordered Ni2Fe1 nanofoams enabled highly efficient oxygen evolution reaction in alkaline electrolyte[J]. Nano Energy, 2018, 44: 319-326. DOI:10.1016/j.nanoen.2017.12.010 |
| [11] |
WANG C, YANG H, ZHANG Y, et al. NiFe alloy nanoparticles with hcp crystal structure stimulate superior oxygen evolution reaction electrocatalytic activity[J]. Angewandte Chemie International Edition, 2019, 58(18): 6099-6103. DOI:10.1002/anie.201902446 |
| [12] |
PI Y, SHAO Q, WANG P, et al. Trimetallic oxyhydroxide coralloids for efficient oxygen evolution electrocatalysis[J]. Angewandte Chemie International Edition, 2017, 56(16): 4502-4506. DOI:10.1002/anie.201701533 |
| [13] |
WANG P, WAN L, LIN Y, et al. NiFe hydroxide supported on hierarchically porous nickel mesh as a high-performance bifunctional electrocatalyst for water splitting at large current density[J]. ChemSusChem, 2019, 12(17): 4038-4045. DOI:10.1002/cssc.201901439 |
| [14] |
GONG M, LI Y, WANG H, et al. An advanced Ni-Fe layered double hydroxide electrocatalyst for water oxidation[J]. Journal of the American Chemical Society, 2013, 135(23): 8452-8455. DOI:10.1021/ja4027715 |
| [15] |
FRIEBEL D, LOUIE M W, BAJDICH M, et al. Identification of highly active Fe sites in (Ni, Fe)OOH for electrocatalytic water splitting[J]. Journal of the American Chemical Society, 2015, 137(3): 1305-1313. DOI:10.1021/ja511559d |
| [16] |
GAO M, SHENG W, ZHUANG Z, et al. Efficient water oxidation using nanostructured α-nickel-hydroxide as an electrocatalyst[J]. Journal of the American Chemical Society, 2014, 136(19): 7077-7084. DOI:10.1021/ja502128j |
| [17] |
BURKE M S, KAST M G, TROTOCHAUD L, et al. Cobalt-iron (oxy)hydroxide oxygen evolution electrocatalysts: The role of structure and composition on activity, stability, and mechanism[J]. Journal of the American Chemical Society, 2015, 137(10): 3638-3648. DOI:10.1021/jacs.5b00281 |
| [18] |
WU G, CHEN W, ZHENG X, et al. Hierarchical Fe-doped NiOx nanotubes assembled from ultrathin nanosheets containing trivalent nickel for oxygen evolution reaction[J]. Nano Energy, 2017, 38: 167-174. DOI:10.1016/j.nanoen.2017.05.044 |
| [19] |
TROTOCHAUD L, RANNEY J K, WILLIAMS K N, et al. Solution-cast metal oxide thin film electrocatalysts for oxygen evolution[J]. Journal of the American Chemical Society, 2012, 134(41): 17253-17261. DOI:10.1021/ja307507a |
| [20] |
LI P, ZENG H. Sandwich-like nanocomposite of CoNiOx/reduced graphene oxide for enhanced electrocatalytic water oxidation[J]. Advanced Functional Materials, 2017. DOI:10.1002/adfm.201606325 |
| [21] |
ZHAO X, SHANG X, QUAN Y, et al. Electrodeposition-solvothermal access to ternary mixed metal Ni-Co-Fe sulfides for highly efficient electrocatalytic water oxidation in alkaline media[J]. Electrochimica Acta, 2017, 230: 151-159. DOI:10.1016/j.electacta.2017.01.178 |
| [22] |
DONG B, ZHAO X, HAN G, et al. Two-step synthesis of binary Ni-Fe sulfides supported on nickel foam as highly efficient electrocatalysts for the oxygen evolution reaction[J]. Journal of Materials Chemistry A, 2016, 4(35): 13499-13508. DOI:10.1039/C6TA03177C |
| [23] |
LUO P, SUN F, DENG J, et al. Tree-like NiS-Ni3S2/NF heterostructure array and its application in oxygen evolution reaction[J]. Acta Physico-Chimica Sinica, 2018, 34(12): 1397-1404. DOI:10.3866/PKU.WHXB201804022 |
| [24] |
YIN Z, ZHU C, LI C, et al. Hierarchical nickel-cobalt phosphide yolk-shell spheres as highly active and stable bifunctional electrocatalysts for overall water splitting[J]. Nanoscale, 2016, 8(45): 19129-19138. DOI:10.1039/C6NR07009D |
| [25] |
SONG D, HONG D, KWON Y, et al. Highly porous Ni-P electrode synthesized by an ultrafast electrodeposition process for efficient overall water electrolysis[J]. Journal of Materials Chemistry A, 2020, 8(24): 12069-12079. DOI:10.1039/D0TA03739G |
| [26] |
GONG M, DAI H. A mini review of NiFe-based materials as highly active oxygen evolution reaction electrocatalysts[J]. Nano Research, 2015, 8(1): 23-39. DOI:10.1007/s12274-014-0591-z |
| [27] |
ZHAO J, ZHANG J, LI Z, et al. Recent progress on NiFe-based electrocatalysts for the oxygen evolution reaction[J]. Small (Weinheim an Der Bergstrasse, Germany), 2020. DOI:10.1002/smll.202003916 |
| [28] |
LI D, KOIKE M, WANG L, et al. Regenerability of hydrotalcite-derived nickel-iron alloy nanoparticles for syngas production from biomass tar[J]. ChemSusChem, 2014, 7(2): 510-522. DOI:10.1002/cssc.201300855 |
| [29] |
MERKI D, VRUBEL H, ROVELLI L, et al. Fe, Co, and Ni ions promote the catalytic activity of amorphous molybdenum sulfide films for hydrogen evolution[J]. Chemical Science, 2012, 3(8): 2515-2525. DOI:10.1039/c2sc20539d |
| [30] |
LOUIE M W, BELL A T. An investigation of thin-film Ni-Fe oxide catalysts for the electrochemical evolution of oxygen[J]. Journal of the American Chemical Society, 2013, 135(33): 12329-12337. DOI:10.1021/ja405351s |
| [31] |
LIU Z, TANG B, GU X, et al. Selective structure transformation for NiFe/NiFe2O4 embedded porous nitrogen-doped carbon nanosphere with improved oxygen evolution reaction activity[J]. Chemical Engineering Journal, 2020. DOI:10.1016/j.cej.2020.125170 |
| [32] |
JIA X, ZHAO Y, CHEN G, et al. Ni3FeN nanoparticles derived from ultrathin NiFe-layered double hydroxide nanosheets: An efficient overall water splitting electrocatalyst[J]. Advanced Energy Materials, 2016. DOI:10.1002/aenm.201502585 |
| [33] |
LIU G, HE D, YAO R, et al. Amorphous NiFeB nanoparticles realizing highly active and stable oxygen evolving reaction for water splitting[J]. Nano Research, 2018, 11(3): 1664-1675. DOI:10.1007/s12274-017-1783-0 |
| [34] |
SHI R, WANG J, WANG Z, et al. Unique NiFeNiCoO2 hollow polyhedron as bifunctional electrocatalysts for water splitting[J]. Journal of Energy Chemistry, 2019, 33: 74-80. DOI:10.1016/j.jechem.2018.08.016 |
| [35] |
LIU G, YAO R, ZHAO Y, et al. Encapsulation of Ni/Fe3O4 heterostructures inside onion-like N-doped carbon nanorods enables synergistic electrocatalysis for water oxidation[J]. Nanoscale, 2018, 10(8): 3997-4003. DOI:10.1039/C7NR09446A |
| [36] |
CHE Q, LI Q, TAN Y, et al. One-step controllable synthesis of amorphous (Ni-Fe)Sx/NiFe(OH)y hollow microtube/sphere films as superior bifunctional electrocatalysts for quasi-industrial water splitting at large-current-density[J]. Applied Catalysis B: Environmental, 2019, 246: 337-348. DOI:10.1016/j.apcatb.2019.01.082 |
| [37] |
ZHU K, LI M, LI X, et al. Enhancement of oxygen evolution performance through synergetic action between NiFe metal core and NiFeOx shell[J]. Chemical Communications, 2016, 52(79): 11803-11806. DOI:10.1039/C6CC04951F |
 2022, Vol. 39
2022, Vol. 39





