2. 天津市膜科学与海水淡化重点实验室,天津 300350;
3. 天津大学理学院,天津 300350
2. Tianjin Key Laboratory of Membrane and Desalination Technology, Tianjin 300350, China;
3. School of Sciences, Tianjin University, Tianjin 300350, China
随着人类社会的不断发展,全球对于能源和环境问题的关注度也在持续提升。化石燃料正面临着日益枯竭的危机,并且其燃烧后带来了严重的环境问题。因此,急需开发清洁、可再生的替代能源。在所有燃料中,氢能是最清洁的能源,其燃烧产物只有水,不会造成任何污染[1]。并且氢是宇宙中最丰富的元素,其气体单质热值可达143 MJ·kg-1,是石油(41.87 MJ·kg-1)的3倍之多[2]。因此,氢能在开发新能源的研究中倍受青睐,具有很好的开发前景。目前,全球96%的氢气供应都来自天然气重整以及煤气化[3],来源于化石燃料的氢能不是真正意义上的可再生能源。生物质具有可再生性,并且来源广泛、产量大。我国生物质资源非常丰富,每年产生的生物质能源换算为标准煤可达50亿t,相当于目前我国每年总能耗的4倍之多[4]。生物质能源的高效、清洁利用成为近年来的一个研究热点。利用生物质来制取氢气是实现生物质清洁利用的一个重要途径。
生物质制氢技术主要包括热转化法、发酵法、光电化学转化法、电解法等[5]。生物质热转化法是对农业或林业废弃物进行气化、热解或蒸汽处理来制取氢气[3],该方法非常容易实现规模化生产,但该方法存在热量效率低、催化剂耐久性差和产品杂质多等问题[6],从而制约了该技术的进一步应用和发展。发酵和光电化学(PEC)工艺可以通过生物质及其衍生物制氢,表现出很好的发展前景[7, 8]。然而,2者同样面临产氢率低的问题,难以投入实际应用。生物质电解法在阳极处用燃料的氧化反应代替析氧反应,在阴极产生氢气,与电解水相比,产氢能耗显著降低。
理论能量增益系数(Theoretical energy gain, TEG)是用来衡量能源的生产流程是否具有投入价值的相关指数[9],TEG等于产品燃烧释放的理论能量值除以生产所投入的理论能量值。对电解水制氢来说,其TEG等于1。对催化电解葡萄糖制氢来说。其总反应如式(1):
| $ {{\rm{C}}_6}{{\rm{H}}_{12}}{{\rm{O}}_6} + 6{{\rm{H}}_2}{\rm{O}} = 6{\rm{C}}{{\rm{O}}_2} + 12{{\rm{H}}_2} $ | (1) |
查阅热力学数据表中相关物质的标准摩尔生成焓可以计算得到总反应的标准摩尔反应焓变为614.16 kJ·mol-1。产出的氢气燃烧可释放的能量可以通过其标准摩尔燃烧焓得出:
| $ - 285.83 \times 12 = - 3429.96{\rm{kJ}} \cdot {\rm{mo}}{{\rm{l}}^{ - 1}} $ | (2) |
由式(2)可以得出电解葡萄糖制氢流程的理论能量增益系数为:
| $ 3429.96 \div 614.16 = 5.58 $ | (3) |
以多金属氧酸盐(POMs)作为催化剂,可以在较为温和的反应条件下对生物质进行催化电解,并且制氢效率得到显著提高[10-12]。POMs是水溶性金属氧化物簇,现已在光催化水分解领域被广泛应用[13, 14]。POMs还可以被用作水电解中的电子耦合质子缓冲剂,用于解耦氢和氧的析出[15, 16]。将POMs应用于生物质电解中,可以有效地解决传统贵金属催化剂在低温下无法有效断开C—C键的问题,同时相较于传统贵金属催化剂,POMs耐受杂质的能力更强,大大减少了催化剂中毒现象的发生[17-19]。然而POMs的价格仍然较高,这使得生物质制氢的整体成本依旧较高,同时POMs的相对分子质量较大,在配制溶液时很难获得高摩尔浓度的溶液,并且极易堵塞管路。碘酸钾KIO3具有很强的氧化性,理论上也可以作为催化电解生物质的催化剂[20]。相较于POMs,KIO3成本更低,可以在较大的浓度范围内进行调整,也不易造成管路堵塞。基于此,本研究选用KIO3为催化剂来替代POMs,以葡萄糖为模型底物,探究其液相催化电解制氢性能。
1 实验 1.1 阳极溶液预处理以KIO3作为液相催化剂,葡萄糖作为反应底物。首先,将1.07 g的KIO3和9.00 g的无水葡糖糖加入50 mL的去离子水中,经充分搅拌溶解后置于三口烧瓶中,用加热套将混合溶液加热至预定温度,并在该温度下保持一段时间。采用冷凝回流装置来减少溶液的蒸发损失。在预处理过程中,每隔40 min取样1次。
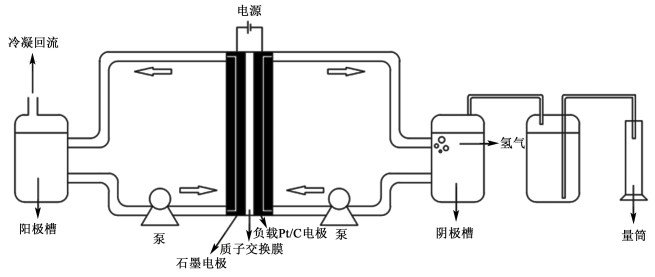
1.2 实验装置KIO3催化电解葡萄糖制氢实验装置如图 1所示。
|
| 图 1 KIO3催化电解葡萄糖制氢实验装置示意图 Fig.1 KIO3 catalytic electrolysis of glucose to hydrogen experiment flow chart |
| |
将预处理后的KIO3-葡萄糖混合溶液置于阳极槽中,通过蠕动泵泵入电解槽的阳极,在阳极内进行电解后返回至阳极槽。阴极槽内置入1 mol·L-1的磷酸溶液,磷酸溶液由蠕动泵泵入电解槽的阴极进行电子交换并生成氢气,带有氢气的磷酸溶液回流至阴极槽,从阴极槽顶部释放出的氢气采用排水集气法来进行收集和测量。电解时,电解槽两极接入直流稳压电源,阳极槽和阴极槽的温度均控制在80 ℃,液体流量都控制在30 mL·min-1。
该实验装置的核心设备是电解槽,它的阳极和阴极是由2块高密度石墨板制成,在每块石墨板上,刻有长50 mm,宽2 mm,深5 mm的蛇形流动通道。在流道内填充了处理过的石墨毡[21]。夹在2个电极之间的是Nafion115膜,膜的阴极侧负载了4 mg·cm-2的Pt/C。Nafion115膜在使用之前需要进行活化处理,将其浸泡于含有H2SO4(1 mol·L-1)和H2O2(质量分数为3%)的混合溶液中,在100 ℃下活化30 min,再用去离子水洗净。
1.3 KIO3还原度分析本实验将KIO3还原度m定义为被还原KIO3分子数与KIO3分子总数之比,可以表示为:
| $ m = \sum {\frac{{\left[ {{{\rm{I}}^ - }} \right]}}{{\left[ {{\rm{KI}}{{\rm{O}}_3}} \right]}}} $ | (4) |
式(4)中:[I-]为溶液中I-的浓度,[KIO3]为溶液中KIO3的初始浓度。
由于溶液在226 nm处的吸光度与I-浓度存在线性关系,且KIO3的浓度不影响该处的吸光度,因此,可利用该处的吸光度来确定I-的浓度。首先,配制具有不同浓度的KI溶液,用紫外分光光度计分别测量其在226 nm处的吸光度,得到如图 2所示的曲线。对实验数据进行线性拟合,拟合结果为:

|
| 图 2 I-浓度标准曲线 Fig.2 I- concentration standard curve |
| |
| $ \mathit{y}{\rm{ = - 0}}{\rm{.82827 + 54}}{\rm{.31056 }}\mathit{x} $ | (5) |
将待测样品溶液进行适当稀释后,通过紫外分光光度计测出226 nm处的吸光度,利用公式(5)即可计算出I-浓度,将I-浓度带入公式(4)即可得到样品溶液中KIO3的还原度。
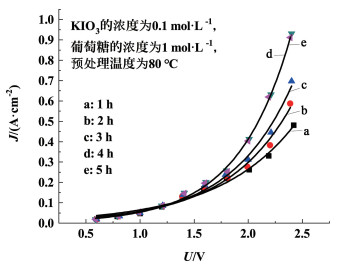
2 结果与讨论 2.1 预处理的影响预处理时间与温度是影响后续电解制氢效率最重要的2个因素。葡萄糖催化电解的产氢性能主要由电流密度决定,在相同的电流密度下,所需电压越小,消耗的电能就越少,制氢效率就越高。如图 3所示,当预处理时间低于4 h时,预处理时间越长,达到相同电流密度所需的电压就越小。这说明随着预处理时间的不断增加,越来越多的葡萄糖被KIO3催化氧化。进一步延长预处理时间至5 h,其变化曲线与4 h基本重合,这说明当预处理时间达到4 h时,KIO3与葡萄糖的反应基本处于饱和状态。因此,适宜的预处理时间为4 h。
|
| 图 3 预处理时间对制氢效率的影响 Fig.3 Effect of pretreatment time on hydrogen production efficiency |
| |
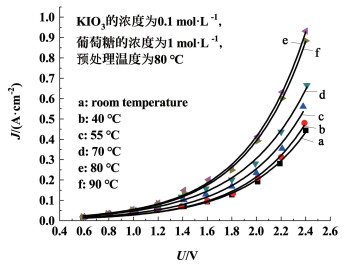
从图 4可以看出,随着预处理温度不断提高,KIO3对葡萄糖的催化氧化效果越来越好,在预处理温度为80 ℃时达到最佳,进一步提高预处理温度,制氢效率开始下降。这是因为预处理温度过高,催化氧化后形成的I-被氧化为I2,减少了电解过程中发生电子转移的离子数量,从而降低产氢的性能。因此,适宜的预处理温度为80 ℃。
|
| 图 4 预处理温度对制氢效率的影响 Fig.4 Influence of pretreatment temperature on hydrogen production efficiency |
| |
在Yang等的研究中[22],以POMs为催化剂,在预处理前将溶液的pH值调至0.3能够显著提高POMs的还原度。基于此,在预处理前,用磷酸将KIO3-葡萄糖混合溶液的pH值调至0.5,在80 ℃下预处理4 h。
从图 5中可以看出,在预处理过程中,KIO3的还原度随预处理时间的增加而不断增大,与未调节pH值的溶液相比,调节pH值后溶液的还原度明显下降。这一结果与POMs的完全相反。由于在溶液中H+浓度较高时,部分I-会被氧气氧化成为I2,使得混合溶液中游离的I-减少,从而还原度降低。

|
| 图 5 pH值对还原度的影响 Fig.5 The effect of pretreatment pH on reduction degree |
| |
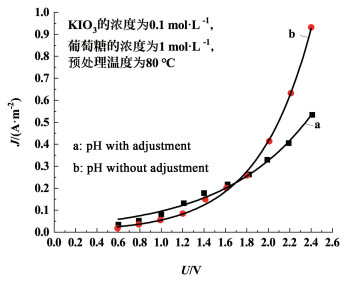
由图 6可以看出,2条电流密度的变化曲线出现了交叉,在电压较低时,调节pH值的混合溶液在电解过程中具有更高的电流密度,随着电压不断增大,电流密度呈现出指数增长的趋势,由于未调节pH值的混合溶液具有更高的增长速率,当电压大于1.6 V后,其电流密度逐渐赶上并超过了调节pH值的混合溶液,并且差距越来越大,当电压为2.4 V时,未调节pH值的电流密度达到了0.931 A·cm-2,是调节pH值的1.74倍。这是由于调节pH值的混合溶液中存在着较多游离的H+,因此,在较低的电压下就可以产生电流。但是在预处理过程中使得部分I-被氧化,电解制氢的效率就会下降。可见,预处理前无需调节pH值。
|
| 图 6 pH值对制氢效率的影响 Fig.6 The effect of pretreatment pH on hydrogen production efficiency |
| |
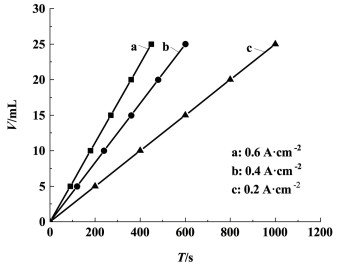
在电流密度分别为0.2、0.4和0.6 A·cm-2的条件下,电解KIO3-葡萄糖混合溶液考察其产氢性能。
从图 7中可以看出,产氢量与时间呈线性关系,这意味着产氢速率恒定、制氢过程稳定。电流密度越大,直线的斜率就越大,产氢速率就越大。且产氢量与时间是呈正比的,由图 8可知,在电解过程中电压一直保持稳定,进一步证实了电解制氢过程的稳定性。
|
| 图 7 不同电流密度下的产氢性能 Fig.7 Hydrogen production performance under different current densities |
| |

|
| 图 8 不同电流密度下的产氢稳定性 Fig.8 Hydrogen production stability under different current densities |
| |
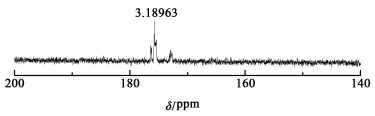
在电流密度为0.2 A·cm-2的条件下电解KIO3-葡萄糖混合溶液至阴极再无气泡生成。电解完成后,取出阳极液,加入等量葡萄糖再次加热预处理,进行第2次电解反应。在第1次和第2次电解完成后对阳极液取样,放入烘箱以50 ℃干燥48 h。干燥完成后进行核磁共振碳谱检测。
|
| 图 9 一次电解核磁共振碳谱图 Fig.9 The first electrolysis NMR carbon spectrum |
| |
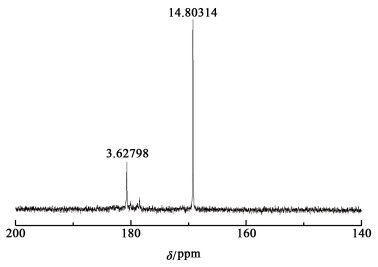
|
| 图 10 二次电解核磁共振碳谱图 Fig.10 The NMR carbon spectrum of second electrolysis |
| |
醇类化合物的氧化途径主要是先生成醛酮类化合物,若氧化剂的氧化性足够强,醛类化合物会继续生成羧酸[23]。通过核磁共振碳谱初步判定电解产物中含有酮基、醛基与羧基,且随着进一步电解,这些官能团含量提升。由此初步判断电解产物生成流程:由葡萄糖生成醛酮类物质,进而生成羧酸,最后彻底氧化生成CO2与H2O。
3 结论与展望1) KIO3催化电解葡萄糖制氢(KIO3的浓度为0.1 mol·L-1,葡萄糖的浓度为1 mol·L-1)的最适宜预处理条件为:预处理温度80 ℃,预处理时间4 h。
2) 液相催化电解葡萄糖制氢过程的理论能量增益系数为5.58,表现出很好的开发前景,并且其产氢性能稳定。
3) 与POMs催化电解葡萄糖制氢相比,采用KIO3作为催化剂,无需在预处理前溶液的pH值,并且其成本更加低廉。
4) 从理论上讲,葡萄糖可以完全被催化电解成CO2和H2,对于电解的具体中间产物及生成流程有待于进一步探究。
| [1] |
TURNER J. Sustainable hydrogen production[J]. Science, 2004, 305(5686): 972-974. DOI:10.1126/science.1103197 |
| [2] |
LIU W, CUI Y, DU X, et al. High efficiency hydrogen evolution from native biomass electrolysis[J]. Energy & Environmental Science, 2016, 9(2): 467-472. |
| [3] |
PARTHASARATHY P, NARAYANAN K S. Hydrogen production from steam gasification of biomass: Influence of process parameters on hydrogen yield: A review[J]. Renewable Energy, 2014, 66: 570-579. DOI:10.1016/j.renene.2013.12.025 |
| [4] |
孔令刚, 蒋晓岚. 生物质及其开发利用的价值与意义[J]. 中国科技论坛, 2007(9): 100-104. KONG Linggang, JIANG Xiaolan. The value and significance of biomass and its development and utilization[J]. Forum on Science and Technology in China, 2007(9): 100-104. (in Chinese) |
| [5] |
TURNER J, SVERDRUP G, MANN M, et al. Renewable hydrogen production[J]. International Journal of Energy Research, 2008, 32(5): 379-407. DOI:10.1002/er.1372 |
| [6] |
LEVIN D, CHAHINE R. Challenges for renewable hydrogen production from biomass[J]. International Journal of Hydrogen Energy, 2010, 35(10): 4962-4969. DOI:10.1016/j.ijhydene.2009.08.067 |
| [7] |
LU X, XIE S, YANG H, et al. Photoelectrochemical hydrogen production from biomass derivatives and water[J]. Chemical Society Reviews, 2014, 43(22): 7581-7593. DOI:10.1039/C3CS60392J |
| [8] |
WONG Y, WU T, JUAN J. A review of sustainable hydrogen production using seed sludge via dark fermentation[J]. Renewable and Sustainable Energy Reviews, 2014, 34: 471-482. DOI:10.1016/j.rser.2014.03.008 |
| [9] |
ZHOU Y, JIA C, ZHANG Y, et al. Experimental study on a new process of producing hydrogen in consumption of water and coal[J]. AIChE Journal, 2008, 54(5): 1388-1395. DOI:10.1002/aic.11478 |
| [10] |
CHEN Y, LAVACCHI A, MILLER H, et al. Nanotechnology makes biomass electrolysis more energy efficient than water electrolysis[J]. Nature Communications, 2014, 5(1): 1-6. |
| [11] |
LIU W, MU W, LIU M, et al. Solar-induced direct biomass-to-electricity hybrid fuel cell using polyoxometalates as photocatalyst and charge carrier[J]. Nature Communications, 2014, 5(1): 1-8. |
| [12] |
LIU W, MU W, DENG Y. High-performance liquid-catalyst fuel cell for direct biomass-into-electricity conversion[J]. Angewandte Chemie, 2014, 126(49): 13776-13780. DOI:10.1002/ange.201408226 |
| [13] |
RIVALTA I, BRUDVIG G, BATISTA V. Molecular water oxidation catalysis: A key topic for new sustainable energy conversion schemes[M]. Chichester UK: John Wiley & Sons, Ltd, 2014.
|
| [14] |
LV H, GELETⅡ Y, ZHAO C, et al. Polyoxometalate water oxidation catalysts and the production of green fuel[J]. Chemical Society Reviews, 2012, 41(22): 7572-7589. DOI:10.1039/c2cs35292c |
| [15] |
SYMES M, CRONIN L. Decoupling hydrogen and oxygen evolution during electrolytic water splitting using an electron-coupled-proton buffer[J]. Nature Chemistry, 2013, 5(5): 403-409. DOI:10.1038/nchem.1621 |
| [16] |
RAUSCH B, SYMES M, CHISHOLM G, et al. Decoupled catalytic hydrogen evolution from a molecular metal oxide redox mediator in water splitting[J]. Science, 2014, 345(6202): 1326-1330. DOI:10.1126/science.1257443 |
| [17] |
刘金鑫. 基于高分子负载非贵金属构建燃料电池氧还原催化剂的研究[D]. 广东深圳: 深圳大学, 2016 LIU Jinxin. Research on the construction of oxygen reduction catalysts for fuel cells based on polymer-supported non-precious metals[D]. Guangdong Shenzhen: Shenzhen University, 2016 (in Chinese) |
| [18] |
黄慧慧. 新型碳基非贵金属催化剂的可控制备及其高效氧还原性能研究[D]. 浙江温州: 温州大学, 2015 HUANG Huihui. Controlled synthesis of novel carbon-based non-precious metal catalysts with high-efficiency ORR performance[D]. Zhejiang Wenzhou: Wenzhou University, 2015 (in Chinese) |
| [19] |
黄孟杰. 氮掺杂碳载非贵金属的氧还原催化剂研究[D]. 北京: 北京化工大学, 2016 HUANG Mengjie. Study of nitrogen-doped carbon with non-precious metals as efficient catalyst for oxygen reduction[D]. Beijing: Beijing University of Chemical Technology, 2016 (in Chinese) |
| [20] |
唐阳. 功能导向的电化学体系建立与碳基复合电极的设计和制备[D]. 北京: 北京化工大学, 2013 TANG Yang. Design of function-oriented electrochemical systems and preparation of carbon-based composite electrodes[D]. Beijing: Beijing University of Chemical Technology, 2013 (in Chinese) |
| [21] |
杨琦, 苏伟, 姚兰, 等. 高效液相催化电解葡萄糖制氢过程研究[J]. 现代化工, 2018, 38(7): 150-153, 155. YANG Qi, SU Wei, YAO Lan, et al. High efficient hydrogen evolution from glucose electrolysis over liquid phase catalyst[J]. Modern Chemical Industry, 2018, 38(7): 150-153, 155. (in Chinese) |
| [22] |
SHENG F, YANG Q, CUI D, et al. Pure hydrogen production from polyol electrolysis using polyoxometalates as both a liquid catalyst and a charge carrier[J]. Energy & Fuels, 2020, 34(8): 10282-10289. |
| [23] |
曹怀宝. 以Saccharin/TEMPO高效催化氧化醇制备醛酮的研究[J]. 化学研究与应用, 2019, 31(9): 1702-1706. CAO Huaibao. Study on efficient procedure for the catalytic oxidation of alcohols into aldehydes/ketones using Saccharin/TEMPO[J]. Chemical Research and Application, 2019, 31(9): 1702-1706. (in Chinese) |
 2022, Vol. 39
2022, Vol. 39





