制盐工业具有悠久的历史,日晒制盐是蒸发卤水制盐的初始阶段,第2阶段是敞口锅直接烧火加热,真空制盐是蒸发制盐发展的第3阶段,一般是多效加压和真空并用蒸发制盐的简称[1]。真空制盐的原料是卤水,未净化的卤水成垢离子含量高,浓缩蒸发过程中在预热器、加热室、蒸发罐等设备表面结垢。垢层的形成大幅降低传热系数、增加能耗、减少蒸发量、破坏盐硝结晶析出平衡,缩短正常生产时间[2-5],降低制盐企业的生产强度和总产量。通过卤水净化降低成垢离子的浓度,避免结垢物的形成是真空制盐的重要环节。
目前卤水净化工艺有“石灰-烟道气”法、“石灰-纯碱”法和“NaOH-Na2CO3”两碱净化法[6, 7]。3种工艺各有优缺点。“石灰-烟道气”法充分利用烟道气中的二氧化碳资源实现卤水中钙离子的脱除,减少二氧化碳的减排,节约生产成本,达到环境保护和资源综合利用的效果;但也存在钙镁泥浆量大,排泥困难,操作难度大,设备投资及维护成本高等缺点[8]。“石灰-纯碱”法净化卤水具有石灰来源方便,价格便宜,Ca2+和Mg2+等杂质除去率高的优点;其缺点主要是CaO利用率不高,且需过量加入,使纯碱的耗量有所增高,因石灰渣的带入使沉淀的处理量增大,产生的废渣量大不利于环保[9]。“NaOH-Na2CO3”两碱净化法具有反应速度快、周期短、净化效率高,形成的废渣较少的优点,净化渣便于处置利用,是一种清洁高效的卤水净化工艺[10]。
针对硫酸钠型卤水净化,国内制盐企业逐渐采用“NaOH-Na2CO3”法代替“石灰-纯碱”法[8]。但是实际生产中净化后精卤中Ca2+、Mg2+、CO32-等成垢离子的行为与真空制盐结垢的关系缺少深入的研究报道。前期研究表明,盐硝蒸发系统垢泥主要由CaCO3垢和Mg(OH)2垢组成,但结垢机理有所区别,盐系统结垢的诱因是逐效富集的Ca2+随着温度的升高而形成低溶解度的CaCO3达到过饱和状态沉积析出形成垢层;硝系统结垢的主要原因是卤水中CO32-和OH-的成倍富集所致[11]。因而卤水净化过程中,除了精卤中Ca2+和Mg2+浓度以外,残留CO32-浓度也应该是重要的考核指标。但是实际生产中主要倾向于降低精卤中钙镁离子浓度,往往忽略残留碳酸根离子对结垢的危害,缺少对碳酸根离子浓度控制的手段。本研究针对现有卤水净化过程仅仅关注钙镁离子浓度总量,而忽略残留碳酸根离子对结垢影响的误区,提出了控制成垢离子总量Q[c(Ca2+)+c(Mg2+)+c(CO32+), mg ·L-1]的思路,研究了“NaOH-Na2CO3”用量与成垢离子沉降之间的关系,通过优化两碱用量,使Ca2+与CO32-形成CaCO3,Mg2+与OH-结合形成Mg(OH)2沉淀,达到除去Ca2+和Mg2+的目的,同时降低精卤中残留CO32-浓度,减少成垢离子总量Q,避免和减少真空制盐过程结垢物的形成。为延长真空制盐蒸发工段的正常作业周期,提高换热效率,降低蒸汽消耗提供理论指导。
1 实验 1.1 原料与试剂铬蓝黑R和铬黑T指示剂(分析纯,天津恒兴化学试剂制造有限公司),酚酞指示剂(天津市化学试剂三厂),甲基橙(分析纯,天津市恒兴化学试剂制造有限公司),NaOH、Na2CO3以及所用制盐卤水由云南某公司提供。采用EDTA络合滴定法、双指示剂法、氯化银沉淀滴定法测定原卤中的Ca2+、Mg2+、CO32-、HCO3-及原卤中主要成分Na2SO4和NaCl的浓度,结果见表 1。由表 1可知,原卤中NaCl、Na2SO4、Ca2+、Mg2+和HCO3-的浓度分别为306、21、480、31和140 mg ·L-1。
| Component | c(NaCl)/
(g·L-1) |
c(Na2SO4)/
(g·L-1) |
c(Ca2+)/
(mg·L-1) |
c(Mg2+)/
(mg·L-1) |
c(HCO32-)/
(mg·L-1) |
c(CO32-)/
(mg·L-1) |
| Concentration range | 303~307 | 20~21 | 470~490 | 30~32 | 138~142 | 检测不出 |
| Mean concentration | 306 | 21 | 480 | 31 | 140 | 检测不出 |
将装有1 000 mL原卤的烧杯放置于已预设实验温度的恒温水浴锅(HH-S26S型,金坛市大地自动化仪器厂) 中,开启搅拌器(JB60-SH杭州齐威仪器有限公司) 并调节至实验所需的搅拌速率150 r ·min-1,用蠕动泵逐渐向烧杯中泵入卤水至5 000 mL,同时加入已配置好的NaOH和Na2CO3,以进料结束的时刻点为起点开始计时,并在预定时刻结束实验。净化实验结束后,采用砂芯过滤装置对净化液进行过滤,检测过滤后清液中Ca2+、Mg2+和CO32-的浓度及溶液pH值,并通过XRD、SEM-EDS和FT-IR等手段对钙镁泥沉淀物进行测试表征。
1.3 实验原理“NaOH-Na2CO3”卤水法的原理为NaOH与卤水中的Mg2+发生沉淀反应,生成低溶解度的Mg(OH)2沉淀,见式(1)。Na2CO3与卤水中Ca2+生成CaCO3沉淀,见式(2)。通过实验和理论计算研究卤水中CO32-和HCO3-随pH值的变化情况。设定水溶液的pH值和总碱度,依据式(3)、式(4)和式(5)计算H2CO3、HCO3-和CO32-在水溶液中的分布情况[12],结果如图 1所示。
| $ {\rm{MgS}}{{\rm{O}}_4} + 2{\rm{NaOH}} = {\rm{Mg}}{({\rm{OH}})_2} \downarrow + {\rm{N}}{{\rm{a}}_2}{\rm{S}}{{\rm{O}}_4} $ | (1) |
| $ {\rm{CaS}}{{\rm{O}}_4} + {\rm{N}}{{\rm{a}}_2}{\rm{C}}{{\rm{O}}_3} = {\rm{CaC}}{{\rm{O}}_3} \downarrow + {\rm{N}}{{\rm{a}}_2}{\rm{S}}{{\rm{O}}_4} $ | (2) |
| $ {\alpha _0} = {\left( {1 + \frac{{{K_1}}}{{\left[ {{{\rm{H}}^ + }} \right]}} + \frac{{{K_1}{K_2}}}{{{{\left[ {{{\rm{H}}^ + }} \right]}^2}}}} \right)^{ - 1}} $ | (3) |
| $ {\alpha _1} = {\left( {1 + \frac{{\left[ {{{\rm{H}}^ + }} \right]}}{{{K_1}}} + \frac{{{K_2}}}{{\left[ {{{\rm{H}}^ + }} \right]}}} \right)^{ - 1}} $ | (4) |
| $ {\alpha _2} = {\left( {1 + \frac{{{{\left[ {{{\rm{H}}^ + }} \right]}^2}}}{{{K_1}{K_2}}} + \frac{{\left[ {{{\rm{H}}^ + }} \right]}}{{{K_2}}}} \right)^{ - 1}} $ | (5) |
| $ {{\text{H}}^{+}}+\text{CO}_{3}^{2-}\rightleftharpoons \text{HCO}_{3}^{-} $ | (6) |
| $ \text{HCO}_{3}^{-}+\text{O}{{\text{H}}^{-}}\rightleftharpoons \text{CO}_{3}^{2-}+{{\text{H}}_{2}}\text{O} $ | (7) |
| $ {\rm{C}}{{\rm{a}}^{2 + }} + {\rm{CO}}_3^{2 - } \to {\rm{CaC}}{{\rm{O}}_3} \downarrow $ | (8) |
式(1)~式(8)中:α0、α1、α2分别为水溶液中碳酸、碳酸氢根、碳酸根的分布系数,[H+]、K1和K2分别为水溶液中氢离子浓度、碳酸一级离解平衡常数、二级离解平衡常数。
由图 1,在实验过程中,调节卤水的pH值在10以上时,可将部分的HCO3-逐步转化为CO32-,根据式(8),随着CO32-浓度的提高,可以促进CaCO3沉淀。因此,通过调节pH值,促进HCO3-转化为CO32-,提高精卤中CO32-利用效率,可以降低Na2CO3使用量,同时也降低精卤中残留的CO32-浓度,从而降低成垢离子的总量,为后期盐硝系统的阻垢防垢提供基础。

|
| 图 1 不同pH值下水溶液中H2CO3-HCO3--CO32-的分布情况图 Fig.1 Distribution of H2CO3-HCO3--CO32- in aqueous solution with different pH values |
| |
通过Factsage热力学软件计算并绘制Ca2+-Mg2+-CO32--H2O体系在25 ℃下的电位pH图[2],结果如图 2所示。由图 2可知,当pH<12,CO32-与Ca2+, Mg2+结合生成CaCO3及钙镁共晶体CaMg(CO3)2。随着pH值增高,主要生成CaCO3和Mg(OH)2沉淀,提高碳酸根离子的利用效率。
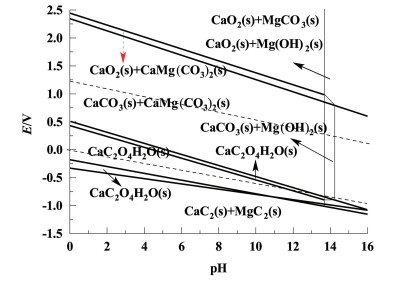
|
| 图 2 Ca2+-Mg2+-CO32--H2O体系的φ-pH图 Fig.2 φ-pH diagram of Ca2+-Mg2+-CO32--H2O system |
| |
精卤中钙镁离子净化效果、精卤pH值、CO32-浓度和成垢离子总量的变化结果分别如图 3、图 4、图 5和图 6所示。
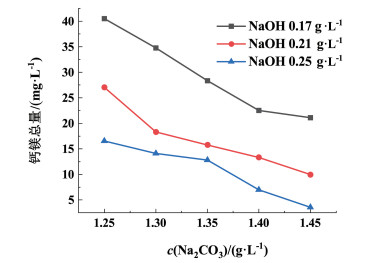
|
| 图 3 精卤中钙镁总量随碳酸钠添加量的变化图 Fig.3 The variation diagram of the total amount of calcium and magnesium in refined brine with the amount of sodium carbonate added |
| |
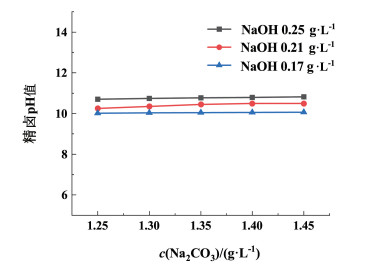
|
| 图 4 精卤pH值随碳酸钠添加量的变化图 Fig.4 Variation of pH value of refined brine with the amount of sodium carbonate added |
| |
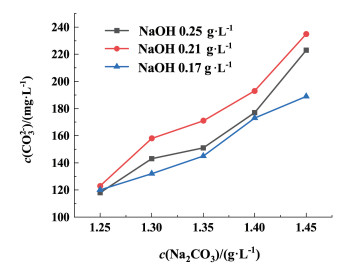
|
| 图 5 精卤中碳酸根离子浓度随碳酸钠添加量的变化图 Fig.5 Variation of carbonate ion concentration in refined brine with amount of sodium carbonate added |
| |
|
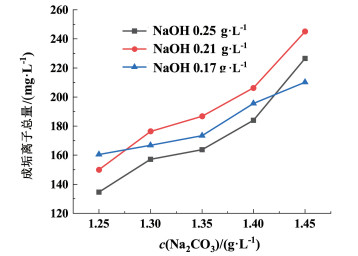
| 图 6 精卤中成垢离子总量随碳酸钠添加量的变化图 Fig.6 Variation of the total amount of scale-forming ions in refined brine with the amount of sodium carbonate added |
| |
由图 3可知,控制NaOH浓度为定值,随着Na2CO3浓度的增加,钙镁总量呈明显下降趋势。该过程中,随着Na2CO3溶解,CO32-浓度的增加,与Ca2+充分反应,实现深度净化。实际生产中精卤中钙镁离子浓度总量一般控制在15 mg ·L-1以内,考虑NaOH浓度的变化,NaOH在0.17 g ·L-1时钙镁离子浓度总量大于15 mg ·L-1,达不到实际生产要求;当NaOH在0.21 g ·L-1时,适当提高Na2CO3浓度可以将钙镁总量控制在15 mg ·L-1。在NaOH为0.25 g ·L-1时,Na2CO3在1.30~1.45 g ·L-1都可以控制钙镁总量小于15 mg ·L-1,满足生产对钙镁离子浓度的要求。结果表明,提高氢氧化钠浓度,可以提高卤水净化效果,并降低Na2CO3的用量。
由图 4可以看出,在NaOH浓度不变时,随着Na2CO3浓度的增加pH值并没有明显的变化,在相同Na2CO3浓度下,随着NaOH浓度的增加,pH值明显升高。表明精卤pH值主要依赖NaOH调控,且pH值都在10以上,在这个范围内有助于促进HCO3-向CO32-的转化,提高碳酸根的利用效率,实现碳酸根的高效利用和卤水的深度净化,从而降低Na2CO3用量。
由图 5可知,在NaOH浓度为固定值时,随着Na2CO3浓度的增加,溶液中的CO32-增多,精卤中残留的CO32-浓度呈明显上升趋势。控制Na2CO3浓度相同,NaOH为0.17 g ·L-1时,精卤中残留的碳酸根离子浓度最低,结合图 1和图 2,pH值升高会促进溶液中的HCO3-转化为CO32-,提高碳酸根的利用效率,pH值越低HCO3-的转化率越小,碳酸根的利用效率越低。但NaOH为0.21 g ·L-1时,精卤中残留的CO32-浓度最高,由式(6)~式(8),随着pH值的升高,会促进碳酸钙的生成。结合图 2,当pH值在10~11范围以及电位在-0.50~-0.25 V范围内,处在碳酸钙的稳定区域,此区域内有助于钙离子与碳酸根的结合,NaOH浓度为0.25 g ·L-1时,pH值升高至10.76左右,结果表明pH值升高提高了碳酸根的反应活性,促进了碳酸根离子与钙离子的结合,相比NaOH为0.21 g ·L-1时式(8)的反应,碳酸根离子的消耗量要高于HCO3-转化为CO32-的转化量,故此时精卤中残留的CO32-浓度少于NaOH为0.21 g ·L-1时的残留量。从图 3和图 6也可以看到,在NaOH浓度为0.25 g ·L-1时,由于卤水中的钙镁离子总量更低,使得Na2CO3为1.25~1.40 g ·L-1范围内,成垢离子总量都处于最低的位置,卤水得到了深度净化。
2.2 氢氧化钠浓度对卤水净化效果的影响考察不同NaOH加入量对卤水中钙镁离子净化效果、精卤pH值和CO32-浓度的影响,结果分别如图 7、图 8和图 9所示。
|
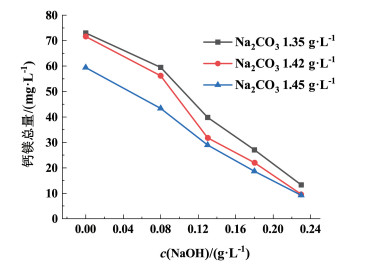
| 图 7 钙镁离子浓度总量随氢氧化钠添加量的变化图 Fig.7 The variation diagram of total concentration calcium and magnesium with sodium hydroxide added |
| |
|
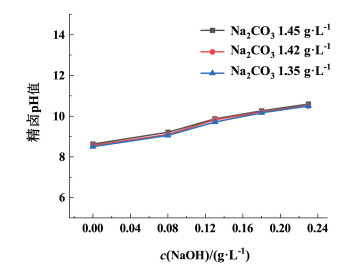
| 图 8 精卤pH值随氢氧化钠添加量的变化图 Fig.8 Variation of pH value with the amount of sodium hydroxide added |
| |
|
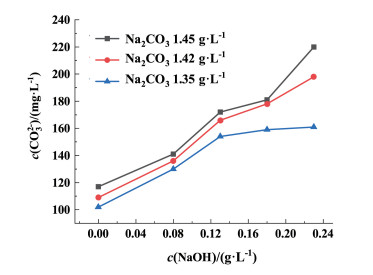
| 图 9 碳酸根离子浓度随氢氧化钠添加量的变化图 Fig.9 Variation of carbonate ion concentration with sodium hydroxide addition |
| |
由图 7可知,控制Na2CO3浓度不变,随着NaOH浓度的增加,钙镁离子浓度总量呈明显的下降趋势。当NaOH浓度不变时,随着Na2CO3浓度的增加,钙镁离子浓度总量也呈下降趋势。相比较而言,NaOH的浓度对卤水中钙镁离子的沉降作用影响更大,起着主导作用。由图 8也可以看出,在Na2CO3浓度不变时,随着NaOH浓度的增加pH值也呈明显的上升趋势,但在NaOH浓度相同时,Na2CO3在1.35~1.45 g ·L-1的范围内,随着Na2CO3浓度的增加,pH值并没有明显的变化,实验结果表明,NaOH用量对精卤pH值的控制起着主导作用。NaOH在卤水净化过程中发挥2方面的作用:1)促进镁离子沉降,是降低卤水中镁离子浓度的关键条件。2)随着氢氧化钠添加量增大,提高溶液pH值后,将部分HCO3-转化为CO32-,提高碳酸根的利用效率,促进碳酸根离子与钙离子结合形成碳酸钙沉淀。因此,选择合适浓度的NaOH,可以降低Na2CO3的使用量,减少精卤中残留的CO32-,有利于卤水净化和真空制盐阻垢防垢。
由图 9可知,在Na2CO3浓度为固定值时,随着NaOH浓度的增加,CO32-浓度仍然呈上升趋势。结合图 1可知NaOH促进溶液中的HCO3-转化为CO32-。结合图 7,随着NaOH浓度的增大,Na2CO3对钙镁离子的沉降影响逐渐降低,当NaOH为0.23 g ·L-1时,Na2CO3用量增大对钙镁离子的沉降具有一定效果,但精卤中残留CO32-浓度明显增大,不利于真空制盐阻垢防垢。
随着NaOH浓度的增大,Na2CO3对钙镁离子的沉降影响越来越小,在NaOH浓度为0.23 g ·L-1时,Na2CO3浓度在1.35~1.45 g ·L-1范围内都可以满足生产要求(图 7)。结合图 2和图 5,考虑对CO32-的控制,适当提升NaOH浓度为0.25 g ·L-1时,可以进一步提高对碳酸根的利用效率,减少Na2CO3用量,降低精卤中残留的CO32-浓度。综上,针对云南某公司的硫酸钠型卤水,两碱净化过程在进行钙镁离子脱除的同时,考虑对CO32-浓度的控制,研究获得最适宜的两碱用量NaOH为0.25 g ·L-1,Na2CO3为1.35 g ·L-1,该条件下精卤成分与原有工艺条件(NaOH为0.21 g ·L-1,Na2CO3为1.42 g ·L-1)下精卤成分对比分析如表 2所示,新工艺条件下钙镁离子浓度总量为12.80 mg ·L-1,残留CO32-浓度为151 mg ·L-1,成垢离子总量163.80 mg ·L-1,相比原有工艺中CO32-浓度223 mg ·L-1,成垢离子总量234.10 mg ·L-1,新两碱用量条件下,CO32-浓度下降了32%,成垢离子总量降低了30%。
| Component | c(NaCl)/
(g·L-1) |
c(Na2SO4)/
(g·L-1) |
c(Ca2+)/
(mg·L-1) |
c(Mg2+)/
(mg·L-1) |
c(CO32-)/
(mg·L-1) |
Q/
(mg·L-1) |
pH |
| Original process concentration | 302 | 24.79 | 8.35 | 2.75 | 223 | 234.10 | 10.50 |
| New process concentration | 302 | 24.35 | 10.94 | 1.86 | 151 | 163.80 | 10.77 |
采用XRD、SEM-EDS和FT-IR现代分析技术对两碱净化过程中的钙镁泥的物相组成和形貌特性进行分析,结果分别如图 10、图 11、表 3和图 12所示。
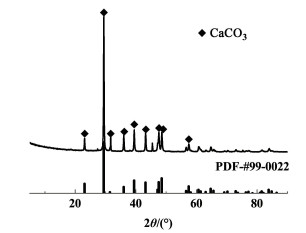
|
| 图 10 卤水净化沉淀物XRD图 Fig.10 X ray diffraction pattern of brine purification precipitate |
| |

|
| 图 11 卤水净化沉淀物SEM图 Fig.11 SEM pattern of brine purification precipitate |
| |
| Element | O | Ca | C | Na | Mg | S | Cl |
| Part 1./% | 61.4 | 30.3 | 3.4 | 1.9 | 1.5 | 1.0 | 0.5 |
| Part 2./% | 59.0 | 32.8 | 3.9 | 1.8 | 1.1 | 1.0 | 0.3 |
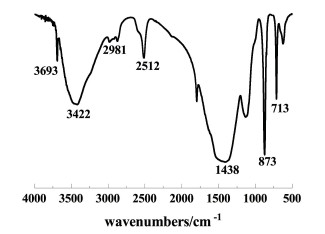
|
| 图 12 卤水净化沉淀物FT-IR图 Fig.12 FT-IR diagram of brine purification precipitate |
| |
XRD分析结果表明(图 10)所得沉淀物主要为碳酸钙。碳酸钙的晶型主要有3种,分别为方解石型、球霰石型和文石型。方解石型CaCO3的特征衍射峰[13]分别为:23(012),29(104),36(110),39(113)和43(202)。从图 10可以看出,沉淀物的衍射峰相对应的2θ依次为23.24°、29.28°、31.85°、36.20°、39.60°、43.09°、47.50°、48.40°和57.58°,2者基本一致,因此可以判断沉淀物主要成分为方解石型CaCO3,且结晶度良好,其余杂质含量较少。
图 11为场发射扫描电镜照片。从EDS分析可知沉淀物主要成分是碳酸钙,含有少量钠镁离子,与XRD分析基本一致。从图 11(a)中可以看出,碳酸钙为不规则的小立方体[14, 15],部分出现团聚现象,结构相对稳定,颗粒不规则;进一步观察,从图 11(b)发现碳酸钙的形貌为立方体,结构稳定、表面光滑,综合SEM-EDS和XRD图结果可得,卤水净化沉淀物主要为方解石型碳酸钙[13, 16]。
对沉淀物进行FT-IR分析。结果如图 12,在3 422 cm-1处的吸收峰由粒子中残留水中的—OH键伸缩振动产生,在1 438 cm-1处的吸收峰为O=C=O的不对称伸缩振动峰,该峰是碳酸钙中CO32-的特征峰[13]。在873和713 cm-1处的特征峰为方解石特征吸收峰[17-19]。
XRD、SEM-EDS、FT-IR分析结果表明,卤水净化反应进行所得钙镁泥沉淀物主要成分为方解石型碳酸钙。方解石在碳酸钙3种晶型中最为稳定。
4 结论1) 卤水净化过程添加NaOH有利于促进镁离子的沉降, 同时主导了精卤pH值的大小,增大pH值可以促进溶液中碳酸氢根转化为碳酸根离子,提高碳酸根的利用效率,促进钙离子与碳酸根结合,保证钙离子的净化效果。NaOH的调控对优化两碱配比,节约试剂成本、促进碳酸根离子的高效利用,降低精卤中残留碳酸根离子的浓度具有重要意义。
2) 针对云南某公司的硫酸钠型卤水,研究获得卤水净化的最适宜两碱用量NaOH为0.25 g ·L-1,Na2CO3为1.35 g ·L-1,净化后的卤水,钙离子浓度从480 mg ·L-1降至10.94 mg ·L-1,镁离子浓度从31 mg ·L-1降至1.86 mg ·L-1。相比原有工艺,在控制钙镁离子浓度总量合格的前提下,碳酸根离子浓度下降了32%,大幅降低了精卤中残留碳酸根离子的浓度,成垢离子总量降低了30%,减少真空制盐过程CaCO3结垢物的形成,真空制盐生产周期由原来的66 d延长至85 d,实现长周期运行。
3) 卤水净化过程中的钙镁泥沉淀物主要成分为方解石型碳酸钙。
| [1] |
苏家庆. 真空制盐[M]. 北京: 轻工业出版社, 1983.
|
| [2] |
罗兴国, 彭建波, 郑三强, 等. NaOH-烟道气法卤水净化中成垢离子的沉降行为[J]. 过程工程学报, 2021, 21(2): 174-182. LUO Xingguo, PENG Jianbo, ZHENG Sanqiang, et al. The settling behavior of scaling ions in brine purification process by NaOH-flue gas method[J]. The Chinese Journal of Process Engineering, 2021, 21(2): 174-182. (in Chinese) |
| [3] |
CHAUSSEMIER M, POURMOHTASHAM E, GELUS D, et al. State of art of natural inhibitors of calcium carbonate scaling. A review article[J]. Desalination, 2015, 356: 47-55. DOI:10.1016/j.desal.2014.10.014 |
| [4] |
ZHU T, WANG L, SUN W, et al. The role of corrosion inhibition in the mitigation of CaCO3 scaling on steel surface[J]. Corrosion Science, 2018, 140: 182-195. DOI:10.1016/j.corsci.2018.06.003 |
| [5] |
赵彦, 章立新, 高明, 等. 循环冷却水系统除碳酸钙污垢的研究进展[J]. 精细化工, 2020, 37(12): 2447-2456. ZHAO Yan, ZHANG Lixin, GAO Ming, et al. Research progress of removing calcium carbonate fouling in circulating cooling water system[J]. Fine Chemicals, 2020, 37(12): 2447-2456. (in Chinese) |
| [6] |
陈留平, 姚金华, 赵营峰, 等. 烧碱-烟道气法卤水净化之试验研究[J]. 现代盐化工, 2014(3): 6-9. DOI:10.3969/j.issn.1005-880X.2014.03.003 |
| [7] |
杨文俊, 杨云, 杨丽梅. "石灰-烟道气法"卤水净化之试验研究[J]. 中国井矿盐, 2007, 38(5): 29-31. YANG Wenjun, YANG Yun, YANG Limei. Experimental study on brine purification with "lime-flue gas" process[J]. China Well and Rock Salt, 2007, 38(5): 29-31. DOI:10.3969/j.issn.1001-0335.2007.05.010 (in Chinese) |
| [8] |
聂龙. 浅谈石灰烟道气法卤水净化工艺的应用[J]. 中国井矿盐, 2015, 46(6): 13-15. NIE Long. Brief discussion on the application of lime flue gas method for brine purification process[J]. China Well and Rock Salt, 2015, 46(6): 13-15. DOI:10.3969/j.issn.1001-0335.2015.06.005 (in Chinese) |
| [9] |
杨云. "烧碱-纯碱法"代替"石灰-纯碱法"卤水净化初探[J]. 中国井矿盐, 2006, 37(6): 21-23. YANG Yun. Brief discussion on the replacement of "lime-soda ash" process with "caustic soda-soda ash" process in brine purification[J]. China Well and Rock Salt, 2006, 37(6): 21-23. DOI:10.3969/j.issn.1001-0335.2006.06.007 (in Chinese) |
| [10] |
吕其臻, 赵海. 卤水净化工艺技术比较及钙镁泥处理探究[J]. 化工管理, 2020(13): 206-207. DOI:10.3969/j.issn.1008-4800.2020.13.120 |
| [11] |
罗兴国, 魏昶, 李兴彬, 等. 真空制盐中碳酸根离子的转化与阻垢防垢[J]. 精细化工, 2020, 37(12): 2571-2577. LUO Xingguo, WEI Chang, LI Xingbin, et al. Conversion of carbonate ions in vacuum salt production and scale inhibition and prevention[J]. Fine Chemicals, 2020, 37(12): 2571-2577. (in Chinese) |
| [12] |
汤鸿霄. 碳酸平衡和pH调整计算(1)[J]. 环境科学, 1979(6): 19-26. TANG Hongxiao. Calculation of carbonate balance and pH adjustment (1)[J]. Environmental Science, 1979(6): 19-26. (in Chinese) |
| [13] |
王倩倩. 碳酸钙矿物的晶型调控试验研究[D]. 内蒙古包头: 内蒙古科技大学, 2020 WANG Qianqian. Study on crystal regulation of calcium carbonate mineral[D]. Inner Mongolia Baotou: Inner Mongolia University of Science & Technology, 2020 (in Chinese) |
| [14] |
PLUMMER L N, BUSENBERG E. The solubilities of calcite, aragonite and vaterite in CO2-H2O solutions between 0 and 90 ℃, and an evaluation of the aqueous model for the system CaCO3-CO2-H2O[J]. Geochimica et Cosmochimica Acta, 1982, 46(6): 1011-1040. DOI:10.1016/0016-7037(82)90056-4 |
| [15] |
KETRANE R, SAIDANI B, GIL O, et al. Efficiency of five scale inhibitors on calcium carbonate precipitation from hard water: Effect of temperature and concentration[J]. Desalination, 2009, 249(3): 1397-1404. DOI:10.1016/j.desal.2009.06.013 |
| [16] |
WU Z, DAVIDSON J H, FRANCIS L F. Effect of water chemistry on calcium carbonate deposition on metal and polymer surfaces[J]. Journal of Colloid and Interface Science, 2010, 343(1): 176-187. DOI:10.1016/j.jcis.2009.11.031 |
| [17] |
YANG X, XU G, CHEN Y, et al. CaCO3 crystallization controlled by (2-hydroxypropyl-3-butoxy) propylsuccinyl chitosan[J]. Powder Technology, 2012, 215/216: 185-194. DOI:10.1016/j.powtec.2011.09.046 |
| [18] |
GOPI S P, VIJAYA P, SUBRAMANIAN V K. Morphological and crystallization process of CaCO3 in the presence of Aqua soft 330 (AS 330)[J]. Powder Technology, 2012, 225: 58-64. DOI:10.1016/j.powtec.2012.03.032 |
| [19] |
DINAMANI M, KAMATH P V, SESHADRI R. Electrochemical synthesis of calcium carbonate coatings on stainless steel substrates[J]. Materials Research Bulletin, 2002, 37(4): 661-669. DOI:10.1016/S0025-5408(02)00699-2 |
 2022, Vol. 39
2022, Vol. 39





