2. 天津化学化工协同创新中心,天津 300072;
3. 天津市功能精细化学品技术工程中心,天津 300350
2. Collaborative Innovation Center of Chemical Science and Engineering(Tianjin), Tianjin 300072, China;
3. Tianjin Engineering Research Center of Functional Fine Chemicals, Tianjin 300350, China
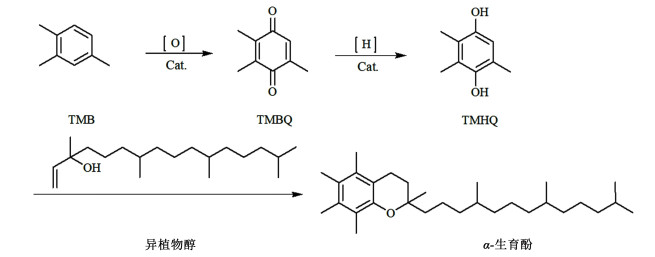
维生素E(VE)是一类脂溶性维生素,在食品、医疗、保健和化妆品等行业中被广泛用作抗氧化剂[1-4]。VE具有八种分子形式,其中α-生育酚是自然界中分布最广泛、含量最丰富、活性最高的维生素E形式[5]。由于提纯困难、工艺复杂,天然VE的产量低、价格较贵[6],难以满足市场需求。醌类化合物作为合成维生素E的中间体,其高效合成方法及工艺的研究开发引起广泛关注[7]。2, 3, 5-三甲基苯醌(TMBQ)就是合成α-生育酚的关键中间体[8, 9]。TMBQ经加氢还原先得到2, 3, 5-三甲基氢醌(TMHQ),TMHQ再与异植物醇缩合即可制得α-生育酚[10]。目前,国内主要是采用过渡金属催化剂,以氧气或空气为氧化剂,催化氧化2, 3, 6-三甲基苯酚(TMP)合成TMBQ[11-15],该工艺可以获得较高的TMBQ选择性和收率。
然而,目前我国TMP的工业生产能力难以满足TMBQ的合成需要,进口TMP原料价格高[16],导致VE生产成本高居不下。1, 2, 4-三甲基苯(TMB)又称偏三甲苯,是从重芳烃C9中通过连续精馏提取的基础化工原料[17],来源广、价格低。开发以TMB为原料合成TMBQ的工艺,具有很大的成本优势。TMB氧化合成TMBQ的方法可分为3种:磺化硝化水解法、电解法[18]和催化氧化法。磺化硝化水解法以及电解法均会产生大量废水,不符合现代化工绿色环保和高效节能的生产要求,且后处理成本高,已逐渐被淘汰[19, 20]。本论文主要针对TMB催化氧化合成TMBQ的方法进行综述。
TMB与TMBQ结构相似(如图 1所示),理论上在TMB苯环的3和6位引入羰基即可得到目标产物TMBQ,实际上由于苯环的共轭稳定作用,其C—H键并不容易被氧化。苯环上C—H键的活化及选择性氧化是学术界和工业界共同面对的重要挑战之一。例如,针对苯的催化羟基化,张鹏鹏等[21]对铁基催化剂、Zhang等[22]对铜基催化剂在热催化条件下的反应规律进行了研究;Zhao[23]、Kurikawa[24]和Shahid[25]等研究了苯的光催化羟基化反应,均提高了反应选择性。TMB中苯环的催化氧化与苯的催化羟基化反应有相似性。与苯相比,TMB含有3个侧链甲基,这又使得TMB的氧化具有特殊性,即:3个侧链甲基的供电作用使TMB中的苯环比苯更容易被氧化;而且侧链甲基含有活泼的α-H,在氧化条件下易被氧化,生成醛或羧酸类衍生物,导致反应选择性降低。因此,设计构建高效的催化剂以及筛选适宜的反应体系是TMB直接氧化合成TMBQ工艺的研究重点和难点。本论文针对近年来H2O2氧化TMB制备TMBQ所采用的典型非金属和金属基催化氧化体系的研究进展进行系统评述,对VE绿色合成工艺的研究开发具有一定指导意义。
|
| 图 1 TMB为原料合成VE路线图 Fig.1 Synthetic route of vitamin E using TMB as raw material |
| |
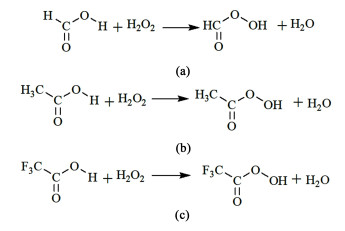
在无金属参与的氧化体系中,几乎均以羧酸作为溶剂。通常认为H2O2能将羧酸氧化为相应的过氧酸(如图 2所示)[26-29],过氧酸与TMB进一步反应并被还原为对应的羧酸,在该体系中羧酸不仅作为溶剂,同时也参与氧化反应过程。
羧酸的羰基具有吸电子作用,使其与H2O2生成的过氧酸具有较高亲电性,Yoshihiko等[30]研究发现,亲电活性氧物种可以使用氧转移试剂处理,进而表现出与环氧乙烯型氧物种(Oxene species)类似的氧化能力。以下将分别评述不同酸性体系中TMB的直接氧化反应。
Orita等[31]以甲酸为溶剂,H2O2为氧化剂,得到TMB转化率100%,但TMBQ产率仅为16%,反应选择性较低。Asakawa等[32]选用TMB-间氯苯甲酸-H2O2体系,在60~70 ℃下反应30 min得到TMBQ收率约为16%。2018年,张旭斌等[33]以HCOOH-H2O2为氧化体系,当TMB浓度为0.2 mol ·L-1,n(TMB) ∶n(H2O2)=1 ∶5,反应温度为27 ℃时,TMBQ的选择性为72%。研究发现,TMB的氧化过程中具有过度氧化和选择性氧化的双重活性,过度氧化对过氧甲酸的浓度和反应温度更加敏感,因而它比TMB的选择性氧化具有更高的反应级数和反应活化能,可以通过降低反应温度和氧化剂浓度来提高反应选择性。
陈红等[34]以H2O2-CH3COOH-H2SO4为氧化体系,n(H2O2) ∶n(H2SO4) ∶n(TMB)=6.5 ∶3.0 ∶1.0,70 ℃反应3 h,得到TMB转化率为47.3%,TMBQ产率为53.0%。张卫东等[35]以50% H2O2为氧化剂,85 ℃反应3 h,n(TMB) ∶n(CH3COOH) ∶n(H2O2)=1 ∶12 ∶11,反应结束加入Na2S2O4还原氧化产物TMBQ,可直接得到TMHQ收率为11.4%。
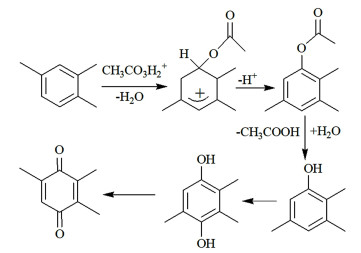
如图 3所示,在TMB氧化体系中,使用CH3COOH做溶剂时,过氧乙酸首先可能被质子化,然后经过与芳环的亲电取代反应生成2, 3, 5-三甲基苯乙酸酯,进而得到2, 3, 5-三甲基苯酚,然后在羟基对位以同样的方式引入第2个羟基,得到2, 3, 5-三甲基氢醌,最终进一步氧化获得目标产物TMBQ。
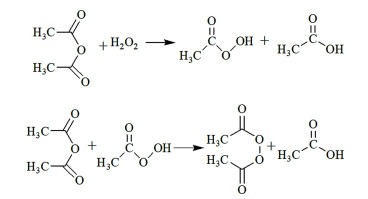
与乙酸相比,乙酸酐具有吸水性、水解速度快,乙酸酐与H2O2反应生成过氧乙酸的速率更快且浓度更高,生成的过氧乙酸可继续将乙酸酐氧化为过氧乙酸酐(如图 4所示)。Bohle等[37]曾使用乙酸酐-乙酸-H2O2-H2SO4体系氧化2-甲基萘生成2-甲基-1, 4-萘醌,该体系亦可用于TMB直接氧化合成TMBQ。
2 金属基催化氧化体系 2.1 Fe基催化剂铁元素在地球储量高、价格低,毒性较低[39, 40],研究发现Fe基配合物在羟基化、环氧化及仿生催化反应中均具有良好的催化活性[41-47]。因此,一系列Fe基催化剂被开发用于TMB的催化氧化。
刘春艳等[48]以复合铁卤化络合物为催化剂,石油醚为溶剂,向反应体系中滴加H2O2,得到TMBQ粗产品,经水蒸气蒸馏法进一步制得纯度较高的产品,TMBQ产率可达83.2%。2011年,Moller等[49]使用n(FeCl3 ·6H2O) ∶n(2, 6-二羧酸吡啶) ∶n(正丁基苄胺)=1.0 ∶1.0 ∶2.2的三元催化剂体系,实现TMB转化率为69%,反应选择性为38%。2016年,包吉等[50]以芬顿试剂作为反应的催化剂和氧化剂,在n(TMB) ∶n(H2O2) ∶n(FeSO4)=1 ∶1 ∶4,45 ℃下反应5 h得到TMBQ收率为34.95%。目前,将铁基催化剂用于TMB氧化的研究并不多,且多为均相反应,反应后会产生含铁废液,后续处理中也会增加成本,未来可以考虑将负载型的非均相铁基催化剂应用于该反应中。
2.2 Cu基催化剂目前,以TMP为原料合成TMBQ的工艺中,铜基催化剂显示了良好催化效果。因此,近年来将该类铜基催化剂应用于TMB的催化氧化也取得了一些研究进展。
2012年,赵峰等[51]以硅酸钠和CuCl2为原料,十六烷基三甲基溴化铵(CTAB)为模板剂,合成了不同Cu含量的具有六方介孔结构的分子筛催化剂。当n(Cu) ∶n(Si)=1 ∶50时,杂原子Cu修饰的MCM-41分子筛表现出良好的催化氧化活性[52-54]。使用0.05 g催化剂,n(H2O2) ∶n(TMB)=3.5 ∶1.0,乙酸为溶剂,加入适量的浓硫酸,反应6 h,TMB转化率为78.86%,TMBQ收率为66.13%。
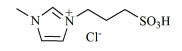
2017年,颉林等[55]以磺酸基功能化离子液体([PSMIm]Cl,结构如图 5)与CuCl2的复合物为催化剂,甲苯为溶剂,110 ℃反应5 h,TMBQ产率为78.7%,纯度为99.5%。对催化剂进行循环稳定性测试发现,经过6次回收套用,原料转化率和产品产率稳定,但经8次套用后转化率及产率下降较快,副产物增多,选择性降低。为更好回收利用催化剂、降低成本,在套用第9次时,补加离子液体和CuCl2各5%,催化剂活性和反应选择性可以恢复到原水平,实现催化剂的稳定循环利用。
就现有研究而言,铜基催化剂为非均相催化剂,易于反应后分离回收。同时,应用铜基催化剂实现的TMB转化率和TMBQ收率都相对较高,且催化剂价格低廉,在工业化过程中具有一定优势。
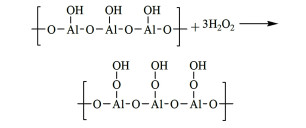
2.3 Al基催化剂γ-Al2O3比表面积大、表面构型独特、催化活性位点丰富,同时价格低廉、工业应用前景广泛,备受行业内关注。Michiel[56]、Jorge[57]和Renato[58]等曾先后以γ-Al2O3为催化剂,H2O2为氧化剂对烯烃环氧化反应进行研究。研究表明,这一类催化剂对TMB催化氧化制备TMBQ也具有优良的催化活性。反应过程中γ-Al2O3对应的活性氧物种结构如图 6所示。在γ-Al2O3的(110)表面上铝原子与氧原子交错排列,且Al2O3的3d原子轨道为空,容易吸附O2和H2O(g),形成表面羟基[59]。Al—OH与H2O2作用后形成过氧化物种,这独特的表面结构使其具有一定的吸电作用,可能更容易催化氧化电子云密度较高的C=C,从而减少TMB苯环侧链烷基的氧化,抑制副产物生成。
2008年,李岁党等[60]使用γ-Al2O3为催化剂,乙酸为溶剂,H2O2为氧化剂,通过均匀设计对各因素和实验结果进行回归方程计算,定量描述各因素对目标函数的影响,获得制备TMBQ的最适宜反应条件:4.1 g γ-Al2O3、30 mL乙酸、18 mL H2O2。3次重复实验证实TMB的平均转化率和TMBQ的平均产率分别为56.7%和59.7%。
本课题组张天永[36, 61, 62]团队开展了一系列以γ-Al2O3为载体或催化剂氧化TMB制备TMBQ的研究。2013年[61],将首次具有较大π电子共轭体系的铜酞菁与γ-Al2O3在pH=9下搅拌30 min,经水热反应得到复合催化剂。在m(催化剂) ∶m(TMB)= 0.083 ∶1.000,回流温度下反应2 h,TMB转化率和TMBQ产率分别为72.8%和65.3%。2016年[62],采用价格低廉的工业填料品γ-Al2O3为催化剂,在m(30%H2O2) ∶m(γ-Al2O3) ∶m(TMB)=2.500 ∶0.005 ∶1.000,80 ℃下反应2 h,得到TMB转化率为21.3%,TMBQ收率为16.0%,选择性为75.2%。后续使用试剂级γ-Al2O3催化反应,选择性略有提高,达到84%。结合X射线衍射光谱(XRD)和扫描电子显微镜(SEM)分析,发现试剂级γ-Al2O3结晶度更高,晶体生长更完整,推测结晶程度和外观形貌可能是影响本体系中γ-Al2O3催化效果的关键因素,不过低廉的价格决定了工业填料γ-Al2O3具有更好的成本优势。因此,在随后研究中[36],使用偶联剂γ-(2, 3-环氧丙基) 丙基三甲氧基硅烷(KH560)对工业填料γ-Al2O3进行改性,首先将KH560在乙醇中室温水解1 h,随后在50 ℃下加入γ-Al2O3浸渍吸附4 h。偶联剂中的硅氧键水解生成的硅醇键与γ-Al2O3表面羟基脱水缩合成膜,覆盖在催化剂表面。这样的修饰不仅保持了γ-Al2O3的形貌和晶型,而且提高了催化剂的耐腐蚀性和溶剂分散性,调控了催化位点活性,使催化过程反应温和、副反应减少。TMB转化率和TMBQ选择性分别为14.3%和72.4%。
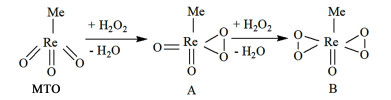
2.4 Re基催化剂甲基三氧化铼(MTO)在H2O2为氧化剂的反应中,对芳环类化合物具有优良催化作用,如催化氧化酚类、芳醛类生成相应醌类化合物[63, 64]。该催化剂与氧化剂的作用方式如图 7所示,MTO在H2O2中首先原位反应生成单过氧配合物A,该配合物在过量的H2O2存在下进一步氧化生成双过氧化配合物B,过氧化物A和B可以作为氧转移活性物种,在氧化反应中表现出较好催化活性[65-69]。
Jacob等[71]最初在CH3COOH-H2O2的体系中,以MTO为催化剂,催化TMB一步氧化制备TMBQ,转化率75%,产率为67%。
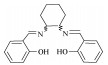
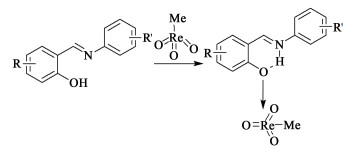
2011年,Carril等[72]通过筛选溶剂、使用不同配体与MTO配位,改善了TMBQ的收率。当反应在无有机溶剂存在的H2O2溶液中进行时,TMBQ的选择性可达100%,转化率为13%。而采用乙腈、正己烷、DMF等为溶剂时,无法生成TMBQ。研究发现,反应在溶剂配位能力较强的硝基甲烷中进行时,转化率可提高至25%,TMBQ收率达到15%。该过程虽然提高了TMB的转化率,但不可避免地降低选择性,又带来分离纯化问题。当使用Salen型配体(表 1,行2)与MTO结合[73],显示出对TMB具有较高的选择性氧化能力,TMBQ的选择性高达85%。同时发现含吸电子取代基(N-水杨醛基)苯胺衍生物的Schiff碱(表 1,行3)作为配体时,反应选择性提高至84%。原因在于Schiff碱通过氧原子与MTO配位(如图 8所示),降低了金属中心的Lewis酸度,提高了对苯醌的化学选择性。而配体中吸电子基团的存在不仅影响配位强度,还可影响分子内氢键形成。
2012年,Carril等[70]发现在MTO-H2O2体系中使用两亲试剂可以使反应在保持高选择性的同时提高TMB转化率。如使用中性两亲树脂Brij30(结构如图 9)作为添加剂,可以在维持选择性为67%的同时将转化率提高到27%。而在既添加Brij30,又以硝基甲烷为溶剂时,反应选择性可提高至80%,转化率为28%。此外,以上研究还证实,在MTO为催化剂的体系中,用硝基甲烷、氯仿或碳酸二甲酯代替常用溶剂(乙酸和乙酸酐),可以显著降低反应中H2O2的用量和浓度。
向MTO中添加中性两亲树脂Brij30,提高了化合物难以继续被氧化成对苯醌类衍生物反应的选择性,并且Carril等[72]曾使用硝基甲烷作为溶剂时,水杨醛肟(表 1,行4)及其衍生物(表 1,行5)为配体与MTO结合,反应选择性约70%,TMBQ产率约30%。如果在反应体系中同时加入水杨醛肟与Brij30,可能使催化剂具有更高的稳定性和更好的选择性。他们以水杨醛肟为配体,应用于Brij30-MTO-H2O2-硝基甲烷体系中,选择性提升至72%,同时发现硝基甲烷的浓度对反应有影响。浓度过低时,Brij30/水杨醛肟与MTO结合强度降低,浓度过高则失去硝基甲烷在酚类中间体形成过程中的诱导作用[70]。
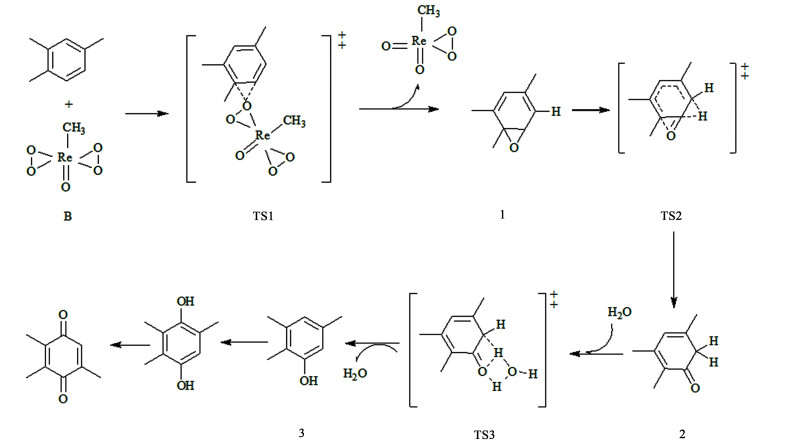
Carril等根据Kudrik和Sorokin[75]提出的苯氧化机理进行调整,得到以MTO为催化剂氧化TMB反应机理。如图 10所示,当加入过量H2O2时,MTO形成催化活性物种B。B具有亲电性,会被富含电子的亲核芳烃(TMB)进攻,在TMB苯环的1、6位发生环氧化反应形成TS1,随后形成环氧化物中间体1,经过TS2过程将H转移到相邻的碳原子上,同时生成羰基得到中间体2(2, 3, 5-三甲基-2, 4-环己二烯酮),在水参与下经过TS3发生H转移将酮转化为3(2, 3, 5-三甲基苯酚),经过再一次的环氧化和类似的氢转移得到2, 3, 5-三甲基氢醌,进一步氧化生成目标产物TMBQ。
在铼基催化体系中,单独使用时MTO为均相催化剂,铼作为重金属元素对水体有一定的危害,在工业中应用会加大后处理成本。而加入树脂等添加剂时,则为非均相体系,在后续的处理中易于分离,相对更易于稀有元素铼的回收。
2.5 其它金属基催化剂除以上常用的金属基催化剂外,钨基和钒基催化剂也被研究。钒基催化剂能与H2O2作用形成亲电活性氧物种,在烯烃环氧化[76]和烷烃羟基化[77]中显现出良好催化活性。研究者将其应用于含取代基的芳烃羟基化时,发现有醌类化合物生成[78]。Petrov等[79]以过氧乙酸为氧化剂,TMB为原料,钒钼酸(H2Mo4V8O31等)为辅助催化剂,得到TMB转化率为15%,TMBQ选择性31.3%。2015年,Zalomaeva等[80]使用被钒取代的磷钨酸盐(Bu4N)4[γ-PW10O38V2(μ-O)(μ-OH)为催化剂,乙腈和特丁醇为溶剂,35% H2O2为氧化剂,HClO4提供酸性环境,TMB转化率为46%,TMBQ收率为18%。此类催化剂作用下,TMBQ收率较低,原因在于催化剂体积大,较大的空间位阻阻碍了氧原子在TMB苯环3号位上的取代,使得形成的单取代酚类化合物难以继续被氧化成对苯醌类衍生物。
3 结语目前TMB经一步氧化反应合成TMBQ中,羧酸作为溶剂使用较多,其与H2O2反应生成具有亲电活性的过氧羧酸,能与TMB发生亲电取代反应,从而促进反应。在金属基催化体系中,Fe和Cu在地球上储量丰富、来源广泛、价格低廉,在TMB氧化反应中表现出良好的催化性能,未来应考虑设计构建高活性的Fe、Cu基催化体系。γ-Al2O3基负载型催化剂,易于分离回收且价格低廉。本课题组也研究了系列γ-Al2O3为载体的催化剂,未来将进一步提升其催化活性并推进其工业应用。铼系化合物具有较高的催化活性,特别是使用硝基甲烷代替常用酸性溶剂时效果较好,但是该体系受溶剂影响较大,且价格昂贵、难循环使用、成本高,不利于在工业中推广应用。
TMB氧化制备TMBQ是一个氧化程度较高的反应,在不同催化体系中,以H2O2为氧化剂时,H2O2通常过量使用。原因在于当H2O2用量较少时,不足以将苯环的C—H氧化为C=O,且H2O2随温度升高易分解,会降低H2O2的有效利用率;而加入过量H2O2能在一定程度上保证较好的氧化效果,不会由于H2O2分解显著影响氧化反应。在以羧酸为溶剂的非金属催化体系下,H2O2与羧酸反应形成的过氧羧酸可有效促进TMB氧化为TMBQ,为获得有效的过氧羧酸,H2O2在该体系中大多需要过量使用;在金属基催化氧化体系中,除包吉等在n(TMB) ∶n(H2O2)为1 ∶1条件下进行研究,其余反应体系中双氧水也均过量使用。总体而言,H2O2的用量依据反应体系有所不同,均以达到TMBQ较高的收率为目标。对于过量双氧水的有效利用也是工艺改进需要考虑的问题。
未来在催化TMB直接氧化合成TMBQ的反应体系研究中,需关注如下方面:1)金属基均相催化反应会产生含有金属离子的废水(如Fe2+和Cu2+),增加后续三废处理成本,且金属离子残留也会影响产品品质。因此,应进一步关注铁和铜基负载型催化剂的设计开发;2)多数体系以羧酸为溶剂,表明TMB氧化合成TMBQ需要具有亲电活性的氧转移物种。因此,深入研究羧酸在反应体系中的作用机理,对理性设计催化剂具有指导意义;3)在反应过程中,TMB侧链3个甲基被氧化,会导致TMBQ的选择性和收率降低,价格昂贵的铼基催化剂显示了良好的选择性,可以考虑制备铼系非均相催化剂,在降低催化剂成本的同时维持高选择性;4)在提升催化剂活性的同时,还需进一步考虑催化剂循环利用效率,以便为后续工业化应用打下坚实基础。
| [1] |
TIETZE L F, SOMMER K M, ZINNGREBE J, et al. Palladium-catalyzed enantioselective domino reaction for the efficient synthesis of vitamin E[J]. Angewandte Chemie International Edition, 2005, 44(2): 257-259. DOI:10.1002/anie.200461629 |
| [2] |
NETSCHER T, MALAISÉ G, BONRATH W, et al. A new route to vitamin E key-intermediates by olefin cross-metathesis[J]. Catalysis Today, 2007, 121(1/2): 71-75. |
| [3] |
HERNÁNDEZ-TORRES G, URBANO A, CARREÑO M C, et al. Stereocontrolled generation of the (2R) chroman core of vitamin E: Total synthesis of (2R, 4'RS, 8'RS)-α-tocopherol[J]. Organic Letters, 2009, 11(21): 4930-4933. DOI:10.1021/ol9020783 |
| [4] |
王义永, 章城亮, 许新德. 天然维生素E提纯技术进展[J]. 中国食品添加剂, 2014(2): 203-207. WANG Yiyong, ZHANG Chengliang, XU Xinde. Research progress of purification technology of natural vitamin E[J]. China Food Additives, 2014(2): 203-207. DOI:10.3969/j.issn.1006-2513.2014.02.030 (in Chinese) |
| [5] |
周健, 汤洪波. GC-MS内标法测定大豆渣油中维生素E的含量[J]. 应用化工, 2010, 39(12): 1934-1935. ZHOU Jian, TANG Hongbo. Determination of vitamin E in soybean residue with GC-MS by using internal standard method[J]. Applied Chemical Industry, 2010, 39(12): 1934-1935. DOI:10.3969/j.issn.1671-3206.2010.12.040 (in Chinese) |
| [6] |
吴缨, 陈红. 三甲氢醌合成中各组分的气相色谱分析[J]. 化学世界, 2002, 43(9): 466-468. WU Ying, CHEN Hong. A GC analysis of different components in synthesizing 2, 3, 5-trimethyl hydroquinone[J]. Huaxue Shijie (Chemical World), 2002, 43(9): 466-468. DOI:10.3969/j.issn.0367-6358.2002.09.006 (in Chinese) |
| [7] |
YAMAGUCHI S, SHINODA H, INOUE M, et al. ChemInform abstract: Mechanistic studies on the oxidation of naphthalenes and methylbenzenes to quinones with H2O2 in the presence of Pd(Ⅱ) catalysts[J]. ChemInform, 1986, 34(11): 4467-4473. |
| [8] |
SUN H J, HARMS K, SUNDERMEYER J. Aerobic oxidation of 2, 3, 6-trimethylphenol to trimethyl-1, 4-benzoquinone with copper(Ⅱ) chloride as catalyst in ionic liquid and structure of the active species[J]. Journal of the American Chemical Society, 2004, 126(31): 9550-9551. DOI:10.1021/ja0391964 |
| [9] |
SUN H, LI X, SUNDERMEYER J. Aerobic oxidation of phenol to quinone with copper chloride as catalyst in ionic liquid[J]. Journal of Molecular Catalysis A: Chemical, 2005, 240(1/2): 119-122. |
| [10] |
柳东明, 李荀, 臧恒昌. 维生素E母核合成研究进展[J]. 大学化学, 2015, 30(3): 26-33. LIU Dongming, LI Xun, ZANG Hengchang. Research advance in the synthesis of vitamin E nucleus[J]. University Chemistry, 2015, 30(3): 26-33. (in Chinese) |
| [11] |
ZHOU J, HUA Z, CUI X, et al. Hierarchical mesoporous TS-1 zeolite: A highly active and extraordinarily stable catalyst for the selective oxidation of 2, 3, 6-trimethylphenol[J]. Chemical Communications, 2010, 46(27): 4994-4996. DOI:10.1039/c0cc00499e |
| [12] |
SHIMIZU M, WATANABE Y, ORITA H, et al. Synthesis of alkyl substitutedp-benzoquinones from the corresponding phenols using molecular oxygen catalyzed by copper(Ⅱ) chloride-amine hydrochloride systems[J]. Bulletin of the Chemical Society of Japan, 1992, 65(6): 1522-1526. DOI:10.1246/bcsj.65.1522 |
| [13] |
WANG C, GUAN W, XIE P, et al. Effects of ionic liquids on the oxidation of 2, 3, 6-trimethylphenol to trimethyl-1, 4-benzoquinone under atmospheric oxygen[J]. Catalysis Communications, 2009, 10(5): 725-727. DOI:10.1016/j.catcom.2008.11.027 |
| [14] |
ZHANG W, HU L, ZHANG H, et al. Stable non-covalent Co(salphen)-based polymeric catalyst for highly efficient and selective oxidation of 2, 3, 6-trimethylphenol[J]. Polymers, 2020, 12(5): 1076-1086. DOI:10.3390/polym12051076 |
| [15] |
CHANG S, AN H, CHEN Y, et al. Multiunit catalysts with synergistic reactivity: Three-dimensional polyoxometalate-based coordination polymers for highly efficient synthesis of functionalized p-benzoquinones[J]. ACS Applied Materials & Interfaces, 2019, 11(41): 37908-37919. |
| [16] |
张天永, 王梦颖, 李彬, 等. 三甲基苯酚催化合成三甲基苯醌研究进展[J]. 化工进展, 2016, 35(2): 513-518. ZHANG Tianyong, WANG Mengying, LI Bin, et al. Research progress on the catalytic oxidation of 2, 3, 6-trimethylphenol to 2, 3, 5-trimethybenzoquinone[J]. Chemical Industry and Engineering Progress, 2016, 35(2): 513-518. (in Chinese) |
| [17] |
宋彬彬, 刘海涛. 重整C9芳烃制取偏三甲苯、均三甲苯的技术与产品市场[J]. 化学工业, 2016, 34(3): 36-39. SONG Binbin, LIU Haitao. Market and technological advance on comprehensive utilization of C9 heavy aromatics[J]. Chemical Industry, 2016, 34(3): 36-39. DOI:10.3969/j.issn.1673-9647.2016.03.007 (in Chinese) |
| [18] |
李建生, 张淑云. 2, 3, 5-三甲基苯醌电解合成新工艺[J]. 化学工程师, 1994, 8(2): 22-23. LI Jiansheng, ZHANG Shuyun. New process for the electrolytic synthesis of 2, 3, 5-trimethylbenzoquinone[J]. Chemical Engineer, 1994, 8(2): 22-23. (in Chinese) |
| [19] |
白元盛, 李子成, 王立新, 等. 2, 3, 5-三甲基氢醌的合成研究进展[J]. 合成化学, 2014, 22(3): 423-428. BAI Yuansheng, LI Zicheng, WANG Lixin, et al. Research progress on the synthesis of 2, 3, 5-trimethylhydroquinone[J]. Chinese Journal of Synthetic Chemistry, 2014, 22(3): 423-428. DOI:10.3969/j.issn.1005-1511.2014.03.035 (in Chinese) |
| [20] |
杨俊娟, 李西营, 刘勇, 等. 2, 3, 5-三甲基氢醌制备工艺研究进展[J]. 化学研究, 2011, 22(4): 94-99. YANG Junjuan, LI Xiying, LIU Yong, et al. Research progress for manufacturing 2, 3, 5-trimethylhydroquinone[J]. Chemical Research, 2011, 22(4): 94-99. DOI:10.3969/j.issn.1008-1011.2011.04.021 (in Chinese) |
| [21] |
张鹏鹏, 孟思寒, 赵宇, 等. 铁盐胶束均相催化苯羟基化制备苯酚的反应[J]. 山东化工, 2020, 49(3): 3-6. ZHANG Pengpeng, MENG Sihan, ZHAO Yu, et al. Homogenous hydroxylation of benzene to phenol under iron acetate micelles catalysis[J]. Shandong Chemical Industry, 2020, 49(3): 3-6. DOI:10.3969/j.issn.1008-021X.2020.03.002 (in Chinese) |
| [22] |
ZHANG T, NIE X, YU W, et al. Single atomic Cu-N2 catalytic sites for highly active and selective hydroxylation of benzene to phenol[J]. iScience, 2019, 22: 97-108. DOI:10.1016/j.isci.2019.11.010 |
| [23] |
ZHAO Q, ZHANG L, ZHAO M, et al. Vanadium oxyacetylacetonate grated on metal organic framework as catalyst for the direct hydroxylation of benzene to phenol[J]. ChemistrySelect, 2020, 5(22): 6818-6822. DOI:10.1002/slct.202000842 |
| [24] |
KURIKAWA Y, TOGO M, MURATA M, et al. Mechanistic insights into visible light-induced direct hydroxylation of benzene to phenol with air and water over Pt-modified WO3 photocatalyst[J]. Catalysts, 2020, 10(5): 557-568. DOI:10.3390/catal10050557 |
| [25] |
SHAHID A, LOPEZ-OROZCO S, MARTHALA V R, et al. Direct oxidation of benzene to phenol over hierarchical ZSM-5 zeolites prepared by sequential post synthesis modification[J]. Microporous and Mesoporous Materials, 2017, 237: 151-159. DOI:10.1016/j.micromeso.2016.09.012 |
| [26] |
ZHAO X, ZHANG T, ZHOU Y, et al. Preparation of peracetic acid from hydrogen peroxide: Part Ⅰ: Kinetics for peracetic acid synthesis and hydrolysis[J]. Journal of Molecular Catalysis A: Chemical, 2007, 271(1/2): 246-252. |
| [27] |
ZHAO X, CHENG K, HAO J, et al. Preparation of peracetic acid from hydrogen peroxide, part Ⅱ: Kinetics for spontaneous decomposition of peracetic acid in the liquid phase[J]. Journal of Molecular Catalysis A: Chemical, 2008, 284(1/2): 58-68. |
| [28] |
SUN X, ZHAO X, DU W, et al. Kinetics of formic acid-autocatalyzed preparation of performic acid in aqueous phase[J]. Chinese Journal of Chemical Engineering, 2011, 19(6): 964-971. DOI:10.1016/S1004-9541(11)60078-5 |
| [29] |
DE FILIPPIS P, SCARSELLA M, VERDONE N. Peroxyformic acid formation: A kinetic study[J]. Industrial & Engineering Chemistry Research, 2009, 48(3): 1372-1375. |
| [30] |
MORO-OKA Y, AKITA M. Bio-inorganic approach to hydrocarbon oxidation[J]. Catalysis Today, 1998, 41(4): 327-338. DOI:10.1016/S0920-5861(98)00023-6 |
| [31] |
ORITA H, SHIMIZU M, HAYAKAWA T, et al. Oxidation of methoxy-and/or methyl-substituted benzenes and naphthalenes to quinones and phenols by H2O2 in HCOOH[J]. Bulletin of the Chemical Society of Japan, 1989, 62(5): 1652-1657. DOI:10.1246/bcsj.62.1652 |
| [32] |
ASAKAWA Y, MATSUDA R, TORI M, et al. Efficient preparation of some biologically active substances from natural and nonnatural aromatic compounds by m-chloroperbenzoic acid oxidation[J]. The Journal of Organic Chemistry, 1988, 53(23): 5453-5457. DOI:10.1021/jo00258a010 |
| [33] |
ZHANG X, HAO Z, YANG C, et al. Preparation of vitamin E intermediate from an inexpensive substrate by selective oxidation of pseudocumene in HCOOH-H2O2 system[J]. Transactions of Tianjin University, 2018, 24(3): 263-271. DOI:10.1007/s12209-017-0113-7 |
| [34] |
陈红, 吴缨, 徐国梅. 过氧化氢直接氧化法合成2, 3, 5-三甲基氢醌[J]. 精细石油化工进展, 2002, 3(4): 25-27. CHEN Hong, WU Ying, XU Guomei. Synthesis of 2, 3, 5-trimethylhydroquinone by direct oxidation using hydrogen peroxide[J]. Advances in Fine Fetrochemicals, 2002, 3(4): 25-27. DOI:10.3969/j.issn.1009-8348.2002.04.008 (in Chinese) |
| [35] |
张卫东, 马新起, 安利敏. 2, 3, 5-三甲基氢醌的绿色合成工艺研究[J]. 化学研究, 2012, 23(2): 31-34. ZHANG Weidong, MA Xinqi, AN Limin. Process for green synthesis of 2, 3, 5-trimethylhydroquinone[J]. Chemical Research, 2012, 23(2): 31-34. DOI:10.3969/j.issn.1008-1011.2012.02.008 (in Chinese) |
| [36] |
张天永, 刘晓思, 李彬, 等. 偶联剂改性对γ-Al2O3催化氧化偏三甲苯性能的影响[J]. 化学通报, 2017, 80(6): 573-578. ZHANG Tianyong, LIU Xiaosi, LI Bin, et al. Effect of coupling agent modification on the catalytic performance of γ-Al2O3 for pseudocumene oxidation[J]. Chemistry, 2017, 80(6): 573-578. (in Chinese) |
| [37] |
BOHLE A, SCHUBERT A, SUN Y, et al. A new metal-free access to vitamin K3[J]. Advanced Synthesis & Catalysis, 2006, 348(9): 1011-1015. |
| [38] |
杨超群. 偏三甲苯一步氧化制备2, 3, 5-三甲基苯醌的研究[D]. 天津: 天津大学, 2017 YANG Chaoqun. Preparation of 2, 3, 5-trimethylquinone from one-step oxidation of 1, 2, 4-trimethylbenzene[D]. Tianjin: Tianjin University, 2017 (in Chinese) |
| [39] |
GÓMEZ L, GARCIA-BOSCH I, COMPANY A, et al. Stereospecific C-H oxidation with H2O2 catalyzed by a chemically robust site-isolated iron catalyst[J]. Angewandte Chemie (International Ed in English), 2009, 48(31): 5720-5723. DOI:10.1002/anie.200901865 |
| [40] |
CHEN M, WHITE M C. Combined effects on selectivity in Fe-catalyzed methylene oxidation[J]. Science, 2010, 327(5965): 566-571. DOI:10.1126/science.1183602 |
| [41] |
HENSEN E J M, ZHU Q, JANSSEN R A J, et al. Selective oxidation of benzene to phenol with nitrous oxide over MFI zeolites: 1. On the role of iron and aluminum[J]. Journal of Catalysis, 2005, 233(1): 123-135. DOI:10.1016/j.jcat.2005.04.009 |
| [42] |
CHOI J S, KIM T H, CHOO K Y, et al. Direct synthesis of phenol from benzene on iron-impregnated activated carbon catalysts[J]. Applied Catalysis A: General, 2005, 290(1/2): 1-8. |
| [43] |
ANILKUMAR G, BITTERLICH B, GELALCHA F G, et al. An efficient biomimetic Fe-catalyzed epoxidation of olefins using hydrogen peroxide[J]. Chemical Communications (Cambridge, England), 2007(3): 289-291. DOI:10.1039/B612048B |
| [44] |
BITTERLICH B, ANILKUMAR G, GELALCHA F G, et al. Development of a general and efficient iron-catalyzed epoxidation with hydrogen peroxide as oxidant[J]. Chemistry-an Asian Journal, 2007, 2(4): 521-529. DOI:10.1002/asia.200600407 |
| [45] |
SCHRÖDER K, TONG X F, BITTERLICH B, et al. Novel biomimetic iron-catalysts for environmentally benign epoxidations of olefins[J]. Tetrahedron Letters, 2007, 48(36): 6339-6342. DOI:10.1016/j.tetlet.2007.07.006 |
| [46] |
GELALCHA F, BITTERLICH B, ANILKUMAR G, et al. Iron-catalyzed asymmetric epoxidation of aromatic alkenes using hydrogen peroxide[J]. Angewandte Chemie International Edition, 2007, 46(38): 7293-7296. DOI:10.1002/anie.200701235 |
| [47] |
BITTERLICH B, SCHRÖDER K, TSE M K, et al. An improved iron-catalyzed epoxidation of aromatic and aliphatic olefins with hydrogen peroxide as oxidant[J]. European Journal of Organic Chemistry, 2008, 2008(29): 4867-4870. DOI:10.1002/ejoc.200800712 |
| [48] |
刘春艳, 刘琳, 钱建华. 2, 3, 5-三甲基氢醌合成新方法[J]. 辽宁化工, 2006, 35(5): 249-250, 290. LIU Chunyan, LIU Lin, QIAN Jianhua. A novel synthesis method of 2, 3, 5-trimethylhydroquinone[J]. Liaoning Chemical Industry, 2006, 35(5): 249-250, 290. DOI:10.3969/j.issn.1004-0935.2006.05.001 (in Chinese) |
| [49] |
MÖLLER K, WIENHÖFER G, WESTERHAUS F, et al. Oxidation of 1, 2, 4-trimethylbenzene (TMB), 2, 3, 6-trimethylphenol (TMP) and 2-methylnaphthalene to 2, 3, 5-trimethylbenzoquinone (TMBQ) and menadione (vitamin K3)[J]. Catalysis Today, 2011, 173(1): 68-75. DOI:10.1016/j.cattod.2011.02.069 |
| [50] |
包吉, 刘高赋, 高荣, 等. 2, 3, 5-三甲基苯醌的合成研究[J]. 化工管理, 2016(4): 187-187. BAO Ji, LIU Gaofu, GAO Rong, et al. Study on the synthesis of 2, 3, 5-trimethylbenzoquinone[J]. Chemical Enterprise Management, 2016(4): 187-187. DOI:10.3969/j.issn.1008-4800.2016.04.121 (in Chinese) |
| [51] |
赵峰, 杨蓓玉, 顾剑江, 等. Cu-MCM-41催化剂对偏三甲苯的催化氧化性能[J]. 工业催化, 2012, 20(6): 62-66. ZHAO Feng, YANG Beiyu, GU Jianjiang, et al. Performance of Cu-MCM-41 catalyst for catalytic oxidation of 1, 2, 4-trimethylbenzene[J]. Industrial Catalysis, 2012, 20(6): 62-66. DOI:10.3969/j.issn.1008-1143.2012.06.014 (in Chinese) |
| [52] |
NOREÑA-FRANCO L, HERNANDEZ-PEREZ I, AGUILAR-PLIEGO J, et al. Selective hydroxylation of phenol employing Cu-MCM-41 catalysts[J]. Catalysis Today, 2002, 75(1/2/3/4): 189-195. |
| [53] |
蒋斯扬, 孔岩, 吴丞, 等. 高Cu含量MCM-41在苯直接羟基化反应中的催化性能[J]. 催化学报, 2006, 27(5): 421-426. JIANG Siyang, KONG Yan, WU Cheng, et al. Catalytic performance of Cu-MCM-41 with high copper content for the direct hydroxylation of benzene to phenol[J]. Chinese Journal of Catalysis, 2006, 27(5): 421-426. DOI:10.3321/j.issn:0253-9837.2006.05.012 (in Chinese) |
| [54] |
孙建敏, 孟祥举, 王润伟, 等. Cu修饰的MCM-41的合成、表征及对芳烃羟化反应催化作用的研究[J]. 高等学校化学学报, 2000, 21(9): 1451-1454. SUN Jianmin, MENG Xiangju, WANG Runwei, et al. Preparation, characterization of Cu-MCM-41 and its catalysis for hydroxylation of aromatic compounds[J]. Chemical Research in Chinese Universities, 2000, 21(9): 1451-1454. DOI:10.3321/j.issn:0251-0790.2000.09.020 (in Chinese) |
| [55] |
颉林, 林富荣, 李薇, 等. 功能化离子液体催化氧化偏三甲苯合成2, 3, 5-三甲基苯醌[J]. 中国建材科技, 2017, 26(5): 33-35. XIE Lin, LIN Furong, LI Wei, et al. Functionalized ionic liquid catalytic oxidation of pseudocumene to 2, 3, 5-trimethyl-benzoquinone[J]. China Building Materials Science & Technology, 2017, 26(5): 33-35. DOI:10.3969/j.issn.1003-8965.2017.05.013 (in Chinese) |
| [56] |
VAN VLIET M C A, MANDELLI D, ARENDS I W C E, et al. Alumina: A cheap, active and selective catalyst for epoxidations with (aqueous) hydrogen peroxide[J]. Green Chemistry, 2001, 3(5): 243-246. DOI:10.1039/b103952k |
| [57] |
SEPULVEDA J, TEIXEIRA S, SCHUCHARDT U. Alumina-catalyzed epoxidation of unsaturated fatty esters with hydrogen peroxide[J]. Applied Catalysis A: General, 2007, 318: 213-217. DOI:10.1016/j.apcata.2006.11.004 |
| [58] |
CESQUINI R, DE SE SILVA J, WOITISKI C, et al. Alumina-catalyzed epoxidation with hydrogen peroxide: Recycling experiments and activity of Sol-gel alumina[J]. Advanced Synthesis & Catalysis, 2002, 344(8): 911-914. |
| [59] |
沈彬, 罗敏, 赵丽娜, 等. SO2和NO2在γ-Al2O3(110)表面吸附的第一性原理计算[J]. 原子与分子物理学报, 2021, 38(1): 15-21. SHEN Bin, LUO Min, ZHAO Lina, et al. First-principles calculation of SO2 and NO2 adsorbed on γ-Al2O3(110) surface[J]. Journal of Atomic and Molecular Physics, 2021, 38(1): 15-21. (in Chinese) |
| [60] |
李岁党, 傅吉全. 催化氧化偏三甲苯合成三甲基苯醌[J]. 石化技术与应用, 2008, 26(3): 234-236. LI Suidang, FU Jiquan. Novel synthesis technology of trimethylbenzoquinone by catalytic oxidation of pseudocumene[J]. Petrochemical Technology & Application, 2008, 26(3): 234-236. DOI:10.3969/j.issn.1009-0045.2008.03.008 (in Chinese) |
| [61] |
张天永, 段永洁, 李彬, 等. 偏三甲苯催化氧化法制备2, 3, 5-三甲基苯醌的研究[J]. 化学试剂, 2013, 35(1): 3-6. ZHANG Tianyong, DUAN Yongjie, LI Bin, et al. Synthesis of 2, 3, 5-trimethylbenzoquinone by catalytic oxidation of pseudocumene[J]. Chemical Reagents, 2013, 35(1): 3-6. (in Chinese) |
| [62] |
张天永, 王梦颖, 李彬, 等. 工业填料γ-Al2O3催化氧化偏三甲苯制2, 3, 5-三甲基苯醌[J]. 应用化学, 2016, 33(10): 1161-1167. ZHANG Tianyong, WANG Mengying, LI Bin, et al. Industrial packing γ-Al2O3 catalyzed oxidation of 1, 2, 4-trimethylbenzene to 2, 3, 5-trimethybenzoquinone[J]. Chinese Journal of Applied Chemistry, 2016, 33(10): 1161-1167. DOI:10.11944/j.issn.1000-0518.2016.10.160004 (in Chinese) |
| [63] |
ADAM W, HERRMANN W A, LIN J, et al. Catalytic oxidation of phenols to p-quinones with the hydrogen peroxide and methyltrioxorhenium(Ⅶ) system[J]. The Journal of Organic Chemistry, 1994, 59(26): 8281-8283. DOI:10.1021/jo00105a058 |
| [64] |
ADAM W, HERRMANN W A, SAHA-MÖLLER C R, et al. Oxidation of methoxybenzenes to p-benzoquinones catalyzed by methyltrioxorhenium(Ⅶ)[J]. Journal of Molecular Catalysis A: Chemical, 1995, 97(1): 15-20. DOI:10.1016/1381-1169(94)00070-0 |
| [65] |
KVHN F E, SCHERBAUM A, HERRMANN W A. Methyltrioxorhenium and its applications in olefin oxidation, metathesis and aldehyde olefination[J]. Journal of Organometallic Chemistry, 2004, 689(24): 4149-4164. DOI:10.1016/j.jorganchem.2004.08.018 |
| [66] |
KVHN F E, SANTOS A M, HERRMANN W A. Organorhenium(Ⅶ) and organomolybdenum(Ⅵ) oxides: Syntheses and application in olefin epoxidation[J]. Dalton Transactions, 2005(15): 2483-2491. DOI:10.1039/b504523a |
| [67] |
ROMÃO C C, KVHN F E, HERRMANN W A. Rhenium(Ⅶ) oxo and imido complexes: Synthesis, structures, and applications[J]. Chemical Reviews, 1997, 97(8): 3197-3246. DOI:10.1021/cr9703212 |
| [68] |
HANSEN P J, ESPENSON J H. Oxidation of chloride ions by hydrogen peroxide, catalyzed by methylrhenium trioxide[J]. Inorganic Chemistry, 1995, 34(23): 5839-5844. DOI:10.1021/ic00127a023 |
| [69] |
HERRMANN W A, KVHN F E. Organorhenium oxides[J]. Accounts of Chemical Research, 1997, 30(4): 169-180. DOI:10.1021/ar9601398 |
| [70] |
MÓNICA C, ALTMANN P, BONRATH W, et al. Methyltrioxorhenium-catalysed oxidation of pseudocumene in the presence of amphiphiles for the synthesis of vitamin E[J]. Catalysis Science & Technology, 2012, 2(4): 722-724. |
| [71] |
JACOB J, ESPENSON J H. Selective C-H bond activation of arenes catalyzed by methylrhenium trioxide[J]. Inorganica Chimica Acta, 1998, 270(1/2): 55-59. |
| [72] |
CARRIL M, ALTMANN P, DREES M, et al. Methyltrioxorhenium-catalyzed oxidation of pseudocumene for vitamin E synthesis: A study of solvent and ligand effects[J]. Journal of Catalysis, 2011, 283(1): 55-67. DOI:10.1016/j.jcat.2011.07.003 |
| [73] |
XU Z, ZHOU M, DREES M, et al. Mono- and bis- methyltrioxorhenium(Ⅶ) complexes with salen ligands: Synthesis, properties, applications[J]. Inorganic Chemistry, 2009, 48(14): 6812-6822. DOI:10.1021/ic900761u |
| [74] |
ZHOU M, YU Y, CAPAPÉ A, et al. (N-salicylidene)aniline derived Schiff base complexes of methyltrioxorhenium(Ⅶ): Ligand influence and catalytic performance[J]. Chemistry-an Asian Journal, 2009, 4(3): 411-418. DOI:10.1002/asia.200800358 |
| [75] |
KUDRIK E, SOROKIN A. N-bridged diiron phthalocyanine catalyzes oxidation of benzene with H2O2 via benzene oxide with NIH shift evidenced by using 1, 3, 5-[D3]benzene as a probe[J]. Chemistry-A European Journal, 2008, 14(24): 7123-7126. |
| [76] |
NAKAGAWA Y, MIZUNO N. Mechanism of[γ-H2SiV2W10O40](4-)-catalyzed epoxidation of alkenes with hydrogen peroxide[J]. Inorganic Chemistry, 2007, 46(5): 1727-1736. DOI:10.1021/ic0623258 |
| [77] |
KAMATA K, YONEHARA K, NAKAGAWA Y, et al. Efficient stereo- and regioselective hydroxylation of alkanes catalysed by a bulky polyoxometalate[J]. Nature Chemistry, 2010, 2(6): 478-483. DOI:10.1038/nchem.648 |
| [78] |
FLOREA M, MARIN R S, PǍLǍANU F M, et al. Mesostructured vanadia-alumina catalysts for the synthesis of vitamin K3[J]. Catalysis Today, 2015, 254: 29-35. |
| [79] |
PETROV L A, LOBANOVA N P, VOLKOV V L, et al. Catalytic properties of polyvanadomolybdic acids in oxidation of 1, 2, 4-trimethylbenzene by peracetic acid[J]. Bulletin of the Academy of Sciences of the USSR, Division of Chemical Science, 1989, 38(9): 1806-1809. DOI:10.1007/BF00957766 |
| [80] |
ZALOMAEVA O V, EVTUSHOK V Y, MAKSIMOV G M, et al. Selective oxidation of pseudocumene and 2-methylnaphthalene with aqueous hydrogen peroxide catalyzed by γ-Keggin divanadium-substituted polyoxotungstate[J]. Journal of Organometallic Chemistry, 2015, 793: 210-216. DOI:10.1016/j.jorganchem.2015.04.020 |
 2022, Vol. 39
2022, Vol. 39