O-3-氯-2-丙烯基羟胺(简称氯代胺)是重要的农药中间体,主要用于生产环己烯酮类除草剂,如烯草酮(clethodim)、噻草酮(cycloxydim)和苯草酮(tralkoxydim)等,该类除草剂是一种芽后选择性除草剂,常用于防治禾本科杂草及阔叶作物田中自生禾谷类作物[1, 2]。
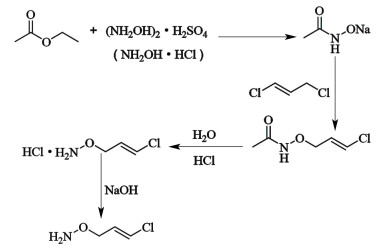
目前,氯代胺的工业化生产是以乙酸乙酯和硫酸羟胺或者盐酸羟胺为起始原料,经过酰化、缩合、水解、碱解四步反应(见图 1)得到氯代胺的水溶液,然后加入二氯甲烷萃取分层得到氯代胺的二氯甲烷溶液,最后通过脱溶得到氯代胺。尽管该生产工艺成熟,但在生产过程中易超温发生爆炸。近年来国内发生了2起与氯代胺有关的爆炸事故,分别为2020年辽宁先达农业科学有限公司的“2.11”爆炸事故(5人死亡、10人受伤)及2014年沾化家裕化工工贸有限公司的“7.18”爆炸事故(8人受伤)。
|
| 图 1 氯代胺合成工艺 Fig.1 Synthesis process of O-(3-chloro-2-propenyl)-hydroxylamine |
| |
国内外学者对于氯代胺的研究主要为合成方法方面[2-7],对于其热危险性研究却少见文献报道,但对于羟胺类化合物的热危险性有一定的研究。闫姣姣等[8]对盐酸羟胺和N-甲基羟胺盐酸盐进行了研究,差示扫描量热仪(DSC)测试结果表明2者的比放热量分别为2 285和2 188 J ·g-1,放热量大,潜在爆炸危险性高;等温法和中断回扫法均表明2者均具有自催化分解特性。王犇等[9]利用DSC在不同升温速率条件下对硫酸羟胺进行测试,其放热峰峰型尖锐,表明测试过程中发生了爆炸性放热反应。Iwata等[10]运用联合国推荐的危险物质运输标准实验测得,50%羟胺水溶液的自加速分解温度(SADT)为80 ℃,不属于自反应性物质,但当加入1.0×10-6的铁离子后属于自反应性物质,且随着铁离子含量的增加,热稳定性降低,热分解敏感度增加。
当想减缓或终止某些反应时,可加入具有降低反应物浓度、温度作用的淬灭剂进行淬灭,其加入量、加入速率及温度是淬灭的关键参数[11]。廉价易得且比热容大的水是最常用的淬灭剂之一,但当氯代胺受热分解时,能否使用水进行淬灭以及水淬灭工艺等未见报道。本研究采用DSC、绝热量热仪(Phi-TEC)等常用的热分析仪对氯代胺的热危险性进行研究,期望为相关工艺安全措施的建立提供依据。
1 实验部分 1.1 试剂氯代胺,质量分数97.8%,自制。
1.2 DSC测试DSC测试采用瑞士梅特勒-托利多(METTLER TOLEDO)公司生产的DSC3+型差示扫描量热仪。测试坩埚为带镀金垫片的25 μL镀金高压密闭坩埚(耐压15 MPa),测试温度范围为25~350 ℃。
1.3 Phi-TEC测试Phi-TEC测试采用英国赫尔(HEL)公司生产的Phi-TEC Ⅱ型绝热量热仪,10 mL哈氏合金样品池。Ramp扫描模式测试样品量为1.06 g,温度范围为25~350 ℃,升温速率为4 ℃ ·min-1。HWS模式测试样品量为1.44 g,温度范围为80~400 ℃,升温台阶为10 ℃,等待搜索时间为10 min。
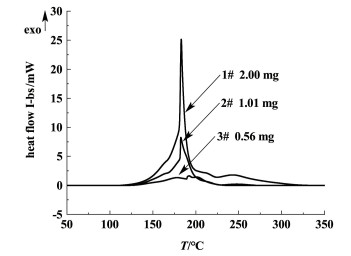
2 DSC测试结果与讨论在升温速率为4 ℃ ·min-1、样品量为2.00 mg条件下氯代胺的DSC曲线见图 2,测试结果见表 1。由图 2可以看出,在测试温度范围内氯代胺连续放热,峰值温度(Tpeak)处峰型十分尖锐,说明此时放热剧烈,发生了爆炸性放热反应[12]。由表 1可知,氯代胺的起始放热温度(Tleft,放热曲线刚刚偏离基线时的温度)为112 ℃,Tpeak为183 ℃。由于Tpeak处峰型十分尖锐,此时放热速率可能超过了仪器的最大追踪速率,从而导致数据失真,因此对于出现此现象的测试不再分析其比放热量数据。为得到更加真实的数据,主要从降低样品质量、改变气氛和升温速率3个方面来改善测试条件。
|
| 图 2 不同样品质量下氯代胺的DSC曲线 Fig.2 DSC curves of O-(3-chloro-2-propenyl)- hydroxylamine of different masses |
| |
| 编号 | 质量m/mg | 气氛 | 升温速率β/(℃·min-1) | 起始放热温度Tleft/℃ | 峰值温度Tpeak/℃ | 比放热量Qd/(J·g-1) | 是否爆炸性放热 |
| 1# | 2.00 | 空气 | 4.0 | 112 | 183 | 是 | |
| 2# | 1.01 | 空气 | 4.0 | 114 | 183 | 是 | |
| 3# | 0.56 | 空气 | 4.0 | 114 | 192 | 2 105 | 否 |
| 4# | 0.54 | 氮气 | 4.0 | 111 | 191 | 2 168 | 否 |
| 5# | 1.05 | 空气 | 2.0 | 99 | 171 | 是 | |
| 6# | 1.08 | 空气 | 1.0 | 90 | 162 | 是 | |
| 7# | 1.06 | 空气 | 0.5 | 80 | 155 | 是 |
图 2为不同样品质量下氯代胺的DSC曲线,可以看出随着样品质量的减少,Tpeak处尖锐的放热峰逐渐减弱,表明随着样品质量的减小,放热缓慢,危险性降低。这与文献[13]中提出的具有高分解能量的物质需使用较少样品量的观点一致。
当样品质量为0.56 mg时,DSC曲线较为平滑,可认为此时其放热速率在仪器的追踪速率范围内。由表 1可知,其Tleft为114 ℃,Tpeak为192 ℃,Qd为2 105 J ·g-1。根据应急管理部(原国家安全监管总局)关于加强精细化工反应安全风险评估工作的指导意见(安监总局三[2017]1号)之附件“精细化工反应安全风险评估导则(试行)”可知,氯代胺的分解热评估等级为3级(评估准则详见表 2),说明氯代胺的分解放热量大,潜在爆炸危险性高。在实际应用过程中,要通过风险研究和风险评估,界定其安全操作温度,避免超过规定温度,引发爆炸事故的发生。
| 等级 | 分解热/(J·g-1) | 说明 |
| 1 | 分解热 < 400 | 潜在爆炸危险性。 |
| 2 | 400≤分解热≤1 200 | 分解放热量较大,潜在爆炸危险性较高。 |
| 3 | 1 200 < 分解热 < 3 000 | 分解放热量大,潜在爆炸危险性高。 |
| 4 | 分解热≥3 000 | 分解放热量很大,潜在爆炸危险性很高。 |
图 3为不同气氛下氯代胺的DSC曲线,可以看出氯代胺在空气和氮气2种气氛下的DSC曲线变化趋势基本一致,且由表 1可知2种气氛下的Tleft、Tpeak和Qd也基本一致,表明空气中的O2对氯代胺的热危险性基本无影响。

|
| 图 3 不同气氛下氯代胺的DSC曲线 Fig.3 DSC curves of O-(3-chloro-2-propenyl)- hydroxylamine at different atmospheres |
| |
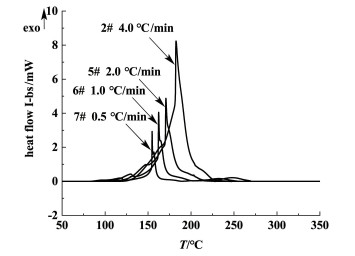
图 4为不同升温速率下氯代胺的DSC曲线,可以看出氯代胺在不同升温速率下的DSC曲线变化趋势基本一致,Tpeak处峰型均十分尖锐,表明升温速率对氯代胺的热危险性影响不大。由表 1可知,随着升温速率的降低,Tleft和Tpeak均降低,这是因为升温速率高,样品与测试环境的热交换时间短,测试的分解温度向高温区移动[14]。
|
| 图 4 不同升温速率下氯代胺的DSC曲线 Fig.4 DSC curves of O-(3-chloro-2-propenyl)- hydroxylamine at different heating rates |
| |
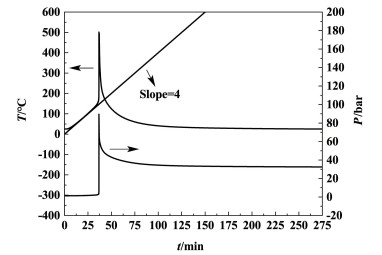
图 5为Ramp扫描模式下氯代胺的温度、压力随时间变化曲线。
|
| 图 5 Ramp扫描模式下氯代胺的温度、压力随时间变化曲线 Fig.5 T-t and P-t curves of O-(3-chloro-2-propenyl)- hydroxylamine in Ramp mode |
| |
由图 5可以看出氯代胺在测试温度范围内有1段放热;当温度为120 ℃时,温度曲线的斜率开始变大,表明氯代胺开始放热,178 ℃后温度、压力迅速升高,表明测试池内放热剧烈,发生了爆炸性放热反应,与DSC测试结果基本一致。测试结束降至25 ℃时,测试池内压力为32.52 bar(1 bar=100 kPa),未回归至测试前压力,如图 6所示。
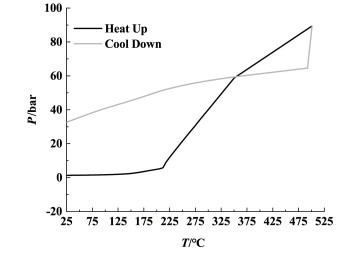
|
| 图 6 Ramp扫描模式下氯代胺的压力随温度变化曲线 Fig.6 P-T curves of O-(3-chloro-2-propenyl)- hydroxylamine in Ramp mode |
| |
根据理想气体状态方程PV=nRT,将测试结束后测试池内的气体折算为常压下的体积V:
| $ V \approx {P_0}{V_0}/P \approx 32.52 \times \left( {10 - 1} \right)/1 \approx 293\;{\rm{mL}} $ | (1) |
式(1)中:P0为测试结束降至25 ℃时测试池内压力,bar;P为常压,1 bar;V0为测试结束降至25 ℃时测试池内气相体积,一般使用测试前测试池内气相体积进行估算,mL。
因此,单位样品质量的产气量约为
| $ \begin{array}{l} \left[ {293 - \left( {10 - 1} \right)} \right]/1.06 \approx 268\;{\rm{mL}} \cdot {{\rm{g}}^{ - 1}}\\ \;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\left( {25\;℃, 常压} \right) \end{array} $ | (2) |
表明氯代胺在测试过程中分解产生了大量的不凝气,在密闭容器内有引发超压爆炸的可能。
3.2 HWS模式图 7为HWS模式下氯代胺的温度、压力随时间变化曲线。
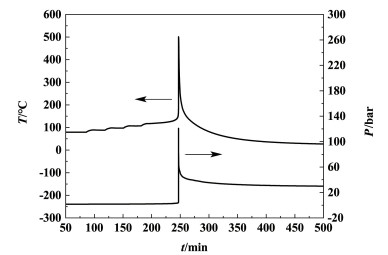
|
| 图 7 HWS模式下氯代胺的温度、压力随时间变化曲线 Fig.7 T-t and P-t curves of O-(3-chloro-2-propenyl)- hydroxylamine in HWS mode |
| |
由图 7可以看出氯代胺在测试温度范围内有1段放热;起始放热温度为115 ℃,放热初期,温度、压力增长较为缓慢,140 ℃后温度、压力急剧增加,这与自催化分解反应较为相似[15]。冷却失效条件(绝热状态)下,n级分解反应和自催化分解反应的温度随时间变化曲线完全不同。对于n级反应,冷却失效后体系温度就开始升高,达到报警温度后仍然会留有应急响应的时间,而对于自催化反应,冷却失效后的一段时间内温度基本维持不变,然后急剧上升发展为热失控,达到报警温度后的应急响应时间极短,热风险很高[16]。因此,在实际应用中可以参考氯代胺具有自催化分解特性,采取针对性的安全管控措施。
3.3 淬灭由图 7可知,140 ℃后温度、压力急剧增加,如果氯代胺的热分解已达到这种状态,基本无法控制。因此对140 ℃前加入水能否将其淬灭进行了考察。取2.22 g氯代胺加入到10 mL哈氏合金样品池中,在HWS模式下从85 ℃开始进行测试,当样品池内温度为125 ℃时,使用高压进样器一次性打入3.37 g 25 ℃的水(氯代胺与水的质量比为1.0∶1.5),测试结果见图 8。样品池内温度瞬间降至70 ℃,然后又快速回升至95 ℃,约5 h后自然降温至25 ℃。图 8中1#曲线为40%氯代胺水溶液(氯代胺与水的质量比为1.0∶1.5)的测试结果,107 ℃时有一段十分微弱的放热,从122 ℃开始有一段明显的放热,放热温度范围为122~217 ℃,高于1.5倍氯代胺质量的水淬灭后的温度95 ℃。由此可见,氯代胺一旦因超温而发生热分解时,在分解初期可通过加入1.5倍氯代胺质量的水进行淬灭。
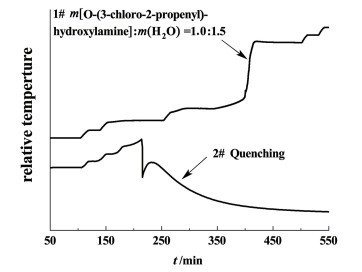
|
| 图 8 不同测试条件下温度随时间变化曲线 Fig.8 T-t curvs at different conditions |
| |
1) DSC测试结果表明,氯代胺连续放热,当其质量超过1 mg时,热分解初期放热缓慢,达到一定温度后会出现爆炸性放热。
2) 与气氛、升温速率相比,样品质量对氯代胺热危险性的影响较大。在样品量为0.56 mg、升温速率为4 ℃ ·min-1、空气气氛的条件下,氯代胺未发生爆炸性放热,其Tleft为114 ℃,Tpeak为192 ℃,Qd为2 105 J ·g-1,说明分解放热量大,潜在爆炸危险性高。
3) 氯代胺热分解过程中除放出大量的热外,还会产生大量的不凝气,有引发密闭容器超压爆炸的可能。
4) 氯代胺一旦因超温发生分解放热时,在分解初期可通过加入1.5倍氯代胺质量的水进行淬灭。为获得能够实际应用的淬灭工艺,还需进一步详细研究。
5) 实际生产中,不应大量存储氯代胺,且应对其存储温度进行严格监控,避免因存储温度过高导致爆炸事故。
| [1] |
程春生, 魏振云, 李全国, 等. 烯草酮合成工艺热危险性及动力学[J]. 农药, 2014, 53(2): 99-101, 125. CHENG Chunsheng, WEI Zhenyun, LI Quanguo, et al. Thermal hazard and reaction kinetics for synthesis process of clethodim[J]. Agrochemicals, 2014, 53(2): 99-101, 125. (in Chinese) |
| [2] |
吴迎晓, 戴立言. 中间体O-3-氯-2-丙烯基羟胺的制备[J]. 农药, 2004, 43(3): 113-114. WU Yingxiao, DAI Liyan. Preparation of O-(3-chloro-2-propenyl)-hydroxylamine[J]. Pesticides, 2004, 43(3): 113-114. DOI:10.3969/j.issn.1006-0413.2004.03.006 (in Chinese) |
| [3] |
SCHNEIDER H D. Hydroxamic acid esters: US4965390[P]. 1990-10-23
|
| [4] |
高伟, 王陈承, 田冠东. 一种O-反式-(3-氯-2-丙烯基)-羟胺的合成方法: CN110437098A[P]. 2019-11-12
|
| [5] |
孙国庆, 侯永生, 绳敏, 等. 一种烯草酮中间体的制备方法及其应用: CN111217729A[P]. 2020-06-02
|
| [6] |
杨运旭, 杜晓雨. 一种反式-3-氯-2-丙烯基羟胺的制备方法: CN112358416A[P]. 2021-02-12
|
| [7] |
刘鹏, 王蕾, 张玉天. 一种O-3-氯-2-丙烯基羟胺游离碱的制备工艺: CN112500311A[P]. 2021-03-16
|
| [8] |
闫姣姣, 陈利平, 陈网桦, 等. 盐酸羟胺和N-甲基羟胺盐酸盐的自催化分解特性[J]. 含能材料, 2015, 23(11): 1140-1146. YAN Jiaojiao, CHEN Liping, CHEN Wanghua, et al. Autocatalytic decomposition of hydroxylamine hydrochloride and N-methyl hydroxylamine hydrochloride[J]. Chinese Journal of Energetic Materials, 2015, 23(11): 1140-1146. DOI:10.11943/j.issn.1006-9941.2015.11.020 (in Chinese) |
| [9] |
王犇, 黄文君, 黄飞, 等. 硫酸羟胺的热分解动力学研究[J]. 中国安全生产科学技术, 2011, 7(4): 40-45. WANG Ben, HUANG Wenjun, HUANG Fei, et al. Study on thermal decomposition kinetics of hydroxylamine sulfate[J]. Journal of Safety Science and Technology, 2011, 7(4): 40-45. (in Chinese) |
| [10] |
IWATA Y, KOSEKI H. Decomposition of hydroxylamine/water solution with added iron ion[J]. Journal of Hazardous Materials, 2003, 104(1/2/3): 39-49. |
| [11] |
陈网桦, 彭金华, 陈利平. 化工工艺的热安全——风险评估与工艺设[M]. 北京: 科学出版社, 2009.
|
| [12] |
王犇. 苯硝化生产硝基苯工艺危险性分析及爆炸事故热安全研究[D]. 山东青岛: 青岛科技大学, 2011 WANG Ben. Process risk analysis for nitrobenzene production and study on thermal safety of explosion accident[D]. Shandong Qingdao: Qingdao University of Science & Technology, 2011 (in Chinese) |
| [13] |
程春生, 秦福涛, 魏振云. 化工安全生产与反应风险评估[M]. 北京: 化学工业出版社, 2011.
|
| [14] |
许亚北, 谭迎新, 曹卫国, 等. RDX热分解特性及HMX对其热稳定性的影响[J]. 含能材料, 2020, 28(2): 157-163. XU Yabei, TAN Yingxin, CAO Weiguo, et al. Thermo-decomposition performance of RDX and the effect of HMX on its thermo-stability[J]. Chinese Journal of Energetic Materials, 2020, 28(2): 157-163. (in Chinese) |
| [15] |
闫姣姣. 三种羟胺类化合物热解的实验及理论研究[D]. 南京: 南京理工大学, 2015 YAN Jiaojiao. Study on thermal hazards and decomposition mechanisms of three hydroxylamine compounds[D]. Nanjing: Nanjing University of Science and Technology, 2015 (in Chinese) |
| [16] |
BOU-DIAB L, FIERZ H. Autocatalytic decomposition reactions, hazards and detection[J]. Journal of Hazardous Materials, 2002, 93(1): 137-146. DOI:10.1016/S0304-3894(02)00044-4 |
 2022, Vol. 39
2022, Vol. 39





