2. 天津化学化工协同创新中心,天津 300072
2. Collaborative Innovation Center of Chemical Science and Chemical Engineering(Tianjin), Tianjin 300072, China
开发更准确快速高效的癌症诊断方法和技术已经成为世界各地研究人员的目标[1]。近年来,近红外荧光染料探针已被广泛应用于临床研究[2, 3]。相比于传统的成像诊断方法,近红外荧光染料探针的吸收波长和发射波长更长,具有更大的穿透深度,可避免生物体组织自身吸收的干扰,在成像方面表现出明显优势[4, 5]。
氟硼二吡咯化合物(BODIPY)是一类受关注的近红外荧光染料,具有较大的摩尔吸光系数、较好的光稳定性和方便修饰的优点[6-8]。其作为荧光探针和光敏剂等得到了广泛研究,已经被运用在多个领域,如生物分子标记[9]、药物追踪[10]、肿瘤诊断[11]和荧光分子开关[12]等。
然而,目前大多BODIPY染料的吸收波长和发射波长达不到近红外区,在成像诊断中受组织自身吸收干扰较大[13, 14];另外,BODIPY染料的水溶性与生物相容性问题限制了其在生物体内的应用[15];并且对BODIPY在肿瘤诊疗复合应用的研究较少[16],没有充分发挥BODIPY染料在光诊疗方面的优势。
针对以上问题,研究人员通常通过对BODIPY的结构进行修饰使其吸收波长达到近红外区,并采用给母核偶联亲水性共聚物、修饰亲水性基团或用两亲性共聚物包覆等方法提高其水溶性,达到在生物体中应用的目的[17-19]。
本课题在碘代BODIPY的3, 5位上引入吩噻嗪单元,得到单/双取代的2种新的BODIPY结构并通过自组装得到具有靶向性的纳米粒子。通过光谱研究,探究2种不同结构之间的差异,在细胞水平上进行实验研发出了一种具有优良成像能力,良好生物相容性和肿瘤细胞靶向能力的分子,为构建基于BODIPY染料的荧光探针提供了新思路。
1 实验部分 1.1 实验原料卵磷脂,DSPE-PEG2000,胆固醇,生物试剂,天津百赛斯生物科技有限公司;2, 4-二甲基吡咯,对甲酰基苯甲酸甲酯,2, 3-二氯-5, 6-二氰对苯醌(DDQ),三氟乙酸,三氟化硼乙醚,叔丁醇钾,分析纯,天津希恩斯生化科技有限公司;二氯甲烷,石油醚,四氢呋喃,分析纯,天津市元立化工有限公司;N-乙基吩噻嗪-3-甲醛,碘单质,碘酸,分析纯,上海阿拉丁生化科技股份有限公司;甲苯,冰乙酸,分析纯,天津市光复精细化工研究所;哌啶,分析纯,中国医药上海化学试剂研究所。所有化学药品都未经过处理可以直接使用。
1.2 实验设备AVANCE Ⅲ型核磁共振仪,德国布鲁克公司;Autoflex tof/tofIII型基质辅助激光解吸附-串联飞行时间质谱,布鲁克道尔顿公司;S-4800型场发射扫描电子电镜,日立公司;JEM-2100F型场发射透射电子显微镜,荷兰FEI公司;Shimadzu UV-1800紫外可见分光光度计,Hitachi F-2500荧光分光光度计,辉因科技有限公司;Perkin Elmer Enspire型酶标仪,瑞典百欧林科技,A1R+型共聚焦显微镜,日本尼康。
1.3 实验路线 1.3.1 8-对甲氧羰基苯基-1, 3, 5, 7-四甲基氟硼二吡咯(1)化合物的合成采用实验室制法,具体步骤见文献[20]。
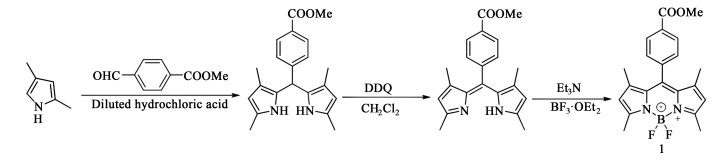
|
| 图 1 化合物1的合成 Fig.1 The synthesis of compound 1 |
| |
取50 mL双口圆底烧瓶,加入250 mg (0.65 mmol) 化合物BOD和207 mg (0.82 mmol)碘单质I2。用等体积的二氯甲烷/无水酒精混合溶液溶解。之后将230 mg (1.31 mmol)碘酸溶解于少量水中,逐滴滴加进溶液中。60 ℃下搅拌2 h,冷却至室温,旋蒸除溶剂,得到紫色粗产物。采用长硅胶柱[洗脱剂为V(二氯甲烷) ∶V(石油醚)=2 ∶1]柱层析分离,收集红色色带,旋蒸除溶剂,得到深红色颗粒状晶体化合物2 (392 mg,产率95.2%)。
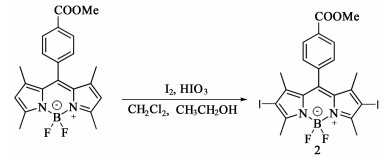
|
| 图 2 化合物2的合成 Fig.2 The synthesis of compound 2 |
| |
取50 mL双口圆底烧瓶,加入化合物2 (80 mg,0.126 mmol),N-乙基吩噻嗪-3-甲醛(化合物3)(96.417 mg,0.378 mmol),加入12 mL甲苯溶解。向溶剂中加入催化剂哌啶和冰乙酸,各0.1 mL。120 ℃下避光反应8 h,空气冷凝。反应过程中,TLC监测反应进程,并根据需要补加原料。反应结束后,停止加热搅拌并冷却至室温。利用二氯甲烷萃取,无水硫酸钠干燥,旋蒸除溶剂,得到深色粗产物。采用硅胶柱[洗脱剂为V(二氯甲烷) ∶V(石油醚)=2 ∶1]柱层析分离,收集第1、第2深色色带,分别为单取代3a,双取代3b。
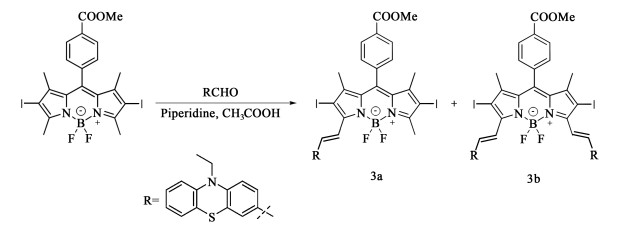
|
| 图 3 化合物3a/3b的合成 Fig.3 The synthesis of compound 3a/3b |
| |
精确称量5.5 mg卵磷脂,1.0 mg化合物3a/3b以及1.0 mg胆固醇,加入5 mL氯仿溶解,旋蒸除去氯仿,以形成一层薄膜。另精确称量3.0 mg卵磷脂,1.0 mg化合物3a/3b,2.5 mg DSPE-PEG2000-MAL-RGD(参照文献[21]方法合成)以及1.0 mg胆固醇,加入5 mL氯仿溶解,旋蒸除去氯仿,同样形成一层薄膜。加入10 mL磷酸PBS缓冲液(pH=7.8)于烧瓶中,超声20 min,观察到溶液澄清,经0.45 μm滤膜过滤分别制得BODIPY-PC溶液和BODIPY-PC-RGD溶液。冻干并用冷冻干燥机除去溶剂,获得白色固体,在4 ℃下保存。
1.4 表征测试 1.4.1 核磁共振氢谱(1H NMR)和碳谱(13C NMR)采用核磁共振仪表征化合物。溶剂为氘代氯仿(CDCl3)。
1.4.2 紫外可见吸收光谱和荧光发射光谱的测定采用紫外可见分光光度计测定吸收光谱图,扫描波长范围为200~800 nm。采用荧光分光光度计测定稳态荧光发射光谱图,激发波长为560 nm,狭缝宽为2.5 nm,电压为400 V。
1.4.3 扫描电镜(SEM)和透射电镜(TEM)测试BODIPY和BODIPY-PC-RGD的形貌通过扫描电镜、透射电镜和光学显微镜进行测试。
1.4.4 BODIPY-PC-RGD生物性能评价通过MTT法对BODIPY、BODIPY-PC、BODIPY-PC-RGD的毒性进行评价。选择Hela细胞进行实验,按照MTT铺板要求进行铺板,设置浓度梯度为:1、10、20、40、80和100 μg ·mL-1。
采用激光共聚焦显微镜观察细胞对BODIPY-PC和BODIPY-PC-RGD的摄取情况。用DAPI对细胞核进行染色,多聚甲醛固定细胞后在共聚焦显微镜下进行观察。
采用流式细胞实验对BODIPY-PC和BODIPY-PC-RGD的靶向性进行测定。用6孔板代替96孔板按照细胞毒性实验的方法进行细胞铺板,按照激光共聚焦实验进行样品制备,将样品用200目铜网进行过滤,再用细胞流式仪进行测试。
2 结果与讨论 2.1 化合物3a/3b的合成分析按照1.3.3的方法合成化合物3a和3b。1H NMR (400 MHz, Chloroform-d) δ 8.21 (d, J=8.3 Hz, 2H), 8.07 (d, J=16.6 Hz, 1H), 7.50 (d, J=16.5 Hz, 1H), 7.43 (dd, J=8.7, 2.0 Hz, 1H), 7.40 (d, J=8.4 Hz, 2H), 7.37 (d, J=1.9 Hz, 1H), 7.18~7.10 (m, 2H), 6.95~6.83 (m, 2H), 4.00 (s, 3H), 3.96 (q, J=7.1 Hz, 2H), 2.70 (s, 3H), 1.44 (t, J=7.0 Hz, 3H), 1.41 (s, 3H), 1.37 (s, 3H)。HRMS (ESI) calcd。for C36H30BF2I2N3O2S 894.038 1, found 894.038 4。1H NMR谱图如图 4,化学位移δ=8.07和7.50处的双重峰为新生成—CH CH—的特征峰,δ=6.80~7.40之间的峰的为吩噻嗪环上的氢,δ=3.96和1.44处的四重峰和三重峰分别对应吩噻嗪N上亚甲基氢和甲基氢,确证化合物3a成功合成。
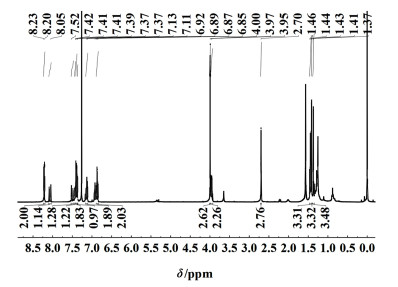
|
| 图 4 化合物3a的氢谱图 Fig.4 1H NMR spectra of 3a |
| |
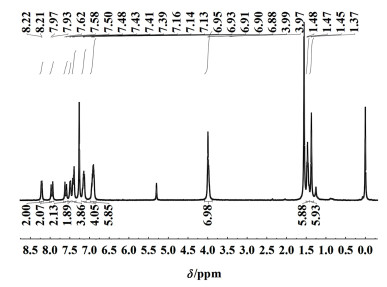
化合物3b:1H NMR (400 MHz, Chloroform-d) δ 8.21 (d, J=7.3 Hz, 2H), 7.95 (d, J=16.3 Hz, 2H), 7.60 (d, J=16.5 Hz, 2H), 7.49 (d, J=8.4 Hz, 2H), 7.45~7.37 (m, 4H), 7.21~7.10 (m, 4H), 6.91 (dt, J=11.6, 7.1 Hz, 6H), 3.98 (d, J=7.7 Hz, 7H), 1.47 (t, J=6.2 Hz, 6H), 1.37 (s, 6H)。HRMS (ESI) calcd。for C40H39BF2I2N4O2 1 131.049 1, found 1 131.049 2。1H NMR谱图如图 5,化学位移δ=7.95和7.60处的双重峰为新生成—CH CH—的特征峰,确证化合物3b成功合成。
|
| 图 5 化合物3b的氢谱图 Fig.5 1H NMR spectra of 3b |
| |
为了研究化合物3a和3b的光学性质,分别测试了紫外可见吸收光谱和荧光发射光谱,结果见图 6。已经有报道的母核BODIPY(化合物1)的最大吸收波长在500 nm处,发射波长在550 nm处[20]。由图 6可知,3a和3b 2种染料的最大吸收波长分别达到了620和725 nm,最大发射波长分别达到了650和775 nm,都发生了比较大的红移,而且双取代要比单取代红移更加明显。这主要是因为BODIPY结构共轭程度的增加,而双取代分子的共轭程度要高于单取代分子。并且双取代分子3b的斯托克斯位移为50 nm,表现出优异的荧光成像能力。

|
| 图 6 3a和3b的(a)紫外可见吸收光谱图;(b)荧光发射光谱图 Fig.6 (a) Ultraviolet absorption; (b) Fluorescence spectra of 3a, 3b |
| |
另外,对比了染料包覆后发射波长的变化。由图 7可知,用磷脂将BODIPY染料包覆后,相较于包覆前,染料的荧光强度变弱,同时,最大荧光发射峰发生轻微蓝移。荧光强度变弱主要是因为用磷脂包裹后,BODIPY分子进入空间较小的磷脂形成的间隙中,发生聚集, 从而引起荧光猝灭,使得荧光强度下降。另一方面,经磷脂包裹后,BODIPY染料外层多了一层屏障,阻碍了荧光的透过,同样引起了荧光强度的下降。而蓝移是因为包裹后的BODIPY周边微环境的极性下降,极化率变小,斯托克斯位移变小,使得荧光发射峰发生微弱蓝移[22]。

|
| 图 7 (a) 3a和(b) 3b包覆前后荧光对比图 Fig.7 Fluorescence spectra of (a) 3a and (b) 3b before and after self-assembling |
| |
利用SEM,TEM以及光学显微镜对BODIPY、BODIPY-PC-RGD的形貌特征进行观察。结果如图 8所示。单独BODIPY大小不均等一致,表面粗糙,形状多样,在水相中成聚集态,片层较厚且分子间存在堆积现象,片层表面可以观察到大小不一的褶皱,颗粒直径难以测算。当用PC-RGD将BODIPY包覆后,发现包裹后的纳米颗粒大小均一,形状规则,表面圆润。在光学显微镜下,BODIPY在水相中呈灰绿色,呈现不规则分散,用磷脂包裹后发现,BODIPY-PC-RGD在水相中分散较为均匀,尺寸约为100 nm。并且BODIPY-PC-RGD显现出浅绿色,说明磷脂将BODIPY成功包裹。

|
| 图 8 BODIPY的(a) SEM,(b)TEM,(c)光学显微镜下形貌图;BODIPY-PC-RGD的(d)SEM,(e)TEM,(f)光学显微镜下形貌图 Fig.8 (a)SEM, (b)TEM, (c)optical microscopy images of BODIPY; (d) SEM, (e) TEM, (f) optical microscopy images of BODIPY-PC-RGD |
| |
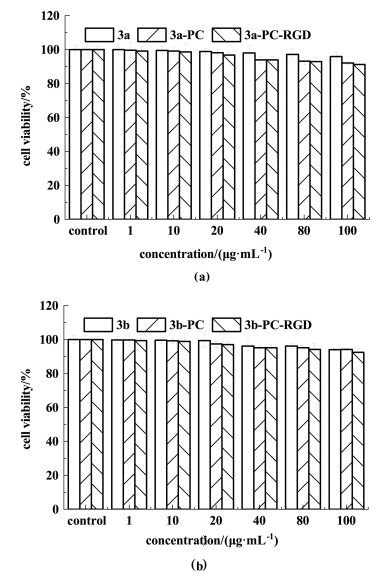
分别测试了24 h BODIPY(3a和3b)、BODIPY-PC/BODIPY-PC-RGD在不同浓度1、10、20、40、80和100 μg ·mL-1下对Hela细胞的毒性,结果如图 9所示。
|
| 图 9 (a) 3a和(b) 3b的细胞毒性实验结果 Fig.9 The MTT outcomes of (a) 3a and (b) 3b |
| |
结果表明,当浓度较低时,BODIPY-PC-RGD对细胞无毒副作用,当浓度上升到100 μg ·mL-1, Hela细胞存活率依然能达到80%以上。因此,在使用浓度范围内,BODIPY-PC-RGD几乎不具有细胞毒性,可以将其应用在生物体内成像领域。
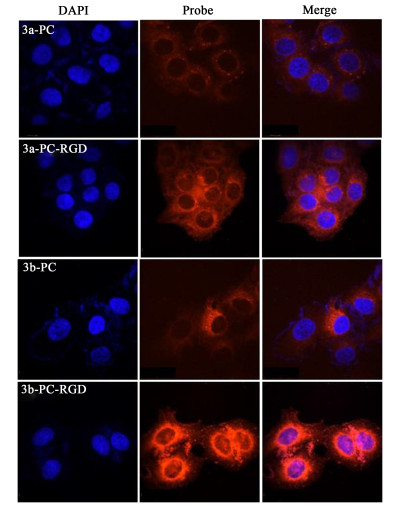
RGD可以有效靶向肿瘤细胞,因此利用激光共聚焦对脂质体的体外靶向能力和荧光成像效果进行研究。用DAPI对细胞核进行染色,确定细胞的位置,再结合脂质体本身的荧光,利用激光共聚焦显微镜双通道观察,可以确定细胞对脂质体的摄取情况。选择Hela细胞作为细胞模型,探究对连有靶向基团和不连靶向基团的脂质体的摄取情况。如图 10所示,蓝色荧光为细胞核的位置,红色荧光为脂质体的位置,探针与细胞结合的数量通过红色荧光的强弱来判断,进一步验证BODIPY-PC-RGD的靶向性。通过实验结果可以看出,不连有靶向基团RGD的BODIPY-PC,细胞内的荧光十分微弱甚至没有,而连有靶向基团的BODIPY-PC-RGD,在细胞核周围可以观察到明亮的红色荧光。这证明了连有靶向基团RGD的磷脂具有良好的靶向性,可以有效提高Hela细胞对其的摄取能力。
|
| 图 10 共聚焦显微镜结果 Fig.10 The fluorescence images of Hela in vitro |
| |
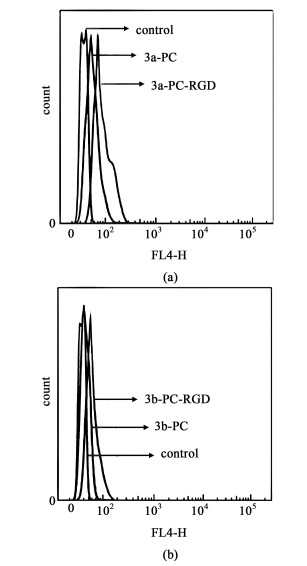
采用细胞流式仪进一步对细胞摄取情况进行定量研究。如图 11所示,横坐标表示荧光强度,纵坐标表示对应强度下的细胞数目。可以看出,BODIPY-PC-RGD探针与单独的BODIPY相比,横坐标数值明显发生变大。即带有靶向基团RGD的探针的荧光强度均较无靶向基团的探针有较明显变强,结果与上述共聚焦显微镜实验结论一致,进一步证明了BODIPY-PC-RGD对Hela细胞具有良好的靶向作用,在肿瘤诊断中具有很好的潜力。
|
| 图 11 流式细胞实验测定结果 Fig.11 Cell viability experiments outcomes |
| |
经过修饰的2种BODIPY分子3a和3b的紫外、荧光接近近红外区域,具有优良的光学性能。细胞毒性实验表明,在实验所需浓度范围内,细胞存活率在80%以上,BODIPY-PC-RGD显示低毒性,符合生物学要求。共聚焦与流式实验表明,BODIPY-PC-RGD较BODIPY-PC具有比较强的主动靶向性。说明了将染料与PC-RGD进行自组装,使得在光学性能不影响其在生物体中应用的同时,提高了水溶性、生物相容性以及靶向性。所以,这种纳米粒子有作为荧光探针的潜力,为之后BODIPY在肿瘤诊疗一体化的研究提供了思路。
| [1] |
LIU Y, BHATTARAI P, DAI Z, et al. Photothermal therapy and photoacoustic imaging via nanotheranostics in fighting cancer[J]. Chemical Society Reviews, 2019, 48(7): 2053-2108. DOI:10.1039/C8CS00618K |
| [2] |
RAJORA M A, LOU J W H, ZHENG G. Advancing porphyrin's biomedical utility via supramolecular chemistry[J]. Chemical Society Reviews, 2017, 46(21): 6433-6469. DOI:10.1039/C7CS00525C |
| [3] |
PENG J, ZHAO L, ZHU X, et al. Hollow silica nanoparticles loaded with hydrophobic phthalocyanine for near-infrared photodynamic and photothermal combination therapy[J]. Biomaterials, 2013, 34(32): 7905-7912. DOI:10.1016/j.biomaterials.2013.07.027 |
| [4] |
NGUYEN V N, YIM Y, KIM S, et al. Molecular design of highly efficient heavy-atom-free triplet BODIPY derivatives for photodynamic therapy and bioimaging[J]. Angewandte Chemie International Edition, 2020, 59(23): 8957-8962. DOI:10.1002/anie.202002843 |
| [5] |
WANG C, CHENG L, LIU Y, et al. Imaging-guided pH-sensitive photodynamic therapy using charge reversible upconversion nanoparticles under near-infrared light[J]. Advanced Functional Materials, 2013, 23(24): 3077-3086. DOI:10.1002/adfm.201202992 |
| [6] |
SWEDIN R, ZATSIKHA Y V, HEALY A T, et al. Rapid excited-state deactivation of BODIPY derivatives by a boron-bound catechol[J]. The Journal of Physical Chemistry Letters, 2019, 10(8): 1828-1832. DOI:10.1021/acs.jpclett.9b00751 |
| [7] |
CUI A, PENG X, FAN J, et al. Synthesis, spectral properties and photostability of novel boron-dipyrromethene dyes[J]. Journal of Photochemistry and Photobiology A: Chemistry, 2007, 186(1): 85-92. DOI:10.1016/j.jphotochem.2006.07.015 |
| [8] |
LIU N, ZHU M, NIU N, et al. Aza-BODIPY probe-decorated mesoporous black TiO2 nanoplatform for the highly efficient synergistic phototherapy[J]. ACS Applied Materials & Interfaces, 2020, 12(37): 41071-41078. |
| [9] |
LOUDET A, BURGESS K. BODIPY dyes and their derivatives: Syntheses and spectroscopic properties[J]. Chemical Reviews, 2007, 107(11): 4891-4932. DOI:10.1021/cr078381n |
| [10] |
ZHANG J, BAO X, ZHOU J, et al. A mitochondria-targeted turn-on fluorescent probe for the detection of glutathione in living cells[J]. Biosensors and Bioelectronics, 2016, 85: 164-170. DOI:10.1016/j.bios.2016.05.005 |
| [11] |
YUAN P, RUAN Z, JIANG W, et al. Oxygen self-sufficient fluorinated polypeptide nanoparticles for NIR imaging-guided enhanced photodynamic therapy[J]. Journal of Materials Chemistry B, 2018, 6(15): 2323-2331. DOI:10.1039/C8TB00493E |
| [12] |
王红萍, 崔爱军, 田茂忠, 等. 氟硼荧(BODIPY)染料的研究进展[J]. 当代化工, 2007, 36(2): 198-201. WANG Hongping, CUI Aijun, TIAN Maozhong, et al. Development of boron dipyrromethene(BODIPY) fluorophores[J]. Contemporary Chemical Industry, 2007, 36(2): 198-201. DOI:10.3969/j.issn.1671-0460.2007.02.026 (in Chinese) |
| [13] |
BOENS N, LEEN V, DEHAEN W. Fluorescent indicators based on BODIPY[J]. Chemical Society Reviews, 2012, 41(3): 1130-1172. DOI:10.1039/C1CS15132K |
| [14] |
卢博为, 孟舒献, 冯亚青. 氟硼荧类亲水性生物荧光探针的研究进展[J]. 有机化学, 2018, 38(2): 350-362. LU Bowei, MENG Shuxian, FENG Yaqing. Progress of fluorescent bio-probe based on water-soluble boron-dipyrromethene[J]. Chinese Journal of Organic Chemistry, 2018, 38(2): 350-362. (in Chinese) |
| [15] |
NIU S, ULRICH G, ZIESSEL R, et al. Water-soluble BODIPY derivatives[J]. Organic Letters, 2009, 11(10): 2049-2052. DOI:10.1021/ol900302n |
| [16] |
GUO Z, ZOU Y, HE H, et al. Bifunctional platinated nanoparticles for photoinduced tumor ablation[J]. Advanced Materials, 2016, 28(46): 10155-10164. DOI:10.1002/adma.201602738 |
| [17] |
WANG Z, IVANOV M, GAO Y, et al. Spin-orbit charge-transfer intersystem crossing (ISC) in compact electron donor-acceptor dyads: ISC mechanism and application as novel and potent photodynamic therapy reagents[J]. Chemistry-A European Journal, 2020, 26(5): 1091-1102. DOI:10.1002/chem.201904306 |
| [18] |
QIN Y, LIU X, JIA P, et al. BODIPY-based macrocycles[J]. Chemical Society Reviews, 2020, 49(16): 5678-5703. DOI:10.1039/C9CS00797K |
| [19] |
RUAN Z, MIAO W, YUAN P, et al. High singlet oxygen yield photosensitizer based polypeptide nanoparticles for low-power near-infrared light imaging-guided photodynamic therapy[J]. Bioconjugate Chemistry, 2018, 29(10): 3441-3451. DOI:10.1021/acs.bioconjchem.8b00576 |
| [20] |
SUN F, YANG G, ZHANG Q, et al. The self-assembly of monosubstituted BODIPY and HFBI-RGD[J]. RSC Advances, 2018, 8(38): 21472-21479. DOI:10.1039/C8RA03687J |
| [21] |
VANKAYALA R, HWANG K C. Near-infrared-light-activatable nanomaterial-mediated phototheranostic nanomedicines: An emerging paradigm for cancer treatment[J]. Advanced Materials, 2018, 30(23): 1706320-1706347. DOI:10.1002/adma.201706320 |
| [22] |
钮文杰. 含氮稠杂环有机小分子荧光化合物的合成及其性能研究[D]. 杭州: 浙江工业大学, 2020 NIU Wenjie. Synthesis and properties of nitrogencontaining condensed heterocyclic organic small molecule fluorescent compounds[D]. Hangzhou: Zhejiang University of Technology, 2020 (in Chinese) |
 2022, Vol. 39
2022, Vol. 39





