2. 西安交通大学能源动力与工程学院,西安 710049
2. School of Energy and Power Engineering, Xi'an Jiaotong University, Xi'an 710049, China
化石能源是目前全球消耗的最主要能源,2020年全球消耗的能源中,化石能源占比高达84.7%[1],各国都已意识到问题的严峻,但随着人类的不断开采,化石能源的枯竭是不可避免的,若不尽快增加非化石能源的开发,大部分化石能源本世纪将被开采殆尽。化石能源的使用过程中会产生大量温室气体CO2,威胁全球生态。在2020年9月联合国大会上,中国提出力争二氧化碳排放于2030年前达到峰值,努力争取2060年前实现碳中和[2]。同时,使用化石能源还可能有SO2、PM2.5等有污染的烟气排放,因而开发更清洁的可再生能源是今后发展的方向。
氢气(H2)具有能量密度高、来源范围广、环境友好等优点,可以通过直接燃烧或氢燃料电池释放能量,被认为是最理想的化石燃料替代品之一[3]。此外,在许多现代化学过程中,如Fischer-Tropsch反应和合成氨反应,H2都是一种重要的工业原料。因此,迫切需要在工业规模上以合理的成本建立一个可持续的、碳中和的、高效的H2生产系统[4]。
目前,氢气的主要来源有以下一些途径, 煤气化制氢、电解水制氢、太阳能制氢。煤气化制氢是指先将煤炭气化得到以H2和CO为主要成分的气态产品,然后经过CO变换和分离、提纯等处理而获得一定纯度的氢气[5]。但其消耗化石能源,会导致化石能源的枯竭,且存在污染严重等环保问题,不符合碳中和的理念。电解水制氢[6]是指在充满电解液的电解槽中通入直流电,水分子在电极上发生电化学反应,分解成H2和O2。该方法技术成熟,不产生污染,但缺点是运行过程中需要大量的电能,制氢的成本过高。太阳能催化制氢是指在光的照射下,通过催化剂利用光子能量,将水分解为H2和O2。太阳能具有取之不竭、洁净无污染、可再生等优点。由于人们越来越关注能源资源的减少和环境的恶化,太阳能已成为一种很有前景的化石燃料替代能源[7, 8]。因此,以水为原料,利用太阳能制氢则是从根本上解决能源及环境污染问题的理想途径之一。
太阳能制氢方法有光催化制氢、热化学制氢、光电化学制氢、生化制氢等。本论文主要从光催化的原理出发,系统介绍光催化太阳能制氢的3个关键步骤:光吸收、电荷分离和表面反应。对催化剂的选取以及各催化剂的作用机理做进一步解释。另外介绍多场耦合催化的优点以及目前催化剂的选择及优化方法。最后,对目前的挑战和未来的发展前景进行展望。
1 光催化制氢原理1972年,Fujishima和Honda[9]报道,在近紫外光照射下,TiO2电极分解水产生氢气,为后续光催化的研究打下了坚实的基础。1995年,Hoffman[10]以常见的光催化剂TiO2为例,总结了光催化反应的基元过程。用反应式(1)~(8)式表示,见表 1。
| 过程 | 分子式 | 状态 | 序号 |
| 光生电子-空穴对的产生 | TiO2+hv→hvb++ecb- | fs | (1) |
| 载流子迁移到颗粒表面并被捕获 | hvb++>TiⅣOH |
快10 ns | (2) |
| ecb-+>TiⅣOH |
浅层捕获(100 ps) | (3) | |
| ecb-+>TiⅣ→>TiⅢ | 深层捕获(10 ns) | (4) | |
| 自由载流子与被捕获的载流子的重新结合 | ecb-+[>TiⅣOH·]+→>TiⅣOH | 慢(100 ns) | (5) |
| hvb++[>TiⅢOH·] →>TiⅣOH | 快(10 ns) | (6) | |
| 界面间电荷转移,发生氧化还原反应 | [>TiⅣOH·]++Red→>TiⅣOH+Red·+ | 慢(100 ns) | (7) |
| etr-+Ox→>TiⅣOH+Ox·- | 很慢(ms) | (8) |
式(8)中,>TiⅣOH表示TiO2的表面羟基官能团;ecb-表示导带电子;etr-为被捕获的导带电子;hvb+为价带空穴;Red为电子给体(还原剂);Ox为电子受体(氧化剂);[>TiⅣOH ·]+是在颗粒表面捕获价带空穴后的形式;[>TiⅢOH]是颗粒表面捕获导带电子后的形式;反应式后标注的时间是通过激光脉冲光解实验测定的每一步骤的特征时间。
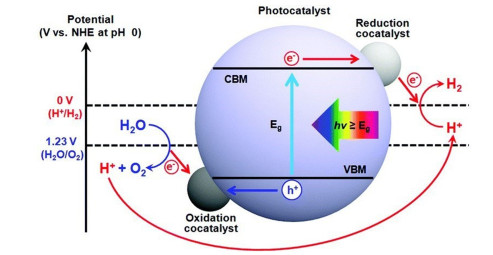
根据该组基元反应,光催化过程可分为以下3大过程:光吸收、载流子分离、表面反应。根据固体的能带理论,当入射光子的能量大于半导体光催化剂的带隙时,电子可以从价带(VB)激发到导带(CB),分别在VB和CB中产生空穴和电子。具有氧化能力的空穴能与水中的OH-反应生成O2,而具有还原能力的电子能与氢离子反应生成H2[11]。图 1是描述半导体光催化剂上水分解的基本原理的示意图。空穴和电子的氧化还原能力由VB和CB的相对位置决定。当光催化剂的CB最小值比H+/H2的氧化还原电位更负(0 V vs. NHE, pH=0),VB最大值比O2/H2O的氧化还原电位更正(1.23 V vs. NHE, pH=0)时,光催化水分解在热力学角度才是可行的[12]。
迄今为止,光催化过程中常用的光催化剂有贵金属、金属氧化物(如TiO2[9]、SrTiO3[13]、BiVO4[14])、金属硫化物(CdS[15]、ZnIn2S4[16])、g-C3N4[17]和金属有机框架MOFs[18]等。从利用太阳光的效率来看,上述催化剂光吸收范围较窄,主要吸收紫外区的能量,太阳光利用率低。另外金属氧化物和金属硫化物电子空穴分离能力弱且存在光腐蚀的问题,导致光催化制氢活性低。因此,对传统光催化剂的改性是必须的。目前影响催化剂效率的因素有比表面积小、光吸收能力弱、禁带宽度较宽、载流子迁移能力弱等。为了克服上述缺点,需要对催化剂的设计做进一步的研究。
2 光催化材料的优化设计 2.1 提高催化材料比表面积催化剂的比表面积大,表明催化活性中心多;晶粒尺寸小,对反应物和产物的传质以及反应热的扩散有利。获得高比表面积的途径其一是制备纳米粒子,其二是构筑多孔晶体。
2.1.1 纳米粒子提高表面活性催化剂粒子的尺寸越小,比表面积越高,表面原子数大幅增加,暴露的活性位点也显著增多,这大大增强了纳米粒子的表面效应。例如Tojo[20]等用水/乙二醇为溶剂,合成了组氨酸修饰的CdS(hi/CdS)复合纳米粒子。在100%水为溶剂下,制备的hi/CdS(A)粒径为42.3 nm,比表面积为3.76 m2 ·g-1。在100%乙二醇为溶剂下,制备的hi/CdS(B)粒径为10.1 nm,比表面积为23.62 m2 ·g-1。使用0.3% Pt(质量分数)作为助催化剂,hi/CdS(A)和hi/CdS(B)的产氢量分别为200和600 μmol ·g-1 ·h-1。此类案例很多。催化剂的纳米化会显著提高比表面积,增加催化活性中心数目,进而促使产氢率提高。
2.1.2 多孔晶体提高表面活性由于制备方法、团聚问题的限制,仅将催化剂纳米化对产氢率的提高效果并不显著。近期通过引入金属-有机框架材料(MOF)[18]、共价有机框架材料(COF)[21]及沸石咪唑酯骨架结构材料(ZIF) 等[22]多孔晶体材料作为催化剂的载体,对提高比表面积和产氢率具有显著效果。
多孔晶体材料具有明确的、有序的二维(2D)或三维(3D)框架结构,具有较高的比表面积,规整有序的孔结构和易于功能化等优点,特别适用于作为催化剂的载体,稳定纳米粒子、提高反应物和产物的扩散效率。
Mao等[23]通过溶剂热法合成了UIOS-CdS复合材料。UIO-66/CdS0.7的比表面积为447.2 m2 ·g-1,是2.1.1中hi/CdS(B)的19倍,测得UiOS-CdS0.7产氢量为15 320 μmol ·g-1 ·h-1。多孔晶体材料的高比表面积、高孔隙率使得催化活性位点暴露,并促进反应物/产物的输运。
可见,利用多孔晶作为催化剂的载体,将催化材料纳米化构成复合材料,可充分发挥2者的优势,有效防止纳米粒子团聚,大幅提高活性位点数,增强表面活性,提高传质效率,促使产氢率提高。
2.2 扩展半导体的光吸收波长太阳能光谱由5%的紫外光、42%~45%的可见光和50%的近红外光组成。目前光催化材料主要吸收紫外区的能量,可见和红外区的能量利用率低。如何将光催化剂的光吸收从紫外区扩展到可见光区,甚至红外区,是光催化制氢工业化应用目前面临的一大难题。为此,发展出了各种以拓展可见光吸收为目标的研究策略。
2.2.1 敏化材料掺杂扩展吸收波长敏化剂有较高的光吸收效率及较宽的吸收带,通常分子中含有共轭体系,能够吸收可见、红外光。敏化剂吸收光能跃迁至激发态,然后将激发态上的电子传递给催化剂导带,促进催化剂与活性物种的反应,从而达到扩展吸收波长的目的。
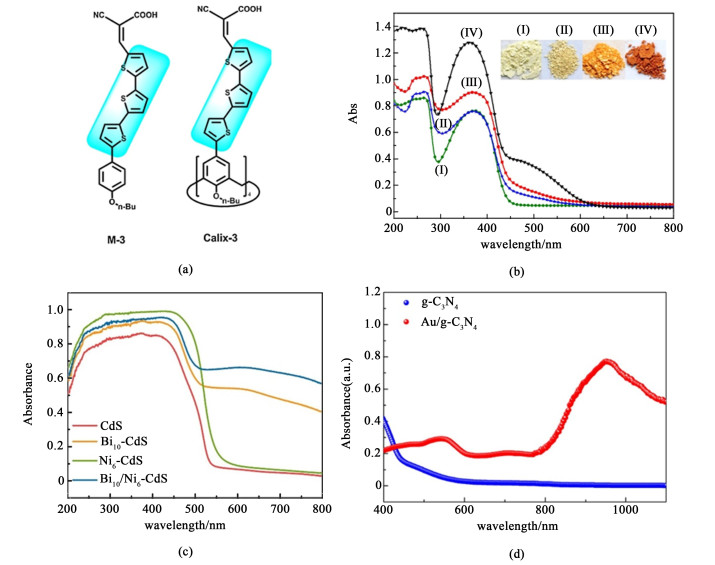
有机敏化剂容易吸附在某些表面具有大量羧基或氨基官能团的MOFs上。例如,Chen等[24]将锥形芳烃基[图 2(a)]吸附到UiO-66-NH2上,在Pt作助催化剂的条件下,得到了一种对可见光响应的MOFs光催化制氢材料,由图 2(b)中可看出吸收峰发生红移,有效地扩大了光催化剂的光谱响应范围并提高吸光强度,使其产氢能力最高可达1 528 μmol ·g-1 ·h-1。
|
| 图 2 (a) 锥形芳烃基结构图;(b) (Ⅰ)UiO-66-NH2-1 (Ⅱ)Pt@UiO-66-NH2-1 (Ⅲ)M-3/Pt@UiO-66-NH2-1和(Ⅳ) Calix-3/Pt@UiO-66-NH2-1的吸收波长曲线[24];(c) Bi10/Ni6-CdS的紫外-可见光谱图[25];(d) Au NRs/g-C3N4可见-近红外光谱图[26] Fig.2 (a)Structures of M-3 and Calix-3; (b) UV-vis diffraction spectra of (Ⅰ)UiO-66-NH2-1 (Ⅱ)Pt@UiO-66-NH2-1 (Ⅲ)M-3/Pt@UiO-66-NH2-1 and (Ⅳ) Calix-3/Pt@UiO-66-NH2-1[24]; (c) ultraviolet-visible spectrum of Bi10/Ni6-CdS[25]; (d) visible-NIR spectrum of Au NRs/g-C3N4[26] |
| |
根据能带理论,当入射光的能量等于或大于半导体的禁带宽度时,价带上的电子e-会被激发跃迁至导带,同时在价带上产生相应的空穴h+。实践中常通过元素掺杂产生一定的杂质能级来调节禁带宽度,以达到扩展吸收波长的效果。
Lv等[25]将Bi和Ni元素掺杂在CdS中,可以将硫化镉的带隙从2.2 eV缩小到1.5 eV。紫外可见光谱图如图 2(c)所示,Bi10-CdS样品在可见光照射下(λ>600 nm)表现出明显的尾部吸收。此外,Bi10/Ni6-CdS显示出比Bi10-CdS更高的可见光吸收率。Bi10/Ni6-CdS的产氢量为5 294.4 μmol ·g-1 ·h-1,比CdS产氢量高20倍。
2.2.3 表面等离子体效应扩展吸收波长近年来,有研究组利用表面等离子体效应来拓展光谱吸收范围,也取得了一定的成效。等离子体是一种部分电离的气体,由电子、离子、分子、自由基、光子和受激物质组成。等离子体物种的反应性、非平衡状态增强了与等离子体物种接触的表面的反应性[27]。等离子体已广泛应用于催化剂表面空位、缺陷、掺杂和粗糙表面的产生、活性位点的增加以及表面官能团的修饰。
Tian等[26]在g-C3N4中引入了Au纳米棒,Au的表面等离子体共振效应将热电子注入g-C3N4,带隙能量值从g-C3N4的2.71 eV下降到Au NRs/g-C3N4的1.90 eV,可见-近红外光谱图如图 2(d)所示。Au NRs/g-C3N4在可见光下产氢量为350.6 μmol ·g-1 ·h-1,在近红外光下产氢量为63.1 μmol ·g-1 ·h-1。表面等离子体共振效应实现了Au NRs/g-C3N4异质结构的近红外光催化制氢活性。
总的来说,扩展吸收波长可以采用敏化材料掺杂、元素掺杂、表面等离子体效应等方法。敏化材料掺杂和元素掺杂扩展波长进展目前仍停留在可见光区域,但在制氢产率方面,敏化材料掺杂和元素掺杂仍占有一定的优势。而近些年新兴起的表面等离子体已扩展波长至近红外区域,但近红外区域的制氢产率不高。提高近红外区域能量利用率,实现太阳光全光谱制氢,是科研人员努力的目标。
2.3 提高迁移效率提高载流子迁移效率也是提高光催化效率的一个关键问题,抑制电子空穴的复合是提高载流子迁移效率的关键。目前主要解决电子空穴复合的方法有:1)复合材料形成异质结,来促进电子空穴的分离;2)加入助催化剂来促进电子空穴的分离;3)复合高导电性材料提高迁移效率。
2.3.1 复合材料形成异质结当p型半导体和n型半导体紧密接触时,会形成“结”,在结的两侧由于其能带等性质的不同会形成空间电势差。这种空间电势差的存在有利于电子空穴的分离,可提高催化效率。异质结分为p-n型和Z型等。
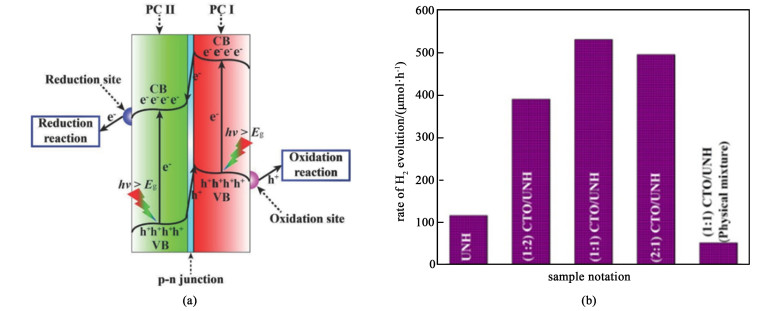
p-n异质结型光催化体系如图 3(a)所示,光催化剂Ⅰ(PC Ⅰ)的CB中的光生电子迁移到光催化剂Ⅱ(PC Ⅱ)的CB,而PC Ⅱ的VB中的光生空穴移动到PC Ⅰ的VB。光生电子和空穴在空间上被隔离,这极大地抑制了它们的复合。由于PC Ⅰ的VB电位比PC Ⅱ的更正,PC Ⅱ的CB电位比PC Ⅰ的更负,光生电子和空穴的氧化还原能力在电荷转移后减弱[28, 29]。
Subudhi等[30]通过水热法制备了一系列稳定高效的CoTiO3/UiO-66-NH2 p-n异质结多相光催化剂。在可见光的照射下,电子从p-CTO流向n-UNH发生还原反应,空穴从n-UNH流向p-CTO发生氧化反应。(1 ∶1)CTO/UNH的产氢量为530.87 μmol ·h-1,不同比例产氢量如图 3(b)所示。结论表明p-n异质结增加了光生载流子的寿命,并为氧化还原反应提供了不同的反应位点,提高了载流子迁移效率。
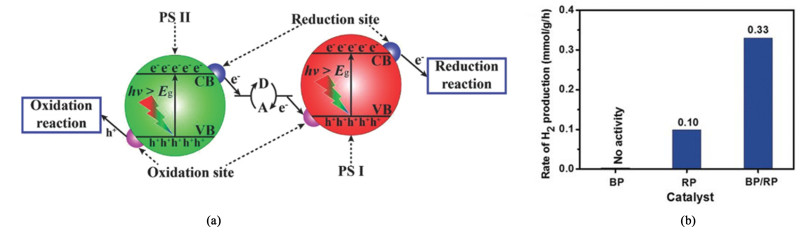
Z型异质结光催化体系如图 4(a)所示,PS Ⅰ和PS Ⅱ的VB留下光生空穴,电子被激发到PS Ⅰ和PS Ⅱ的CB上。PS Ⅰ VB处的激发态电子有很强的还原能力,PS Ⅱ CB上的光生空穴有很强的氧化能力,同时PS Ⅰ VB的空穴和PS Ⅱ CB上的电子在导电介质上湮灭。Z型光催化体系对PS Ⅰ和PS Ⅱ的能隙有一定要求,PS Ⅱ的CB必须要比PS Ⅰ的VB低,同时两者的CB、VB要有一定范围的落差。Z型异质结体系实现光生载流子的有效空间分离,同时有较强的氧化还原能力,从而大幅度提高光催化剂的催化活性[31, 32]。
Liu等[33]通过湿化学方法制备了一种黑磷(BP)/红磷(RP)异质结光催化剂,RP和BP的VB留下光生空穴,电子被激发到RP和BP的CB上。在BP VB处的发生还原反应,RP CB处发生氧化反应,同时BP VB的空穴和SP CB上的电子发生湮灭。BP/RP的产氢量为0.33 mmol ·g-1 ·h-1,如图 4(b)所示。由于Z型结交错排列的适当能带结构和完美的相位结界面,实现了光生载流子的有效分离和转移,同时促进了氧化还原反应。
2.3.2 助催化剂提高迁移效率助催化剂常作为氧化或还原的活性中心,降低氧化或还原的过电位,促进电子空穴分离,抑制光腐蚀,促进光催化反应迁移效率的提高[11, 34]。常见的助催化剂有贵金属如Pt、Pd、Ru、Rh、Au和Ir等;氧化物如RuO2和NiO等;硫化物如MoS2、WS2和PdS等;碳基材料如碳量子点、碳纳米管和石墨烯等;模拟氢化酶等。
2.3.2.1 贵金属Mao等[35]通过2种方法成功合成了一种新型光催化剂:通过静电引力将金纳米粒子和UIOS结合起来,然后通过溶剂热法将ZnIn2S4包裹在多孔膜上,得到空间电荷分离结构Au4@UiOS@ZIS40。Au纳米粒子被硫醇吸附,对光催化反应产生协同作用。电荷空间分离结构有利于电子从ZnIn2S4转移到UiOS上,然后再转移到Au纳米粒子上,其中UiOS在其中起着重要的电荷传递作用,位于孔隙中的Au纳米粒子作为助催化剂能显著缩短电荷转移距离,迅速接受电子,提高催化效率。
2.3.2.2 氧化物Soumya等[36]研究InGaO3(ZnO)m(m=1~4)的制氢性能,同时分别用NiO和CuO作为助催化剂来促进电子空穴的分离。在使用NiO作助催化剂后,光催化活性提高了1倍。而在使用CuO作助催化剂时,催化效果并不明显,反而因为CuO窄的禁带宽度,扩展了光催化吸收波长。
2.3.2.3 硫化物Wei等[37]通过水热法合成了TiO2-NiSx杂化材料,研究了NiSx在不同含量下的光催化析氢性能。当使用甲醇作为牺牲剂时,TiO2-NiSx-3%显示出最高的光催化能力,与纯TiO2相比,产氢量为981.59 μmol ·g-1 ·h-1,比TiO2高约20倍。其中助催化剂可以加速电子从TiO2导带转移到NiSx,改善电子迁移效率。
2.3.2.4 碳基材料Wang等[38]将石墨烯(GO)与UiO-66-NH2复合,在高效的TEOA-ErB体系中,进行光催化制氢。可见光被染料敏化的UiO-66-NH2吸收后,光生电子由染料分子转移至UiO-66-NH2中,再转移至石墨烯上,最终在Pt纳米颗粒上产生H2,其中50wt%石墨烯包覆的UiO-66-NH2产氢率可达41.4 mmol ·g-1 ·h-1。石墨烯作为助催化剂,使电子空穴更好的分离,提高了电子的迁移效率。
2.3.2.5 模拟氢化酶氢化酶是能够有效催化质子可逆还原为分子氢的天然酶,在许多微生物中具有显著的活性。氢化酶可以用作助催化剂,与半导体结合用于光催化制氢。许多研究小组致力于开发模拟氢化酶催化中心的小型有机金属分子催化剂。如[Fe][39]、[FeFe][40, 41]、[NiFe][42]、[Mn][43]有机配合物等。Katerina等[40]以CrHydA1[FeFe]模拟物作为助催化剂、CDs作为电子给体进行光催化制氢反应。该体系在420 nm处达到1.7%的量子效率,产氢量为1.73 μmol ·mg-1 ·min-1,且在氧化还原介体存在下的稳定性非常好。
3 多场耦合提高催化效率除了光催化的内在驱动力之外,产生增强效应的外场可以向光催化系统提供额外的能量,作为分离电子空穴的额外推动力,从而提高整体催化效率[44]。表 2列举了目前采取的多场耦合催化制氢的样例,主要有光电耦合、光热耦合以及光热电耦合等方法。
| Strategy | Catalyst | Solution | Light source | Temperature/℃ | H2 evolution rate/(μmol·h-1·g-1) | Current density/(mA·cm-2) | Ref. |
| Photocatalytic | CoTiO3@UIO-66-NH2 | Water | 300 W xenon lamp, λ>420 nm | 25 | 530.87 | [30] | |
| Photocatalytic | Au4@UIOS@ZIS40 | Water | 300 W xenon lamp, λ>420 nm | 25 | 391.6 | [35] | |
| Photocatalytic | CoO | Water | AM 1.5 | 25 | 336.73 | [45] | |
| Photothermal catalysis | Wood/CoO | Water | AM 1.5 | 52 | 5 776.04 | [46] | |
| Photoelectro catalysis | Fh/BiVO4 Photoanode | 0.1 mol·L-1 KH2PO4/K2HPO4 | AM 1.5 | 25 | 1.42 (at 1.23 V vs. RHE) | [47] | |
| Photoelectro catalysis | BiVO4/CoFe-NiOOH photoanodes | 0.5 mol·L-1 Na2SO4 | AM 1.5 | 25 | 1.54 (at 1.23 V vs. RHE) | [48] | |
| Photothermal-promoted electrocatalysis | Co(OH)2/C photoanodes | 1.0 mol·L-1 KOH | λ>630 nm | 33 | 2.62 (at 1.65 V vs. RHE) | [49] | |
| Photothermal-promoted electrocatalysis | MoS2/C | 0.5 mol·L-1 H2SO4 | λ>630 nm | 36.9 | -8.62 (at -0.65 V vs. RHE) | [49] |
光电耦合催化制氢包括光电催化制氢(PEC)以及光伏-电解催化制氢(PVEC)[50]。PEC是在光照和外加电场的作用下,空穴(或电子)迁移到阳极(或阴极)表面,参与水的氧化(或还原)反应,从而提高催化效率的方式。PVEC是利用光伏设备产生电能,通过电催化来进行制氢的方式。在这2种方式中,电极的性能对于催化效率的提高至关重要。光电极的研究目前主要集中在光催化剂的改性、电极材料的筛选以及探索如何将其组装成高效使用的光电极。各种n型金属氧化物半导体(TiO2,WO3,Fe2O3和BiVO4等)是实用光阳极的候选材料[51],但它们具有宽带隙和导电性差的缺点。针对以上2个问题,可以对催化剂进行掺杂助催化剂以及表面钝化等方法来解决。
高铁酸盐(Fh)是提高光阳极性能的有效表面改性剂,Yin等[47]用时间分辨光谱技术研究了Fh负债在BiVO4上的水氧化作用。结果表明,Fh钝化了BiVO4中的表面态,导致BiVO4中空穴的寿命比纯BiVO4增加了2.4倍。瞬态吸收光谱表明,Fh表面缺陷的钝化效应延迟了BiVO4的电子/空穴复合,进一步提高了催化效率。
Fang等[48]通过使用CoFe-NiOOH作为三元多金属表面析氧助催化剂来改善BiVO4光阳极的PEC性能。BiVO4/CoFe-NiOOH光阳极降低了光生载流子的复合速率。CoFe-NiOOH提供了更多的俘获位点和活性位点,增强了电荷分离和传输特性。
3.2 光热耦合催化制氢目前太阳能制氢的主要挑战为从紫外到红外的整个太阳光谱的利用。光热耦合催化同时利用光能和热能2大反应推动力,以此产生的协同效应来增强反应效率。而其中光效应可以降低在反应条件下所需的反应温度和压力。热效应可以促进反应的热力学和动力学,以此来克服光和热催化的缺点,解决相关的难题。
根据光热催化材料作用方式的不同,光热协同作用可分为2类,一类是光和热分别作用于光催化剂和热催化剂,然后通过材料的耦合产生协同作用[52]。另一类是光、热同时作用于双功能催化剂产生光热协同作用[53]。Guo等[46]使用木材基底搭载CoO,在AM 1.5 (100 mW ·cm-2)光照强度下进行光热催化制氢,H2析出率为5776 μmol ·h-1 ·g-1,比单纯使用CoO进行光催化产氢量高17倍[45]。该方法通过光照木材基底将液态水转化为水蒸气,形成蒸汽/光催化剂/氢气的双相界面,显著降低了界面势垒,并显著降低氢气传输阻力2个数量级。
3.3 光热电耦合催化制氢PTPE(photothermal-promoted electrocatalysis)制氢是通过结合光吸收材料和电催化剂实现的。前者从光子收集和聚集热量,以提高电催化剂的局部温度。较高的温度促进了电催化剂上发生反应的热力学和动力学[49]。PTPE面临的挑战在于开发光响应强、良好的导热和导电材料。
Gu等[54]首先通过水热法合成Ni(OH)2纳米粒子,然后通过H2/Ar(含有3%的H2)气氛在500 ℃下还原Ni(OH)2/RGO 5 h,得到Ni/RGO复合物。在黑暗和光照的情况下,研究了Ni/RGO的HER电催化活性。在Ni/RGO体系中,通过光照促进了反应的热力学和动力学。
Qi等[49]通过界面张力诱导收缩法[55]来合成碳纳米球,并将Co(OH)2和MoS2分别与碳纳米球一起作为析氧反应(OER)和析氢反应(HER)的电催化剂。碳纳米球在光照下会吸收大量的热,由于被光加热的碳的局部温度升高,这2种杂化物在光照射下电催化活性增强。同时进行周期性实验发现在黑暗情况下电催化活性减弱,证明了光热可以促进催化活性的增强。
4 结论从1972年光催化分解水被发现到如今,研究人员已经研发了多种半导体光催化剂,对光催化机理的理解也更加深入。
光催化剂的纳米化以提高比表面、增强催化活性;有效拓展催化剂的光谱范围和光吸收性能;多渠道抑制光生电子和空穴的复合是改善催化剂性能的核心要素。
目前虽然对多场耦合催化制氢做了一定的探索,但距离高效太阳能催化的实际应用仍有很大差距。需更加深入了解催化剂微观结构-活性关系和电荷载体的动力学;理解多场过程中电子、光子、声子等的耦合作用机制;理解界面电子的反应与多相多组分微观传递的作用机制。
| [1] |
中华人民共和国国务院新闻办公室. 新时代的中国能源发展: (2020年12月)[N]. 人民日报, 2020-12-22(10)
|
| [2] |
习近平. 在第七十五届联合国大会一般性辩论上的讲话[J]. 中华人民共和国国务院公报, 2020(28): 5-7. XI Jinping. Statement at the general debate of the 75th session of the united nations general assembly[J]. Gazette of the State Council of the People's Republic of China, 2020(28): 5-7. (in Chinese) |
| [3] |
ZHANG G, LAN Z, WANG X. Conjugated polymers: Catalysts for photocatalytic hydrogen evolution[J]. Angewandte Chemie International Edition, 2016, 55(51): 15712-15727. DOI:10.1002/anie.201607375 |
| [4] |
YOUNG J, STEINER M A, DÖSCHER H, et al. Direct solar-to-hydrogen conversion via inverted metamorphic multi-junction semiconductor architectures[J]. Nature Energy, 2017. DOI:10.1038/nenergy.2017.28 |
| [5] |
FAN L, LI F, RAMKUMAR S. Utilization of chemical looping strategy in coal gasification processes[J]. Particuology, 2008, 6(3): 131-142. DOI:10.1016/j.partic.2008.03.005 |
| [6] |
CHI J, YU H. Water electrolysis based on renewable energy for hydrogen production[J]. Chinese Journal of Catalysis, 2018, 39(3): 390-394. DOI:10.1016/S1872-2067(17)62949-8 |
| [7] |
BARBER J. Photosynthetic energy conversion: Natural and artificial[J]. Chemical Society Reviews, 2009, 38(1): 185-196. DOI:10.1039/B802262N |
| [8] |
LEWIS N S. Toward cost-effective solar energy use[J]. Science, 2007, 315(5813): 798-801. DOI:10.1126/science.1137014 |
| [9] |
FUJISHIMA A, HONDA K. Electrochemical photolysis of water at a semiconductor electrode[J]. Nature, 1972, 238(5358): 37-38. DOI:10.1038/238037a0 |
| [10] |
HOFFMANN M R, MARTIN S T, CHOI W, et al. Environmental applications of semiconductor photocatalysis[J]. Chemical Reviews, 1995, 95(1): 69-96. DOI:10.1021/cr00033a004 |
| [11] |
RAN J, ZHANG J, YU J, et al. Earth-abundant cocatalysts for semiconductor-based photocatalytic water splitting[J]. Chemical Society Reviews, 2014, 43(22): 7787-7812. DOI:10.1039/C3CS60425J |
| [12] |
YUAN Y, CHEN D, YU Z, et al. Cadmium sulfide-based nanomaterials for photocatalytic hydrogen production[J]. Journal of Materials Chemistry A, 2018, 6(25): 11606-11630. DOI:10.1039/C8TA00671G |
| [13] |
WAGNER F T, SOMORJAI G A. Photocatalytic hydrogen production from water on Pt-free SrTiO3 in alkali hydroxide solutions[J]. Nature, 1980, 285(5766): 559-560. DOI:10.1038/285559a0 |
| [14] |
KUDO A, HIJⅡ S. H2 or O2 Evolution from aqueous solutions on layered oxide photocatalysts consisting of Bi3+with 6s2 configuration and d0 transition metal ions[J]. Chemistry Letters, 1999, 28(10): 1103-1104. DOI:10.1246/cl.1999.1103 |
| [15] |
SHI J, SUN D, ZOU Y, et al. Trap-level-tunable Se doped CdS quantum dots with excellent hydrogen evolution performance without co-catalyst[J]. Chemical Engineering Journal, 2019, 364: 11-19. DOI:10.1016/j.cej.2019.01.147 |
| [16] |
SHANG L, ZHOU C, BIAN T, et al. Facile synthesis of hierarchical ZnIn2S4 submicrospheres composed of ultrathin mesoporous nanosheets as a highly efficient visible-light-driven photocatalyst for H2 production[J]. Journal of Materials Chemistry A, 2013. DOI:10.1039/C3TA01685D |
| [17] |
ZHANG L, LIU Q, CHAI Y, et al. Facile construction of phosphate incorporated graphitic carbon nitride with mesoporous structure and superior performance for H2 production[J]. International Journal of Hydrogen Energy, 2018, 43(11): 5591-5602. DOI:10.1016/j.ijhydene.2018.01.185 |
| [18] |
JAMES S L. Metal-organic frameworks[J]. Chemical Society Reviews, 2003. DOI:10.1039/B200393G |
| [19] |
WANG Z, LI C, DOMEN K. Recent developments in heterogeneous photocatalysts for solar-driven overall water splitting[J]. Chemical Society Reviews, 2019, 48(7): 2109-2125. DOI:10.1039/C8CS00542G |
| [20] |
TOJO F, ISHIZAKI M, KUBOTA S, et al. Histidine decorated nanoparticles of CdS for highly efficient H2 production via water splitting[J]. Energies, 2020. DOI:10.3390/en13143738 |
| [21] |
FENG X, DING X, JIANG D. Covalent organic frameworks[J]. Chemical Society Reviews, 2012. DOI:10.1039/c2cs35157a |
| [22] |
YAO J, WANG H. Zeolitic imidazolate framework composite membranes and thin films: Synthesis and applications[J]. Chemical Society Reviews, 2014, 43(13): 4470-4493. DOI:10.1039/C3CS60480B |
| [23] |
MAO S, ZOU Y, SUN G, et al. Thio linkage between CdS quantum dots and UiO-66-type MOFs as an effective transfer bridge of charge carriers boosting visible-light-driven photocatalytic hydrogen production[J]. Journal of Colloid and Interface Science, 2021, 581: 1-10. DOI:10.1016/j.jcis.2020.07.121 |
| [24] |
CHEN Y, TAN L, LIU J, et al. Calix[J]. Applied Catalysis B: Environmental, 2017, 206: 426-433. DOI:10.1016/j.apcatb.2017.01.040 |
| [25] |
LV Z, LI W, CHENG X, et al. Constructing internal electric field in CdS via Bi, Ni co-doping strategy for enhanced visible-light H2 production[J]. Applied Surface Science, 2021. DOI:10.1016/j.apsusc.2021.149758 |
| [26] |
TIAN H, LIU X, LIANG Z, et al. Gold nanorods/g-C3N4 heterostructures for plasmon-enhanced photocatalytic H2 evolution in visible and near-infrared light[J]. Journal of Colloid and Interface Science, 2019, 557: 700-708. DOI:10.1016/j.jcis.2019.09.075 |
| [27] |
WANG Z, ZHANG Y, NEYTS E C, et al. Catalyst preparation with plasmas: How does it work?[J]. ACS Catalysis, 2018, 8(3): 2093-2110. DOI:10.1021/acscatal.7b03723 |
| [28] |
LO S S, MIRKOVIC T, CHUANG C H, et al. Emergent properties resulting from type-Ⅱ band alignment in semiconductor nanoheterostructures[J]. Advanced Materials, 2011, 23(2): 180-197. DOI:10.1002/adma.201002290 |
| [29] |
ZHOU P, YU J, JARONIEC M. All-solid-state Z-scheme photocatalytic systems[J]. Advanced Materials, 2014, 26(29): 4920-4935. DOI:10.1002/adma.201400288 |
| [30] |
SUBUDHI S, PARAMANIK L, SULTANA S, et al. A type-Ⅱ interband alignment heterojunction architecture of cobalt titanate integrated UiO-66-NH2: A visible light mediated photocatalytic approach directed towards Norfloxacin degradation and green energy (Hydrogen) evolution[J]. Journal of Colloid and Interface Science, 2020, 568: 89-105. DOI:10.1016/j.jcis.2020.02.043 |
| [31] |
LUO J, WANG Z, JIANG H, et al. Localized building titania-graphene charge transfer interfaces for enhanced photocatalytic performance[J]. Langmuir, 2020, 36(17): 4637-4644. DOI:10.1021/acs.langmuir.0c00297 |
| [32] |
WANG Y, SUZUKI H, XIE J, et al. Mimicking natural photosynthesis: Solar to renewable H2 fuel synthesis by Z-scheme water splitting systems[J]. Chemical Reviews, 2018, 118(10): 5201-5241. DOI:10.1021/acs.chemrev.7b00286 |
| [33] |
LIU F, SHI R, WANG Z, et al. Direct Z-scheme hetero-phase junction of black/red phosphorus for photocatalytic water splitting[J]. Angewandte Chemie, 2019, 131(34): 11917-11921. DOI:10.1002/ange.201906416 |
| [34] |
HARA M, NUNOSHIGE J, TAKATA T, et al. Unusual enhancement of H2 evolution by Ru on TaON photocatalyst under visible light irradiation[J]. Chemical Communications (Cambridge, England), 2003(24): 3000-3001. DOI:10.1039/b309935k |
| [35] |
MAO S, SHI J, SUN G, et al. Au nanodots@thiol-UiO66@ZnIn2S4 nanosheets with significantly enhanced visible-light photocatalytic H2 evolution: The effect of different Au positions on the transfer of electron-hole pairs[J]. Applied Catalysis B: Environmental, 2021, 282. DOI:10.1016/j.apcatb.2020.119550 |
| [36] |
NARENDRANATH S B, THEKKEPARAMBIL S V, GEORGE L, et al. Photocatalytic H2 evolution from water-methanol mixtures on InGaO3(ZnO)m with an anisotropic layered structure modified with CuO and NiO cocatalysts[J]. Journal of Molecular Catalysis A: Chemical, 2016, 415: 82-88. DOI:10.1016/j.molcata.2016.01.018 |
| [37] |
WEI Y, CHENG G, XIONG J, et al. Synergistic impact of cocatalysts and hole scavenger for promoted photocatalytic H2 evolution in mesoporous TiO2NiSx hybrid[J]. Journal of Energy Chemistry, 2019, 32: 45-56. DOI:10.1016/j.jechem.2018.05.013 |
| [38] |
WANG Y, YU Y, LI R, et al. Hydrogen production with ultrahigh efficiency under visible light by graphene well-wrapped UiO-66-NH2 octahedrons[J]. J Mater Chem A, 2017, 5(38): 20136-20140. DOI:10.1039/C7TA06341E |
| [39] |
SHIMA S, ERMLER U. Structure and function of[J]. European Journal of Inorganic Chemistry, 2011, 2011(7): 963-972. DOI:10.1002/ejic.201000955 |
| [40] |
HOLÁ K, PAVLIUK M V, NÉMETH B, et al. Carbon dots and[J]. ACS Catalysis, 2020, 10(17): 9943-9952. DOI:10.1021/acscatal.0c02474 |
| [41] |
CASTNER A T, JOHNSON B A, COHEN S M, et al. Mimicking the electron transport chain and active site of[J]. Journal of the American Chemical Society, 2021, 143(21): 7991-7999. DOI:10.1021/jacs.1c01361 |
| [42] |
BRAZZOLOTTO D, GENNARI M, QUEYRIAUX N, et al. Nickel-centred proton reduction catalysis in a model of[J]. Nature Chemistry, 2016, 8(11): 1054-1060. DOI:10.1038/nchem.2575 |
| [43] |
PAN H, HUANG G, WODRICH M D, et al. A catalytically active[J]. Nature Chemistry, 2019, 11(7): 669-675. DOI:10.1038/s41557-019-0266-1 |
| [44] |
LI X, WANG W, DONG F, et al. Recent advances in noncontact external-field-assisted photocatalysis: From fundamentals to applications[J]. ACS Catalysis, 2021, 11(8): 4739-4769. DOI:10.1021/acscatal.0c05354 |
| [45] |
ZHAN X, WANG Z, WANG F, et al. Efficient CoO nanowire array photocatalysts for H2 generation[J]. Applied Physics Letters, 2014. DOI:10.1063/1.4898681 |
| [46] |
GUO S, LI X, LI J, et al. Boosting photocatalytic hydrogen production from water by photothermally induced biphase systems[J]. Nature Communications, 2021. DOI:10.1038/s41467-021-21526-4 |
| [47] |
YIN H, LI D, WANG X, et al. Surface passivation effect of ferrihydrite with hole-storage ability in water oxidation on BiVO4 photoanode[J]. The Journal of Physical Chemistry C, 2021, 125(15): 8369-8375. DOI:10.1021/acs.jpcc.1c02369 |
| [48] |
FANG G, LIU Z, HAN C, et al. Promising CoFe-NiOOH ternary polymetallic cocatalyst for BiVO4-based photoanodes in photoelectrochemical water splitting[J]. ACS Applied Energy Materials, 2021, 4(4): 3842-3850. DOI:10.1021/acsaem.1c00247 |
| [49] |
QI J, ZHANG W, CAO R. A new strategy for solar-to-hydrogen energy conversion: Photothermal-promoted electrocatalytic water splitting[J]. ChemElectroChem, 2019, 6(10): 2762-2765. DOI:10.1002/celc.201900530 |
| [50] |
KIM J H, HANSORA D, SHARMA P, et al. Toward practical solar hydrogen production-an artificial photosynthetic leaf-to-farm challenge[J]. Chemical Society Reviews, 2019, 48(7): 1908-1971. DOI:10.1039/C8CS00699G |
| [51] |
SIVULA K, van de KROL R. Erratum: Semiconducting materials for photoelectrochemical energy conversion[J]. Nature Reviews Materials, 2016. DOI:10.1038/natrevmats.2016.10 |
| [52] |
LI Y, HUANG J, PENG T, et al. Photothermocatalytic synergetic effect leads to high efficient detoxification of benzene on TiO2 and Pt/TiO2 nanocomposite[J]. ChemCatChem, 2010, 2(9): 1082-1087. DOI:10.1002/cctc.201000085 |
| [53] |
FANG S, LI Y, YANG Y, et al. Mg-doped OMS-2 nanorods: A highly efficient catalyst for purification of volatile organic compounds with full solar spectrum irradiation[J]. Environmental Science: Nano, 2017, 4(9): 1798-1807. DOI:10.1039/C7EN00567A |
| [54] |
GU L, ZHANG C, GUO Y, et al. Enhancing electrocatalytic water splitting activities via photothermal effect over bifunctional nickel/reduced graphene oxide nanosheets[J]. ACS Sustainable Chemistry & Engineering, 2019, 7(4): 3710-3714. |
| [55] |
FANG Y, LV Y, GONG F, et al. Interface tension-induced synthesis of monodispersed mesoporous carbon hemispheres[J]. Journal of the American Chemical Society, 2015, 137(8): 2808-2811. DOI:10.1021/jacs.5b01522 |
 2022, Vol. 39
2022, Vol. 39